铁掺杂微纳米生物活性玻璃促进牙本质矿化的实验研究
2022-08-08苗国厚李正茂
*苗国厚 李正茂
(广州医科大学附属口腔医院·广东省口腔组织修复与重建工程技术研究中心·广州市口腔再生医学基础与应用研究重点实验室 广东 510182)
自从20世纪70年代,Hench教授发明熔融法45S5生物活性玻璃以来[1],因其良好的生物相容性和骨键合性能,国内外研究人员先后开展了广泛深入的研究[2-4]。在制备方法上,先后历经90年代的溶胶-凝胶法生物活性玻璃和目前的微纳米生物活性玻璃[5-6];在化学组成上,从原来的Na2OSiO2-CaO-P2O5四元体系到SiO2-CaO-P2O5三元体系和SiO2-CaO二元体系及不同离子包括锶、铜、锌的掺入以提升其生物学性能[7-10];在应用领域上,涵盖了骨、齿硬组织缺损修复和皮肤等软组织创面的修复与再生研究[11-13]。
目前,国内外研究热点是在生物活性玻璃微球的制备中通过掺杂不同的离子来增强其生物学性能[14-15]。本文在常规光滑表面MNBG微球基础上,通过优化制备工艺,研制出一种铁掺杂微纳米生物活性玻璃(MNBGf)微球,并对其进行了一系列物化性能表征和体外成牙本质矿化研究。
1.材料与方法
(1)实验试剂
正硅酸乙酯(TEOS)、四水合硝酸钙、九水合硝酸铁和无水乙醇均购自广州市金华大化学试剂有限公司(分析纯);氨水购自天津市大茂化学试剂厂(分析纯);去离子水为实验室自制。
(2)MNBGf微球的制备
溶液A:在磁力搅拌器上,先将12.5ml无水乙醇、12.5ml去离子水和5ml氨水加入100ml烧杯中,以600rpm转速搅拌30min后至透明得溶液A;溶液B:在磁力搅拌器上,将25ml无水乙醇和2.5mlTEOS依次加入100ml烧杯中,以600rpm转速搅拌30min后至透明得溶液B;然后,将溶液A快速加入溶液B中,得到悬浮液C,以1000rpm转速持续搅拌1h;接着,向悬浮液C中加入四水合硝酸钙和九水合硝酸铁后持续搅拌1h,超声20min,静置陈化1d,无水乙醇洗涤三次,冷冻干燥;最后,650℃热处理1h,即得MNBGf微球。
(3)表征测试
样品的表面形貌采用场发射扫描电子显微镜(FESEM,Merlin,Zeiss,Germany)在10kV加速电压条件下进行观察。样品的显微形貌采用透射电子显微镜(TEM,JEM-1400,JEOL,Japan)在100kV加速电压条件下进行观察微纳米生物活性玻璃的物相组成通过X射线衍射仪(XRD,Empyrean,PANalytical,Netherlands)在Cu Kα辐射(λ=0.154nm)条件下测定。
(4)细胞培养
收集18~25岁健康成年患者的前磨牙或第三磨牙(征得患者的知情同意),从牙齿根部取出牙髓组织,并用磷酸盐缓冲液(PBS)冲洗3次。在生物安全柜中用眼科剪将牙髓组织剪成1mm×1mm×1mm大小的组织块,然后转移到培养皿中,加入含10% FBS和1% P/S的DMEM培养液,置5% CO2,37℃培养箱内进行原代培养。细胞达到80%融合后进行传代,重新接种在细胞培养瓶中。
(5)qRT-PCR实验
DPSCs细胞采用DMEM完全培养基处理,同MNBG/MNBGf微球共培养3天后提取总RNA,RNA的纯度和数量使用NanoDrop 1000C分光光度法测定,取500ng总RNA逆转录成cDNA,最后采用qRT-PCR仪检测OPN、OSX、CAP和CEMP1表达水平,引物序列详见表1。

表1 qRT-PCR检测相关引物序列表
2.结果与讨论
MNBG和MNBGf的FESEM和TEM表征结果见图1。从图中可以看出MNBG微球呈表面光滑、粒径均一的球形。MNBGf微球表面出现小颗粒堆积,形成了大微球同小颗粒共混的显微形貌。同MNBG微球相比,MNBGf微球粒径尺寸出现一定程度的减小,这可能是由于铁离子的掺入,进一步破坏了生物活性玻璃微球中氧化硅网络的完整性,从而微球粒径有所减小。实验制备过程中催化剂氨水的加入,使得反应体系成碱性环境,出现了氢氧化铁沉淀,因此我们推断,MNBGf微球表面的小颗粒可能是氢氧化铁经高温热处理后(一般高于500℃)生成的Fe2O3[16-17]。

图1 生物活性玻璃微球的FESEM照片A:MNBG,B:MNBGf;生物活性玻璃微球的TEM照片C:MNBG,D:MNBGf
MNBG和MNBGf的XRD衍射谱图结果见图2。从图中可以看出,MNBG组呈现典型的非晶态“馒头峰”,说明MNBG微球为玻璃相结构[18-19]。MNBGf组衍射峰的非晶态“馒头峰”形态未见明显改变,说明我们制备的这一铁掺杂微纳米生物活性玻璃微球没有因为铁的掺入而改变原有玻璃相结构。
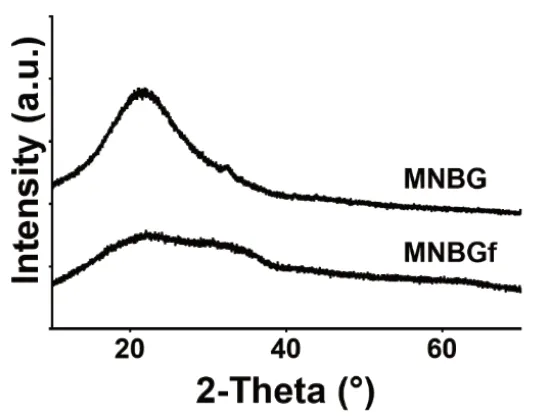
图2 MNBG和MNBGf微球的XRD衍射谱图
我们通过qRT-PCR和茜素红S染色实验研究生物活性玻璃微球对DPSCs细胞成骨向分化的直接作用。DPSCs细胞分别在MNBG和MNBGf微球直接刺激下共培养3d后的qRT-PCR结果如图3显示,同空白对照组相比,MNBG和MNBGf组成骨向分化相关基因表达水平明显上调,特别是MNBGf组中OPN、OSX和CEMP1基因上调更显著[20]。这说明铁离子的掺入显著增强了MNBG微球的成骨向分化促进作用。DPSCs细胞同生物活性玻璃微球共培养14d后的茜素红染色实验结果(见图4)可以看出,掺入铁后的MNBGf组具有更明显的矿化结节,上述结果进一步证明了MNBGf微球对DPSCs细胞具有促进体外矿化作用[21]。

图3 微纳米生物活性玻璃同牙髓干细胞共培养3d后qRT-PCR结果
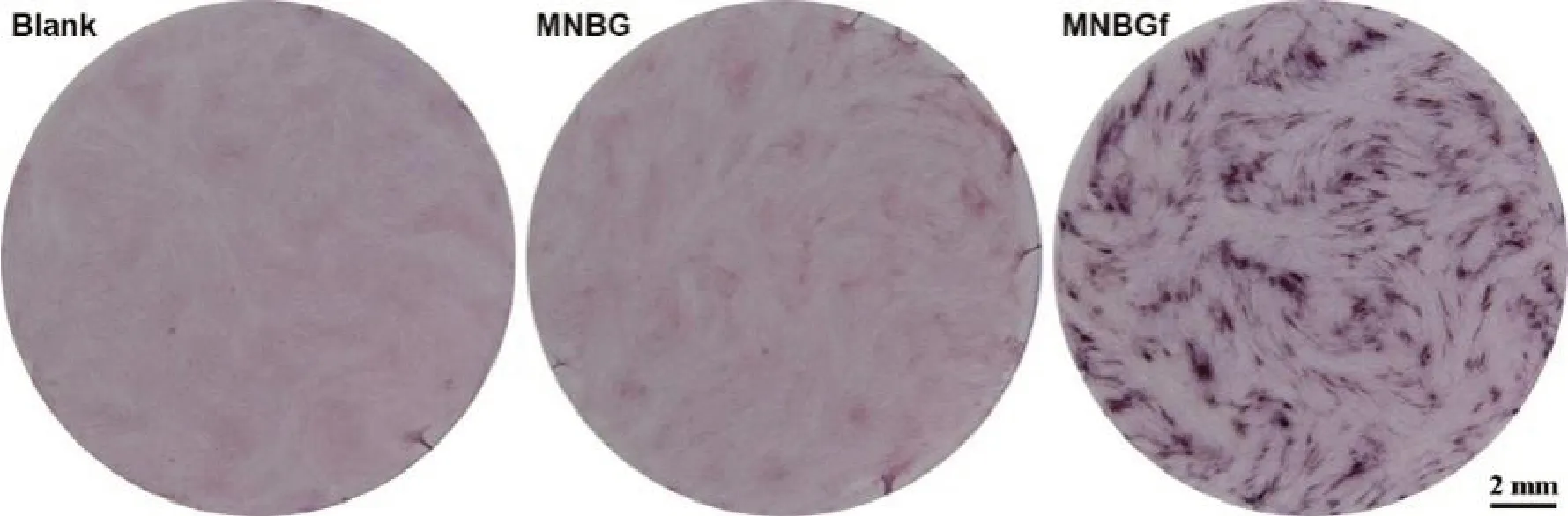
图4 微纳米生物活性玻璃同牙髓干细胞共培养14d后的茜素红染色结果
3.结论
本文通过溶胶-凝胶法成功制备出一种铁掺杂微纳米生物活性玻璃微球,采用FESEM、TEM和XRD对样品的物化性能进行表征测试,发现这一MNBGf微球形成了大微球同小颗粒共混的显微形貌结构。体外细胞实验证明,该MNBGf生物活性玻璃微球具有优异的促成骨分化和体外矿化性能。综上,我们认为这一铁掺杂生物活性玻璃微球在牙科盖髓材料和骨缺损填充领域有潜在应用前景。
