NOX4-NLRP3信号通路在衰老小鼠肾脏纤维化中的激活研究
2022-08-04韩玉立董夏男李学望李卫平李维祖
韩玉立,董夏男,杨 柳,李学望,李 艳,李卫平,李维祖
衰老是众多疾病的潜在风险因素。肾脏是最易受到衰老影响的器官之一,而肾脏纤维化是肾脏衰老的结构变化之一[1]。在肾脏衰老的众多机制中,氧化应激和炎症备受关注。氧化应激是由于内源性活性氧(reactive oxygen species, ROS)的过度生成对细胞造成损伤的过程。有报道[2]称,ROS的长期积累在肾脏纤维化中起着关键作用。NADPH氧化酶(NADPH oxidases, NOX)是细胞中产生ROS的重要酶系统[3]。NOX家族由NOX1~5等同源物的细胞膜蛋白组成,其中在肾脏中主要表达的是NOX4[4]。炎症也被认为可能在衰老相关的肾脏损害中发挥重要作用。核苷酸结合寡聚化结构域蛋白样受体蛋白家族(nucleotide-binding oligomerization domain-containing protein-like receptor protein, NLRP)是第一个被发现形成炎症小体的传感器蛋白家族[5]。NLRP3炎症小体可能是慢性肾脏疾病、急性肾损伤和糖尿病肾病的发病机制[6]。然而,NLRP3的激活是否参与衰老相关的肾脏纤维化仍不清楚。本研究旨在探索NOX4-NLRP3信号通路的激活在衰老小鼠肾脏纤维化中的作用,对研究肾脏与年龄相关因素的关系具有重要意义。
1 材料与方法
1.1 实验动物6月龄雄性、体质量(33~40)g昆明种小鼠购自安徽医科大学实验动物中心,SCXK(皖)2017-001。48只小鼠依据体质量被随机化分为6、16、20和24月龄组(n=12)。小鼠饲养于温度25 ℃,12 h/12 h明暗交替的环境中,小鼠可以自由进食饮水,各组小鼠饲养条件保持一致。6、16、20和24月龄组的小鼠分别饲养6、16、20和24个月后处死取材。其中20月龄组的1例小鼠死亡,24月龄组的2例小鼠死亡。
1.2 主要试剂血清尿素氮(blood urea nitrogen,BUN)和血清肌酐(serum creatinine,SCr)试剂盒(南京建成生物工程研究所);超氧化物阴离子荧光探针(dihydroethidium,DHE)和β-半乳糖苷酶(β-galactosidase,β-Gal)试剂盒(上海碧云天生物科技有限公司);Hoechst 33258(美国Sigma公司);兔抗胶原蛋白Ⅳ(collagen Ⅳ, COL4)抗体、兔抗NLRP3多克隆抗体、兔抗NOX4多克隆抗体、兔抗p47phox多克隆抗体和兔抗p22phox多克隆抗体(上海bioworld生物技术有限公司);兔抗胱天蛋白酶募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)(北京博奥森生物技术有限公司);兔抗Caspase-1多克隆抗体、兔抗白介素-1β(interleukin-1β,IL-1β)多克隆抗体和兔抗转化生长因子β1(transforming growth factor-β1, TGF-β1)多克隆抗体(美国abcam公司);小鼠抗β-actin、辣根酶标记山羊抗兔IgG(H+L)、辣根酶标记山羊抗小鼠IgG(H+L)和DAB染色剂(北京中杉金桥生物技术公司)。
1.3 主要方法
1.3.1BUN和SCr的测定 腹腔注射3%三溴乙醇将小鼠麻醉,并从心脏采集血样,离心分离出血清。试剂盒检测BUN和SCr的水平,以评估不同组别的肾功能。
1.3.2肾皮质中ROS水平检测 小鼠尾静脉注射DHE工作液(100 μmol/L,0.1 ml/10g),30 min后取出肾脏并嵌入OCT包埋剂。用冷冻切片机将肾脏切成10 μm的切片。然后用Hoechst 33258孵化切片5 min。使用荧光显微镜观察切片。Image-Pro Plus 6.0对每个切片中肾皮质的5个随机区域(×400)的DHE染色的平均荧光密度进行量化,以评估ROS的产生。
1.3.3测定衰老相关的β-Gal活性 冰冻切片使用试剂盒进行β-Gal染色。用光学显微镜拍照,Image-Pro Plus 6.0对每个切片中肾皮质的5个随机区域(×400)的平均光密度进行量化,以评估β-Gal活性。
1.3.4肾脏组织学评价 小鼠的肾脏浸泡在4%多聚甲醛24 h后取出在石蜡中包埋,切片,脱蜡。进行苏木精和伊红(hematoxylin and eosin,HE)染色,高碘酸-希夫(periodic acid-Schiff , PAS)染色和Masson染色。在光学显微镜下观察拍照,选取切片中的5个随机区域(×400)的肾小球进行定量分析。Image J检测PAS染色中肾小球的面积和直径。Image-Pro Plus 6.0对PAS和Masson染色进行量化分析,用阳性区域的平均密度来评估肾脏组织学的变化。
1.3.5免疫组化 肾组织石蜡切片脱蜡,在3%的双氧水中孵化10 min。将切片在微波炉中的柠檬酸钠抗原修复液中沸腾7 min,并用正常的山羊血清封闭30 min。将切片与COL4、NLRP3抗体在4 ℃下孵育过夜。洗净切片,二抗孵育1 h,然后用DAB染色,在显微镜下观察拍照。每张切片选5个肾脏皮质区域(×400)进行定量分析,Image-Pro Plus 6.0测量阳性区域的平均密度,以评估COL4和NLRP3的表达。
1.3.6Western blot实验 取肾皮质组织50 mg用RIPA法提取总蛋白。等量的蛋白质通过SDS-PAGE分离并转移到PVDF膜上。室温下封闭1 h,并在4 ℃下用以下抗体孵育过夜:NLRP3、ASC、Caspase-1、IL-1β、NOX4、p47phox、p22phox、TGF-β1和β-actin单克隆抗体(1 ∶1 000)。然后将PVDF膜与相应的二抗在室温下孵育1 h。用Chemi-Doc MP、Bio-Rad成像系统对蛋白条带进行拍照。Image J测量蛋白条带的灰度值,并与相应的β-actin进行归一化。

2 结果
2.1 衰老对小鼠SCr和BUN和肾脏组织形态学的影响与6月龄小鼠相比,老年小鼠的SCr和BUN水平增加(P<0.05,P<0.01),见图1A、B。HE染色结果显示,在20和24月龄小鼠中,肾小球和肾小管组织出现了损伤,许多肾小管上皮细胞空泡化、扁平和脱落,管腔肿胀、破裂和间质炎症浸润。肾小球基底膜增厚,系膜基质增加,细胞外基质沉积,系膜面积比升高,见图1C。
2.2 衰老对小鼠肾皮质中β-半乳糖苷酶表达的影响β-Gal活性上调是衰老细胞的一个重要标志。结果显示,随着小鼠年龄的增长,β-Gal活性增加(P<0.05或P<0.01),见图1D、E。

图1 衰老对血清中肾功能参数,肾脏病理形态(HE ×400)和β-Gal活性的影响
2.3 衰老对小鼠肾脏酸性糖蛋白沉积的影响PAS染色结果显示,与6月龄小鼠相比,20和24月龄小鼠肾小管上皮细胞和基质中沉积的酸性糖蛋白增加,肾小球酸性糖蛋白沉积的面积和水平增加,其红色密度更高;进一步测量肾小球的直径,与6月龄小鼠相比,20和24月龄的小鼠的肾小球直径也增加(P<0.05或P<0.01),见图2A~D。

图2 衰老对小鼠肾小球和肾小管酸性糖蛋白沉积的影响 PAS染色 ×400
2.4 衰老对小鼠肾脏纤维化的影响Masson染色显示,6月龄和16月龄小鼠的肾小球和间质没有明显的肾脏纤维化。在20和24月龄小鼠中,肾小球和肾间质纤维化增加(P<0.01),见图3A、B。在20和24月龄小鼠中,COL4在肾小球和肾小管中的表达增加(P<0.01),见图4A、B。16月龄小鼠TGF-β1在肾皮质中的表达增加,但差异无统计学意义。20和24月龄小鼠TGF-β1在肾皮质中的表达增加(P<0.01),见图4C。
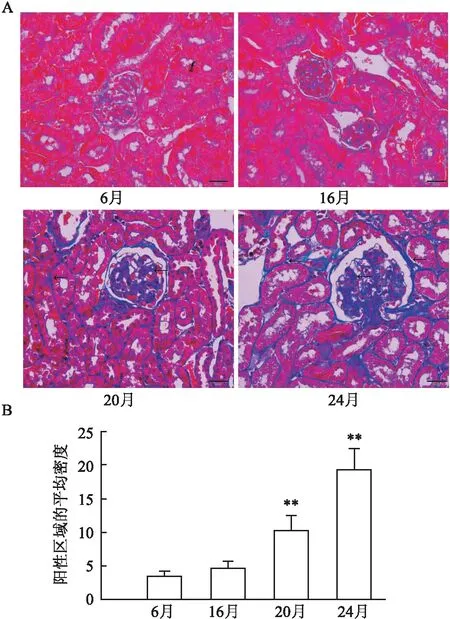
图3 衰老对6、16、20和24月龄小鼠的肾脏胶原蛋白沉积的影响(n=4)

图4 衰老对6、16、20和24月龄小鼠肾皮质中COL4和TGF-β1表达的影响(n=4)
2.5 衰老对小鼠肾皮质中ROS产生的影响DHE荧光染色结果显示,与6月龄小鼠相比,16、20和24月龄小鼠肾皮质中的ROS产生增加(P<0.01),见图5A、B。

图5 衰老对6、16、20和24月龄小鼠肾皮质中ROS生成及NOX4、p22phox和p47phox表达的影响(n=3)
2.6 衰老对小鼠肾皮质中NOX4、p22phox和p47phox表达的影响蛋白免疫印迹结果显示,与6月龄组小鼠相比,20和24月龄小鼠肾皮质中NOX4、p22phox和p47phox的表达增加(P<0.05或P<0.01),见图5C~E。
2.7 衰老对小鼠肾皮质中NLRP3、ASC、Caspase-1和IL-1β表达的影响与6月龄小鼠相比,16、20和24月龄小鼠肾皮质中NLRP3、ASC、Caspase-1和IL-1β的表达增加(P<0.05或P<0.01),见图6A~D。免疫组化法检测NLRP3在肾皮质的表达。结果显示,随着年龄的增加,小鼠的肾小球中NLRP3的表达增加(P<0.05或P<0.01),见图7A、B。

图6 衰老对6、16、20和24月龄小鼠肾皮质中NLRP3、ASC、Caspase-1和IL-1β表达的影响(n=3)

图7 衰老对6、16、20和24月龄小鼠肾皮质中NLRP3表达的影响(n=4)
3 讨论
该研究探索了衰老小鼠的肾脏纤维化的变化及与NOX4-NLRP3信号通路的相关性。该研究表明,20和24月龄小鼠BUN和SCr水平、肾皮质β-Gal活性、ROS和IL-1β水平以及病理形态学和肾脏纤维化相关参数都增加(P<0.01)。与肾脏衰老的病理变化相一致,20和24月龄小鼠肾皮质中NOX4和NLRP3炎症小体的表达增加(P<0.05)。这些结果表明,NOX4介导的NLRP3炎症小体的激活可能在衰老相关的肾脏纤维化中发挥重要作用。
肾脏衰老是一个复杂的过程,其特点是肾脏功能逐渐退化和结构逐渐改变[7]。在衰老过程中,受损的细胞器和线粒体有明显的积累,将导致肾功能不全[8]。当肾脏发生进行性和破坏性损伤时,BUN和SCr的产生将增加[9]。该研究结果也同样证实了这一点。此外,衰老的肾脏表现出交联的细胞外基质蛋白和纤维化的增加。TGF-β1是肾脏疾病最重要的促纤维化因子[10],其表达在20和24月龄小鼠增加。该研究数据表明,16月龄小鼠肾脏结构和功能开始出现轻微的改变,纤维化不明显,但是促纤维化因子开始增加。而20和24月龄小鼠肾脏结构和功能都出现了改变,肾小管和肾小球出现纤维化。
各种机制参与了与衰老相关的肾脏老化损伤,如氧化应激、炎症、线粒体功能障碍和钙调节的改变等。氧化应激是细胞和组织中氧化和抗氧化之间的不平衡,是氧自由基和相关ROS过度生产的结果[11]。该研究中ROS的产生在20和24月龄小鼠中增加。NOX4是参与慢性肾脏疾病发展的ROS氧化应激的主要来源[12-13]。与ROS相似,6月龄小鼠肾皮质中NOX4、p22phox和p47phox的表达较低,而在20和24月龄小鼠中则增加。提示NOX4介导的ROS生成在衰老过程中对肾脏纤维化有重要作用。炎症也在肾脏纤维化的发展中起着重要作用。由巨噬细胞移动抑制因子介导的炎症反应是糖尿病肾病中肾脏纤维化发展的重要原因[14]。NADPH氧化酶激活过度产生的ROS与NLRP3炎症小体的成熟密切相关[15]。在衰老小鼠肾脏NLRP3炎症小体的激活过程中,NOX4的激活起到关键的促进作用。
总之,该研究发现20和24月龄小鼠肾皮质ROS和IL-1β水平升高,并伴有衰老相关的肾损伤和纤维化。在衰老过程中,肾脏中的NOX4和NLRP3炎症小体被激活,提示NOX4介导的过量ROS的产生在肾皮质NLRP3炎症小体的激活中起重要作用,与小鼠衰老相关的肾损伤和纤维化密切相关。但是NOX4和NLRP3炎症小体参与衰老过程中肾脏纤维化的具体分子机制还有待进一步研究。
