SGK-1通过软骨破坏和炎性疼痛传导参与颞下颌关节骨关节炎
2022-08-04程慧欣白苗苗沈振国季华锋王元银
程慧欣,白苗苗,沈振国,季华锋,张 政,邢 田,王元银,3
颞下颌关节骨关节炎(temporomandibular joint osteoarthritis,TMJ-OA)是一种以下颌髁突软骨(mandibular condylar cartilage,MCC)退变为特征的进行性退行性关节疾病[1],患者主要表现为关节疼痛、下颌运动异常及功能障碍。目前对于TMJ-OA的临床治疗方案多以对症治疗为主,尚无有效的预防和根治措施。血清和糖皮质激素诱导的蛋白激酶1(serum-and glucocorticoid-induced kinase 1,SGK-1)作为丝/苏氨酸蛋白激酶家族成员之一,参与离子通道调节、细胞增殖分化、自噬抑制等多种临床生理和病理过程[2]。近年来有研究[4-6]表明,SGK-1在膝骨关节炎(knee osteoarthritis,KOA)及外周神经系统的痛觉传导中发挥作用,但SGK-1在TMJ-OA中的作用尚无研究报道。本研究旨在探究SGK-1是否参与调控TMJ-OA软骨破坏及以痛觉传导进程,以期为临床预防和治疗TMJ-OA提供新靶点。
1 材料与方法
1.1 实验动物6周龄雄性SPF级SD大鼠16只体质量(200±20)g,购于安徽医科大学实验动物中心,保持室温(22±2)℃,湿度(50±10)%,自由进食水,每12 h变换昼夜节律,实验开始前适应性喂养7 d,本实验采用的实验方法均符合实验室动物伦理准则(动物伦理批号:LLSC20190123)。
1.2 实验材料碘乙酸钠(monosodium iodoacetate,MIA)购自美国Sigma-Aldrich公司;逆转录试剂盒(日本Takara公司);qRT-PCR引物( 上海生工生物工程股份有限公司);扩增试剂盒(中国南京诺唯赞公司);超微量紫外分光光度计(美国Thermo Fisher公司);实时荧光定量PCR仪(瑞士Roche公司)。
1.3 实验方法
1.3.1实验性大鼠TMJ-OA模型建立 将16只6周龄雄性SPF级SD大鼠随机分为两组,即TMJ-OA组和Control组。按3 ml/kg腹腔注射10%水合氯醛麻醉,双侧TMJ区域消毒,以大鼠外耳道和眼角连线上,距外耳道约3 mm处,相当于颧弓下方作为进针点,向上向前向内,抵骨壁后后退后退约1 mm,回抽无血后,双侧关节腔分别注射50 μl MIA(10 mg/ml),留针1 min,Control组双侧关节腔按同样的方法,注射等量0.9%氯化钠溶液,见图1。造模后28 d,过量麻醉处死大鼠,分别取各组大鼠左侧完整TMJ及三叉神经节(trigeminal ganglion,TG)用于HE染色和番红固绿染色,取右侧MCC及TG用于qRT-PCR。

图1 TMJ-OA动物模型构建
1.3.2行为学检测 采用von-Frey毛刷测定大鼠头退缩阈值(head withdrawal threshold,HWT),分别在造模前3 d测定大鼠基础阈值,筛除过于迟钝或敏感的大鼠,并在造模后1 、7、14、21、28 d测定大鼠HWT值变化;检测HWT前,将大鼠分别置于不同小笼中适应30 min,待大鼠安静后,用von-Frey毛刷按照从小到大的力度刺激TMJ区域,每个力度重复刺激10次,以出现至少6次头退缩,或抓挠TMJ区域视为阳性,记录最小阳性值作为HWT值。
1.3.3HE染色 将取出的完整左侧TMJ在4%多聚甲醛中固定24 h后,10%EDTA脱钙30 d,至探针可以轻松穿过组织,然后常规脱水、浸蜡、包埋、切片、HE染色;左侧TG多聚甲醛中固定24 h后,直接脱水、浸蜡、包埋、切片,HE染色,在显微镜下观察组织病理变化。
1.3.4番红固绿染色 将左侧TMJ石蜡切片脱蜡,脱水,经固绿、番红染液染色后快速脱水,封片,显微镜下观察。
1.3.5qRT-PCR检测mRNA表达水平 将右侧MCC和TG分别在液氮中研磨至粉末状,转移至无酶EP管, TRIzol法提取RNA,DEPC水溶解,测定总RNA浓度、纯度,定量后,逆转录成cDNA,SYBR法扩增,用2-ΔΔCt法计算,β-actin校准。引物序列详见表1。


表1 各基因qRT-PCR引物序列一览表
2 结果
2.1 行为学检测结果Control组和TMJ-OA组大鼠体质量变化无明显差异(t=4.76,P>0.05)(图2);Control组大鼠HWT值未见明显变化,TMJ-OA组HWT值低于Control组 [ Control组(21.53 ± 0.72)g,TMJ-OA组(12.29 ± 3.46)g ],差异有统计学意义(t=2.61,P<0.05),且1 d后即出现HWT降低(t=4.29,P<0.001),约在7 d左右达到阈值最低点(t=5.64,P<0.000 1),此后HWT值出现缓慢上升,但是28 d左右阈值仍然明显低于Control组(t=3.17,P<0.05),表明TMJ-OA组大鼠出现机械痛觉过敏,见图3。

图2 大鼠体质量变化
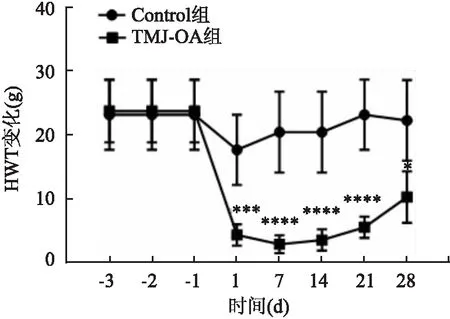
图3 大鼠HWT变化
2.2 组织病理学结果
2.2.1TMJ组织病理学变化 取出大鼠MCC后肉眼可见Control组大鼠MCC表面光滑透亮, TMJ-OA组MCC表面缺损,粗糙失去光泽(图4)。HE染色结果显示(图5A、B),Control组大鼠MCC由层次分明的四层组成:纤维层、增殖层、肥大层、钙化软骨层。注射MIA 28 d后,TMJ-OA组大鼠出现典型的骨关节炎样病变:MCC表面部分缺损,软骨纤维化,纤维层部分细胞核丢失(黑色箭头),肥大层变薄甚至消失(绿色箭头),细胞层次紊乱、界限不清(黄色箭头),出现无细胞区(红色箭头),软骨细胞簇形成(白色箭头)。番红固绿染色结果显示(图4C、D),Control组大鼠MCC肥大细胞层基质均匀红染;TMJ-OA组软骨基质淡染,甚至部分区域红染消失(黑色箭头),表明软骨受到损伤,软骨细胞释放过量蛋白多糖,使软骨基质分布不均。
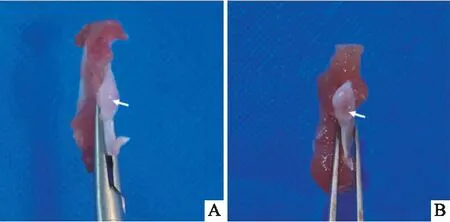
图4 大鼠髁突大体观A:Control组;B:TMJ-OA组
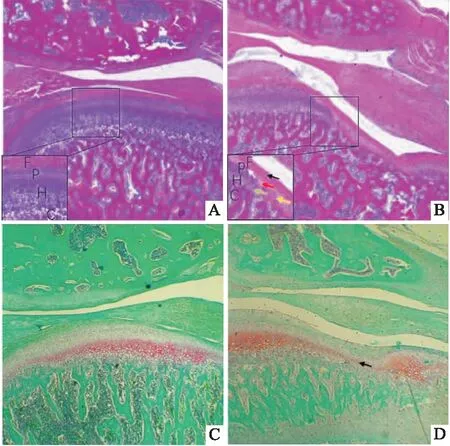
图5 TMJ组织病理学变化 ×40
2.2.2TG组织病理学变化 Control组大鼠 TG神经纤维排列整齐紧密,施万细胞分布均匀。注射MIA 28 d后,TMJ-OA组神经纤维排列紊乱松散(黄色箭头),出现空泡样变,即脱髓鞘改变(红色箭头),施万细胞增多(绿色箭头)等(图6)。

图6 TG组织病理学变化 HE染色 ×400A:Control组;B:TMJ-OA组
2.3 大鼠MCC中mRNA表达qRT-PCR检测大鼠MCC中SGK-1、IL-1β、环氧合酶(cyclooxygenase,COX)-2、基质金属蛋白酶(matrix metalloproteinases ,MMP)-13 mRNA的表达,结果显示:与Control组相比,TMJ-OA组SGK-1(t=2.21,P<0.05)、IL-1β(t=2.81,P<0.05)、COX- 2 (t=3.11,P<0.05)、MMP-13(t=3.21,P<0.01)的mRNA表达量均有不同程度的上调,差异有统计学意义(图7)。

图7 大鼠MCC中mRNA表达与Control组比较:*P<0.05,**P<0.01
2.4 大鼠TG中mRNA表达qRT-PCR检测TG中SGK-1、COX-2 mRNA的表达,结果显示:与Control组相比,TMJ-OA组SGK-1(t=4.76,P<0.01)、COX-2(t=2.76,P<0.05) mRNA的表达量均有不同程度的上调,差异有统计学意义(图8)。

图8 大鼠TG mRNA表达 与Control组比较:*P<0.05,**P<0.01
3 讨论
TMJ-OA特征是细胞应激和细胞外基质降解,表现为局部炎症及软骨损伤。本研究参照Wang et al[7]的方法通过关节腔内局部注射MIA构建大鼠TMJ-OA模型,大体观及组织病理学结果显示MIA注射可引起OA特征性改变,与临床TMJ-OA患者具有相似的组织病理变化[1, 8]。本研究发现IL-1β及COX-2在MCC中高表达,提示MIA可以引起MCC炎症反应及氧化应激损伤,这与临床患者和其他动物模型疾病进程相一致[9-10]。软骨细胞主要功能是合成胶原蛋白等对细胞外基质进行补充,MMP通过分解Ⅱ型胶原维持TMJ的生理结构的平衡;在本研究中,TMJ-OA组软骨基质淡染,同时MCC中MMP-13 mRNA高表达,推测可能是在炎性微环境下,软骨细胞损伤,产生细胞因子可能刺激MMPs等的合成,加重软骨基质降解,从而加剧了OA 的发展。
TMJ关节区疼痛是TMJ-OA患者最亟待解决的问题,TG作为头面部外周痛觉信号枢纽接收TMJ软骨下骨及滑膜组织中游离神经末梢传导的神经冲动,并将它们上传至中枢神经系统,产生疼痛。本研究中TMJ-OA组大鼠HWT显著降低,且TG神经纤维出现显著脱髓鞘改变,形成慢性疼痛损伤。有研究指出,氧化应激可能直接损害神经元功能或导致胶质细胞过度激活,这可能有助于神经退行性疾病中的慢性持续性炎症及神经元功能障碍[11],在高糖诱导的背根神经节神经元细胞损伤模型中,抑制COX-2 的表达可减轻神经元细胞的损伤和氧化应激水平[12],而在TMJ-OA模型中TG内COX-2的表达鲜有报道,本研究结果显示COX-2在TMJ-OA组TG内表达显著上调。尽管MCC中无神经分布,但发生TMJ-OA时,持续的炎症状态、关节内炎性因子诱导TG神经元细胞损伤及神经递质的变化也可能对疼痛的放大和迁延具有促进作用。
SGK-1 是Webster et al[13]在对糖皮质激素诱导的大鼠乳腺癌细胞进行基因表达的差异筛选时发现的一个丝/苏氨酸蛋白激酶。近年来研究报道SGK-1与KOA的软骨破坏相关,研究发现,临床患者和小鼠KOA模型中,损伤的软骨细胞高表达SGK-1,敲低软骨细胞SGK-1基因表达后,受到炎症刺激的软骨细胞增殖明显,且胶原合成增加[4-5]。尽管同为关节软骨,TMJ软骨与膝关节软骨具有不同的组织结构:TMJ是纤维软骨,由Ⅰ、Ⅱ型胶原蛋白组成[14]。本研究发现与Control组相比,TMJ-OA组MCC中SGK-1的mRNA表达水平上调。除了参与炎症免疫性疾病的病理过程,SGK-1还与学习记忆、神经元兴奋、中枢神经系统性疾病相关;研究发现,SGK-1可以通过促进背根神经节中Nav1.7上调从而诱导慢性手术后疼痛,抑制SGK-1减轻周围伤害感受器中Nav1.7的失调可能是防止慢性手术后疼痛向中枢神经痛发展的有效途径[6]。但目前SGK-1在TG中是否表达尚无文献报道,本研究发现TMJ-OA组TG中SGK-1的表达水平上调。以上实验结果提示,SGK-1通过关节局部软骨破坏和炎性疼痛传导两种途径参与TMJ-OA的病理过程。
综上所述,MIA关节内注射可以得到与TMJ-OA患者相似的病理表现和疼痛症状,SGK-1在破坏的MCC中和损伤的TG中均表达上调,将SGK-1作为治疗靶点,抑制患者异常表达的SGK-1,可能具有抗炎和缓解疼痛的双相效应。但SGK-1参与TMJ-OA进程的分子机制及涉及的信号通路调控途径尚不清楚,还需进一步在动物实验和细胞水平深入研究。
