猪细小病毒HNLY201301株遗传特性及其对小鼠的致病性研究
2022-08-04徐伊璇彭文婧曹三杰颜其贵黄小波文翼平杜森焱
郑 艺,徐伊璇,彭文婧,曹三杰,颜其贵,黄小波,文翼平,赵 勤,杜森焱,伍 锐
(四川农业大学动物医学院猪病研究中心,成都 611130)
猪细小病毒(porcine parvovirus,PPV)自1966年首次报道以来,一直是导致猪繁殖障碍的常见病毒之一[1],严重威胁着养猪业的发展。PPV引发的繁殖障碍性疾病的特点是流产、木乃伊胎、死胎和后续不孕。除此以外,PPV感染也可引起全白细胞减少、肝炎、肠炎、红细胞再生障碍、免疫复合物介导的血管炎和小脑共济失调等症状[2]。与其他病毒相比,PPV对环境具有较强的抵抗力,一般来说,一旦猪场感染PPV,其根除将非常困难。根据遗传差异,PPV被分为7种基因型,除经典细小病毒1型(PPV1)外,2001年至今全球陆续分离鉴定成功PPV2~7[1,3-4]。近年来,PPV1感染日趋严重,我国已分离出大量毒株。通过将这些分离到的毒株与20世纪分离到的毒株进行比较,证实了现代毒株与以前毒株有愈发相似的趋势[5-6]。为了解河南洛阳地区分离到的PPV毒株的基因型和致病性,本研究拟对HNLY201301株进行遗传信息分析以及生物学特性研究。
1 材料和方法
1.1 病毒与细胞
2013年5月,在河南省洛阳市郊区某养猪场的100头初产母猪(未接种过PPV疫苗)发生了流产和死胎,共计20头。将死胎组织病料处理后接种PK-15细胞,成功分离出一株猪细小病毒,并命名为HNLY201301;PK-15细胞由四川农业大学动物医学院猪病研究中心(以下称本中心)保存。
1.2 菌株与实验动物
感受态细胞DH5α由本中心制作并保存;SPF级BalB/c小鼠,购自成都达硕生物科技有限公司。
1.3 主要试剂与试剂盒
1%动物红细胞、4%多聚甲醛固定液,购自成都百思博生物技术有限公司;pMD19-T载体购自美国Promega公司;T4连接酶、Taq DNA聚合酶,购自宝生物工程(大连)有限公司;DMEM培养基、青链霉素溶液,购自美国Gibco公司;胎牛血清购自美国Hyclone公司;基因组DNA提取试剂盒、DNA纯化试剂盒、质粒提取试剂盒,均购自天根生化科技(北京)有限公司。
1.4 引物设计与病毒DNA提取
根据Genbank上发表的PPV的基因序列(登录号:DKX242359),利用Primer Premier 5.0软件分段设计了5对引物(表1),用于扩增HNLY201301株的全基因组序列。将病毒接种于50%融合度的PK-15细胞,待出现明显细胞病变效应(CPE)后收集病毒液,按照说明书步骤提取病毒DNA,保存于-20℃。

表1 引物信息Table 1 Primer sequence
1.5 基因克隆与基因组测序
以提取到的病毒DNA为模板进行PCR扩增,在1%琼脂糖凝胶上通过凝胶电泳分离PCR产物,试剂盒纯化目的条带。将纯化后的片段连接到pMD19-T载体上,然后转化进大肠杆菌DH5α感受态细胞,37℃平板培养过夜。挑选阳性白色菌落扩大培养后提取重组质粒,提取的重组质粒送往生工生物工程(上海)股份有限公司进行测序。使用DNAMAN软件对得到的DNA序列进行比对拼接,获得完整的基因组序列。最后将得到的核苷酸序列利用Bankit序列提交工具提交给GenBank[7]。
1.6 系统发育分析
使用Lasergene 4.0软件对HNLY201301株的NS1和VP1基因进行核苷酸同源性分析和氨基酸同源性分析。利用Mega 5.0软件,对NS1和VP1核苷酸序列进行分子演化遗传分析,采用邻接法(neighbor-joining method),基于1 000个重复,构建系统发育树[2],以确定HNLY201301株与其他猪细小病毒之间的进化关系[8]。
1.7 生长曲线测定
按感染复数(MOI)1将病毒接种于PK-15细胞,分别在感染后不同时间点收集病毒液。PK-15细胞正常传代消化后接种于96孔板,于37℃、5% CO2环境中培养过夜。将待测病毒液10倍梯度稀释后接种于96孔板,每个稀释度分别接种8孔,同时设置健康细胞孔作为对照,于37℃、5% CO2环境中继续培养,5~7 d内观察并记录细胞病变情况,按Reed-Muench法计算TCID50[9],绘制生长曲线。
1.8 血凝试验
在V底96孔板中各加入25µL磷酸盐缓冲盐溶液(PBS),再在第一孔中加入25µL病毒液,从左往右依次倍比稀释病毒液,然后在每孔中加入1%动物的红细胞,震荡混匀,37℃孵育45 min后判定结果,以完全凝集的最高稀释孔为该病毒的凝集价。
1.9 小鼠体内感染试验
1.9.1 静脉注射感染试验
对COPD患者而言,肺康复训练是一项长期的医疗过程,因此需患者具有较强的耐力和毅力。在肺康复训练中需对患者实施有效的健康宣教,这有利于后期训练,提高患者对疾病的认知度,促进患者养成良好的生活饮食习惯,提高其治疗依从性,也一定程度增强患者对治疗疾病的信心,使患者掌握正确肺康复方法并持之以恒,能避免疾病加重[9]。
为评估HNLY201301株的组织嗜性,36只BalB/c小鼠公母各半,统一静脉注射0.2 mL病毒液(病毒滴度为10-6.71TCID50/mL),对照组注射等量PBS,3 d内观察病变。每6 h随机选择3只小鼠进行人道安乐死[10],收集血液、心脏、肝脏、脾脏、肺脏、睾丸、储精囊、子宫和卵巢等多器官组织样本。
1.9.2 阴道灌注感染试验
为评估HNLY201301株的生殖道途径感染情况,12只雌性BalB/c小鼠,统一阴道灌注40µL病毒液(病毒滴度为10-6.71TCID50/mL),对照小鼠灌注等量PBS。在接种后不同时间点,每组3只小鼠被人道安乐死,并收集其子宫、心脏、肝脏和脾脏。
1.10 组织病理诊断
将新鲜组织用固定液浸泡固定24 h以上,用手术刀将目的部位组织修平整,依次进行脱水、包埋、切片、脱蜡至水处理,然后使用苏木素和伊红进行染色,脱水后用中性树胶封片,最后在光学显微镜下观察并采集图像。
1.11 荧光定量PCR(qPCR)
基于HNLY201301株VP2基因设计用于qPCR法检测病毒载量的引物(表1),收集的血液及组织用于提取病毒DNA作为检测模板。qPCR扩增程序为:95 ℃ 30 s;95 ℃ 5 s,68 ℃ 30 s,72 ℃ 30 s(39个循环);绘制熔解曲线。
2 结果与分析
2.1 病毒基因序列分析
测序结果显示,HNLY201301株的基因组全长为4 723 bp,有两个主要ORF,其中ORF1编码437个氨基酸的NS1,116个氨基酸的NS2和77个氨基酸的NS3,ORF2编码480个氨基酸的VP1和375个氨基酸的VP2。我们已将本研究获得的HNLY201301株核苷酸序列提交给了GenBank,获得登录号MF447833。使用DNAMAN软件对DNA序列进行比对(表2)后发现,HNLY201301株与其他PPV1株之间的核苷酸序列同源性为92.3%~99.7%,与GD2013株的基因组序列同源性最高。除GD2013株以外,相较于其他参考毒株,HNLY201301株序列的121至159位存在39个碱基的缺失。使用Lasergene 4.0软件对NS1、VP1和VP2进行核苷酸及氨基酸同源性分析(表2)发现,与参考毒株相比,HNLY201301株NS1的核苷酸和氨基酸序列同源性分别为99.4%~99.9%和99.2%~99.7%,VP1的核苷酸和氨基酸序列同源性分别为98.7%~100.0%和98.5%~99.7%,VP2的核苷酸和氨基酸序列同源性分别为98.4%~99.9%和98.2%~99.8%。HNLY201301株与从中国河南省分离的HN-2011株和J-PPV株具有较高的核苷酸同源性和氨基酸同源性。对HNLY201301株和参考毒株VP2编码区关键氨基酸位点进行分析(表3),结果表明,HNLY201301株和高致病性Kresse株第378、383氨基酸突变位点以及和HN-2011株在第45、144、320、436个氨基酸突变位点上具有高度相似性。
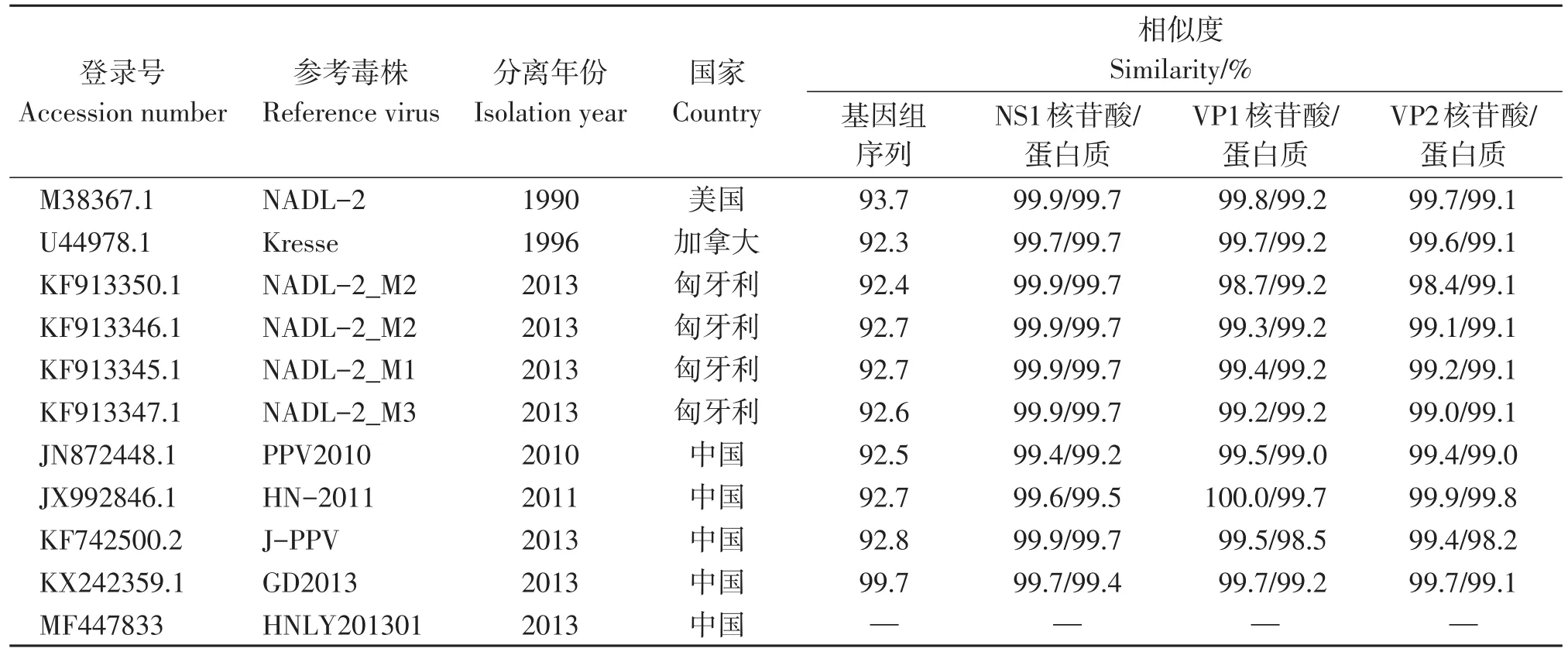
表2 HNLY201301株与其他PPV1株的序列比对Table 2 Sequence information for HNLY201301 strain and other reference PPV1 strain
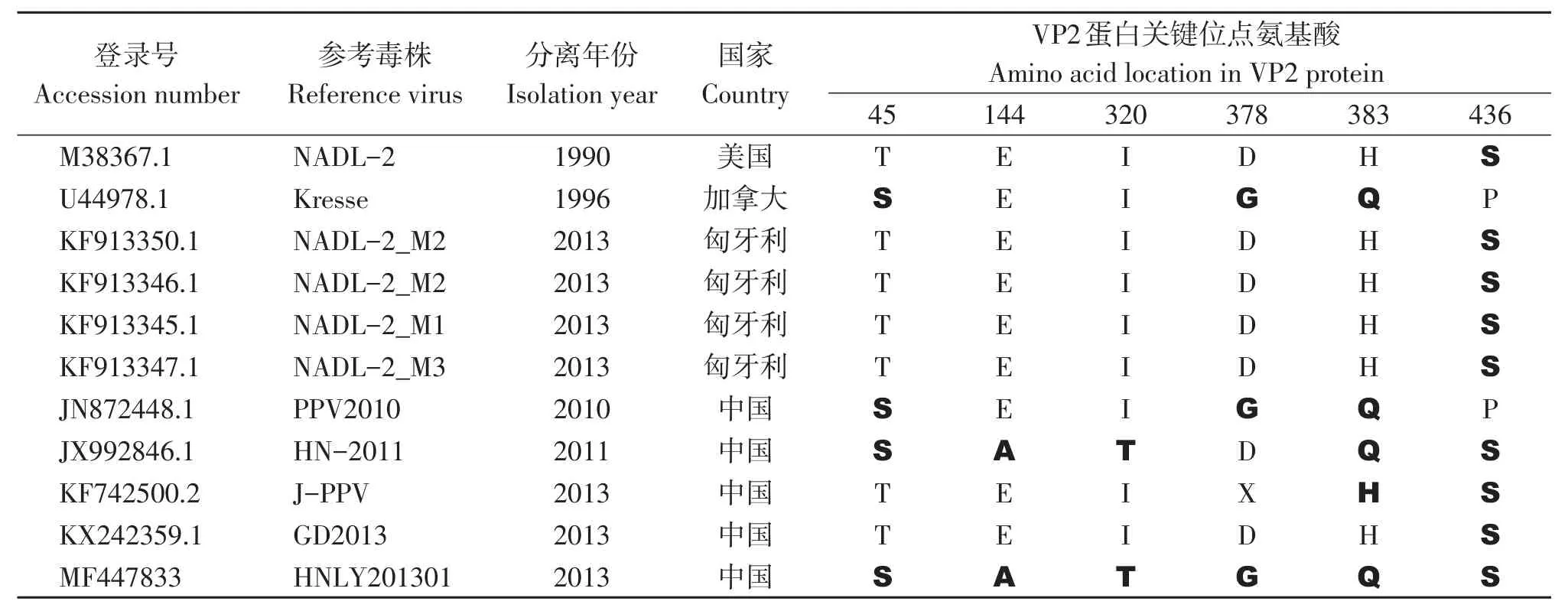
表3 HNLY201301株与其他PP1株VP2蛋白关键位点氨基酸比较Table 3 Amino acid difference in VP2 between HNLY201301 strain and other reference PPV1 strain
2.2 病毒系统发育树分析
基于NS1基因的系统发育树分析(图1)表明,HNLY201301株与J-PPV株、Kresse株以及NADL-2株亲缘关系最近,基于VP1基因的系统发育树分析(图2)表明,HNLY201301株与HN-2011株的亲缘关系最近。总体而言,HNLY201301株与PPV1株的关系最为密切且其他PPV1株形成了与其他细小病毒不同的系统发育分支。
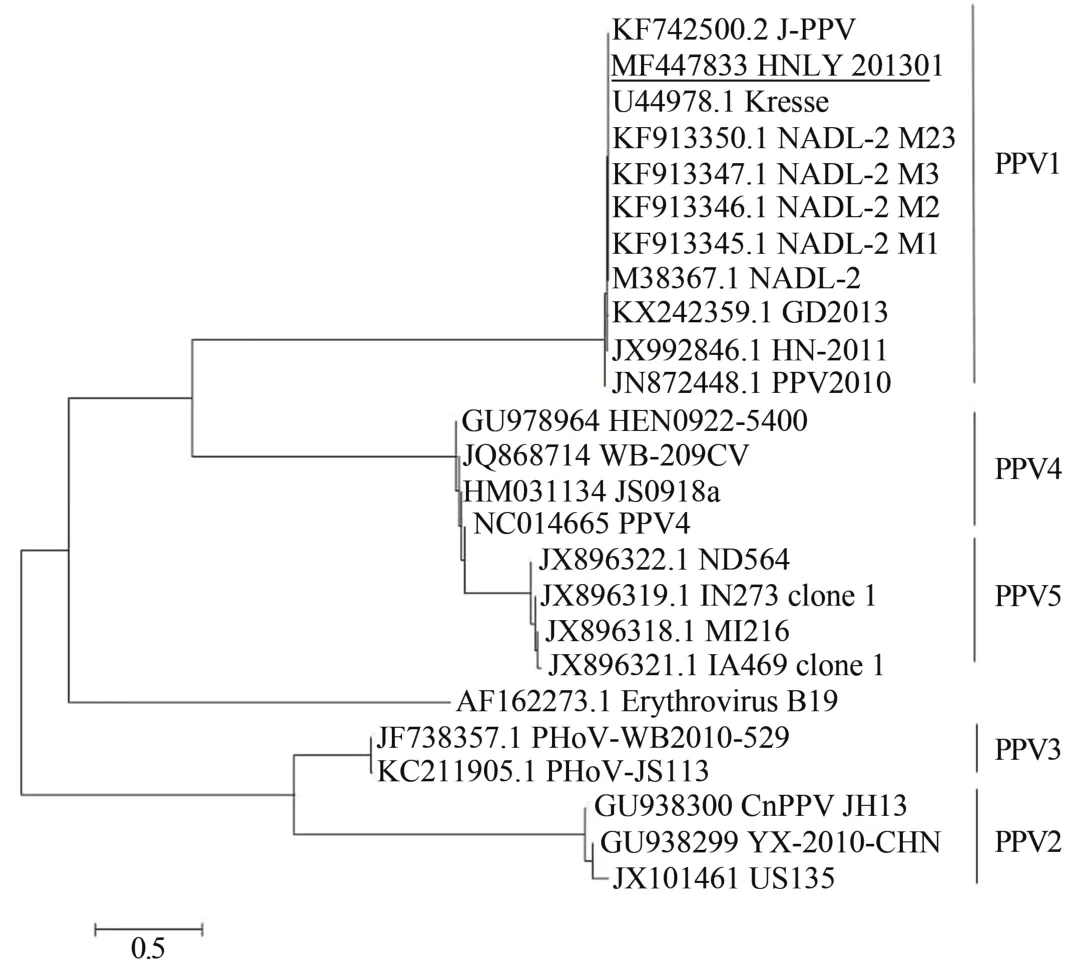
图1 基于NS1基因的系统发育树分析Figure 1 Phylogenetic tree analysis based on NS1 gene
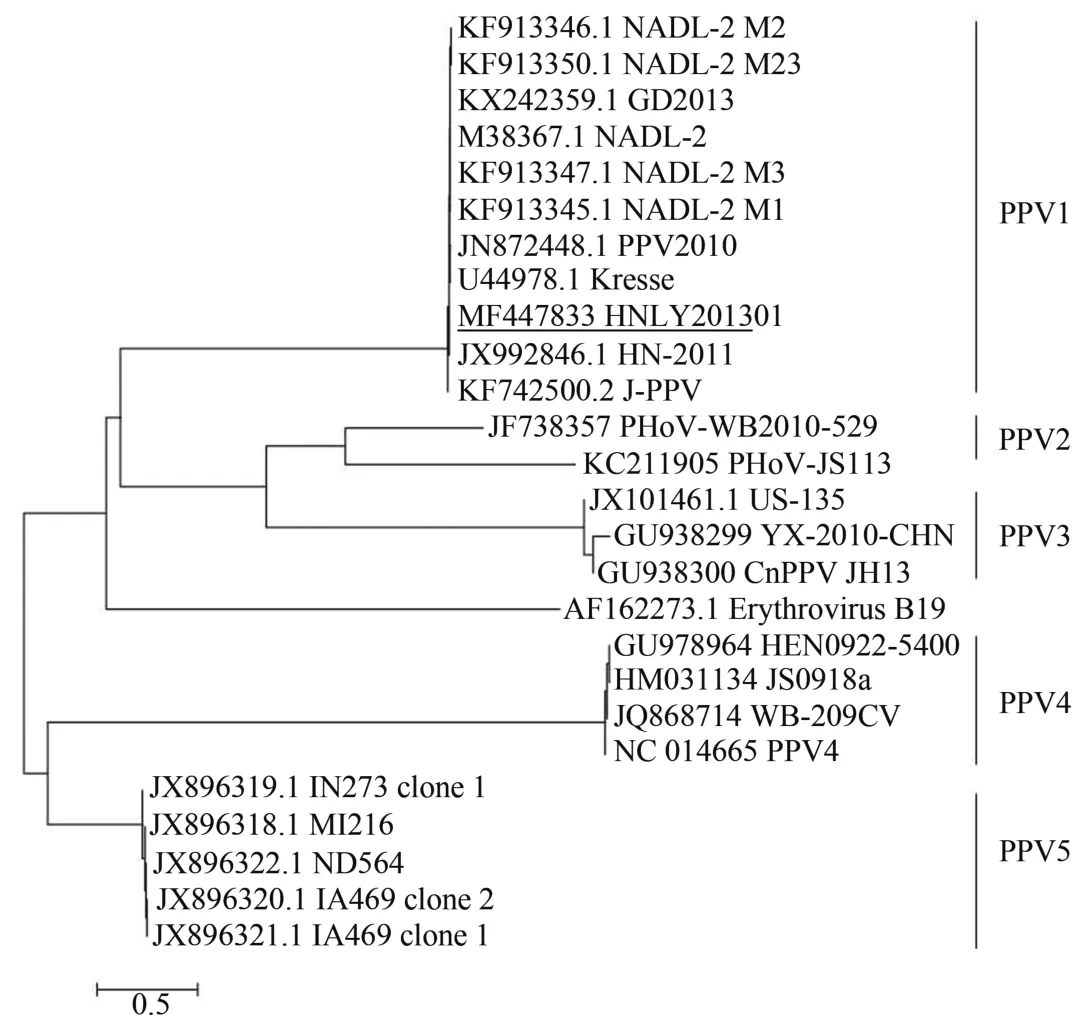
图2 基于VP1基因的系统发育树分析Figure 2 Phylogenetic tree analysis based on VP1 gene
2.3 病毒的细胞病变效应及生长曲线测定

图3 HNLY201301株在PK-15细胞上引起的CPE(200×)Figure 3 CPE induced by HNLY201301 strain on PK-15 cells
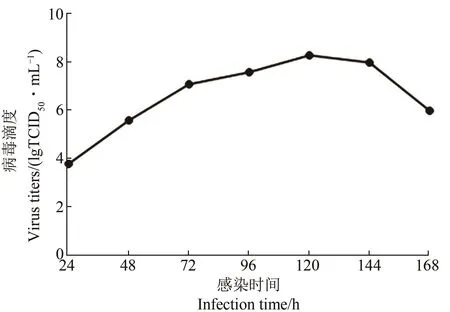
图4 HNLY201301株在PK-15细胞上的生长曲线Figure 4 Growth curve of HNLY201301 strain on PK-15 cells
2.4 病毒血凝性分析
血凝试验结果显示,HNLY201301株可以凝集小鼠、大鼠、豚鼠、兔、鸡、鸭和猪的红细胞。其中猪的红细胞的凝集价最高,为1∶1 024,其次为兔和小鼠的红细胞的凝集价,均为1∶512,其余动物红细胞的凝集价为1∶256。表明HNLY201301株血凝谱广,凝集价高。
2.5 静脉注射导致的小鼠感染分析
静脉注射HNLY201301株,在3 d的观察期内,未观察到明显临床症状,所有小鼠均存活。取小鼠血液及部分组织器官,提取病毒DNA后qPCR法检测病毒拷贝数。结果(表4)表明,36 h内能在小鼠血液中检出PPV,不同性别之间差异不显著。对于多种组织器官中病毒的检测,主要在雌鼠子宫检出了PPV,睾丸和脾脏仅一例阳性无代表性,其余部位如心、脾、肺、卵巢和储精囊检测结果均为阴性。病理切片结果(图5)显示,小鼠的子宫有明显的病理变化,主要病变为子宫固有层毛细管扩张充血,子宫腺增生(绿色箭头指示),中性粒细胞及淋巴细胞浸润全层,组织疏松肿胀,炎症明显(红色箭头指示)。基于试验结果以及PPV的生殖道感染特点,我们选择阴道灌注的方式对雌鼠的感染情况进行进一步了解。

表4 静脉注射感染小鼠组织中的病毒载量Table 4 Tissue distribution of PPV DNA load in mice infected by intravenous injection
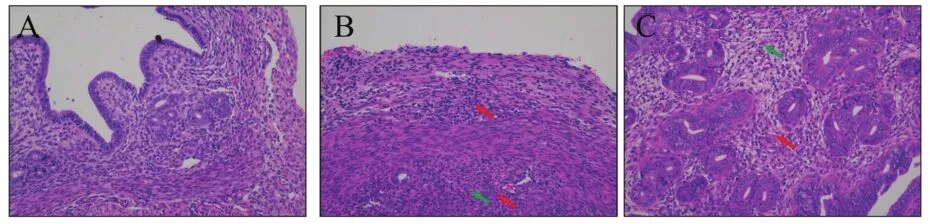
图5 静脉注射PPV后小鼠子宫病理切片(200×)Figure 5 Pathological sections of mouse uterus after intravenous injection of PPV
2.6 阴道灌注导致的小鼠感染分析
通过阴道灌注HNLY201301株,在15 d的观察期内,检查发现小鼠的阴唇肿胀,所有小鼠均存活。qPCR结果(表5)表明,感染3 d后,小鼠的子宫和肝脏检测结果呈阳性。感染7 d后,在子宫和肝脏中未检测到病毒。在子宫、心脏、肝脏和脾脏的病理切片中,同样只有子宫可以观察到不同程度的病变(图6)。比较典型的病变是子宫内膜上皮出现绒毛状增生以及子宫内膜上皮坏死(绿色箭头指示),中性粒细胞浸润,炎症明显(红色箭头指示)。
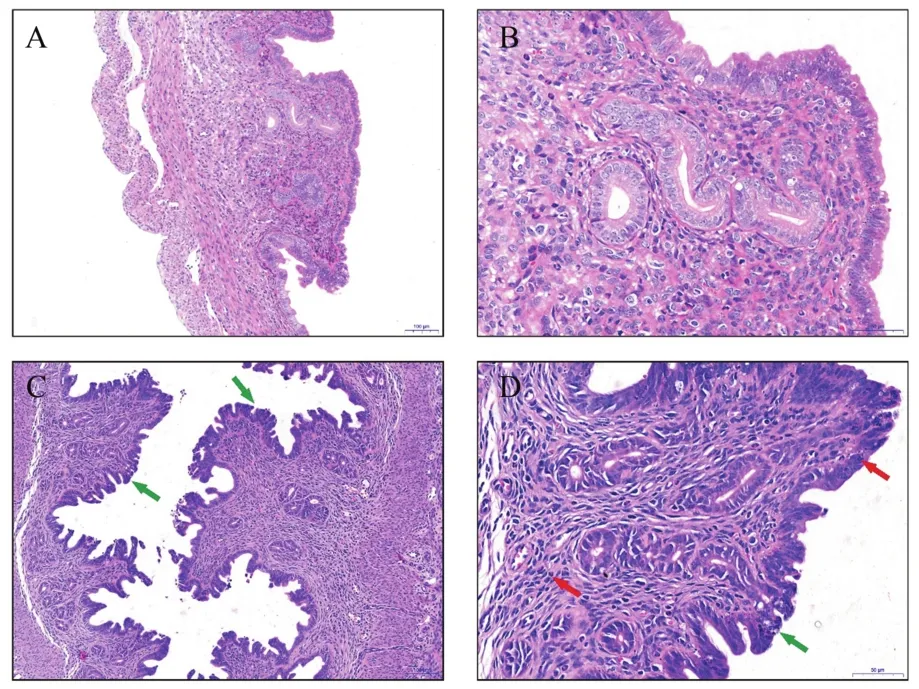
图6 阴道灌注PPV后小鼠子宫病理切片Figure 6 Pathological sections of mouse uterus after vaginal perfusion of PPV

表5 阴道灌注感染小鼠组织中的病毒载量Table 5 Tissue distribution of PPV DNA load in mice infected by intravenous injection
3 讨论
HNLY201301株的基因组大小为4 723 bp,有两个主要ORF,以及5′-UTR和3′-UTR,符合PPV基因组的典型结构[11]。尽管HNLY201301株核苷酸序列的第121至159位存在39个碱基的缺失,但无法确定这些缺失对HNLY201301株的生物学功能是否有影响,需要进一步的研究来确定其生物学特性和遗传进化特征,同时也需要更广泛的流行病学调查来确定PPV1在中国猪群中的分布和传播。
HNLY201301株是2013年5月在河南洛阳某小型养殖户中发现,与从同省份2011年分离的HN-2011株和2013年分离的J-PPV株具有较高的核苷酸同源性和氨基酸同源性,并且同属于PPV1,推测PPV1已在河南的养殖场中流行,并且在当地猪群中保持较低的进化率。查询PPV的流行病学调查研究得知,以河南驻马店为例,2014年上半年PPV的平均阳性率为25.0%[12],国内其他地区PPV的平均阳性率在16.7%~41.1%之间(包括湖北、四川及贵州部分地区)[13],因此PPV在我国仍需得到重视,必须加强防控以减少损失。
国内目前主要依靠疫苗免疫以及提高饲养管理水平来防控PPV感染,尽管亚单位疫苗、重组活载体疫苗以及核酸疫苗的研究陆续取得了一定突破,但目前最常用的疫苗主要为灭活疫苗(所用毒株包括CP-99株、S-1株、BJ-2株、WH-1株、NJ株、CG-05株、YBF01株以及L株)[14],而弱毒疫苗(所用毒株包括NADL-2弱毒株、HT株、HT-SK-C株以及N株)由于存在毒力反强的可能,同时不易保存和运输,再加上无法区分疫苗接种动物及野毒感染动物可能对免疫程序造成影响,这些原因都使弱毒疫苗的运用受到一定限制[15-17]。Kresse株为经典PPV强毒株,NADL-2株为经典PPV弱毒株,通过比对多株PPV VP2蛋白的氨基酸序列分析后发现,45S、215I、378G、383Q及436P位点在决定毒株的组织嗜性和致病性强弱上起重要作用,通常表现为强毒株[18-19],HNLY201301株符合PPV强毒株的特征。本试验中,HNLY201301株的滴度可达10-8.45TCID50/mL,对比弱毒N株的10-4.39TCID50/mL[20]以及重组病毒rPRV-VP2株的10-4.75TCID50/mL[21],HNLY201301株在猪肾细胞系中较高的滴度表明,其作为疫苗候选株具有优良的潜力。
目前,PPV对小鼠的致病性研究尚未见报道。我们的试验发现HNLY201301株感染不会造成小鼠死亡,但能够感染小鼠子宫细胞并造成病理损伤。病毒的感染通常需要病毒与易感细胞上的受体结合,从而达到入侵的目的,由此我们推测,小鼠的生殖细胞上可能存在能与PPV进行结合的受体。
