杉木2代和2.5代种子园遗传多样性评估
2022-08-04杨汉波吴华雪张小国杨昌通陈良华
方 月,杨汉波,吴华雪,雷 洵,张小国,杨昌通,黄 振,陈良华,朱 鹏*
(1.长江上游林业生态工程四川省重点实验室/长江上游森林资源保育与生态安全国家林业和草原局重点实验室/华西雨屏区人工林生态系统研究长期科研基地/四川农业大学生态林业研究所,成都 611130;2.洪雅县国有林场,四川洪雅 620360;3.四川省林业科学研究院,成都 610081)
林木种子园是由优树无性系或家系按营建设计要求,实现集约经营,以生产遗传品质和播种品质优良的林木良种为目的的特种人工林。种子园通过有性繁殖生产林木良种,既要获得较高的遗传增益,又必须保持较宽的遗传基础[1],因此要求种子园具有丰富的遗传多样性。丰富的遗传多样性既是种子园获得高遗传增益的基础,也是种子育苗所营造的林分具有较强的适应性的保障,尤其对避免极端气候等环境因子造成林分损失至关重要[2]。
杉木(Cunninghamia lanceolata)是中国南方省区最重要的用材树种之一,其分布广、面积大、产量高、用途广,在国民经济和生态环境建设中发挥了重要作用。根据《中国森林资源报告(2014-2018)》的数据显示,目前我国杉木林的面积已达1 138.66万hm2(居全国乔木林树种的第二位),其中人工栽植的杉木林面积达990.20万hm2,占全国人工乔木林总面积的17.33%,是全国人工面积最大的乔木树种,所生产的木材约占我国商品材的1/4。四川长久以来就是我国重要的传统杉木产区之一,四川杉木人工林面积达35.42万hm2,仅次于柏木和柳杉,居四川人工林树种的第三位。由于20世纪末和本世纪初四川杉木育种工作较为缓慢,导致目前四川省的杉木种子园仍处在2代和2.5代的育种世代,而全国多个杉木主产省份都已进入3代种子园的育种世代,福建甚至已经开始进入4代种子园的育种世代,因此四川的杉木育种工作亟须加快步伐进入更高育种世代的种子园,为四川杉木人工林的发展提供更高增益的优良种子。种子园的升级换代通常是以现有世代种子园为基础,因此为保障更高世代种子园遗传基础的丰富性,掌握现有世代种子园的遗传背景十分必要。
目前从分子水平评估林木遗传多样性,发掘优良林木基因资源,以促进林木的遗传改良,已经成为开展林木育种工作的重要方法和手段。李云晓[3]利用SSR标记对杉木地理种源群体的遗传多样性水平和遗传结构进行了系统测定和深入分析;Duan H.J.等[4]运用SSR标记,对中国南方六省杉木遗传特性及其核心种质资源进行了分析与评价;陈兴彬等[5]利用SSR标记研究杉木种子园亲子代遗传多样性差异并进行了父本分析;郑会全等[6]应用SRAP标记技术对32个速生型杉木无性系的遗传多态性和遗传相似性进行测定、分析,并作UPGMA聚类;陈由强等[7]利用RAPD标记技术分别对我国不同杉木种源区的杉木进行了遗传变异分析;杨玉玲[8]运用ISSR标记对不同杉木地理种源的无性系与杂交种进行了ISSR指纹鉴定。国外同样有学者运用分子标记技术进行了类似的研究,例如B.Pakull等[9]用SSR技术研究了4个德国花旗松种子园的遗传多样性;A.L.Alzate-marin等[10]用SSR技术分别评估了森林基因库中白坚木属和翅玉蕊属植物的遗传多样性;Bai T.D.等[11]同样运用SSR技术研究了58 a生的马尾松种子园生产群体及其子代林的遗传多样性。相比于传统形态学而言,现代分子标记技术可以准确、快捷地反映出物种的遗传物质和表达产物的遗传变异,且这种方式的运用与目标基因紧密相关,不易受到外界环境或其他基因效应的影响,试验结果稳定可靠[12]。
SSR标记作为目前最常用的分子标记技术之一,具有多态性高、重现性、稳定性好、能够区分纯合体与杂合体和对DNA样品质量要求不高等优点,比RFLP标记的多态性更丰富,较RAPD标记的重复性和可信度高,是目前比较优秀的遗传标记之一。本研究以洪雅县国有林场国家杉木良种基地的杉木2代种子园及2.5代种子园为研究对象,通过SSR分子标记技术分析其遗传多样性水平以及两个种子园的遗传多样性差异,并结合遗传分化、基因流、分子方差、聚类和遗传结构等分析,掌握种子园无性系的遗传分化和遗传结构状况,为指导洪雅县国有林场杉木种子园生产经营和遗传管理提供依据,同时为杉木3代种子园营建的无性系构建提供遗传信息基础。
1 材料和方法
1.1 种子园概况
洪雅林场杉木2代和2.5代种子园均位于洪雅林场目禅寺工区,东经103°15′,北纬29°42′,海拔高度960~1 200 m。土壤为山地黄壤,微酸性,土层厚度100 cm以上,腐殖质层厚度20 cm以上,肥力水平中等。年平均气温12.5℃,≥10℃的活动积温5 054~5 500℃。年降水量2 300 mm,年日照600~800 h,无霜期260 d。
2代种子园始建于2001年,2001年冬完成砧木定植,2003年春进行无性系嫁接,2008年投产,建园无性系为110个无性系。建园无性系由省种苗站组织在川渝地区的1代种子园子代林、优良林分进行优树选择而来,分别来自月江种子园(YJ)、叙永大安林场(XY)、南川林木良种场(NC)、筠连种子园(JL)、富顺种子园(FS)、珙县民生种子园(GX)、玉蝉园用材林研究所(YC)和洪雅林场(HY)8个来源地,无性系编号为全省统一编号。2.5代种子园始建于2015年,2015年冬完成砧木定植,2017年春进行无性系嫁接,目前已经开始投产,建园材料为2代种子园中50个表现更为优良的无性系。
1.2 研究方法
1.2.1 样品采集
剪取110个无性系当年生枝条顶端最幼嫩约5 cm长的部分,放入7 cm×9 cm的自封袋中并立即倒入变色硅胶干燥,然后尽快放入-4℃冰箱中保存。
1.2.2 分子数据获取
①DNA提取
采用改良CTAB法[13]提取DNA,并用1%琼脂糖检测获得的DNA原液,电泳图见图1。
图1 杉木DNA琼脂糖电泳图Figure 1 Agarose electrophoresis of C.lanceolata DNA
②SSR筛选
本试验从已发表的文献中[3,14-18]收集杉木树种的SSR引物。随机选择3个DNA样本作为模板,分别用每对SSR引物对其进行PCR扩增,在试验过程中不断优化反应条件,针对部分引物进行退火温度梯度试验,用1%的琼脂糖凝胶电泳检验扩增结果,确定最适退火温度,筛选可扩出目的条带的引物。经过多次筛选,最终确定13对SSR引物用于数据分析。其中13对SSR引物信息如下表1。
③基因分型
PCR扩增反应体系总体积为15µL,反应液组成如下:Taq酶Mix 6.0µL、Primer F和R引物(20 µmol/mL)各0.3 µL,模板DNA(约 10 ng/µL)2µL,ddH2O 6.4µL。PCR反应程序为:95℃预变性3 min,95 ℃变性30 s,退火30 s,72 ℃延伸40 s,32个循环,72℃延伸5 min。荧光引物扩增产物由生工生物工程股份有限公司进行微卫星分型分析。用ABI-3730测序仪(applied biosystems)检测扩增产物。
1.2.3 数据分析
用GeneMaker软件获取SSR数据,用Microsoft Excel和DataFormate软件将SSR数据转换为各软件所需格式。利用GenAlEx 6.2软件计算遗传多样性参数,包括等位基因数目(Na),有效等位基因数目(Ne),Shannon多样性指数(I),表观杂合度(Ho)和期望杂合度(He)和固定指数(F),并进行AMOVA分析。用Cervus 3.0计算各引物的多态信息含量(PIC)。
用NTSYS 2.1软件计算无性系间的Nei′s遗传距离,然后根据所得Nei′s遗传距离用MEGAX软件进行 UPGMA(unweighted pair-group method analysis)法进行聚类分析,将得到的树状图在ITOL网站(https://itol.embl.de/)上进行美化。用Structure 2.3.4软件进行遗传结构分析,在运算过程中将K值设置为1~10个分类类群进行计算,每个K值重复计算10次,每一次运算都进行1 000 000次迭代次数重复和100 000次BURNIN,然后将Structure计算结果用Structure Harvester[19]计算ΔK与K值得关系,并作变化趋势图分析,然后根据ΔK最大的原则选择最合理的分组数[20],将得到的遗传结构图用Clumpp和Distruct软件美化。
2 结果与分析
2.1 杉木遗传多样性
2.1.1 13个SSR位点的杉木遗传多样性
基于13个SSR位点的两个种子园遗传多样性显示(表2),13个位点在2代种子园110个无性系中均表现出多态性,而在2.5代种子园50个无性系中只有12个位点表现出多态性。相比2代种子园,2.5代种子园有10个位点的等位基因数(Na)出现一定程度的减少,除XSM8减少了7个等位基因外,其他位点的减少数量仅为1~3个,13个位点总共减少了20个等位基因(131 vs 111),平均减少了1.6个(10.1 vs 8.5);有效等位基因数(Ne)2.5代种子园则有8个位点出现了减少,有2个位点没有变化,但有3个位点出现了增多,平均值减少了0.36个(4.71 vs 4.35);Shannon′s信息指数(I)2.5代种子园有10个位点出现减少,而有3个位点出现增多,平均值减少了0.049(1.213 vs 1.164)。杂合度方面,2.5代种子园表观杂合度和期望杂合度相比2代种子园分别有6个和8个位点出现减少,但分别有7个和5个位点出现增多,平均期望杂合度(He)减少了0.009(0.478 vs 0.469),但平均表观杂合度略有增加(0.440 vs 0.441)。固定指数(F)方面,两个种子园均有5个位点表现出杂合子过剩,其余表现为杂合子缺失(除2.5代种子园的CLSSR11),综合来看(平均值)均表现为一定程度的杂合子缺失(0.140和0.086)。根据Botstein对位点多态性程度的划分理论[21],两个种子园的低度多态位点(0<PIC<0.25)、中度多态位点(0.25<PIC<0.5)和高度多态位点(PIC>0.5)数量没有变化,均分别有6、1和6个位点,综合均表现为中度多态性,但2.5代种子园有所增加(0.459 vs 0.487)。
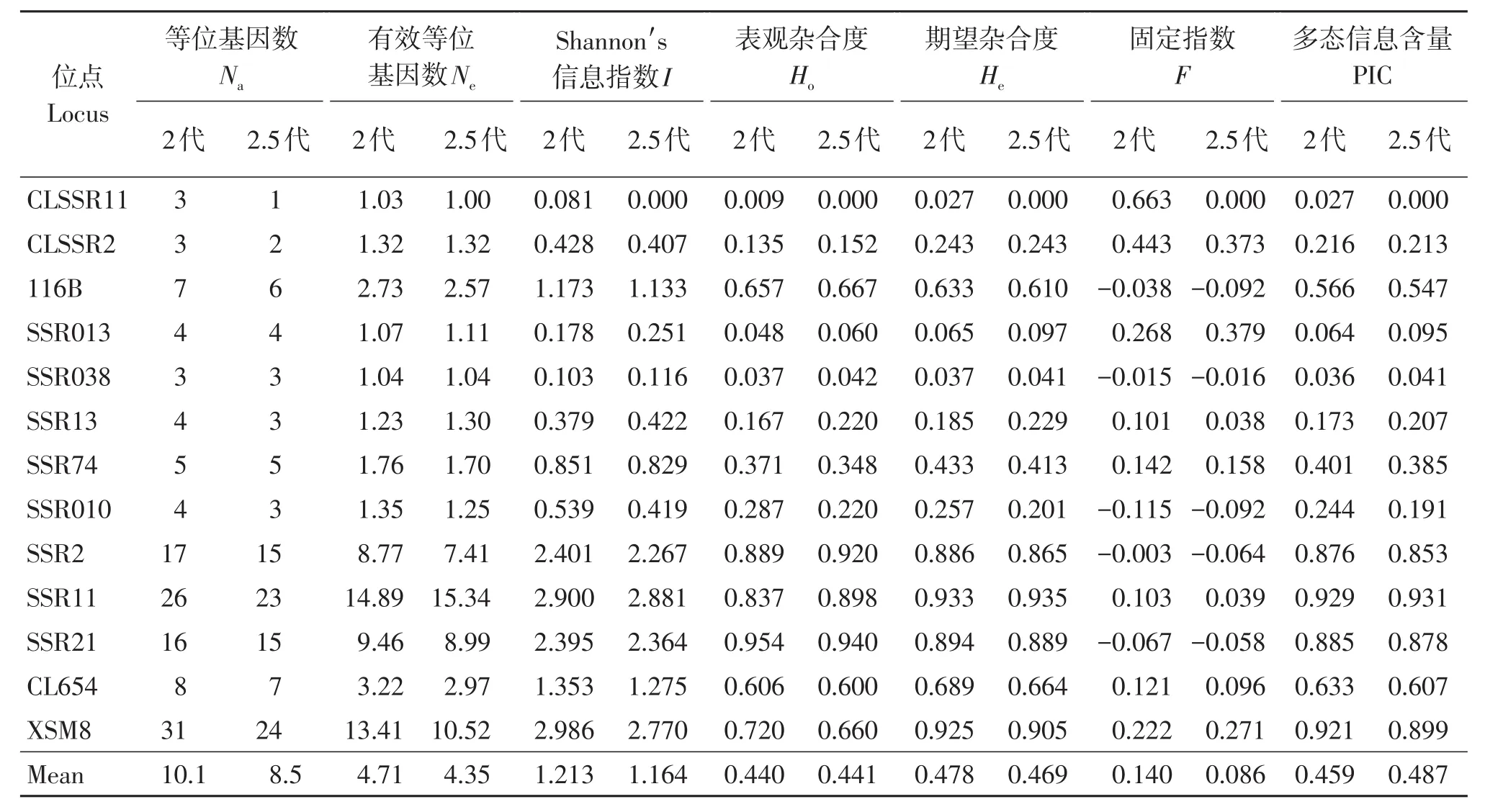
表2 两个种子园13个SSR位点的遗传多样性Table 2 Genetic diversity of 13 SSR locus of two seed orchards
2.1.2 不同来源间的遗传多样性
不同来源杉木群体的遗传多样性显示(表3),各来源的无性系个数为6(GX)到26个(XY)不等,等位基因数在3.62(GX)~6.85(NC),有效等位基因数范围在2.61(HY)~4.52(NC),Shannon′s信息指数在0.836(HY)~1.121(NC),3个指数的最小值和最大值均出现在个体数较少和较多的来源群体中。杂合度方面,表观杂合度最小值(0.428)的最大值(0.487)分别出现在个体数最多的叙永大安林场(XY)和最少的珙县民生种子园(GX),但期望杂合度的最小值(0.409)出现在洪雅林场(HY),最大值(0.472)出现在叙永大安林场(XY),与表观杂合度相反。固定指数显示GX和HY两个群体为杂合子过剩,其余群体为杂合子缺失。
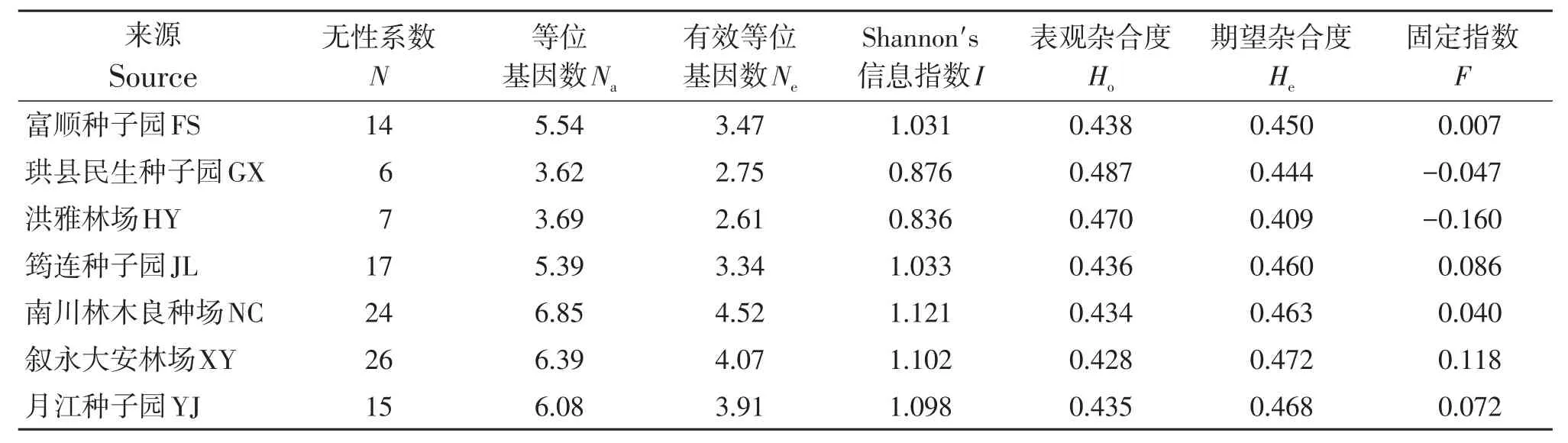
表3 不同来源的杉木2代种子园的遗传多样性Table 3 Genetic diversity of different sources in the 2nd generation seed orchard of C.lanceolata
2.2 杉木2代种子园不同来源的遗传分化与基因流
遗传分化系数(Fst)能够很好地反映出种群的遗传分化程度,其中Fst<0.05说明分化程度较小;0.05<Fst<0.15则显示出一个中等程度的遗传分化水平;Fst>0.15则说明遗传分化程度较大[22-23]。表4可知杉木2代种子园7个来源的遗传分化在0.009~0.051,只有GX和HY群体之间处于中等水平遗传分化,其余群体之间均处于较低水平的遗传分化。种群遗传学认为,不管种群大小如何,只要基因流是多向性的,当种群间的基因迁移数目大于1时(Nm>1),基因流就可以防止由遗传漂变引起的遗传分化[24]。表4中7个来源间的基因流范围为4.643~27.739,均大于1,种群之间存在广泛的基因交流。
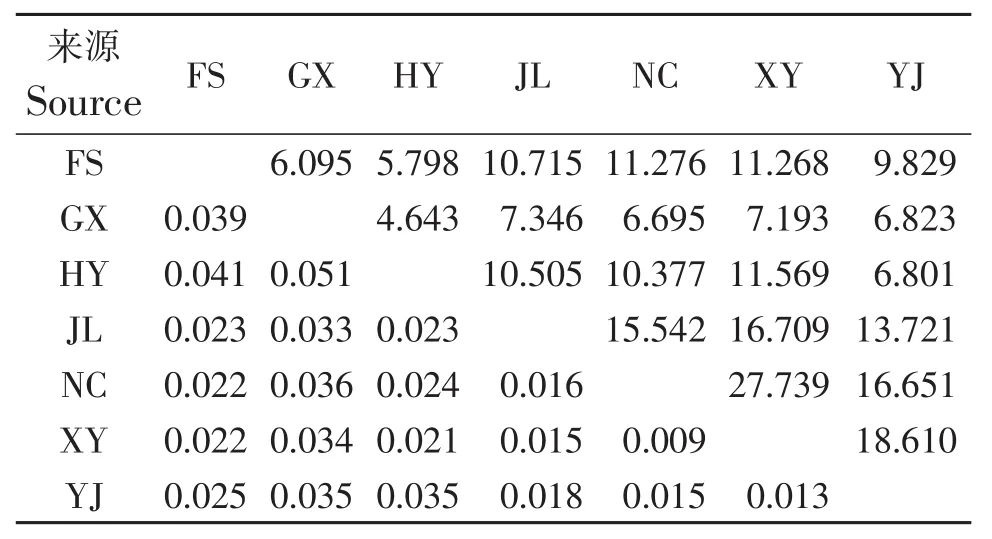
表4 杉木2代种子园不同来源的遗传分化与基因流Table 4 Genetic differentiation and gene flow of different sources in the 2nd generation seed orchard of C.lanceolata
2.3 杉木2代种子园群体的分子方差(AMOVA)分析
通过对7个来源群体进行分子方差分析来进一步了解各来源间的遗传分化水平。结果表明(表5),遗传变异的主要来源是群体内,占总变异的99%,群体之间的遗传变异只占1%,与遗传分化结果一致。
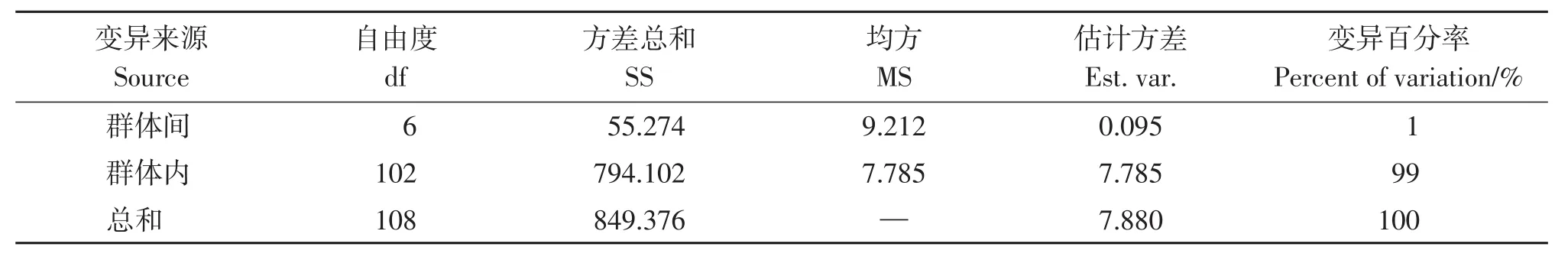
表5 基于13对SSR标记的杉木种子园AMOVA分析Table 5 AMOVA of C.lanceolata seed orchard based on 13 pairs of SSR markers
2.4 杉木2代种子园的聚类分析及遗传结构分析
2.4.1 聚类分析
杉木2代种子园的聚类分析显示(图2~3),无论是以群体来聚类和无性系来聚类,均没有明显的聚类,群体间和无性系间的遗传距离都比较近。群体聚类中只有YC群体单独聚为一类,与该群体只有一个无性系有关;无性系聚类中各来源的无性系均未明显聚在一起。
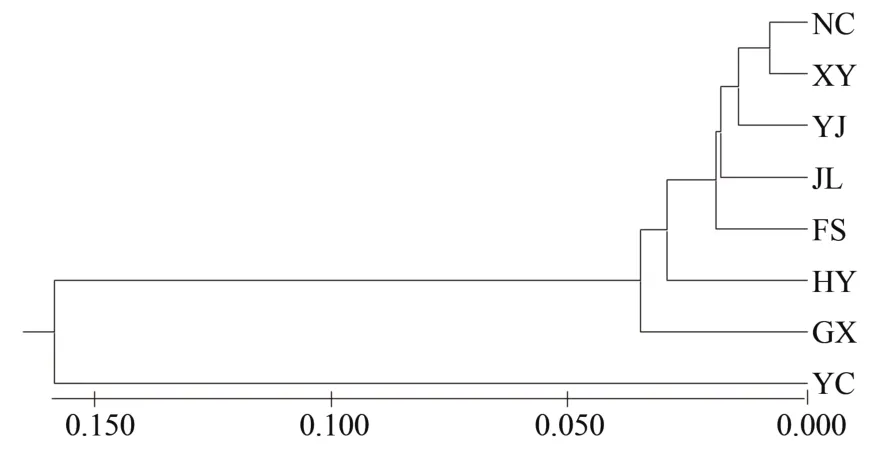
图2 杉木2代种子园8个来源的聚类Figure 2 Clustering of 8 sources in the 2nd generation seed orchard of C.lanceolata
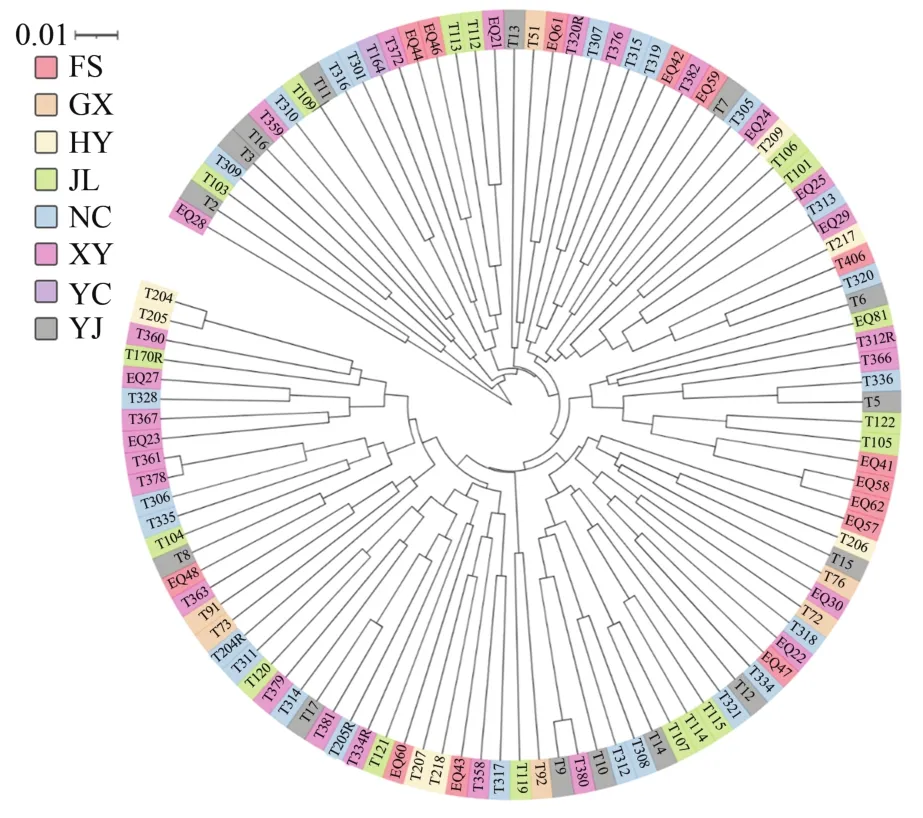
图3 杉木2代种子园110个无性系的聚类Figure 3 Clustering of 110 clones in the 2nd generation seed orchard of C.lanceolata
2.4.2 杉木2代种子园110个无性系的遗传结构分析
利用Structure软件对110个无性系材料进行群体结构分析,以设定的K所对应的最大似然值为标准来选择合适的亚群数目。图4可知,当K=2时ΔK有最大峰值,所以110个无性系最适合分为2个祖先类群。图5为110个无性系遗传结构分析结果,由图可知,每个无性系遗传结构均包含类群Ⅰ和类群Ⅱ,且两个类群成分所占比例差异不大,表明110个无性系均来自相同两个祖先类群,且在遗传上已经趋于一致,与遗传分化结果具有一致性,可视作一个近亲群体。
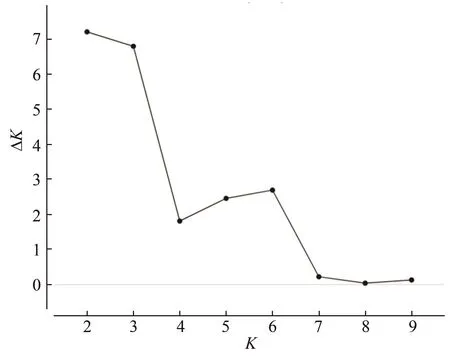
图4 似然值最大法选取K值Figure 4 Maximum likelihood value method to select K value
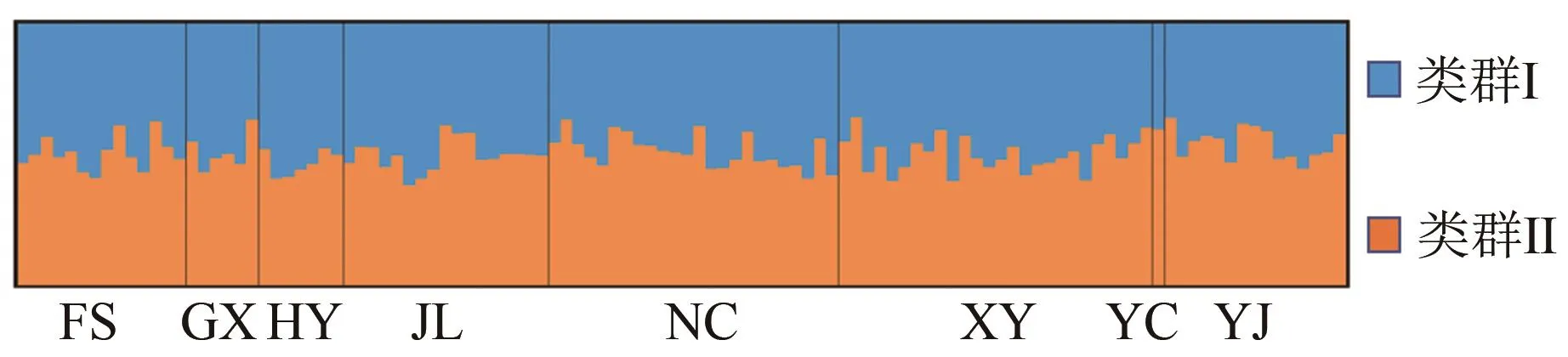
图5 杉木110个无性系遗传结构Figure 5 Genetic structure of 110 C.lanceolata clones
3 讨论
3.1 2代和2.5代种子园遗传多样性状况
洪雅县国有林场国家杉木良种基地2代种子园的表观杂合度(Ho)和期望杂合度(He)分别为0.440和0.478,表现出一定程度的杂合子缺失(F=0.140),与大多数已报道的杉木种子园、种质资源和群体的结果相似[3,25-27],但表观和期望杂合度值要低于大多数已报道的杉木种子园、种质资源和群体,如湖南攸县和广东乐昌不同育种世代杉木种子园(0.630~0.679和0.623~0.692)[26]、陈山红心杉 1.5代种子园(0.571和0.557)[5]、赣南地区的11个杉木群体(0.456和0.565)[25]、广西864份种质材料(0.65和0.60)[28]和全国177个种源184单株材料(0.559和0.751)[3]等;而平均等位基因数(Na,10.1)、有效等位基因数(Ne,4.71)和Shannon多样性指数(I,1.213)则高于大多数的杉木种子园、种质资源和群体[5,25-29],但低于全国177个种源184单株材料[3]。与其他针叶林种子园相比,杉木2代种子园与樟子松[29]杂合子缺失程度和杂合度值都相似,马尾松[30-31]、华北落叶松[32]等种子园杂合子缺失的程度较为严重,但期望杂合度都大大高于杉木2代种子园;而杉木2代种子园的平均等位基因、有效等位基因和Shannon多样性指数要高于华北落叶松[32],但低于马尾松、樟子松和华山松[29-31,33]。综合来看,相比其他杉木种子园、种质资源和群体,以及其他针叶树种,洪雅林场国家杉木良种基地2代种子园等位基因水平相对较高,但杂合度略显不足。
由于SSR位点的等位基因数量本身存在较大的差异,从而导致不同位点或不同位点组合所呈现的遗传多样性可能存在较大差异,而在一定程度上减少了位点不同或位点组合不同的研究之间的可比性,因此直接比较研究中相同位点的遗传多样性信息能更好地反映遗传多样性的状况。本研究的12个位点的等位基因数在3(CLSSR11)到31(XSM8)不等,位点CLSSR11的遗传多样性指标均略高于杭芸等的研究结果,而位点CLSSR2的遗传多样性指标则略低于杭芸等的研究结果[34];SSR74、SSR013、SSR010、SSR038和SSR13这4个位点的多态信息含量低于程健弘的研究结果,但等位基因数要高于程健弘的研究结果[35];SSR2、SSR11和SSR21这3个位点表现出来的遗传多样性要高于Duan H.J.等[4]的研究结果;位点XSM8的遗传多样性指标也高于李云晓[3]的研究结果。因此,12个位点在洪雅林场国家杉木良种基地2代种子园表现出来的遗传多样性大多数并不低于其他研究中的结果。
2.5代种子园是根据2代种子园子代测定的结果在2代种子园中选择出其子代表现优良的母树无性系重新构建的种子园,仅仅根据表型选择可能会导致遗传多样性减少从而影响该种子园的种子质量和遗传增益。本研究中,2.5代种子园相比2代种子园的平均等位基因数(10.1 vs 8.5)、有效等位基因数(4.71 vs 4.35)、Shannon多样性指数(1.213 vs 1.164)和期望杂合度(0.478 vs 0.469)都有所减少,但表观杂合度(0.440 vs 0.441)基本没变,多态信息含量(0.459 vs 0.487)略有增加,杂合子不足的程度也有所下降(F,0.140和0.086)。从单个位点看,相较2代种子园,2.5代种子园各位点除等位基因均出现一定程度的减少外,其他多样性指标都只是部分位点减少但有部分位点增加的现象,表观杂合度和期望杂合度甚至有一半左右的位点存在增加。可见,虽然2.5代种子园虽然因为无性系数量的减少等位基因数量出现了一定程度的减少,但总体上的遗传多样性并没有明显降低的趋势,2.5代种子园的50个无性系能较好地代表原有2代种子园110个无性系的遗传多样性。
3.2 来源间和群体的遗传分化和遗传结构
通过分析洪雅林场杉木2代种子园110个无性系除YC外的7个来源的遗传多样性发现,不同来源之间的杉木遗传多样性明显存在一些差异,但总体都有着较高的遗传多样性水平。除观测杂合度之外的指标最小值均出现在GX和HY两个群体数较小的群体中,最大值出现在NC和XY两个群体数较大的群体中,表明各来源的遗传多样性与群体数大小有一定关联。与何龙燕[25]的研究结果相似,这可能是由个体数较少所导致。而段红静[36]的研究结果表明当杉木样本量足够时,样本的多少可能不再对杉木的遗传多样性产生影响,说明本研究中可能存在7个来源的个体数太少的问题。对7个来源间的遗传分化和基因流进行分析发现,来源间大都处于较低程度的遗传分化水平,存在广泛的基因交流,说明种群间频繁的基因交流导致了较低水平的遗传分化,这与段红静[36]对不同种源间杉木遗传多样性研究结果相同。同样地,分子方差分析(AMOVA)结果表明,变异的主要来源是群体内,群体间只占1%,表明种子园的遗传变异大部分是由个体间差异造成的,这可能与本研究材料来源地均是四川省内或各群体样本数量不平衡有关,也可能是因为本研究中使用的材料为优良的遗传材料,可能已被广泛使用,导致了基因在过去的人为活动下流动,降低了种群间的分化。
对洪雅林场杉木2代种子园的8个来源进行聚类发现,只有YC群体单独分为一类,而其余7个群体分为一类。但从图1可以看出各来源间的遗传距离呈现出一定的规律,即来源的个体数越多与其他来源的遗传距离越小,也就是说遗传聚类的结果同样受到群体数的影响。对110个无性系进行聚类分析发现,110个无性系遗传距离非常小,亲缘关系近,没有明显分类,且聚类结果与各来源没有明显关联。对其遗传结构的分析也呈现相似的结果,110个无性系可看作来源于两个祖先类群,且每个无性系的遗传结构中两个类群所占比例基本相差不大,表明其在遗传上已经趋于一致,可视作一个近亲群体。与部分研究者对杉木群体遗传多样性的研究结果基本相同[37-38],即便是对杉木地理种源水平上的遗传结构研究[3,14,16],也得出相似的结论。总体上与Wang Z.等[39]研究得出的林木以杂交为主,从而具有较高的遗传多样性而较低的群体间的遗传分化结论吻合。这可能是随着育种世代的增加,收集保存的育种材料越来越多,经过大规模长距离的引种栽培致使群体间基因交流加大从而导致亲缘关系也愈来愈复杂[37],这也更说明通过分子技术对这些优良遗传材料进行系统的遗传多样性研究和遗传背景分类的必要性。
4 结论和建议
杉木是我国南方重要的用材树种,对杉木种子园的遗传多样性进行研究,对于维护种质资源和优树选择有非常重要的意义[40]。本研究通过SSR分子标记技术对杉木2代种子园的遗传多样性进行分析发现,洪雅县国有林场杉木2代种子园具有较丰富的遗传多样性,2.5代种子园50个无性系的遗传多样性没有出现明显减少,能较好地代表原有2代种子园110个无性系的遗传多样性。种子园的遗传分化不明显,基因流频繁,没有明显的遗传结构,变异来源主要存在于个体间,与杉木栽培驯化历史较悠久且产地交流频繁有关。因此,在建立3代种子园过程中,应在2代种子园优良子代材料的基础上补充一些其他地理种源或杉木古树资源的优良基因材料,以保证较高的遗传多样水平,增加种子园的遗传分化,从而提高种子园的遗传增益。
