苹果SHR亚家族基因特征及其器官表达谱分析
2022-07-26于婷婷许阿飞张佳林张玮玮杨洪强
于婷婷,许阿飞,张佳林,张玮玮,杨洪强
苹果亚家族基因特征及其器官表达谱分析
于婷婷,许阿飞,张佳林,张玮玮,杨洪强*
山东农业大学园艺科学与工程学院, 山东 泰安 271018
SHR(SHORT-ROOT)是植物特异性转录因子GRAS的一个亚家族,本研究基于拟南芥SHR序列,从苹果、白梨、蜜柚、甜橙和掌叶覆盆子全基因组数据库中分别获得9、10、5、5和4个亚族成员基因,比较了它们的特征,重点分析了苹果MdSHR蛋白结构及其基因的器官表达。结果表明,所得SHR亚家族成员编码蛋白分子质量在29743.72~62251.21Da,全部定位于细胞核。苹果在染色体上有1对串联复制基因和1对共线性基因;编码蛋白含有10个保守基序,其中5个为所获SHR亚家蛋白共有。MdSHRs和AtSHRs的蛋白二级结构都以无规卷曲和 α 螺旋为主,大部分MdSHRs和AtSHRs的蛋白三维结构相似;9个基因的启动子上含有胁迫响应及激素应答相关元件。器官表达谱分析显示,大部分的表达量在苹果果实和花中较高,在种子和枝条中较低,在根系和幼苗中更低,而在不同器官的表达水平与其他的情况基本相反。
苹果;亚族基因; 生物信息学分析
转录因子能够通过调控基因转录而调控植物生长发育及其对于环境的响应,植物特异性转录因子GRAS家族中的SHR(SHORT-ROOT)亚家族参与基本组织(ground tissue)细胞的分裂与分化,调控根的辐射形态(radial patterning)建成,其基因缺失突变体的根尖基本组织不能进行平周分裂,根系变短[1,2]。SHR能够与SCR(SCARECROW)形成复合体SHR-SCR促进植物根瘤形成[3],也能够调控植物叶和芽的生长发育[4,5],基因突变后会使番茄果实生长和成熟会延迟[6],而且SHR亚家族成员和参与月季营养生长向生殖生长的转换以及调控番茄丛枝菌根发育[7,8]等,这些均显示SHR对植物生长发育具有重要调节作用。
苹果是世界第二大水果,器官生长发育是其产量产生和品质形成的基础。本研究基于苹果等果树全基因组信息,分析SHR亚家族的基因特征和苹果SHRs蛋白质结构特征,并进一步分析的启动子、染色体定位和组织表达等,为揭示功能及深入挖掘苹果基因组信息提供参考。
1 材料与方法
1.1 SHR亚族基因鉴定
通过TAIR网站(https://www.arabidopsis.org/)获得4个拟南芥成员SHR蛋白序列。苹果(Borkh)和掌叶覆盆子(Hu)蛋白数据库来自GDR(https://www.rosaceae.org)。白梨(Rehd.)蛋白数据库来自基因组数据来自GIGA(http://gigadb.org/dataset/100083)。甜橙((Linn.) Osbeck)和蜜柚(LOsbeck)蛋白数据库来自甜橙基因组信息平台(http://citrus.hzau.edu.cn/)。
以下载的4个拟南芥序列(AT3G13840/AT4G37650/AT3G49950/AT5G67411)为查询序列,进行本地blastp搜索;通过Pfam数据库(http://pfam.xfam.org/)获得GRAS蛋白保守结构域(PF0351)文件,并利用HMM 3.0搜索蛋白数据库。利用NCBI-CDD[9]和SMART(http://smart.embl-heidelberg. de/)筛选基因,以确定候选基因含有GRAS保守域。并进行系统发育树分析,获得SHR基因序列。将所获得的序列提交于ExPaSy中的ProtParam(http:// web.expasy.org/protparam/),进行理化性质预测。基因名由其在在染色体上的位置决定。亚细胞定位预测通过Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行。
1.2 SHR亚家族基因染色体定位
利用TBtools获得苹果染色体长度信息,并进一步进行染色体定位。
1.3 SHR亚家族成员系统进化、保守基序及基因结构分析
利用Clustal W软件对苹果和拟南芥的蛋白序列进行多重序列比对,利用MEGA 7.0,采用相邻连接法(Neighbor-Join,NJ),设置参数Bootstrap method为1000,并设置参数Poisson model,Pairwise deletion,生成进化树。
利用MEME[10]和TBtools[11]进行进化树、保守基序和基因结构的可视化。
1.4 苹果SHRs蛋白质结构预测
蛋白质二级结构预测利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html),蛋白质三级结构预测通过SWISS-MODEL(https://swissmodel.expasy.org/)进行[12]。
1.5 苹果SHRs基因启动子分析
从苹果基因组中提取基因翻译起始位点ATG上游约2000 bp的片段作为启动子区域,将所有的启动子序列提交至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/ plantcare/html/),进行启动子顺式作用元件的预测分析。
1.6 MdSHRs在不同器官中的表达谱分析
基于NCBI-GEO(GSE42873)数据库,利用TBtools绘制热图[11],进行苹果亚族基因表达模式分析。
2 结果与分析
2.1 SHR亚族基因的鉴定
依据拟南芥SHR蛋白序列,基于全基因组信息,通过NCBI-CDD和SMART筛选之后,获得了9个苹果亚族基因、10个白梨SHR亚族基因、5个蜜柚亚族基因、5个甜橙亚族基因和4个掌叶覆盆子亚族基因,根据它们在染色体上的位置以及拟南芥中的命名方式,命名如表1。
这些基因编码蛋白长度在202aa()~561aa(),平均长度463.59aa,分子质量在29743.72~62251.21Da,等电点稳定在4.98~6.19之间。亚细胞定位预测显示,苹果、白梨、蜜柚、甜橙、掌叶覆盆子和拟南芥6个物种的亚家族基因编码蛋白均定位在细胞核中(表1)。

表 1 苹果中SHR基因的基本信息
2.2 苹果SHR亚家族染色体分布及共线性分析
苹果基因染色体定位结果显示,苹果的和分别定位于0、2、4、和17号染色体上,和均定位于9号染色体上,、和均定位于15号染色体上。另外,在苹果染色体上和基因紧靠在一起,出现了串联复制的现象(图2)。
图3显示,苹果基因组间有1对共线性基因,即1对节段复制基因,为分别在9号和1号染色体上的和;与拟南芥有4对直系同源基因,即-、-、-和-,它们分别位于拟南芥的3-5号染色体和苹果除2号、9号、12号和15号染色体上。

图 1 苹果SHR基因的染色体定位及串联复制基因分析
注:相同染色体上基因有红色线段连接,表示相关基因为串联重复基因。
Note: The genes on the same chromosome are connected by red lines, indicating that the related genes are tandem repeat genes.

图2 苹果SHR基因的共线关系
注:背景中灰色线条表示苹果基因组内的共线区域,彩色线条突出显示共线的基因对。
Note: The gray lines in the background indicate the collinear blocks in the apple genome, and the colored line highlights the syntenygene pairs.

图 3 拟南芥和苹果SHR基因共线性关系
注:背景中灰色线条表不同基因组中的共线区域,红色线条突出显示共线的SHR基因对。Chr00-17为苹果染色体,AtChr1-5、AtPltd和AtMT为拟南芥染色体。
Note: The gray lines in the scene indicate the collinear blocks within genomes, and the red lines highlight the synteny SHR gene pairs. Chr00-17arechromosomes, AtChr1-5, AtPltd and AtMT arechromosomes.
2.3 苹果SHR家族进化树、保守基序及基因结构分析
利用MEGA 7.0程序,构建所获亚家族成员系统发育进化树(图4,A),结果显示,这些亚家族成员编码蛋白共分为三组,苹果MdSHR1、MdSHR4、MdSHR6、MdSHR7、MdSHR8和MdSHR9为第Ⅰ组,与同处第Ⅰ组的拟南芥AtSHR2和AtSHR4以及白梨PbSHR3、PbSHR5、PbSHR7、PbSHR8和PbSHR10亲缘关系较近。苹果MdSHR、MdSHR3和MdSHR8为第Ⅱ组,与拟南芥AtSHR3以及白梨PbSHR1、PbSHR2、PbSHR6和PbSHR9共处同一组。苹果MdSHR5、白梨PbSHR4和拟南芥AtSHR1共处第Ⅲ组。
利用MEME程序,对苹果SHR亚家族蛋白序列分析预测到10个保守基序(图4,B),其中motif 4、motif 7、motif 8、motif 9和 motif 10等5个保守基序为所获SHR亚家蛋白共有,预示着他们在结构及进化过程中的高度保守性。
基因结构分析显示(图4,C),各物种亚家族成员结构同样高度保守,只有、和含有内含子,其他基因只有外显子而无内含子。
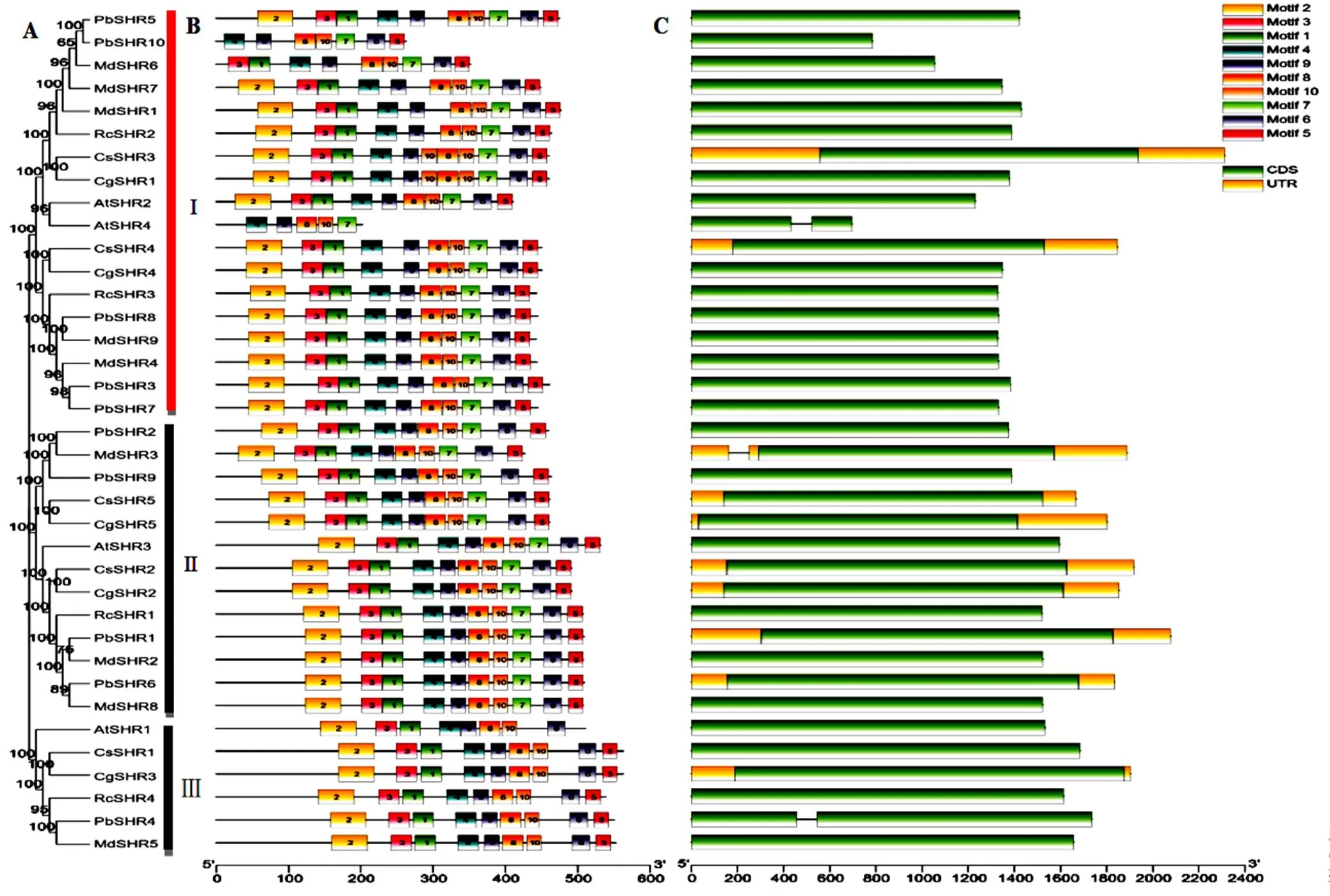
图4 SHR亚家族进化树、保守基序及基因结构
2.4 苹果和拟南芥SHR家族蛋白质结构预测
通过对AtSHRs和MdSHRs蛋白二级结构进行预测(表2),可以发现,13个蛋白质二级结构都以无规卷曲和α螺旋为主,其中,只有AtSHR1和MdSHR5其中无规卷曲占到最大比例。此外,二级结构中还包括β-转角,其占比例都是最小的。通过同源建模的方法绘制AtSHRs和MdSHRs蛋白质三维结构(图5),可以发现,大部分MdSHRs蛋白质三维结构相似,与蛋白的二级结构预测结果相符。其中,MdSHR7与AtSHR1和AtSHR3的蛋白质三级结构相似程度较高,MdSHR2、MdSHR4、MdSHR5、MdSHR8、MdSHR9与AtSHR2的蛋白质三级结构相似程度较高,说明这些基因的编码蛋白具有相似结构,发挥相似功能,也进一步说明进化树聚类、串联复制分析和共线性分析的可靠性。

表2 苹果和拟南芥SHR基因编码蛋白质二级结构
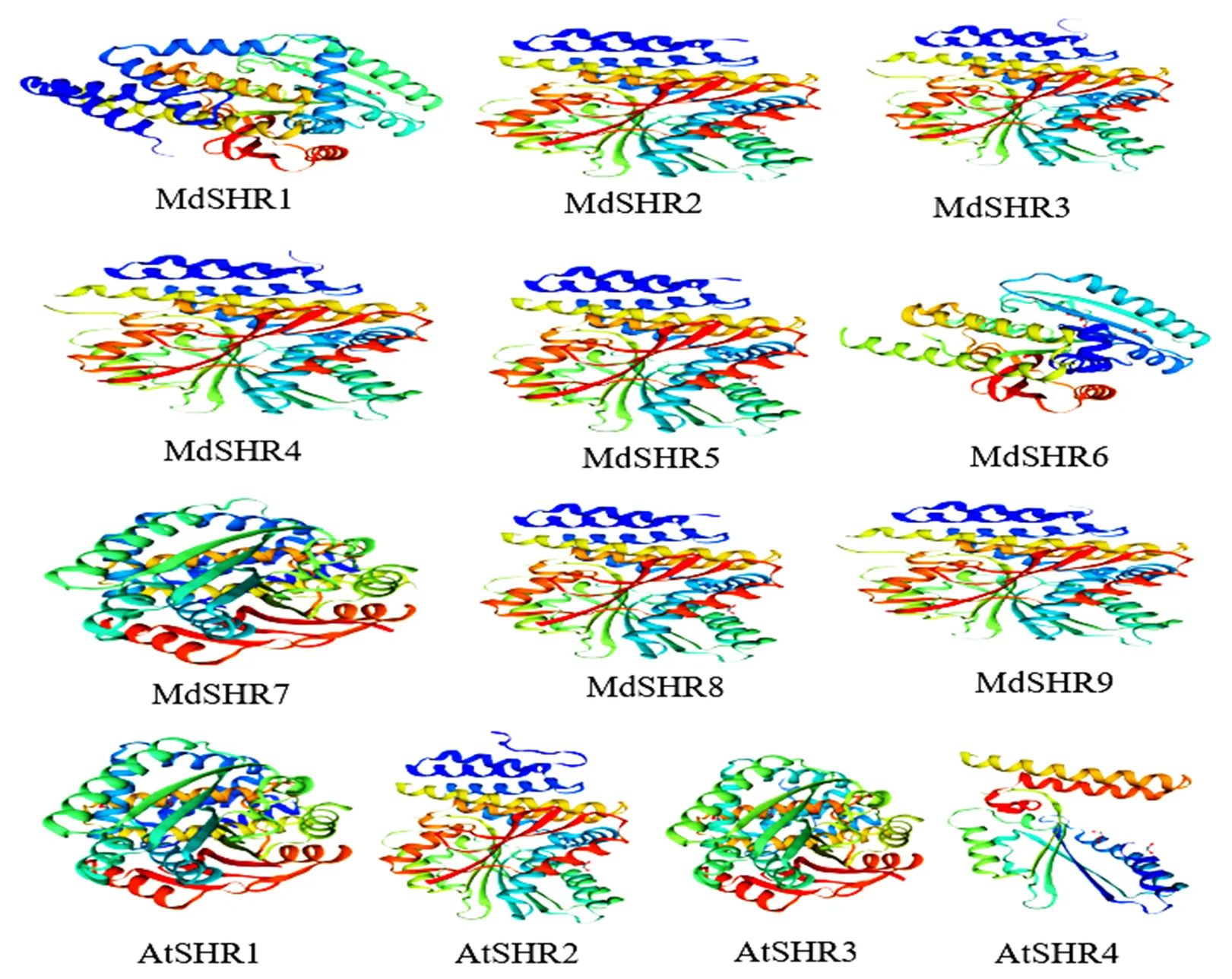
图5 苹果和拟南芥SHR蛋白三级结构预测
2.5 苹果SHR亚家族基因启动子顺式作用元件分析
为预测潜在功能,从苹果基因组中提取翻译起始位点 ATG 上游约 2000 bp 的片段作为启动子区域进行分析(表3),结果显示,9个均含有与非生物胁迫响应相关的多种作用元件,以及与植物激素反应相关的应答元件,比如9个基因上均含有光响应元件和MYB等胁迫相关的元件。其中,在同一分组的中聚在同一进化分支的和的启动子上均含有脱落酸响应元件(ABRE)、低氧诱导响应元件(ARE)、赤霉素(GA)响应元件、低温响应元件(LTR)和茉莉酸(MeJA)响应元件,而与其同在一组的、和启动子上也都含有茉莉酸(MeJA)响应元件。这说明属于同一进化分支的基因可能发挥着相似的功能,也进一步说明进化树聚类的可靠性。

表 3 苹果MdSHRs亚家族基因启动子顺式作用元件分析
2.6 苹果SHR亚家族基因器官表达谱分析
基于NCBI-GEO在线分析,从GEO(GSE42873)数据库,获到9个分别在GD、M14、M20、M49、M67、M74、X41002、X3069、X9220、X4442和X2596等11苹果基因型(或品种)不同器官的表达结果,见图6。该图显示,9个在根系和幼苗中表达水平都很低,大部分在果实和花中的表达水平较高、在种子和枝条中的表达水平较低,暗示不同在苹果器官发育中存在相似功能。但是与其他明显不同,它在枝条中表达水平较高,在果实中表达水平较低,在种子中下调表达。此外,大部分在不同基因型苹果的同一器官中的表达量有所不同,比如,在M49的叶中的表达量明显比在M14中高。

图6 MdSHR基因在苹果不同器官的表达谱
注:红色代表相对较高的表达水平,而白色代表相对较弱的基因表达水平;M14、M20、M49、GD、M67、M74、X41002、X3069、X9220、X4442和X2596代表苹果品种或基因型
Note: Red represents relatively high expression levels, while white represents relatively weak gene expression levels; M14, M20, M49, GD, M67, M74, X8877, X41002, X4442 and X2596 represent apple varieties or genotype.
3 讨 论
本研究鉴定到9个苹果亚族基因,数量上多于掌叶覆盆子、蜜柚、甜橙、枳()[13]、绿豆()[14]和杜仲([15],低于白梨。Fan[16]等认为基因数量可能与其基因组大小有关,但是,白梨基因组(512 Mb)[17]小于苹果基因组(881.3 Mb)、杜仲()基因组(725.20 Mb)[18]、甜橙(588.00 Mb)[19]和绿豆基因组(597 Mb)[20],枳基因组(377.30 Mb)[18]也大于掌叶覆盆子基因组(231.21 Mb)[21]。因此,基因组大小与基因成员数量并没有明确关系[22]。
不同物种中SHRs被分为三组,MdSHR亚家族成员在三组内均有存在,且结构相似,大多数只有一个外显子,无内含子,于大麻[243、黄瓜[24]等相似,表明,基因在高等植物的进化中具有高度的保守性。而无内含子的原因可能在于植物基因在进化过程中主要是通过水平基因转移和重复事件起源于原核基因组[25]。通过对其保守基序、蛋白质二级结构和三级结构的分析发现,其蛋白质C末端结构高度保守,这与黄瓜[24]、大麻[23]、枳[13]和杜仲[15]等中的结果相似。通过启动子预测发现,所有启动子序列中包含大量的非生物胁迫响应元件以及植物激素响应元件,说明基因在植物生长发育和非生物胁迫响应中起着重要作用。
第Ⅰ组中的拟南芥主要在茎顶表达[26],功能目前研究较少,但其会参与羧酸代谢过程、花发育、芽系统发育和组织发育[27]。第Ⅰ组中的()会促进营养生长向生殖生长转变[7],还可以促进果实的成熟[28]。苹果均属于第Ⅰ组,在花、果和叶中表达水平较高,其中在未成熟的果实中表达水平最高,即其可能在促进果实生长等方面具有重要作用。
第Ⅱ组中的会在茎、叶、花、根等不同器官中表达[29],同一组的苹果/在不同品种的花、果和叶中具有较高表达量。基因可以调节叶片气孔的形成[30]和芽的形成[31],还可以调节植物维管束鞘细胞的光合作用[32],会通过NO影响中心碳代谢和内源性植物激素水平促进果实的生长和成熟[6],苹果/可能在叶和果实中行使相似的功能,调节苹果的生长发育。而第Ⅱ组中的在茎中具有较高表达量,有可能是在茎中通过调控生长素转运蛋白LAX3(LIKE AUXIN RESISTANT3)调节生长素含量,进而通过蛋白PINs转运生长素后调节茎的生长发育[33,34]。
第Ⅲ组中,的表达位点有叶、花、根、萼片、茎,主要在花瓣分化扩张阶段表达[28],同样在花、果实和叶片的表达水平较高。过表达的拟南芥抽苔晚且莲座叶边缘锯齿程度及莲座叶表面表皮毛的密度均比野生型的高[35];的同源基因还会促进独脚金内酯的生成[35],而独脚金内酯调节腋芽生长[36]和叶片衰老[37],可能通过独脚金内酯影响果树叶片的生长发育。
4 结 论
基于拟南芥SHR蛋白系列,从苹果全基因组中鉴定出9个苹果亚族基因,它们在染色体上有1对串联复制基因和1对共线性基因,在结构及进化过程中具有高度保守性。苹果与拟南芥共形成4对直系同源基因,它们编码蛋白的二级结构和三级结构相似。苹果含有与非生物胁迫响应相关和与植物激素反应相关的应答元件,大部分表达模式相似,它们在苹果花和果实中有比较高的表达量,而在根系和枝条中表达水平较低。
[1] Helariutta Y, Fukaki H, Wysocka-Diller J,. The SHORT-ROOT gene controls radial patterning of theroot through radial signaling [J]. Cell, 2000,101:555–567
[2] Hernández-Coronado M, Ortiz-Ramírez C. Root patterning: Tuning SHORT ROOT function creates diversity in form [J]. Front Plant Sci, 2021,12:745861
[3] Dong WT, Zhu YY, Chang HZ,. An SHR–SCR module specifies legume cortical cell fate to enable nodulation [J]. Nature, 2021,589:586-590
[4] Dhondt S, Coppens F, De Winter F,. SHORT-ROOT and SCARECROW regulate leaf growth in Arabidopsis by stimulating S-phase progression of the cell cycle [J]. Plant Physiol, 2010,154:1183-1195
[5] Yoon EK, Dhar S, Lee MH,. Conservation and diversification of the SHR-SCR-SCL23 regulatory network in the development of the functional endodermis inshoots [J]. Mol Plant, 2016,9(8):1197-1209
[6] Bodanapu R, Gupta SK, Basha PO,. Nitric oxide overproduction in tomato hrmutant shifts metabolic profiles and suppresses fruit growth and ripening [J]. Front Plant Sci, 2016,7:1714
[7] Guo X, Yu C, Luo L,. Comparative transcriptome analysis of the floral transition in'Old Blush' andvar.[J]. Sci Rep, 2017,7(1):6068
[8] Ho-Plágaro T, Molinero-Rosales N, Fariña Flores D,. Identification and expression analysis of GRAS transcription factor genes involved in the control of arbuscular mycorrhizal development in Tomato [J]. Front Plant Sci, 2019,10:268
[9] Marchler-Bauer A, Bo Y, Han L,. CDD/SPARCLE: functional classification of proteins via subfamily domain architectures [J]. Nucleic Acids Research, 2017,45(D1):200-203
[10] Bailey TL, Williams N, Misleh C,. MEME:discovering and analyzing DNA and protein sequence motifs [J]. Nucleic Acids Research, 2006,34(W):369-373
[11] Chen C, Chen H, Zhang Y,. TBtools: An integrative toolkit developed for interactive analyses of big biological data [J]. Mol Plant, 2020,13(8):1194-1202
[12] 谌容,陈敏,杨春贤,等.基于SWISS-MODEL的蛋白质三维结构建模[J].生命的化学,2006,26(1):54-56
[13] 杨杰,陈蓉,胡文娟,等.枳GRAS基因家族鉴定及其对低温胁迫的响应[J].植物生理学报,2022,58(1):130-140
[14] 张文慧,何光鑫,王子鑫,等.绿豆GRAS基因家族鉴定及其非生物胁迫下的表达模式分析[J/OL].农业生物技术学 报,2022-03-23.861-872.https://kns.cnki.net/kcms/detail/11.3342.S.20220322.1146.012.html
[15] 张传明,张宝会,姚新转,等.杜仲全基因组GRAS基因家族的鉴定和系统发育分析[J].特产研究,2021,43(3):65-74
[16] Fan S, Zhang D, Gao C,. Identification, classification, and expression analysis ofgene family in[J]. Front Physiol, 2017,8:253
[17] Wu J, Wang Z, Shi Z,. The genome of the pear (Rehd.) [J]. Genome Res, 2012,23(2):396-408
[18] Kayim M, Koç NK, Rokka VM. Variation of the nuclear DNA content of species of subtribe Citrinae (Rutaceae) [J]. Hortscience, 1998:1247-1250
[19] Guerra M dos S. Cytogenetics of rutaceae. II. nuclear DNA content [J]. Caryologia, 1984:219-226
[20] Arumuganathan K, Earle ED. Nuclear DNA content of some important plant species [J]. plant Molecular Biology Reporter, 1991,9(3):208-218
[21] Wang L, Lei T, Han G,. The chromosome-scale reference genome of Rubus chingii Hu provides insight into the biosynthetic pathway of hydrolyzable tannins [J]. Plant J, 2021,107(5):1466-1477
[22] 张焕欣,董春娟,尚庆茂.辣椒GRAS家族全基因组鉴定与表达分析[J].园艺学报,2017,44(12):2305-2317
[23] 张苗苗,于江珊,施江,等.大麻GRAS转录因子全基因组研究[J].中草药,2021,52(5):1423-1433
[24] Lu X, Liu W, Xiang C,. Genome-wide characterization of GRAS family and their potential roles in cold tolerance of Cucumber (L.) [J]. International Journal of Molecular Sciences, 2020:3857
[25] Huang W, Xian Z, Kang X,. Genome-wide identification, phylogeny and expression analysis ofS gene family in Tomato [J]. BMC Plant Biology, 2015,15(1):1-18
[26] Obulareddy N, Panchal S, Melotto M. Guard cell purification and RNA isolation suitable for high-throughput transcriptional analysis of cell-type responses to biotic stresses [J]. Mol Plant Microbe Interact, 2013,26(8):844-849
[27] Depuydt T, Vandepoele K. Multi-omics network-based functional annotation of unknowngenes [J]. Plant J, 2021,108(4):1193-1212
[28] Zhao J, Li H, Yin Y,. Fruit ripening inandis associated with distinct gene expression patterns [J]. FEBS Open Bio, 2020,10(8):1550-1567
[29] Schmid M, Davison TS, Henz SR,. A gene expression map ofdevelopment [J]. Nat Genet, 2005,37(5):501-506
[30] Kamiya N, Itoh J, Morikami A,. The SCARECROW gene's role in asymmetric cell divisions in rice plants [J]. Plant J, 2003,36:45-54
[31] Schrader J, Nilsson J, Mellerowicz E,. A high-resolution transcript profile across the wood-forming meristem of poplar identifies potential regulators of cambial stem cell identity [J]. Plant Cell, 2004,16:2278-2292
[32] Cui H, Kong D, Liu X,. SCARECROW, SCR-LIKE 23 and SHORT-ROOT control bundle sheath cell fate and function in[J]. Plant J, 2014,78(2):319-327
[33] Xu J, Hofhuis H, Heidstra R,. A molecular framework for plant regeneration [J]. Science, 2006,311(5759):385-388
[34] Galinha C, Hofhuis H, Luijten M,. PLETHORA proteins as dose-dependent master regulators ofroot development [J]. Nature, 2007,449(7165):1053-1057
[35] 糜利敏.AtSCL26和AtSCL29在氮胁迫下对拟南芥根系发育的功能研究[D].武汉:华中农业大学,2016
[36] 范吴蔚,潘志演,王原秀,等.独脚金内酯对烟草腋芽生长以及抗氧化酶活性和糖含量的影响[J].植物生理学报,2021,57(4):910-918
[37] Yamada Y, Umehara M. Possible roles of strigolactones during leaf senescence [J]. Plants (Basel), 2015,4(3):664-677
Gene Identification and Organ Expression Characteristics ofSubfamily in
YU Ting-ting, XU A-fei, ZHANG Jia-lin, ZHANG Wei-wei, YANG Hong-qiang*
271018,
SHORT-ROOT (SHR) transcription factors belong to a subfamily of plant-specific GRAS. Based on the SHR sequencein, we obtained nine, ten, five, five and fourgenesfrom the genome-wide databases ofBorkh,Rehd.,(L.)(Linn.)andHu, respectively. The characteristics of these SHR subfamily members were compared and the protein structure and organ-specific expression ofin apple were analyzed. The results showed that the obtained SHR subfamily members encoded proteins with molecular masses ranging from 29743.72 to 62251.21 Da, all of which located in the nucleus. Thehad one pair of tandem duplicating genes and one pair of colinear genes on apple chromosomes;-encoded protein contains 10 conserved motifs, of which five were shared by the obtained SHR subfamily proteins. The protein secondary structures of MdSHRs and AtSHRs were mainly random coils and α-helices, and the three-dimensional structures of most MdSHRs and AtSHRs were similar. The promoters of the nineall contained cis-acting elements related to stress response and hormone response. Organ expression profiling showed that mosthad the highest expressions in flowers and fruits, lower expressions in shoots and seeds, and the lowest expressions in roots and seedling; the expression level ofin different organs of apple was basically opposite to those of other.
Apple; SHR subfamily genes; bioinformatics analysis
S661.1
A
1000-2324(2022)03-0346-09
10.3969/j.issn.1000-2324.2022.03.002
2022-03-05
2022-04-14
国家自然科学基金(32172517 & 31772251);国家重点研发计划(2019YFD1000103)
于婷婷(1996-),女,硕士研究生,研究方向为苹果生理与分子生物学. E-mail:1336179602@qq.com
Author for correspondence. E-mail:hqyang@sdau.edu.cn
