CT用于免疫检查点抑制剂相关性肺炎
2022-07-25徐凯旋李晓宇刘雅茹郭雨竹金光玉
王 畅,徐凯旋,李晓宇,刘雅茹,郭雨竹,张 卓,金光玉
[延边大学附属医院(延边医院)放射科,吉林 延吉 133000]
免疫检查点抑制剂(immune checkpoint inhibitors, ICI)又称免疫系统反制点抑制剂,可靶向特定分子增强免疫应答,主要包括程序性细胞死亡蛋白1(programmed cell death protein 1, PD-1)抑制剂纳武单抗和帕姆单抗、程序性死亡配体1(programmed death ligand 1, PD-L1)抑制剂阿特珠单抗和德瓦鲁单抗、细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated protein 4, CTLA-4)抑制剂替西木单抗和易匹木单抗[1];通过阻断CTLA-4、PD-1、PD-L1肿瘤免疫逃逸通路,激活自身免疫系统、增强T细胞免疫、杀伤肿瘤细胞而达到抗肿瘤的目的[2]。临床上部分患者经ICI治疗后可出现ICI相关性肺炎(checkpoint inhibitor-related pneumonitis, CIP)。本研究观察CT用于诊疗CIP的价值。
1 资料与方法
1.1 一般资料 回顾性分析2019年12月—2021年11月7例于延边大学附属医院接受PD-1/PD-L1治疗后发生CIP患者,男6例、女1例,年龄49~66岁、中位年龄64岁;原发肿瘤包括肺癌3例、肝癌2例、结肠癌及下咽癌各1例;ICI治疗时间为1.5~13.0个月,中位时间6个月;临床主要表现为呼吸困难5例、胸闷4例、咳嗽2例、咳痰1例,2例伴恶心、吞咽不适及纳差等消化道症状。
1.2 仪器与方法 采用Toshiba Aquilion ONE 320排动态容积CT机。使患者仰卧,头先进,指导其吸气后屏气接受扫描;采集肺部轴位CT图像,扫描范围从肺尖至双侧肋膈角下部,参数:管电压120 kV,管电流140 mAs,层厚7 mm,重建层厚1 mm。
1.3 CIP分级与分型 参照美国临床肿瘤学会ICI治疗患者免疫相关不良事件管理标准[3]进行分级与分型。
1.3.1 临床分级 依据临床表现、病灶累及肺脏面积及耗氧量进行分级:1级,无明显临床症状,病变范围<全肺的25%或仅局限于1个肺叶;2级,原有临床症状加重或出现新症状,吸氧需求升高;3级,临床症状严重,病变范围>全肺1/2或累及全部肺叶,伴自理能力受限;4级,出现危及生命的呼吸损伤。
1.3.2 影像学分型 由2名具有10年以上工作经验的影像科医师观察CT所示病灶位置、分布、面积、有无胸腔积液、胸膜增厚、淋巴结受累及支气管扩张等,意见存在分歧时经讨论达成一致。①磨玻璃型:片状、絮状稍高密度影于双肺局限性或弥漫分布,密度介于正常肺与血管、软组织之间,呈“磨玻璃”改变,其内支气管血管束仍可见(图1);②实变型:散在斑片亚型,病灶呈结节状、斑片状致密影,局限于1个肺叶或肺段,早期多位于胸膜下,病变范围<全肺1/4,其内见透亮的支气管影,可伴胸腔积液;多发斑片亚型,病变范围≥全肺1/4,表现为双肺多发斑片状、索条状及结节状致密影,常伴胸腔积液和胸膜增厚(图2);肺实变亚型,由散在斑片影及多发斑片影逐渐发展而成,于1个或多个肺叶内出现斑片状、片状致密影,肺组织呈实质性改变;③网格型:早期可局限于单个肺叶或肺段,呈细网格状高密度影,随病程进展,病变范围增大并呈蜂窝状,肺间质表现为大小不等的囊状结构相互叠加,常伴支气管扩张(图3)。
2 结果
2.1 CIP分级与分型 7例CIP临床分级包括2级1例、3级4例及4级2例;病灶均累及双肺多叶、多段,2例仅累及双肺下叶;3例呈对称、4例呈非对称分布;影像学分型包括磨玻璃型3例、实变型2例(多发斑片亚型、肺实变亚型各1例)及网格型2例; 5例伴胸膜增厚,5例纵隔淋巴结受累,3例伴牵拉性支气管扩张,2例伴小叶间隔增厚,2例伴多发小叶中心结节,1例伴胸腔积液。见表1。
2.2 典型病例 序号6患者,男性,49岁,于结肠癌[溃疡型中分化腺癌及黏液腺癌, 免疫组织化学:肿瘤细胞PMS2(-),MLH1(-),MSH2(+),MSH6(+),Ki-67(70%+),病理分期pT3N0M0,Ⅱ期]根治术后5个月出现上腹部痛,PET/CT提示吻合口复发并小肠转移,予3个周期奥沙利铂联合替吉奥、贝伐珠单抗全身治疗3个月,影像学复查提示疾病进展,予1个周期免疫治疗联合伊立替康联合卡培他滨方案全身化疗,后因无法耐受化疗而接受免疫治疗联合贝伐珠单抗靶向治疗;术后15个月拟再行外科手术治疗,继续予4个周期免疫治疗;现为根治术后21个月,因胸闷、乏力7天入院。胸部平扫CT:双肺弥漫性分布结节状致密影和斑片状磨玻璃影,病变范围>全肺1/2,纵隔见多发细小淋巴结(图4A);根据既往病史、治疗史,考虑为CIP,予大剂量激素冲击治疗(甲泼尼龙2 mg/kg体质量),以胃黏膜保护剂预防激素相关消化道溃疡及出血。治疗5天后胸闷症状改善,复查胸部CT显示双肺弥漫分布斑片状磨玻璃影较前减少(图4B)。治疗2周后将激素用量改为1 mg/kg体质量,继续治疗1个月;再次复查胸部CT,双肺弥漫斑片状磨玻璃影及致密影基本消失(图4C)。
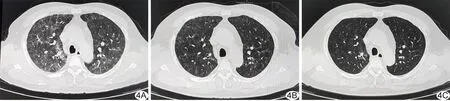
图4 序号6患者,男,49岁,原发肿瘤为结肠癌 A.PD-1抑制剂治疗1年余,胸部CT图示双肺弥漫分布的结节影及斑片状磨玻璃影; B.甲泼尼龙治疗5天后复查,胸部CT示双肺磨玻璃影较前减少; C.甲波尼龙减量治疗1个月后复查,胸部CT示磨玻璃影基本消失
3 讨论
CIP常见于恶性肿瘤患者接受ICI治疗后2~3个月,中位发病时间为ICI后2.8个月[4],发病率约为3%~6%,3级或4级CIP发病率约0.67%[5],可能与ICI用量无明显相关[6]。CIP临床主要表现为发热、胸闷、胸痛、气短、咳嗽及活动耐量降低,查体可闻及呼吸音增粗[7],约1/3可无临床症状[1];本组7例均出现不同程度呼吸道症状或胸闷表现,部分伴消化道症状。一项针对18 715例接受PD-1/PD-L1抑制剂治疗的肿瘤患者的荟萃分析[8]结果显示,CIP发病率约2.79%,其临床、影像学及病理学表现各异。另有研究[9]表明,非小细胞肺癌患者为CIP高危人群,可能因此类人群多有长期吸烟史和肺部疾病史,如肺结节、慢性阻塞性肺疾病或间质性肺疾病等。
诊断CIP需同时满足以下3项[1]:①ICI治疗史;②影像学表现,于ICI治疗后出现新发斑片影、磨玻璃影及结节状致密影,小叶间隔增厚,支气管扩张等;③排除放射性肺炎、肺水肿、肺栓塞等。JOHNSON等[10]报道,磨玻璃型为CIP最常见类型,发生率为87%;其次为实变型(39%),网格影、牵拉性支气管扩张、小叶间隔增厚和小结节影相对少见。CIP常累及双肺多叶、多段,呈对称或不对称分布,少数仅累及单侧或单叶[11]。本组CIP主要影像学表现为肺部局限性或弥漫性斑片状磨玻璃影、实变影及索条状影,多分布于外周带,均累及双肺多肺叶、多段,3例病灶呈对称分布,4例呈非对称分布,伴牵拉性支气管扩张、小叶间隔基底部和周围增厚、局部胸膜增厚和小结节影等多种表现混合存在,类似非特异性间质性肺炎表现,与上述研究[10-11]基本相符。CIP临床表现缺乏特异性,且尚无相关特异性血清学标志物[12],应结合临床病史及影像学资料进行综合分析,并注意与以下疾病鉴别:①放射性肺炎,多为局限于放射区域内的模糊影,慢性期可出现肺纤维化、肺不张;②肺水肿,多见肺门两侧蝴蝶状阴影,也可局限于一侧或一叶;③肺栓塞,肺野可见楔形密度增高影、条状或带状高密度区,中心肺动脉扩张,远端血管分支减少或消失;④癌性淋巴管炎,多见小叶间隔串珠样增厚,肺血管增粗,支气管壁增厚。
CIP是ICI后患者死亡的主要原因之一[13]。对于接受ICI治疗者,若胸部CT发现肺部出现新的炎性病灶,无论有无临床症状,均应考虑CIP并进行分级,根据等级及早进行干预。经糖皮质激素治疗后多数CIP患者预后良好,疗程约6~8周,可随症状、体征及影像学表现改善而逐渐减量,但在部分患者疗效欠佳,即难治性CIP[14];目前对于难治性CIP尚无明确治疗指南,临床可依据经验使用抗生素及免疫抑制剂。
综上,CIP为临床罕见但可能致命的免疫相关不良反应,胸部CT对于诊断CIP具有关键性作用,并有助于准确分级、分型和及时采取有效治疗措施。但本研究为回顾性研究,样本量小,且无病理结果支持,有待进一步观察。