1株叶栖酵母菌鉴定及其培养液代谢物初探
2022-07-25魏嘉妤陈明珠彭丽娟丁海霞
魏嘉妤,陈明珠,彭丽娟,3*,丁海霞,田 静
(1.贵州大学 烟草学院,贵州 贵阳 550025;2.贵州省黔东南州烟草公司岑巩县分公司,贵州 岑巩 557800;3.贵州省烟草品质研究重点实验室,贵州 贵阳 550025;4.贵州大学 农学院,贵州 贵阳 550025)
植物附生菌(epiphyte)是一类庞大且丰富的微生物群体,在植物生长发育过程中具有重要作用。因生长于植物表面,其菌群数量与结构受光、温、水气以及地势等影响而发生改变;同时附生菌的生存方式不同于其他微生物类群,可通过产生胞外分泌物,在植物表面形成一种生物膜,使其粘合在植物表面,这可帮助附生菌有效减少菌体水分散失。附生真菌主要由酵母菌和丝状真菌两大类群构成,分布在植物叶片表面的酵母菌也称为叶栖酵母菌。目前,叶栖酵母菌的研究主要侧重于分离鉴定种类以及菌种资源分布等方面。研究发现,多数植物叶栖酵母菌的种类以担子菌为主,以掷孢酵母属 ()、隐球酵母属()、红酵母属 ()等数量最多。臧威等在浙江雁荡山山脉进行叶栖酵母菌资源考察,分离出 56 个已知类群和 19 个疑似新种,但未探究叶栖酵母菌的功能特点。
课题组前期在分离锦绣杜鹃叶肿病菌(,日本外担菌)的过程中,分离到1株叶栖酵母菌,为探究该叶栖酵母菌具有何种功能及对植物生长发育的影响,明确该菌株的分类地位,依据菌株的形态特征和分子生物学方法进行种的鉴定,同时对其培养液中植物生长物质等代谢物进行初步分析,为该菌作为微生物菌剂的开发利用提供理论依据,以及为后续研究叶栖酵母菌在叶片表面作用提供参考。
1 材料与方法
1.1 材料
2019年、2020年4月中旬,从贵州省贵阳市南明区凤凰山采集的锦绣杜鹃叶肿病典型症状标本,分离方法参考文献[6],代谢组分析培养液参照文献[7]进行制备。
1.2 方法
..形态特征鉴定
挑取 PDA 平板上生长 3 d 的叶栖酵母菌菌落,蔡司 Axio Image M2 光学显微镜下观察测量 30 个分生孢子大小;选取在 PDA 上培养 10 d的叶栖酵母菌,用徕卡 M205FA 体式镜拍摄菌落形态。
..分子生物学鉴定
PDA上25 ℃培养12 d的纯培养物,用灭菌手术刀刮取 2.0 g 于2.0 mL EP ( Eppendorf )管中。用 Biomiga公司真菌DNA提取试剂盒提取总 DNA。选择引物LSU(NL4/NL1)和ITS(ITS5/ITS4)对菌株进行PCR扩增,所用引物信息、反应体系和反应程序均参考李振英的方法,将PCR产物用1%琼脂糖凝胶电泳检测和纯化后,委托生工生物工程(上海)股份有限公司进行测序。
将测序结果在NCBI (http://www.ncbi.nlm.gov) 数据库中进行同源性比对,提交序列至GenBank。在UNITE(https://unite.ut.ee/#panel3)上搜索外担菌纲相关物种和对应种的模式菌株序列(表1),采用最大似然法( Maximum Likehood,ML),通过raxmlGUI 15b2软件构建系统发育树,Bootstrap检验的重复次数为1000。
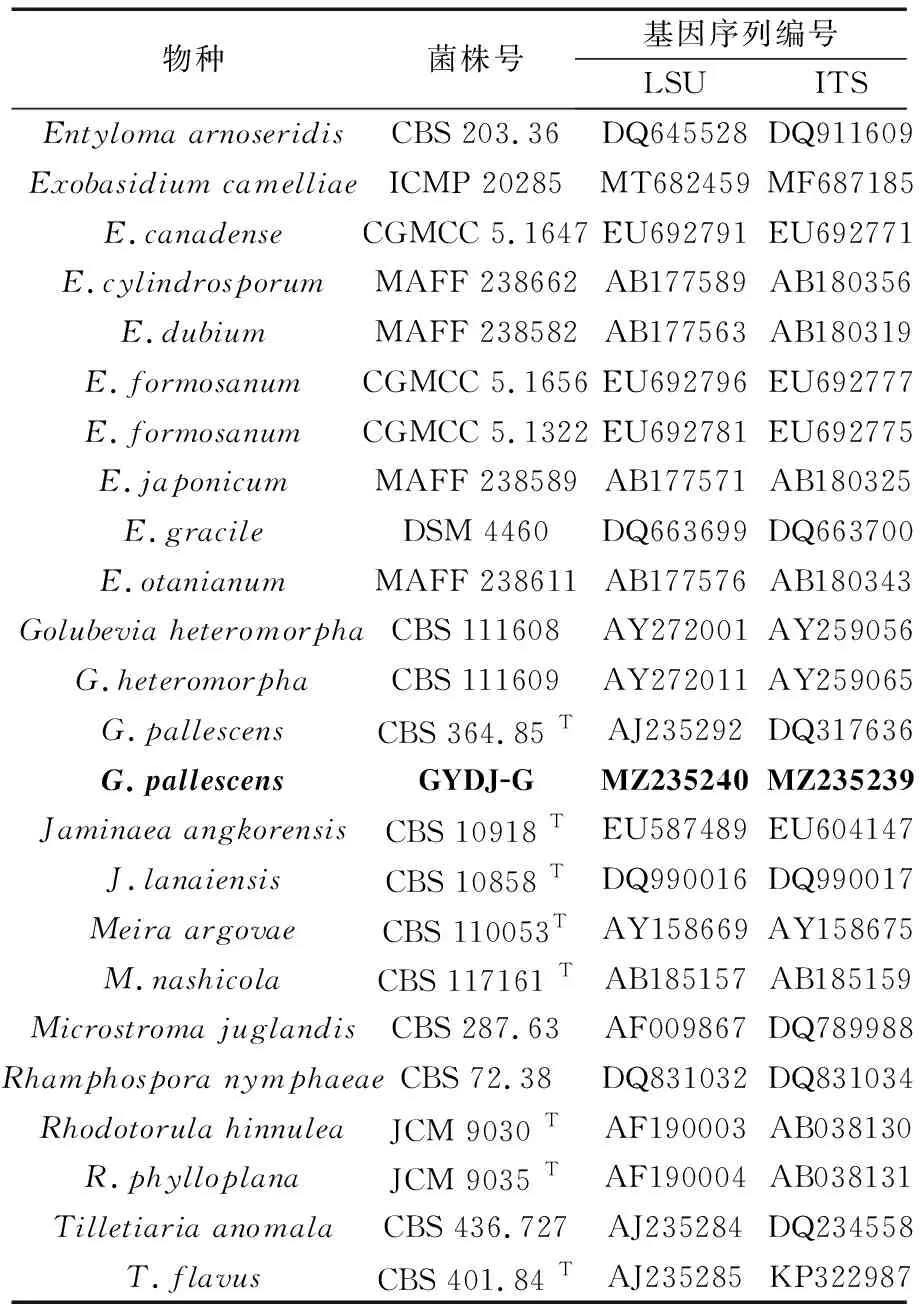
表1 采用类群和序列登录数对2种基因进行组合序列分析Tab.1 Taxa and sequence accession numbers employed in the combined two genes sequence analysis
..ITS 扩增子测序
选取新鲜有典型锦绣杜鹃叶肿病症状的感病叶片,用灭菌手术刀刮取表面白色子实层于无菌1.5 mL EP管中,3个重复,用干冰运送至北京诺禾致源公司对其ITS1区引物(ITS5-F和ITS1-R)进行PCR扩增测序,同时构建PE扩增文库,使用NovaSeq600进行上机测序。下机数据参照Qiime(V1.9.1,http://qiime.org/scripts/split_libraries_fastq.html)的Tags质量控制流程,经过严格的过滤处理得到高质量的Tags数据(Clean Tags),利用Uparse软件(Uparse v7.0.1001,http://www.drive5.com/uparse/)对所有样本的全部 Effective Tag进行聚类,用Qiime软件(Version 1.9.1)中的blast方法(http://qiime.org/scripts/assign_taxonomy.html)与Unit (v7.2) 数据库(https://unite.ut.ee/)进行物种注释分析,最后将 OUTs 代表序列与相应微生物数据库进行比对,得到各样本的物种分类信息与各水平注释信息。同时,获得基于聚类结果的多样性分析与基于注释结果的各分类水平物种组成信息。
..2种真菌共培养
参考Berendsen等的方法,挑取培养12 d的叶栖酵母菌与 15 d的日本外担菌单菌落,同时接种于PDA培养基(ø=9 cm)上,在培养皿底画夹角为30°的两条线,接种8个单菌落呈V形摆放,倒置放于25 ℃恒温培养箱中培养,每隔1天观察2种菌间生长的变化。用徕卡 M205FA 体式镜拍摄其培养菌落形态。
..基于液质联用(LC-MS/MS)技术的非靶向代谢组学
从3瓶叶栖酵母菌培养液中分别取50 mL菌液移至3个无菌离心管后,参照文献[6]的方法进行处理后用干冰送至北京诺禾致源公司,进行LC-MS/MS进行分析。
..致病性测定
分别于2021年3月12日在贵州省贵阳市南明区凤凰山、4月14日在贵州大学西校区进行致病性测定。
采用有伤、无伤2种方法进行接种,共设8个处理(表 2),2种接种方法各4个处理;对照、日本外担菌菌饼、叶栖酵母菌菌饼以及混接2种菌饼。选生长健康的锦绣杜鹃幼嫩叶片用无菌水冲洗3次,使用无菌滤纸吸干叶片表面水分,接着进行接种,有伤处理用无菌一次性针筒(规格为10 mL)的针尖在叶脉两侧各轻轻划开1个约为5 mm的伤口,无伤处理直接接种。用打孔器(ø=5 mm)在培养好的菌种上打孔,取2个菌饼接种于叶片的叶脉两侧各1个(有伤处理接种至伤口处),沾湿无菌水的无菌棉覆盖菌饼,使用保鲜膜缠绕封好,维持保湿状态。不同菌种使用记号笔在叶基部两侧上注明标记(:A;GYDJ-G:B),每片叶接种2个菌饼,每株接种5片叶,每处理5株。锦绣杜鹃处于自然条件下生长。
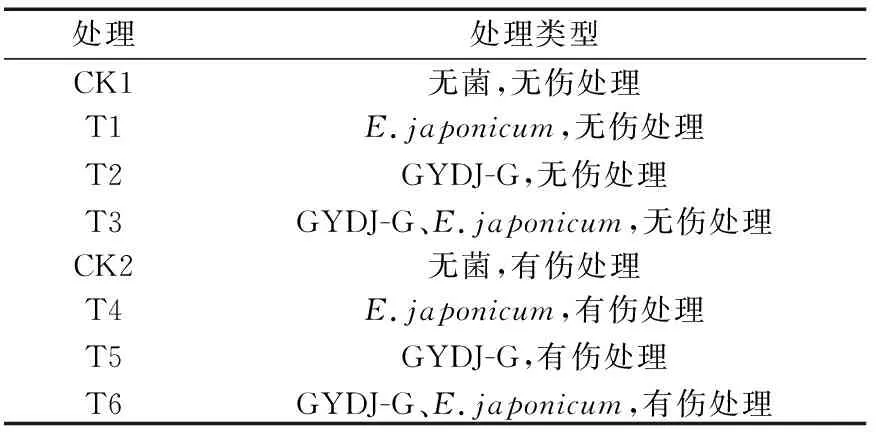
表2 回接试验Tab.2 Pathogenicity testing
1.3 数据分析方法
所有数据均通过Excel 2019整理,利用SPSS 21.0 软件进行试验数据的统计分析,采用Duncan’s新复极差法进行差异显著性检验。
2 结果与分析
2.1 菌株形态特征及培养特性
从锦绣杜鹃病叶上分离到10个叶栖酵母菌纯培养物,选取其中1株编号为GYDJ-G的观察形态特征(图1-a~g)。在PDA平板上25 ℃培养12 d菌落直径13~16 mm,单菌落为圆形(图1-b、c),米白色,毛絮状,紧贴平板向上生长,长在一起形成不规则菌落(图1-a),培养3 d的菌落在显微镜下观察到其掷孢子形态(图1-d、e):长棒状,长10.8~19.1 μm,宽1.7~2.6 μm,有2~3个油球,油球直径1.0~2.3 μm ,部分掷孢子萌发产生芽管(图1-f、g),12 d后菌落生长以菌丝为主。
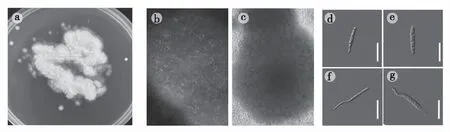
注:a~c为单个掷孢子在PDA上25 ℃黑暗培养12 d后形成的浅色戈卢别夫氏菌菌落形态; d、e为掷孢子; f、g为掷孢子萌发,bars =10 μm图1 浅色戈卢别夫氏菌的形态特征(a-g)Fig.1 Morphological features of Golubevia pallescens(a-g)
2.2 菌株分子生物学鉴定
测序结果显示,叶栖酵母菌GYDJ-G ITS/LSU长度为680/622 bp,序列已上传至NCBI网站。经系统发育树分析,叶栖酵母菌以97%支持率与浅色戈卢别夫氏菌(CBS 364.85) (登录号:DQ3176 36/AJ235292)聚在一起,形成一个明显的分支。结合GYDJ-G 菌株培养性状和形态特征分析,确定该菌株为浅色戈卢别夫氏菌。
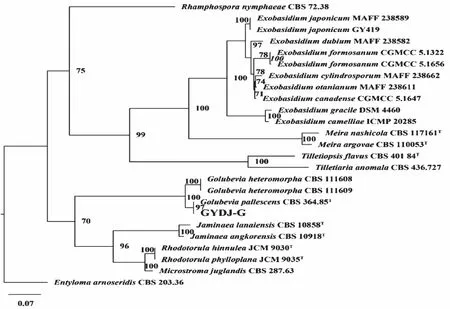
图2 利用LSU和ITS序列的最大似然分析构建了GYDJ-G的系统发育树,以 Entyloma arnoseridis 为外群最大似然bootstrap值(≥70%)Fig.2 Phylogenetic tree constructed by maximum likelihood analyses of LSU and ITS sequences for GYDJ-G,with Entyloma arnoseridis as outgroups.Maximum likelihood bootstrap values(≥70%)
2.3 扩增子分析
分别从属水平与种水平分析扩增子结果。首先通过多序列比对得到top 100属的代表序列,再选取top 34属构建系统发育树,丰度水平排名前12个属依次为、、、戈卢别夫氏菌属()、、外担菌属()、、、、、和(图3),其中,戈卢别夫氏菌属和外担菌属丰度分别位于第4和第6位。种水平丰度前20物种系统发育树显示,浅色戈卢别夫氏菌占所观察物种比例为4.62%,占真菌序列比例为12.00%;日本外担菌相应比例分别为1.03%和2.67%,可聚类到日本外担菌和浅色戈卢别夫氏菌。上述结果说明,在锦绣杜鹃叶肿病叶片上确实存在浅色戈卢别夫氏菌(图4)。
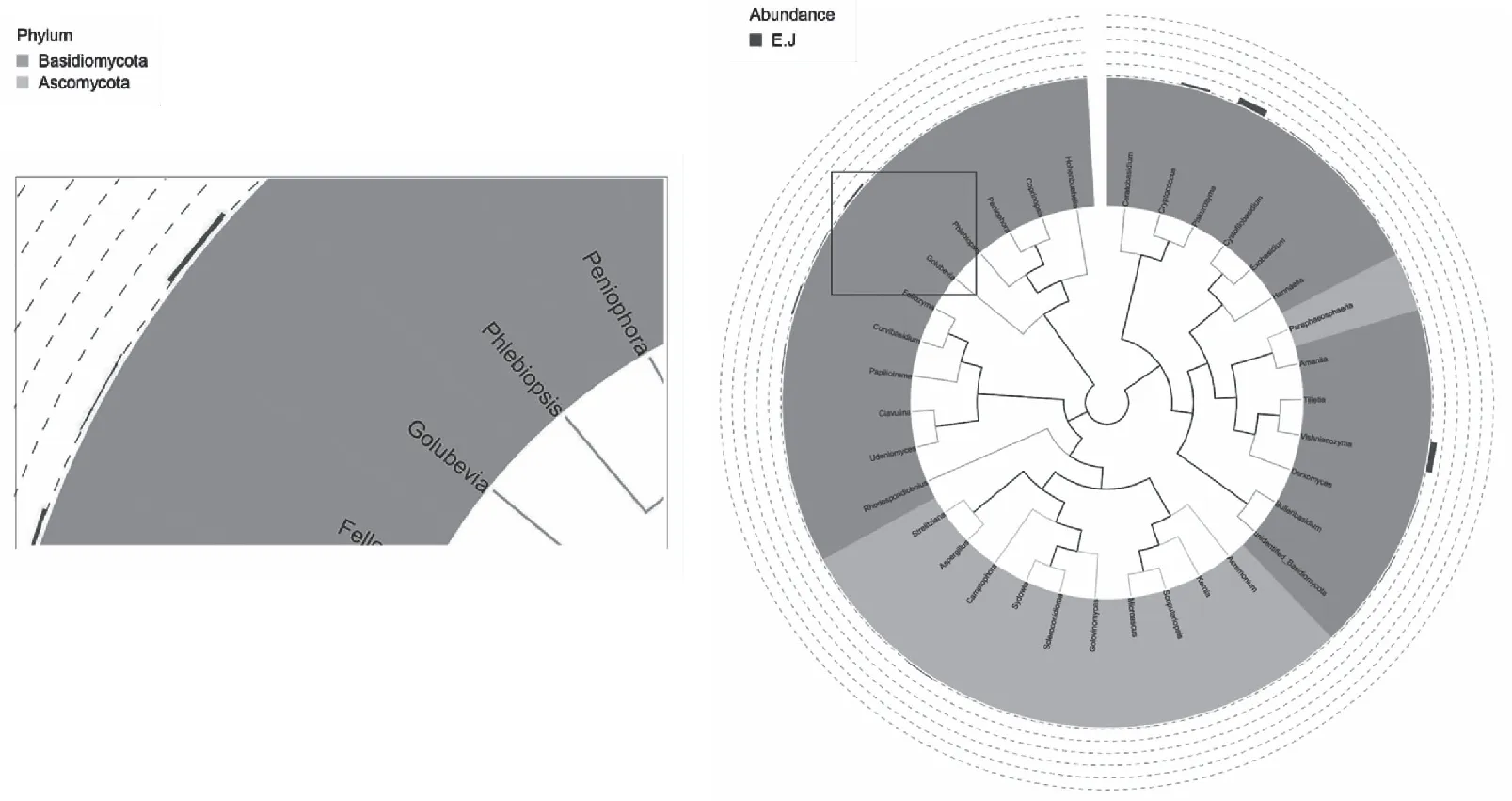
图3 属水平扩增子系统发育树Fig.3 A phylogenetic tree of amplifying subsystems at the genus level

图4 种水平扩增子系统发育树Fig.4 A phylogenetic tree of amplifying subsystems at the species level
2.4 2种真菌共培养
2种真菌共同培养15 d后可看出,浅色戈卢别夫氏菌与日本外担菌在PDA平板上生长不相互排斥(图5-a~d),说明这2种真菌在PDA 平板上生长相互吸引,没有拮抗作用。

注:a,2种真菌共培养;b,日本外担菌菌落; c,浅色戈卢别夫氏菌菌落;d,2种真菌共培养菌落。图5 日本外担菌和浅色戈卢别夫氏菌共培养Fig.5 Synergistic interactions between Exobasidium japonicum and Golubevia pallescens
2.5 培养液代谢组分析
对培养液中代谢物进行分析,结果显示培养液中含有557种化合物,其中正离子化合物379种,负离子化合物178种。因其代谢物中化合物种类较多,本文仅对其中植物生长物质、氨基酸和维生素种类进行统计分析。浅色戈卢别夫氏菌 ()培养液中含有维生素B2、维生素B3、维生素B5、维生素B6和维生素C等5种维生素(图6-a);含有吲哚乙酸(IAA)、反式玉米素(trans-Zeatin)、脱落酸(ABA)、赤霉素(GA)、褪黑素(MT)、茉莉酸(JA)、亚精胺(Spermidine)和组胺(Histamine)等8种植物生长物质(图6-b);含有丝氨酸(Serine)、赖氨酸(Lysine)、谷氨酸(Glutamic acid)、组氨酸(Histidine)、苯丙氨酸(Phenylalanine)、色氨酸(Tryptophan)、缬氨酸(Valine)精氨酸(Arginine)、脯氨酸(Proline)、焦谷氨酸(Pyroglutamic acid)和肌氨酸(Sarcosine)等11种氨基酸(图6-c)。
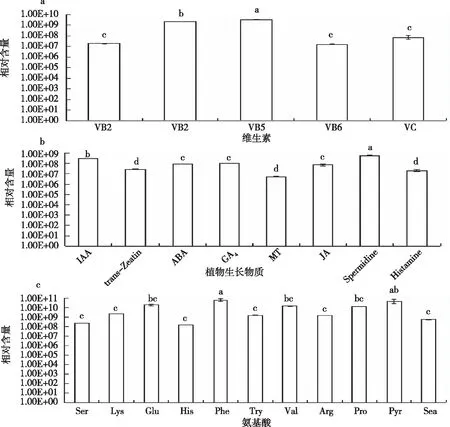
注:a,维生素; b,植物生长物质; c,氨基酸,不同小写字母表示差异显著(P < 0.05)。图6 浅色戈卢别夫氏菌培养液代谢物Fig.6 Metabolites of Golubevia pallescens in liquid culture
2.6 致病性测定结果
处理后第5天、10天、15天,有伤与无伤接种8个处理均未发病(图7-a~f),同时期锦绣杜鹃叶肿病在自然条件下的发病症状如图7-g~i。结果表明浅色戈卢别夫氏菌不是锦绣杜鹃叶肿病的病原菌。

注:a、d,接种第 5 d ; b、 e 接种第 10 d ;c、 f,接种第 15 d;g~i,在同时间自然条件情况下,锦绣杜鹃感病症状。图7 菌株GYDJ-G的致病性试验Fig.7 Pathogenicity test of strain GYDJ-G
3 结论与讨论
经形态特征与分子生物学相结合方法鉴定,该叶栖酵母菌为浅色戈卢别夫氏菌。扩增子结果显示,日本外担菌和浅色戈卢别夫氏菌同时存在于锦绣杜鹃叶片上。共培养发现2种菌在PDA平板上相互吸引,致病性测定证明浅色戈卢别夫氏菌不是锦绣杜鹃叶肿病病原菌。在对这2种菌的分离纯化过程中发现,浅色戈卢别夫氏菌生长速度远快于日本外担菌,菌落直径比日本外担菌大。2019、2020年均从贵州省贵阳市凤凰山锦绣杜鹃叶肿病叶上分离到叶栖酵母菌。2019年从贵州省遵义市和贵州省遵义市凤冈县采集杜鹃()叶肿病分离日本外担菌过程中,并未分离到浅色戈卢别夫氏菌。臧威等在对浙江雁荡山叶栖酵母菌资源进行考察时,采用组织悬挂法从半枯叶片上分离到1株浅色戈卢别夫氏菌,本研究从锦绣杜鹃叶肿病叶上分离,而遵义市2个地点杜鹃()叶肿病叶上未分离到叶栖酵母菌。其中浙江雁荡山与贵州省贵阳市凤凰山均有大量的木本植物,而遵义市标本采集点为园林绿化区域,推测浅色戈卢别夫氏菌和日本外担菌共同生长可能与生态条件有一定关系。
戈卢别夫氏菌属由Wang等采用多基因分子系统发育分析方法建立的新属,其模式种为浅色戈卢别夫氏菌(菌株号:CBS 364.85),其同物异名种为腥掷孢菌属()的。目前报道戈卢别夫氏菌属仅有2个种,浅色戈卢别夫氏菌是1973年从日本链担耳菌属()的子实体上分离到的(http://www.indexfungorum.org/Names/NamesRecord.asp?RecordID =324632)。另1个种是异形戈卢别夫氏菌(),菌落为奶油色或白色,掷孢子与浅色戈卢别夫氏菌相似,呈圆柱形、细长形或月形,在欧洲多国引起苹果果实白斑病。
本研究基于液质联用(LC-MS/MS)技术对浅色戈卢别夫氏菌培养液中代谢物进行分析,其培养液中含有8种植物生长物质,有研究表明一些微生物可产生植物生长物质,对植物生长有一定调控作用。高绘菊等报道桑树内生拮抗细菌枯草芽孢杆菌 ()能产生植物生长激素IAA,该菌株的培养液和菌体悬浮液及胞外分泌物对桑树()和玉米()幼苗有较明显的促生作用;Mehmood等从受到干旱胁迫的催眠睡茄()叶片中分离到1株内生真菌正泡盛曲霉(),该菌产生3-吲哚乙酸(IAA)、酚类和糖类等次生代谢物,可有效定殖于玉米根系并促进玉米生长。韩丽珍等从茶树根际分离出6株根际促生菌,其分属于假单胞菌属(sp.)、芽孢杆菌属(sp.)、束村氏菌属(sp.)、伯克霍尔德氏菌属(sp.)和根瘤菌属(sp.),均有产IAA能力,具有良好的促生性能。而浅色戈卢别夫氏菌培养液的代谢物会通过何种方式影响植株的生长发育尚未明确,值得进一步研究。
