新生牛睾丸支持细胞的体外成熟与分化
2022-07-23东北农业大学动物科学技术学院黑龙江哈尔滨150030
郑 鹏,冯 瑞,秦 雪,李 琦,赵 骞 (东北农业大学 动物科学技术学院,黑龙江 哈尔滨 150030)
雄性动物睾丸曲细精管内的支持细胞增殖与分化形成的血睾屏障(blood-testis barrier,BTB)是维持精子发生的重要内环境[1-5]。公牛出生后,睾丸生长相对缓慢,直到大约25周龄后,睾丸开始迅速生长,睾丸内形成血睾屏障和睾丸功能逐渐完善,动物开始产生精子,标志着初情期的到来[6-7]。初情期以后,睾丸内的支持细胞停止增殖,细胞间形成紧密连接,进而形成血睾屏障,成为成熟的支持细胞。广义的BTB由紧密连接、黏附连接、缝隙连接等连接复合体共同组成。而狭义的BTB,即支持细胞间的紧密连接是构成血睾屏障主要的结构基础。紧密连接主要由跨膜蛋白分子Claudin-1、紧密连接蛋白ZO-1、穿膜蛋白Occludin及连接黏附分子(junctional adhesion molecules,JAMS)共同组成[8-10]。
支持细胞的增殖与其细胞周期进程紧密相关。磷脂酰肌醇3-激酶(phosphoinositide3-kinase,PI3K)是对细胞周期产生影响的一个重要分子。PI3K在质膜上产生第二信使PIP3(3,4,5-三磷酸磷脂酰肌醇),作为第二信使的PIP3与蛋白激酶B(Akt)结合,使Akt转位于细胞膜并获得催化活性,Akt激活后可抑制P21Cip1和P27Kip1蛋白的表达,解除对Cyclin D1-CDK复合物形成的抑制作用,促进细胞增殖[6]。
支持细胞增殖、分化与BTB的形成及支持细胞的功能密切相关[11-12]。本试验分离纯化了犊牛睾丸支持细胞,采用体外传代培养的方法,探索支持细胞体外成熟的培养体系,为建立体外研究血睾屏障机制的细胞模型奠定基础。
1 材料与方法
1.1 试验材料与主要试剂犊牛睾丸(屠宰后割取睾丸,置于4℃生理盐水中3 h内运回实验室。取自黑龙江双城血清厂);0.1%胶原酶购自Sigma公司;0.25%胰酶购自Amresco公司;DMEM,FBS购自Gibco公司;双抗(每毫升含10 000 U青霉素和10 mg 链霉素)购自Biosharp公司;兔抗ZO-1多克隆抗体,兔抗波形蛋白(vimentin)多克隆抗体,FITC标记的羊抗兔IgG购自Proteintech公司;HRP标记的二抗购自Bioss公司。
1.2 支持细胞的体外培养参照本试验之前的研究方法[1-2],用0.1%胶原酶和0.25%胰酶消化睾丸组织,利用差速贴壁方法纯化支持细胞。将纯化的支持细胞按5×105个/mL的密度培养于含10% FBS和1%双抗的DMEM/F12培养液中,于37℃,5% CO2饱和湿度的条件下进行培养。此时的支持细胞记为原代支持细胞(0代),培养2~3 d后,细胞铺满皿底90%以上时进行传代,传代后的细胞记为1代支持细胞,以此类推,进行细胞代数的标记。
1.3 免疫荧光染色待铺满皿底90%以上时,用4%多聚甲醛固定15 min,用含0.1% BSA的PBS溶液清洗2次,每次5 min,滴加5% BSA封闭液,室温封闭40 min,弃掉封闭液,加入按1∶500稀释(含1% BSA的PBS溶液)的一抗,4℃孵育过夜,使用正常IgG作为阴性对照。用含0.1% BSA的PBS溶液清洗2次,每次5 min,加入按1∶200稀释(含1% BSA的PBS溶液)的FITC标记的二抗,室温避光孵育1 h,用含0.1% BSA的PBS溶液清洗2次,每次5 min,用DAPI复染5 min。用PBS清洗3次后,置于荧光显微镜下观察。
1.4 实时荧光定量RT-PCR分析参考WANG等[6]的方法,使用TRIzol(Invitrogen)试剂提取支持细胞的总RNA,进行反转录,采用定量RT-PCR检测PI3K、Akt、ZO-1、Connexin-34和β-actin的表达,内参基因为β-actin,用2-△△Ct法计算靶基因的表达水平。检测基因的引物序列见表1,由华大基因公司合成。

表1 引物序列及相关信息
1.5 免疫蛋白印迹分析参考WANG等[8-10]的方法,将处理后的细胞用PBS洗涤,用胰蛋白酶消化后收集细胞,再次用PBS洗涤细胞2次,去除上清液后,加入150 μL RIPA裂解缓冲液提取蛋白。用BCA蛋白检测试剂盒检测蛋白质量浓度。采用10% SDS-PAGE分离蛋白质,转膜后用5%脱脂奶粉封闭1 h,然后与一抗(PI3K、Akt、ZO-1、Connexin-34、β-actin,1∶1 000,Bioss公司)在4℃下孵育过夜。清洗膜3次,每次10 min,加入HRP标记的二抗(1∶3 000)在室温下孵育1 h。洗涤3次,使用ECL-Western blot检测系统检测(Amersham Biosciences,USA)。用Image J软件进行灰度分析。

2 结果
2.1 支持细胞的体外成熟与分化分离纯化后的支持细胞贴壁较快,形态类似成纤维细胞。传到5代时,有少量细胞的细胞质扩展,面积增大,表现出成熟状态;传到10代时,支持细胞的细胞质充分扩展,细胞质的表面积进一步增大;传到20代时,细胞质充分发育,不同细胞质之间相互连接,细胞质的表面积更大(图1)。随着传代次数增加,支持细胞增殖速度逐渐变慢,支持细胞逐渐趋于成熟状态。因此,在本试验中,5代以内的细胞作为未成熟的支持细胞,10代以上的细胞作为成熟的支持细胞,用于进一步的基因表达分析。

A.1代睾丸支持细胞;B.5代睾丸支持细胞;C.10代睾丸支持细胞;D.20代睾丸支持细胞图1 不同代次犊牛睾丸支持细胞(标尺=50 μm)
2.2 支持细胞的免疫荧光染色对未成熟与成熟的支持细胞进行免疫荧光染色分析,波形蛋白染色显示,未成熟与成熟的支持细胞都呈阳性,波形蛋白表达于细胞质(图2)。ZO-1染色显示,未成熟与成熟的支持细胞都呈阳性, ZO-1表达于支持细胞边缘(图3)。
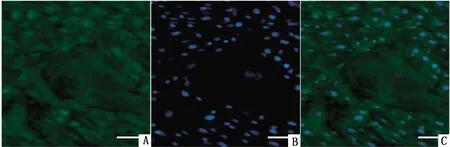
A.波形蛋白染色;B.DAPI染色;C.叠加图图2 犊牛睾丸支持细胞的波形蛋白染色(标尺=50 μm)

A.ZO-1染色;B.DAPI染色;C.叠加图图3 犊牛睾丸支持细胞的ZO-1染色(标尺=20 μm)
2.3 支持细胞增殖与成熟相关基因的表达RT-PCR分析显示,支持细胞成熟分化后,与细胞增殖相关的PI3K的mRNA水平显著下降(P<0.05),Akt的mRNA水平并没有显著改变(P>0.05);与细胞紧密连接相关的ZO-1和Connexin-34的mRNA水平略有升高,但与对照组相比差异不显著(P>0.05)(图4)。Western blot分析的结果与RT-PCR分析的结果一致(图4)。

相同字母表示组间差异不显著(P<0.05),不同字母表示组间差异显著(P<0.05)图4 犊牛睾丸支持细胞增殖与成熟相关基因的表达
3 讨论
在正常的生理状态下,幼年动物睾丸内的未成熟支持细胞具有很强的增殖能力,成年动物的支持细胞高度分化不再增殖[13]。在啮齿动物中,出生后3~5 d内,支持细胞继续增殖并将生殖细胞吸引至基底膜以建立精原干细胞生态位。在出生后第2周,随着精原细胞进入减数分裂,支持细胞停止增殖并变大,形成紧密连接并在出生后15~16 d建立血睾屏障。支持细胞的体外研究,大部分集中于使用未成熟的支持细胞,而关于支持细胞体外成熟分化的形态学及其机制研究相对较少[14]。本实验室前期培养了幼年鼠(7日龄)和青年鼠(6周龄)的睾丸支持细胞,发现原代的青年鼠睾丸支持细胞的细胞质铺展面积较大,增殖速度慢。参照鼠的未成熟和成熟的支持细胞,本试验利用体外不断传代的方法,诱导犊牛睾丸支持细胞成熟分化,从形态学上观察到支持细胞的细胞质充分扩展,增殖能力降低,表现出成熟的特征。随着传代次数的增加,成熟的支持细胞数量不断增多。除了细胞质扩展的形态学特征之外,并没有找到特异性的免疫荧光染色标记来区分未成熟与成熟的支持细胞,后续试验将继续筛选支持细胞体外成熟的标记,为支持细胞体外分化成熟的研究提供参考。
曲细精管内的血睾屏障将生精上皮分为基底室和近腔室,保证精子的发生。伴随血睾屏障的形成,支持细胞停止增殖,成熟的相邻支持细胞之间形成紧密连接[15]。PI3K/Akt信号通路是调控细胞增殖的重要通路,研究表明,激活PI3K/Akt信号通路,可促进细胞增殖,抑制PI3K/Akt信号通路,支持细胞发生成熟分化[6]。本试验检测到细胞质扩展的支持细胞中PI3K/Akt信号通路被抑制,从分子水平证实了细胞质扩展后支持细胞增殖能力降低,逐渐分化成熟。ZO-1和Connexin-34是主要的紧密连接蛋白[8-10],本试验检测到成熟的支持细胞的ZO-1和Connexin-34的mRNA和蛋白的表达水平升高,但与对照组相比差异不显著。血睾屏障的紧密连接在体内是立体结构条件下形成的,在体外培养条件下,可能成熟支持细胞的紧密连接形成不完善,导致ZO-1和Connexin-34的表达没有显著升高。3D培养条件可能更有利于研究支持细胞成熟和血睾屏障紧密连接的形成机制。
综上所述,犊牛睾丸支持细胞体外传代培养过程中,逐渐发生分化成熟,成熟的支持细胞的细胞质扩展,分裂能力逐步降低。
