GlpK影响肠炎沙门菌生物被膜形成
2022-07-23吴同垒冀梦瑶周诗淼张莹辉李佩国河北科技师范学院河北省预防兽医学重点实验室河北秦皇岛066004中国兽医药品监察所北京00080
吴同垒,冀梦瑶,周诗淼,张莹辉,李佩国*,蒋 卉* (.河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066004;.中国兽医药品监察所,北京 00080)
肠炎沙门菌能够引起多种动物的腹泻、呕吐等临床症状,以及幼龄动物的大规模死亡[1-2];成年动物抵抗力强,往往呈隐性感染,但可通过其分泌物向外界排菌,这也是导致其所致疾病难以净化的主要原因[3]。被污染的动物产品被人类食用或人类直接接触感染动物可引起胃肠炎等疾病,对人类健康造成严重威胁[4]。因此,控制动物及动物产品中沙门菌的流行,对人类健康和公共卫生有着重要意义。目前防控沙门菌感染主要依赖抗生素,但耐药菌株的出现给防控工作带来了巨大压力。进一步研究其耐药机制,对防治沙门菌感染具有重要意义。
生物被膜能够显著增强细菌的耐药性,帮助细菌逃避机体的免疫防御反应,造成慢性感染,给疾病防控带来一定的困难。甘油激酶(glycerokinase,GlpK)在大多数细菌和动物细胞中普遍存在,主要参与甘油代谢和质膜的合成[5]。多项研究证实,分枝杆菌属细菌可利用GlpK调节细菌的耐药性,针对GlpK靶点而设计的药物可有效治疗结核病,揭示了GlpK与耐药性之间的关系[6-7]。肠炎沙门菌GlpK能否影响细菌生物被膜的形成,进而影响其耐药性,需要进一步阐明。
本研究构建了肠炎沙门菌GlpK基因敲除菌株,并进行生物被膜分析和药敏试验,为新型靶向抗菌药物的研发奠定了重要基础。
1 材料与方法
1.1 菌株来源肠炎沙门菌c50336、温敏型质粒pKD3、pCP20,重组酶表达质粒pKD46,由河北科技师范学院预防兽医学重点实验室保存;质粒pMD18-T购自宝生物工程(大连)有限公司。
1.2 试剂和试剂盒Taq酶、T4连接酶购自宝生物工程(大连)有限公司;DNA Marker、荧光定量PCR试剂购自康为世纪生物公司;反转录试剂、限制性内切酶和蛋白Marker购自Thermal Scientific公司;L-阿拉伯糖购自Sigma公司;ID32E生化鉴定试纸条购自Biomerieux公司,细菌RNA提取试剂盒购自天根生化科技(北京)有限公司。
1.3 基因敲除和回补相关引物的设计根据NCBI的GenBank中肠炎沙门菌基因组GlpK的基因信息设计引物。引物P3和P4由两部分组成,用于扩增氯霉素基因,下划线部分与GlpK基因同源,其余部分与氯霉素基因同源;引物P5、P6根据引物P3和P4与GlpK同源片段两侧的序列设计,用于敲除菌株的鉴定;引物P1和P2用于pKD46质粒的鉴定;引物P7、P8用于GlpK回补表达菌株的构建。引物信息见表1,由生工生物工程(上海)股份有限公司合成。

表1 引物序列及相关信息
1.4 GlpK基因敲除菌株及回补株的构建提取质粒pKD46,电击转化至肠炎沙门菌c50336中,具体操作:取c50336培养至对数期,使用预冷的去离子水洗涤3次并重悬,87 μL/管分装,取3 μL质粒pKD46,与之混匀进行电击,电压为1.8 kV,电击后使用LB液体培养基于37℃培养,涂布含Amp的LB平板,长出单菌落后,以引物P1和P2鉴定。
以质粒pKD3为模板,使用引物P3、P4进行扩增和回收,获得同源片段;在培养至对数期的c50336(携带pKD46)菌液中加入终浓度30 mmol/L的阿拉伯糖诱导2 h,将同源片段电击转化至c50336(携带pKD46)菌株中,电击过程同前所述;涂布含氯霉素的LB平板,长出单菌落后使用引物P5和P6鉴定。阳性菌经42℃热激去除质粒pKD46,命名为c50336::cat。将质粒pCP20电转化入c50336::cat,经抗性筛选得到丢失氯霉素片段的菌株,即为2次重组菌株c50336ΔglpK,以引物P5和P6对其进行鉴定。42℃热激去除质粒pCP20。
以引物P7和P8扩增GlpK基因,双酶切后克隆至回补质粒pMD18-T,即为pMD18-T-glpK,将质粒电转化至菌株c50336ΔglpK中,即为回补菌株 c50336ΔglpK+glpK。
1.5 生长曲线测定和生化特性分析培养过夜细菌按1∶100转接新鲜LB或LB(含氯霉素)液体培养基,37℃,180 r/min振荡培养;在多个时间点测定菌液D600 nm,并绘制生长曲线。使用ATB自动鉴定系统进行菌株生化特性分析,简要操作如下:挑取单菌落分散在生理盐水中,滴加在ID32E生化鉴定试纸条上,并使用矿物油滴加在厌氧孔;将试纸条放在湿盒中,37℃培养过夜;次日向吲哚孔滴加James后上机分析。
1.6 生物被膜形成能力检测采用试管法和微孔板法进行生物被膜测定。试管法操作步骤:过夜培养菌液按照1∶100比例转接到含有6 mL液体培养基的试管中,28℃低速振荡培养72 h(转速60 r/min ),弃去液体培养基,使用PBS小心洗涤5次。试管洗涤后,使用酒精灯火焰干燥,加入甲醇(要没过菌液平面)固定10 min,弃去甲醇,用PBS反复清洗;加入2%的结晶紫溶液染色30 min,用PBS反复清洗,观察试管壁上的生物被膜。微孔板法简要步骤:将过夜培养菌液加入到96孔微量板中,每孔加入200 μL,按照上述方法培养、洗涤和染色后,加入100 μL无水乙醇,溶解孔壁上结晶紫,测定D570 nm光密度值。
1.7 药敏试验取菌液均匀涂板,使用无菌镊子取药敏纸片贴于平板上,37℃倒置培养12 h。观察抑菌圈并测量抑菌圈直径,根据NCCSL标准判定结果。
1.8 Curli菌毛和纤维素的检测Curli菌毛检测步骤:滴加菌液到含有160 mg/L刚果红与10 mg/L考马斯亮蓝的无盐LB平板上,28℃培养2 d,观察菌落形态和颜色。能够形成Curli菌毛的菌落表面粗糙、干燥,颜色更红,反之,则出现颜色较浅且光滑的菌落。纤维素的检测步骤:滴加菌液到含有 Calcofluor White Stain(200 mg/L)的无盐LB平板上,28℃培养2 d,在紫外灯下观察。能够形成纤维素的菌落荧光强度高,反之,荧光强度低。
1.9 生物被膜相关基因的表达分析培养细菌c50336、c50336ΔglpK至对数期,使用细菌RNA提取试剂盒提取RNA;用DNaseⅠ去除DNA后,反转录合成cDNA,选择文献[8]中与生物被膜形成相关的基因及其引物,采用染料法进行荧光定量PCR分析,内参使16S rRNA。引物序列见表2。

表2 PCR引物名称及序列
2 结果
2.1 GlpK基因缺失菌株和回补菌株的构建以1次重组菌株c50336ΔglpK::cat和2次重组菌株c50336ΔglpK的菌液为模板,使用引物P5、P6鉴定,结果见图1A,与预期相符,证明GlpK基因敲除菌株构建成功。以回补菌株c50336ΔglpK+glpK菌液为模板,以引物P7、P8进行鉴定,结果见图1B,与预期结果一致,表明回补菌株构建成功。
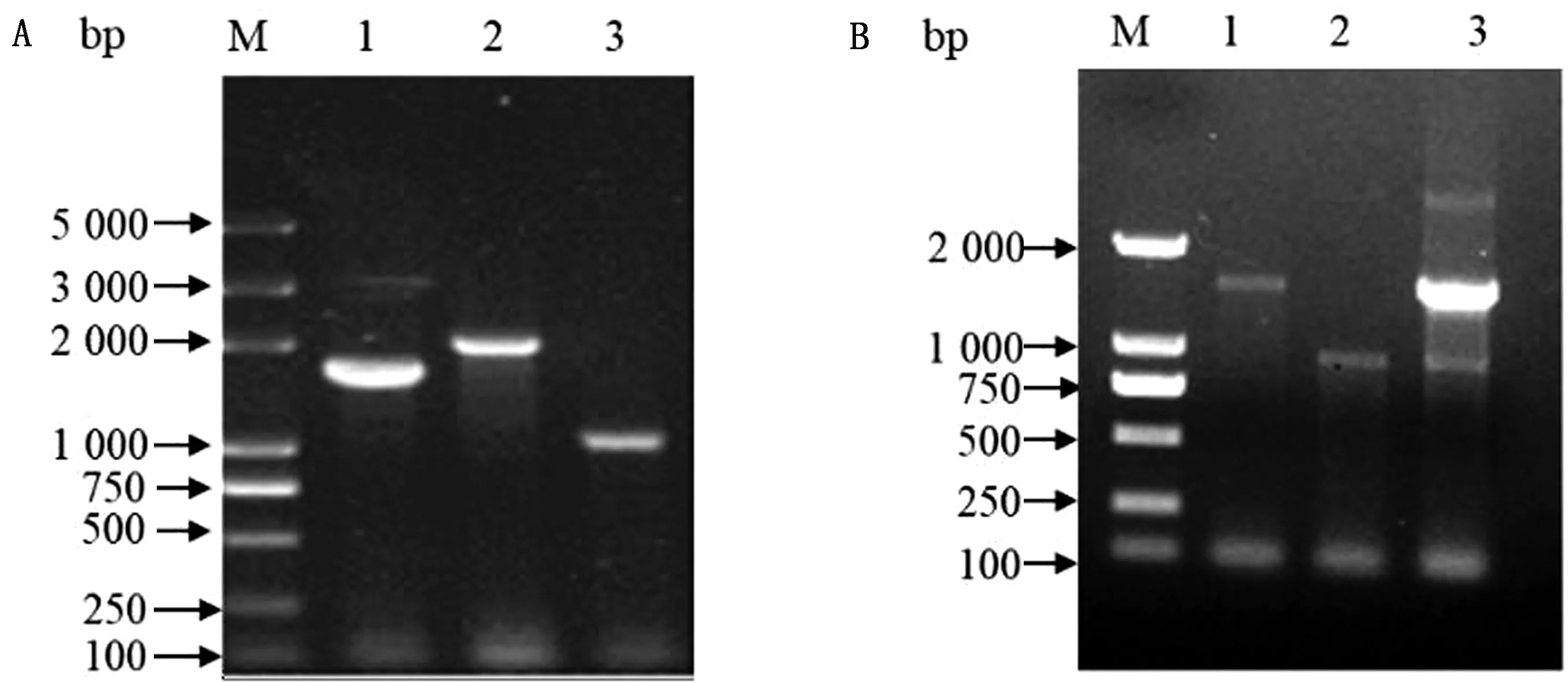
A.GlpK基因敲除菌株的鉴定结果(M.DL5000 Plus DNA Marker;1.c50336;2.c50336ΔglpK::Cat;3.c50336ΔglpK);B.回补菌株的鉴定结果(M.DL2000 Plus DNA Marker;1.c50336;2.c50336ΔglpK;3.c50336ΔglpK+glpK)图1 GlpK基因敲除菌株的鉴定和回补菌株验证
2.2 菌株生长曲线测定和生化特性分析生长曲线绘制结果(图2)显示,3株菌株的生长曲线趋势一致,基因敲除菌株c50336ΔglpK菌株的生长相比于野生型c50336菌株,无明显差异,表明在LB培养的条件下,肠炎沙门菌缺失GlpK基因对生长和营养代谢影响不大。生化特性鉴定结果(表3)显示,菌株c50336ΔglpK和c50336ΔglpK+glpK的d-纤维二糖发酵结果为阴性,野生型菌株c50336为阳性,菌株c50336ΔglpK的α-半乳酸酐酶αGAL为阳性,菌株c50336为阴性,菌株c50336ΔglpK+glpK为阳性,表明GlpK基因缺失肠炎沙门菌的生化特性影响较小。

WT.c50336;KO.c50336ΔglpK;RS.c50336ΔglpK+glpK图2 生长曲线

表3 GlpK基因敲除菌株生化鉴定结果
2.3 生物被膜检测采用试管法和微孔板法进行生物被膜测定,试管法检测结果见图3A,可见菌株c50336ΔglpK试管中形成的生物被膜相比于c50336和c50336ΔglpK+glpK浅且细。结晶紫染色法检测结果显示,c50336ΔglpK菌株黏附的结晶紫吸光度值,明显低于菌株c50336和c50336ΔglpK+glpK(图3B)。上述结果表明GlpK敲除可降低肠炎沙门菌的生物被膜形成能力。

A.试管法;B.微孔板法。WT.c50336;KO.c50336ΔglpK;RS.c50336ΔglpK+glpK;**.示0.001 2.4 药敏试验耐药性结果显示(表4),相对于野生型菌株c50336,菌株c50336ΔglpK对喹诺酮类药物、内酰胺类药物中的头孢曲松和头孢拉定,替米考星、氨基糖甙类药物中的诺氟沙星和恩诺沙星,酰胺醇类中的氟苯尼考,以及乙酰甲喹的敏感性显著提高。回补菌株耐药性得到部分恢复,但对替米考星和乙酰甲喹等药物敏感性未得到恢复,可能的原因是回复菌株GlpK基因表达水平并未完全达到生理水平,且由于染色体上GlpK的敲除导致附近处于同一操纵子下的基因的表达受到抑制,进而影响了菌株耐药性。这些结果表明敲除GlpK基因降低了肠炎沙门菌的耐药性。 表4 GlpK基因缺失菌株药敏试验结果 2.5 Curli菌毛和纤维素检测Curli菌毛试验检测结果显示菌株c50336和c50336ΔglpK+glpK形成红色、边缘粗糙的菌落,而菌株c50336ΔglpK形成白色且边缘光滑的菌落(图4A),表明GlpK基因缺失降低了肠炎沙门菌产生Curli菌毛的能力。纤维素检测结果显示菌株c50336的菌落荧光强度比菌株c50336ΔglpK亮,菌株c50336ΔglpK+glpK的菌落荧光强度得到一定恢复(图4B)。结果表明敲除GlpK基因能抑制肠炎沙门菌纤维素的产生。 WT.c50336;KO.c50336ΔglpK;RS.c50336ΔglpK+glpK图4 Curli菌毛(A)和纤维素的检测(B) 2.6 生物被膜相关基因的表达基因表达分析结果显示bcsgD、bcsA、ropS、ompR、rfbH和fimD表达量均发生不同程度降低(图5),表明GlpK影响生物被膜的形成是多种机制共同作用的结果,这在一定程度上揭示了其在生物被膜形成中的作用机制。 WT.c50336;KO.c50336ΔglpK;*.示0.01 肠炎沙门菌是重要的人兽共患致病菌,主要引起幼龄动物死亡和成年动物的隐性感染以及人类胃肠炎,具有重要的公共卫生学意义。细菌可在人、动物、动物产品和环境之间循环传播,给疾病的防控工作带来严重挑战。在临床实践中,肠炎沙门菌感染往往依靠抗生素进行防治,随着而来的是耐药菌株的大量出现。相关研究显示,甘油激酶GlpK可介导分枝杆菌的耐药,针对该基因设计的靶向药物可有效治疗相关疾病[6-7]。因此,本研究构建了肠炎沙门菌GlpK基因敲除菌株,并进行了生长曲线、生化特性、耐药性和生物被膜形成能力分析,结果显示GlpK基因敲除可显著降低肠炎沙门菌的耐药性和形成生物被膜的能力,降低了其Curli菌毛和纤维素的产生,下调了生物被膜形成相关基因的表达,研究结果为肠炎沙门菌新型靶向抗菌药物的研发奠定了重要基础。 耐药甚至多重耐药菌株给相关疾病的防控工作带来极大压力。不同于抗生素类药物,新型靶向药物不易产生耐药,是目前抗菌药物研发的重要方向。GlpK可介导分枝杆菌的耐药性,但在肠炎沙门菌中的作用尚不明确。本研究通过同源重组技术构建了肠炎沙门菌GlpK敲除菌株,采用K-B纸片法分析其耐药性的变化,证明GlpK基因可介导肠炎沙门菌对喹诺酮类药物、内酰胺类药物中的头孢曲松和头孢拉定,替米考星、氨基糖甙类药物中的诺氟沙星和恩诺沙星,酰胺醇类中的氟苯尼考,以及乙酰甲喹的耐药性。研究结果证明GlpK可影响肠炎沙门菌的耐药性,为新型靶向药物的研制奠定了重要基础。 生物被膜是为单一或多种类细菌为适应周围环境,附着于生物或非生物的固体表面而形成的具有一定结构的微生物群体,可保护细菌免于抗菌药物的杀伤作用,与细菌耐药性息息相关[8-9]。本研究利用试管法和微孔板法证明GlpK基因敲除菌株的生物被膜形成能力显著降低,从生物被膜角度揭示了其影响耐药性的作用机制。卷曲菌毛(Curli菌毛)和纤维素是沙门菌生物被膜的主要成分[10],本研究证明GlpK敲除菌株生成Curli菌毛和纤维素的能力降低,进一步揭示了该基因影响肠炎沙门菌生物被膜形成的机制。 研究显示,调控基因qbcsgD可影响Curli菌毛的生物合成;ropS和ompR基因可激活qbcsgD基因转录,进而对生物被膜产生影响[11-12];rfbH基因可能通过影响细菌O-抗原的形成,从而影响生物被膜的形成;fimD基因编码鞭毛蛋白,鞭毛形成和生物被膜密切相关[13-14];bcsA基因也可影响沙门菌生物被膜形成[15-16]。本研究通过荧光定量PCR方法证明GlpK基因敲除后,bcsgD、bcsA、ropS、ompR、rfbH和fimD表达量降低,研究结果从分子水平揭示了GlpK影响沙门菌生物被膜形成的机制。 综上所述,本研究利用同源重组技术构建了肠炎沙门菌GlpK基因敲除菌株,并进行了生物被膜和药物敏感性检测,同时分析了该基因影响生物被膜形成的作用机制,为防控沙门菌感染的靶向药物研发奠定了重要基础。


3 讨论
