基于生物信息学分析胃癌铁死亡相关基因预后及免疫细胞浸润的临床和功能意义①
2022-07-21罗连响陈心铭郑羽诗广东医科大学海洋医药研究院湛江524023
罗连响 陈心铭 郑羽诗 罗 辉 (广东医科大学海洋医药研究院,湛江 524023)
铁死亡(ferroptosis)是一种区别于细胞凋亡、细 胞坏死、细胞自噬和细胞焦亡的新型细胞程序性死亡方式,由脂质过氧化和致命活性氧积累导致,与肿瘤病理生理过程密切相关[1-3]。铁死亡可能在癌症治疗中,尤其是在根除对传统治疗有抵抗力的恶性肿瘤时引发,癌细胞比正常细胞对铁的需求量大,这种铁依赖性可使癌细胞更易受铁死亡影响。全新的铁死亡诱导剂有望成为治疗耐药性癌症的新方法[4-5]。
胃癌(gastric carcinoma,GC)是全球第五大常见癌症和第三大癌症死亡原因,是一种分子和表型高度异质性的消化道疾病,世界范围内存活率仅为30%,由于人口老龄化,每年新发病例仍在增加[6-8]。胃癌发生与幽门螺杆菌感染和年龄等因素相关[9-10]。随着放疗和化疗技术进步,早期GC 的五年生存率可达到95%,但多数患者诊断时已经是晚期,晚期GC 预后较差,主要治疗方法为分子靶向治疗、免疫治疗及新辅助化疗[11-12]。
GC中一些基因在调节铁死亡中起重要作用,如GPX4 和SLC7A11 表达可增加ROS 积累从而促进GC 细胞铁死亡,SCD1、EIF4A1 和perilipin2 表达可抑制GC 细胞铁死亡[13-16]。此外,TIMP1 与铁死亡存在联系,在GC中过度表达[17];TIMP1可能是GC预后的生物标志物[18];CDO1 对胃癌细胞中Erastin 诱导的铁死亡具有调控作用[19]。但铁死亡相关基因(fer⁃roptosis-related gene,FRG)是否与GC 患者预后相关仍有待研究。
因此,本研究基于TCGA 患者mRNA 表达谱和临床数据构建了一个与铁死亡相关的预后模型,在GEO 队列中进行了验证,并对其功能富集和免疫打分相关性进行分析,旨在开发一种预测GC 患者总生存率(overall survival,OS)的FRG签名和列线图模型,探讨其可能作用机制,为GC 患者个性化治疗提供参考。
1 材料与方法
1.1 表达数据和临床数据收集 研究流程图如图1所示。通过TCGA(The Cancer Genome Atlas)数据库获取胃癌(Stomach adenocarcinoma,STAD)样本基因表达及相关临床信息,共得到403例STAD样本用于训练组研究。通过美国国立生物信息中心(National Center for Biotechnology Information,NCBI)的GEO(Gene Expression Omnibus)数据库获取数据集GSE84426的基因表达数据和临床信息,共得到76例GC 样本被纳入验证组研究。两组临床特征如表1所示。胃腺癌代表了多数胃恶性肿瘤[20],占胃恶性肿瘤的95%,因此来自TCGA-STAD 和GSE84426 的样本可代表胃腺癌样本。
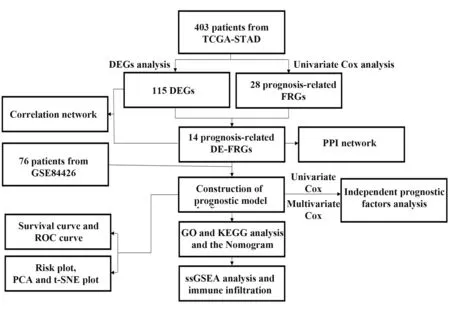
图1 FRG预后模型构建Fig.1 Construction of prognosis model of FRG

表1 纳入本研究的GC患者临床特征[例(%)]Tab.1 Clinical characteristics of GC patients included in this study[n(%)]
1.2 筛选预后相关的差异基因 从FerrDb(http://www.zhounan.org/ferrdb/)收集了290个FRG。采用R软件limma 包对数据进行整理,提取出245FRG,筛选出115 个差异表达基因(differential expression genes,DEG,fdr<0.05,|logFC|>0.5)。采用R 软件survival 包、单因素Cox 分析得到28个预后相关基因(P<0.05),比较后得到的10个差异表达的FRG具有预后价值用于构建预后模型。
1.3 预后模型的构建和验证 基于上述10 个基因,采用R 软件glmnet包进行LASSO-Cox回归分析,构建预后模型。患者风险评分=∑(每个基因表达水平×相应系数)。根据风险评分的中位数将患者分为高风险组和低风险组。受试者操作特征(ROC)分析检验独立风险因素预测生存率的敏感性和特异性,评估模型预测准确性。t-SNE 和PCA 分析探讨高风险组和低风险组分布。
1.4 功能富集分析 采用R 软件clusterProfiler 包进行GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)分析,探讨不同分子机制及高、低风险患者差异。GO 分析包括生物学过程、细胞成分和分子功能。
1.5 免疫细胞和免疫相关通路评分的相关性分析 采用R 软件GSVA 包中的单样本基因集富集分析(ssGSEA)进一步量化16 个免疫细胞的浸润水平和13个免疫相关通路活性。
1.6 统计学分析t检验用于确定肿瘤组织和正常组织中差异表达的FRG。采用卡方检验比较各组比例构成差异。Mann-Whitney 检验评估风险组间免疫细胞或途径ssGSEA 得分差异,并采用BH 方法调整P值。采用Kaplan-Meier分析和对数秩检验(Logrank test)比较各组OS。单因素和多因素Cox 回归分析确定OS 的独立预后因素。所有统计分析均采用R 软件(4.0.3)完成。P<0.05 为差异具有统计学意义。
2 结果
2.1 TCGA-STAD队列中预后相关DEG筛选 TCGASTAD 队列中筛选出115 个铁死亡相关DEG,其中14 个与OS有关(图2A)。14 个铁死亡相关DEG 中,8个基因在肿瘤组织中上调,6个基因在肿瘤组织中下调(图2B)。单因素Cox 分析显示,14 个基因均与GC患者OS显著相关,其中9个为危险基因(HR>1),5 个为保护基因(HR<1)(图2C)。相关性网络显示14 个有预后价值的铁死亡相关DEG 相关(图2D)。STRING 数据库下载的PPI 网络表明基因间相互作用(图2E)。14 个基因中ATG16L1、CAV1、CDO1、DUSP1、GABARAPL1、HIF1A、LONP1、MYB、NFE2L2、NOX4、SLC1A5和TGFBR1在肿瘤组织和正常组织中表达差异有统计学意义(P<0.05,图2F),其中ATG16L1、HIF1A、LONP1、MYB、NOX4、SLC1A5 和TGFBR1 在肿瘤组织表达上调,为致癌基因;CAV1、CDO1、DUSP1、GABARAPL1 和NFE2L2 在肿瘤组织表达下调,为抑癌基因(图2F)。

图2 TCGA-STAD队列中有预后价值的DEG筛选Fig.2 Screening of DEG with prognostic value in TCGASTAD cohort
2.2 10 基因预后模型构建 LASSO-Cox 回归分析得到10 个有预后价值的DEG(表2,基因全称来自https://www. 360zhyx. com/),构建预后模型(图3)。以风险评分中位数为临界值,将TCGA-STAD 队列患者分为高风险组(n=159)和低风险组(n=158)。Kaplan-Meier曲线显示高风险组生存时间缩短(图4A,P<0.01)。ROC 曲线评价模型预测性能,曲线下面积(AUC)在3 年时达到0.693,4 年时达到0.695,5 年时达到0.700(图4B)。图4C 显示患者被分为高、低风险两组。高风险组患者生存时间较低风险患者生存时间缩短(图4D)。PCA 和t-SNE 分析显示,不同风险组患者分为两个方向(图4E、F)。

表2 预后签名中的基因Tab.2 Genes in prognostic gene signatures

图3 TCGA-STAD队列10基因预后模型构建Fig.3 Construction of 10 gene prognosis model in TCGASTAD cohort
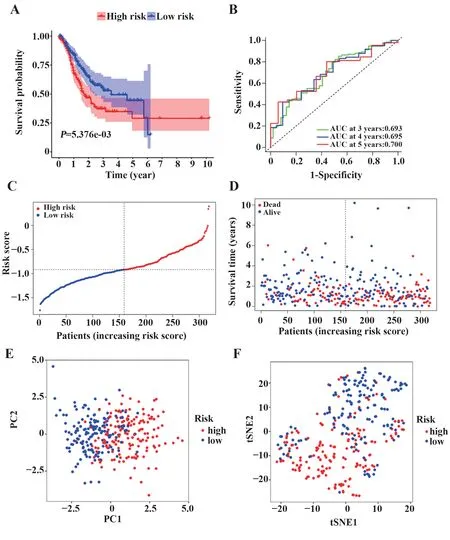
图4 TCGA-STAD队列基于10基因预后模型的生存分析Fig.4 Survival analysis in TCGA-STAD cohort based on 10 gene prognostic model
2.3 10 基因预后模型的验证 将GSE84426 队列患者分为高风险组(n=38)和低风险组(n=38)。GSE84426队列生存分析结果与TCGA-STAD队列生存分析结果相近(图5,P<0.05,AUC 在3 年时达到0.678,4年时达到0.686,5年时达到0.691)。

图5 预后模型验证Fig.5 Validation of prognostic model
2.4 独立预后分析 单因素Cox 回归分析中,分期较高是TCGA-STAD 队列和GSE84426 队列患者OS的不利因素(TCGA-STAD:HR=1.833,95%CI=1.256~2.674,P=0.002;GSE84426:HR=2.690,95%CI=1.042~6.943,P=0.041,图6A、C)。多因素Cox回归分析中,年龄较大在TCGA-STAD 队列中显示出更差的OS(HR=2.038,95%CI=1.395~2.976,P<0.001,图6B)。此外,高风险是两组患者OS 的不利因素(TCGA-BRCA:HR=4.238,95%CI=2.507~7.613,P<0.001;GSE84426:HR=2.137,95%CI=1.057~4.319,P=0.034,图6B、D)。因此,风险评分是OS 的独立预后因素。图6E显示了TCGA-STAD 队列构建的列线图,采用4个预后因素(年龄、性别、分级和分期),可根据影响生存的预后因素的比例对患者进行打分。
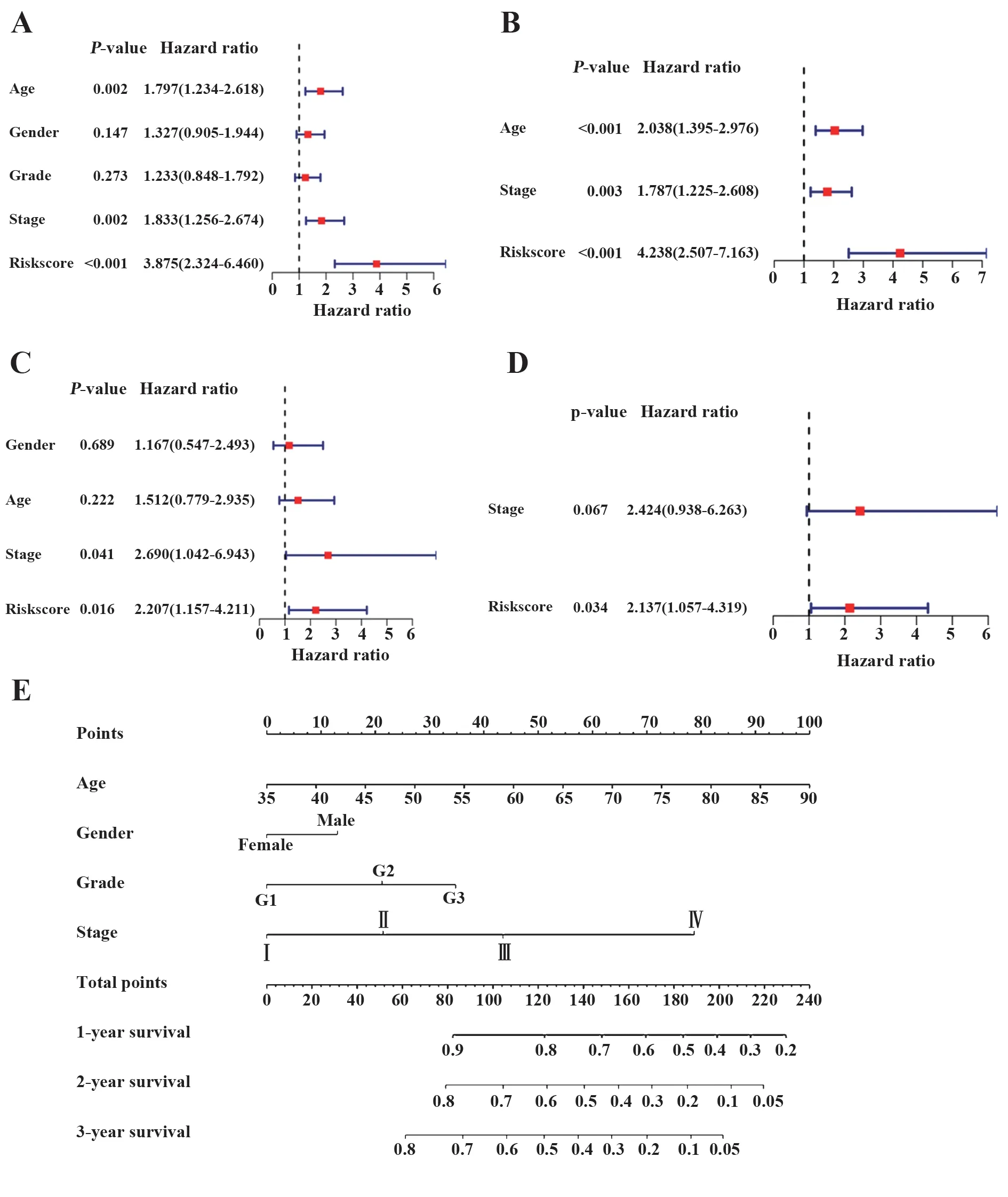
图6 独立预后分析Fig.6 Independent prognostic analysis
2.5 功能富集分析 GO 分析显示,来自TCGA 队列风险组间的DEG 主要富集于细胞外基质组织和细胞外结构组织。细胞成分方面,DEG 主要富集于含胶原细胞外基质(图7A)。KEGG 途径分析显示,黏着斑和PI3K-Akt信号通路显著富集(图7B)。
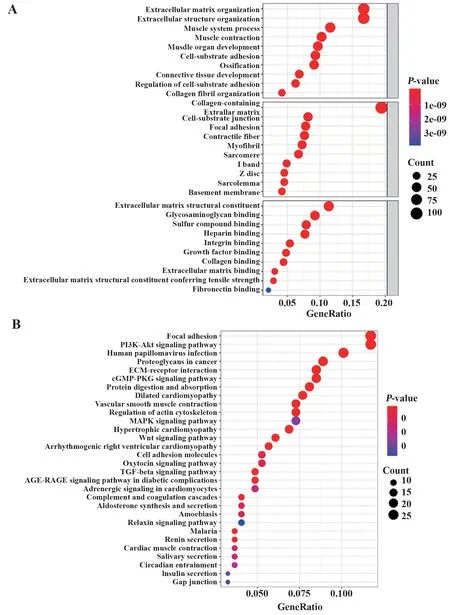
图7 GO和KEGG功能富集分析Fig.7 Enrichment analysis of GO and KEGG functions
2.6 免疫细胞和免疫相关途径 TCGA 队列高风险组中,B 细胞、CD8+T 细胞、树突状细胞、未成熟树突状细胞、巨噬细胞、肥大细胞、中性粒细胞、浆细胞样树突状细胞、辅助性T 细胞、滤泡辅助性T 细胞、TIL细胞和调节性T细胞的免疫细胞亚群显著上调(所有调整后的P<0.05,图8A)。至于免疫相关通路,APC 共刺激、CCR、检查点、副炎症、T 细胞共刺激和Ⅱ型IFN 反应显著上调(均经校正P<0.05,图8B)。通过GSE84426 队列的高风险组验证,B 细胞、滤泡辅助性T 细胞、TIL 细胞、T 细胞共刺激和Ⅱ型IFN反应均被证实(均经调整P<0.05,图8C、D)。
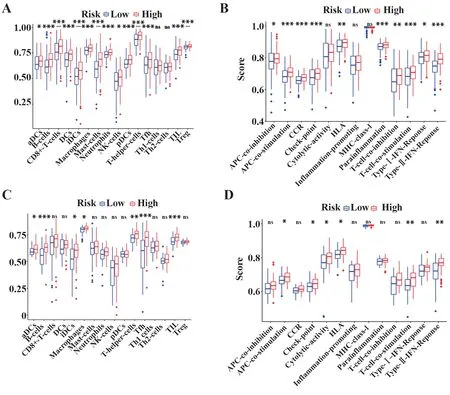
图8 TCGA-STAD 队列和GSE84426 队列高风险组和低风险组ssGSEA得分Fig.8 ssGSEA scores of high-risk group and low-risk group in TCGA-STAD cohort and GSE84426 cohort
3 讨论
GC患者晚期预后较差,五年生存率较低使开发稳定的预后指标变得非常重要。本研究基于TCGA数据建立了一个包含10 个基因签名的铁死亡相关模型预测GC 预后,并在GSE84426 队列中验证其预测准确性。上述两个队列中,高风险组GC 患者生存期均短于低风险组。此外,风险评分是GC 患者独立的预测因子,与临床特征和免疫功能密切相关。
本研究通过对10 个铁死亡相关基因的功能分析,确 定MYB、SLC1A5、NFE2L2、ATG16L1 和LONP1 为 保 护 基 因,TGFBR1、ZFP36、DUSP1、HIF1A和NOX4为危险基因。根据FerrDb,TGFBR1、HIF1A、MYB、SLC1A5、DUSP1 和NOX4 是促进铁死亡的驱动因素,而NFE2L2 和ZFP36 是预防铁死亡的抑制剂(http://www. zhounan. org/ferrdb/)。对于TGFBR1,Linc00462过表达提高TGFBR1和TGFBR2表达,从而促进胰腺癌侵入性[21-22]。此外,TGFBR1表达可促进GC 发展[23]。MYB 在多种白血病和癌症中过度表达,与ROS 递质改变有关[24]。SLC1A5 表达的蛋白是一种细胞表面转运蛋白,转运中性氨基酸[25]。miR-137 通过直接靶向谷氨酰胺转运体SLC1A5 负性调节黑色素瘤细胞铁死亡[26];SLC1A5表达可抑制GC 细胞增殖[27]。NFE2L2(NRF2)可促进癌细胞增殖,其表达可能增强GC 细胞对治疗的抵抗力[28-29]。另外,NFE2L2 过表达促进了对铁死亡的抵抗。ARF 介导的铁死亡在很大程度上被NFE2L2 共表达所消除。NFE2L2 基因抑制增强了铁死亡易感性(http://www.zhounan.org/ferrdb/)。研究发现ZFP36在肝星状细胞铁死亡调控中起关键作用,可抑制铁死亡,并确定ZFP36自噬依赖性铁死亡是治疗肝纤维化的一个潜在靶点,ZFP36 质粒通过破坏ATG16L1 mRNA 稳定性抑制自噬激活,ATG16L1 质粒可消除ZFP36 质粒对铁死亡的抑制作用,与GC 易感性相关[30-31]。ATG16L1是自噬相关的基因[32],本研究发现ATG16L1 与铁死亡有关,其在GC 组织中表达上调,且与正常组织表达差异显著。有研究阐明了LONP1 与铁死亡的关系,LONP1抑制其对胰腺导管腺癌PANC1 细胞铁死亡的保护作用[33]。DUSP1 在erastin 或RSL3 诱导的铁死亡过程中表达上调(http://www.zhounan.org/ferrdb/)不稳定的HIF1A 促进肿瘤细胞铁死亡[34]。土荆皮乙酸通过激活NOX4 和抑制xCT 可引起胶质瘤细胞铁死亡[35]。
单因素Cox 回归分析中,分期和风险评分与OS显著相关。多因素Cox 回归分析显示,风险评分是一个独立的预后因素。为更好地预测GC 患者的OS,本研究将风险评分与临床特征相结合,建立了GC患者列线图。
功能富集分析表明,风险评分改变主要与细胞外基质组织、细胞外结构组织和PI3K-Akt 信号通路有关。PI3K-Akt 信号通路参与细胞周期进展、凋亡和肿瘤转化,是肿瘤治疗靶点,与较差预后有关。作为正常细胞过程中最重要的信号通路之一,PI3K-Akt 信号通路可作为治疗GC 和胰腺癌的潜在治疗策略[36-37]。另外,PI3K 的活动也与其他肿瘤相关,包括肺癌、黑色素瘤和白血病[38]。
免疫评分和免疫评分相关性分析表明,高风险组中,B 细胞、CD8+T 细胞、树突状细胞、未成熟树突状细胞、巨噬细胞、肥大细胞、中性粒细胞、浆细胞样树突状细胞、辅助性T 细胞、滤泡辅助性T 细胞、TIL细胞和调节性T细胞的免疫细胞亚群显著上调,B 细胞、滤泡辅助性T 细胞、TIL 细胞在GSE84426 队列中得到了验证。已知B 细胞、T 细胞、巨噬细胞、肥大细胞、中性粒细胞、TIL 细胞和调节性T 细胞的增加预示GC 患者不良预后,因此高风险组预后较低风险组预后差[39-44]。在免疫相关途径方面,APC共刺激、CCR、检查点、副炎症、T 细胞共刺激和Ⅱ型IFN 反应显著上调,T 细胞共刺激和Ⅱ型IFN 反应被验证组证实,均为上调。程序性死亡-1-导向(PD-1-导向)免疫检查点阻断法可将持久的抗肿瘤活性赋予多种晚期恶性肿瘤。Ⅱ型IFN 反应是癌细胞和宿主细胞中PD-L1表达的关键驱动因素[45]。高风险组Ⅱ型IFN 反应在这两个队列中上调,而Ⅱ型IFN 反应有利于抗肿瘤活性增强,因此高风险组预后较差的原因可能是T 细胞共刺激的作用大于Ⅱ型IFN 反应的作用。本研究也有局限性,如仅采用公共数据库,需要更多临床验证。
总之,本研究应用TCGA 和GEO 数据集构建并验证了铁死亡相关基因的预后模型,该模型是与OS相关的独立因素。此外,本研究还开发了一个列线图,医师可应用列线图提高高风险GC 患者识别的准确性,实现精准治疗。