氯化两面针碱调节AKT/ERK1/2 磷酸化影响肺癌细胞生长、运动、微管形成以及免疫应答①
2022-07-21张建新刘雨露朱子贵姚平波南华大学附属南华医院胸外科衡阳421002
张建新 刘雨露 朱子贵 赵 红 姚平波 (南华大学附属南华医院胸外科,衡阳 421002)
肺癌是癌症相关死亡的最常见原因之一,约占所有癌症病死人数的25%。其中非小细胞肺癌约占所有肺癌病例的85%[1]。由于非小细胞肺癌早期症状不明显及现有检测方法的局限性,多数肺癌患者直到中晚期才能得到确诊[2]。肺癌治疗方法取决于癌症的亚型和所在阶段。肺癌已经成为实体肿瘤分子靶向疗法成功的典范,但免疫疗法的高经济负担、治疗失败率和治疗性副作用促使人们寻找新的治疗策略[3]。氯化两面针碱(nitidine chloride,NC)是一种天然的生物活性植物化学生物碱,提取自芸香科花椒属植物两面针的干燥根[4]。研究发现NC在多种类型的癌症中均表现出抗癌活性,如肝癌、鼻咽癌、口腔鳞癌等[5-7]。但尚无证据表明NC 对肺癌细胞生物学特性的影响。本研究旨在探讨NC 对肺癌细胞生长、运动、微管形成及免疫应答的影响,并阐明其可能机制。
1 材料与方法
1.1 材料 肺癌细胞系A549 和NCI-H661 细胞购自美国典型培养物保藏中心(ATCC,Manassas,VA);12周龄雄性BALB/c小鼠购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2019-0031;F12 Kaighn 培养基、RPMI1640 培养基购自Invitrogen;NC(纯度≥98%,CAS:13063-04-2)购自上海源叶生物科技有限公司;诱导型一氧化氮合酶(iNOS)、TNF-α、IL-10 和IL-4 试剂盒购自R&D Sys⁃tems Co.,Ltd.(美国明尼苏达州明尼阿波利斯);所有抗体和内参GAPDH 均购自Abcam 公司;细胞凋亡检测试剂盒购自中国凯基生物有限公司;Cell LightTMEdU 成像检测试剂盒购自美国Ribbio 公司;DAPI 和RIPA 裂解缓冲液购自上海碧云天公司;奥林巴斯荧光显微镜购自日本奥林巴斯;ChemiDoc XRS 凝胶/发光图像分析仪购自美国Bio-Rad 公司;电泳槽、电转仪购自北京六一公司。
1.2 方法
1.2.1 细胞培养 标准培养条件下,采用含10%FBS、100 U/ml 青霉素和100 U/ml 链霉素的F12 Kaighn 培养基培养A549 细胞,并激活2~3 代。NCI-H661 细胞在RPMI1640中以相同条件培养,37 ℃、5%CO2和95%相对湿度空气中孵育,随后采用以上细胞进行细胞活力、增殖、侵袭、微管形成、炎症水平和通路测定。添加AKT的特异性激活剂(SC79:4 μg/ml)进行验证实验[8]。添加抑制剂后的分组情况为:对照组、SC79 组、SC79+NC 12 nmol/L 组,分别测定通路磷酸化、细胞凋亡、侵袭和炎症水平。
1.2.2 肺癌动物模型建立 48 只雄性BALB/c 小鼠(12 周龄)饲养于受控环境:光照12 h/黑暗12 h,(24±2)℃,55%~60%相对湿度。所有小鼠均可自由获得水和食物。将48只BALB/c小鼠分为2组:模型对照组和NC 治疗组(1.5 μg),建模前2 d 分别饲喂标准饲料和添加NC 的饲料,分别皮下注射A549细胞,造模后以2 d/次的给药频率继续培养30 d。根据先前的报告和预实验选择动物模型中使用的NC 剂量[9]。5 d/次测量肿瘤体积。治疗结束后,摘眼球法取血,收集血样并以3 000 r/min离心1 min分离血浆用于指标测定。小鼠断颈处死,解剖移植的肿瘤组织称重,进行RT-PCR 和免疫组织化学检测。所有动物实验均经南华大学附属南华医院伦理委员会批准,严格按照国际动物研究指导原则进行。
1.2.3 CCK-8 检测 将细胞以1×105个/孔接种于96 孔板,每组设3 个复孔,体积100 μl,培养24 h,分别加入最终浓度为0、0.325、0.75、1.50、3、6、12、24、48、96、192 nmol/L 的NC 溶 液 处 理 细 胞,在5%CO2、37 ℃下于培养箱中预培养24 h 后,10 μl/孔加入CCK-8 试剂,继续培养1~4 h,培养过程中在一定时间于酶标仪上测定,达到最佳时间时即可终止培养,450 nm波长测定吸光值。
1.2.4 EdU 染色 各组细胞在24 孔培养箱中培养。EdU 掺入试验采用Cell LightTMEdU 成像检测试剂盒,按照制造商说明书操作。
1.2.5 Transwell 实验检测侵袭 Transwell 小室加入50 μl 基质胶并于37 ℃孵育3 h 凝固。将1.2.1分组及处理的细胞接种于Transwell 小室上室,其中上室为无血清培养基,下室为完全培养基,培养48 h后取出小室,擦除未过膜的细胞后多聚甲醛固定,1%结晶紫染色后拍照。每组取3个随机视野,计数视野中的染色细胞数目即为侵袭细胞数。
1.2.6 微管形成实验 A549 和NCI-H661 细胞用各浓度NC 处理48 h。 将基质胶与4 ℃预冷的无血清培养基以1∶1 比例混合。将混合物置于24 孔板底部,每孔300 μl,并在5%CO2和37 ℃的培养箱中固化30 min。在无血清RPMI1640 培养基中将浓度调整为1.2×105个/ml,将不同浓度NC 处理的A549和NCI-H661 细胞接种至上述24 孔板。每4 h 观察1 次微管结构。100 倍显微镜下随机取5 个视野,Microvision Saisam 软件分析图像,并计数每5 个视野的微管状结构。
1.2.7 RT-PCR 检测 用Trizol 提取各组细胞中RNA,并以逆转录法(RT法)先合成cDNA,然后进行PCR 扩增,循环条件95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,40 个循环。引物序列为iNOS F:5'-ACTTTCCAAGCACACTTCAC-3',R:5'-TTCGATAGCTTGAGGTAGAAGC-3';TNF-α F:5'-CAATGGCGTGGAGCTGAGAG-3',R:5'-TCTGGTAGGAGACGGCGATG-3';IL-4 F:5'-CACAACTGAGAAGGAAACCTTCTG-3',R:5'-CTCTCTCATGATCGTCTTTAGCCTTTC-3';IL-10 F:5'-TGTCATCGATTTCTTCCCTGT-3',R:5'-GGCTTTGTAGATGCCTTTCCTT-3';GAPDH F:5'-AATGGACAACTGGTCGTGGAC-3',R:5'-CCCTC⁃CAGGGGATCTGTTTG-3'。RT-PCR 产物经电泳后计算机图像分析仪扫描,凝胶图像分析系统对产物电泳条带进行灰度分析,测定iNOS、TNF-α、IL-4 和IL-10 mRNA表达。
1.2.8 ELISA 检测细胞和外周血中炎症因子水平 收集各处理组细胞和外周血,根据ELISA 试剂盒操作说明检测各组外周血中iNOS、TNF-α、IL-4和IL-10含量。
1.2.9 Western blot 从细胞和肿瘤组织匀浆中分别提取总蛋白(20 μg),并用BCA 试剂盒检测。根据目标蛋白分子量将每个样品中的总蛋白上样到6%~12%SDS-PAGE 凝胶电泳中,转移至PVDF 膜。5%脱脂乳封闭膜,并与一抗在4 ℃下孵育过夜。第2天取膜采用含Tween20(TBST)的Tris缓冲盐水洗涤3次,然后在室温下与山羊抗兔IgG辣根过氧化物酶(HRP)二抗共同孵育1 h,TBST洗涤3次,加入蛋白抗体:AKT(ab38449,1∶500)、p-AKT(ab8805,1∶500)、ERK1/2(ab17942,1∶1 000)、p-ERK1/2(ab214362,1∶1 000)、VEGF(ab32152,1∶250)、N-cadherin(ab76011,1∶5 000)、E-cadherin(ab76055,1∶1 000)、内参GAPDH(1∶1 000)。ECL 显色曝光,采用Image J分析内参GAPDH 和目标条带灰度值,目标条带蛋白水平=目标条带灰度值/GAPDH灰度值。
1.3 统计学分析 采用SPSS21.0 软件分析数据。计量数据表示为±s。采用LSD法成对比较。t检验比较两组符合正态分布的数据。P<0.05 为差异有统计学意义。
2 结果
2.1 NC对肺癌细胞生长的影响 采用CCK-8法检测不同浓度NC 对肺癌细胞A549 和NCI-H661 活力的影响。如图1B 所示,当NC 浓度>3 nmol/L 时,对A549细胞的活力具有抑制作用,当NC浓度>6 nmol/L时,对A549 和NCI-H661 细胞活力均有显著抑制作用。根据CCK-8 实验结果,选择0、3、6、12 nmol/L 4 个剂量进行后续实验。EdU 染色实验结果表明当NC浓度>6 nmol/L时,对A549和NCI-H661细胞增殖能力均有显著抑制作用(图1C)。流式检测结果表明NC 浓度>6 nmol/L 时,对A549 和NCI-H661 细胞凋亡均有显著促进作用(图1D)。以上结果表明NC可降低肺癌细胞活力和增殖能力,促进其凋亡。

图1 NC对肺癌细胞生长的影响Fig.1 Effects of NC on growth of lung cancer cells
2.2 NC 对肺癌细胞侵袭和微管形成能力的影响采用Transwell 检测细胞侵袭,微管形成实验检测血管新生,Western blot 检测运动和成管相关蛋白VEGF、E-cad和N-cad表达。如图2A、B所示,当NC>3 nmol/L 时,对A549 细胞侵袭数目和微管形成能力有抑制作用,当NC>6 nmol/L 时,对A549 和NCIH661 细胞侵袭数目和微管形成能力均有显著抑制作 用。当NC>3 nmol/L 时,A549 细 胞 中VEGF 和N-cad 表达水平显著降低,而E-cad 表达水平显著提升,当NC>6 nmol/L 时,A549 和NCI-H661 细 胞 中VEGF 和N-cad 表达显著降低,而E-cad 表达显著提高(图2C)。以上结果表明NC 对肺癌细胞运动和微管形成能力具有显著抑制作用。

图2 NC对肺癌细胞侵袭和微管形成能力的影响(×400)Fig.2 Effects of NC on lung cancer cell invasion and microtubule formation(×400)
2.3 NC对肺癌细胞抗炎能力的影响 采用RT-PCR和ELISA 检测NC 对肺癌细胞抗炎能力的影响。ELISA 检测结果如图3A 所示,当NC>3 nmol/L 时,可显著抑制A549 细胞中促炎因子iNOS 和TNF-α 表达,并提升抗炎因子IL-4 和IL-10 水平。如图3B 所示,当NC>6 nmol/L时,可显著抑制A549和NCI-H661细胞中促炎因子iNOS和TNF-α表达,并提升抗炎因子IL-4 和IL-10 水平。RT-PCR 检测结果如图3C、D所示,与ELISA检测结果一致。以上结果表明NC可提升肺癌细胞抗炎能力。

图3 NC对肺癌细胞抗炎能力的影响Fig.3 Effects of NC on anti-inflammatory ability of lung cancer cells
2.4 NC 通过抑制AKT/ERK1/2 通路磷酸化在体外发挥抗肺癌效果 为探究NC 发挥抗肺癌效果的机制,探究了NC 对AKT/ERK1/2 通路的影响。当NC>3 nmol/L 时,可显著抑制A549 细胞中AKT/ERK1/2通路磷酸化水平,当NC>6 nmol/L时,可显著抑制NCIH661细胞AKT/ERK1/2通路磷酸化水平(图4A)。为进一步证实NC 通过AKT/ERK1/2 通路发挥抗肺癌效果,加入AKT 激活剂SC79。与对照组比较,SC79显著促进A549细胞p-AKT/AKT和p-ERK1/2/ERK1/2水平,而NC 的添加显著削弱了SC79 的作用(P<0.05)。与Western blot 实验结果一致,SC79 显著抑制A549 细胞凋亡,增加侵袭细胞数,提高促炎因子iNOS 水平并降低抗炎因子IL-4 水平,而NC 的添加显著削弱了SC79 的作用(P<0.05,图4D~F)。由此推测NC 通过抑制AKT/ERK1/2通路磷酸化发挥抗肺癌效果。

图4 NC体外抑制AKT/ERK1/2通路磷酸化Fig.4 NC inhibits phosphorylation of AKT/ERK1/2 path⁃way in vitro
2.5 NC 通过抑制AKT/ERK1/2 通路磷酸化在体内发挥抗肺癌效果 为探究NC 在肺癌大鼠体内的抗癌效果,选择BALB/c 小鼠为研究对象,通过皮下注射A549 建立体内肿瘤模型,研究NC 在肺癌小鼠体内的抗癌效果。如图5A所示,与对照组比较,NC处理可显著抑制小鼠体内肿瘤形成(P<0.05)。与对照组比较,NC 显著抑制了肿瘤体积和重量(P<0.05,图5B、C)。免疫组化结果显示,与对照组相比,NC可显著提升caspase-3 水平并降低VEGF 水平(P<0.05,图5D)。与对照组相比,NC 可显著降低iNOS水平并提升IL-4水平(P<0.05,图5E)。Western blot结果表明NC 可显著抑制p-AKT/AKT 和p-ERK1/2/ERK1/2 水平,与体外实验结果一致。因此推测NC在体内通过抑制AKT/ERK1/2 通路磷酸化发挥抗肺癌效果。
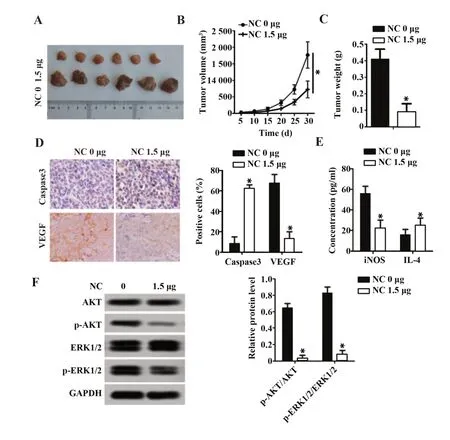
图5 NC体内抑制AKT/ERK1/2通路磷酸化Fig.5 NC inhibits phosphorylation of AKT/ERK1/2 path⁃way in vivo
3 讨论
肺癌的进展迅速,并且多个转移发生在晚期。肿瘤转移需要多种触发癌细胞的分子机制,包括血管生成、血管重塑和免疫逃逸[10]。生物疗法已广泛应用于肺癌治疗,但由于其靶点确定困难,经济负担高等原因而没有被广泛接受。本次研究中NC 可显著降低细胞活力、降低细胞EdU 阳性细胞数量、促进凋亡,抑制细胞侵袭,降低微管形成能力并提高细胞抗炎能力。与模型组相比,NC可抑制肿瘤生长。课题组还发现NC 对肺癌的抑制作用可能与其对AKT/ERK1/2 通路磷酸化的抑制有关。以上结果表明NC可能是一种潜在的肺癌治疗剂。
众所周知,一些中草药成分对细胞有毒作用。为测试NC 对肺癌细胞系是否具有毒性作用,检测了不同浓度NC 对A549 和NCI-H661 细胞活力的影响。数据表明,NC>6 nmol/L 时可显著降低细胞活力。异常增殖是肿瘤细胞的典型特征,因此,抑制增殖成为肿瘤治疗的有效方法之一。研究发现NC对恶性肿瘤细胞增殖具有明显抑制作用[4]。一致地,本研究中EdU 染色结果显示NC 可显著降低肺癌细胞A549和NCI-H661中EdU阳性细胞数量。生物体内各种类型组织细胞通过增殖和凋亡协调发展维持细胞数目平衡,但癌症细胞存在明显增殖和凋亡失调-过度增殖和细胞凋亡抑制现象[11]。肿瘤细胞的增殖情况和凋亡情况对癌症治疗至关重要。本研究中流式结果显示,NC 可显著提升A549 和NCI-H661细胞凋亡率,与EdU 染色测定的增殖结果一致。
微管结构的发达与否对肿瘤生长具有至关重要的影响。VEGF 是高度特异性的促血管内皮生长因子,可促进增加的血管通透性,细胞外基质变性,血管内皮细胞迁移,增殖和血管生成。调节VEGF抑制血管生成并进一步阻断癌症的发展已成为一种新趋势[12]。本研究中NC 可显著抑制A549 和NCI-H661 细胞微管形成,一致地,Western blot 实验结果显示NC 可显著抑制肺癌细胞中VEGF 表达。研究表明NC 对人鼻咽癌细胞生长和转移具有明显抑制作用[13]。本研究中Transwell 实验结果显示NC可显著减少侵袭细胞数量,且Western blot实验结果显示NC 可提升E-cad 蛋白水平并降低N-cad 蛋白水平。可见NC对肺癌细胞迁移具有较好抑制作用。
iNOS 是诱导型一氧化氮合酶,已有证据表明iNOS 在病理生理炎症、感染、肿瘤等疾病中起关键作用[14]。IL-10 和IL-4 是在炎症发生和发展中起重要作用的抗炎递质。炎症递质在各种细胞、组织和器官中起关键作用[15]。本研究中NC 治疗显著降低了大鼠外周血中iNOS 和TNF-α 水平并提升了IL-4和IL-10 水平。可见NC 处理可缓解肺癌细胞中的炎症反应。
有学者发现NC 通过AKT/GSK-3β/Snail 信号通路抑制骨肉瘤细胞上皮向间充质细胞迁移和侵袭[16]。ZHAI 等[17]研究发现NC 通过抑制ERK 信号通路抑制大肠癌细胞的增殖并诱导其凋亡。因此,预测NC 对肺癌体外和体内的抑制作用是通过抑制AKT/ERK1/2 通路磷酸化实现的。本研究结果与预测一致,发现NC可显著抑制p-AKT/AKT和p-ERK1/2/ERK1/2 磷酸化水平。通过添加AKT 激活剂(SC79)进行验证实验,与对照组相比,SC79 添加显著提高了p-AKT/AKT 和p-ERK1/2/ERK1/2 表达水平,抑制了细胞凋亡,增加了侵袭细胞数目,提升了iNOS 水平并降低了IL-4 水平。而NC 的添加显著削弱了SC79 的作用,并抑制了上述现象。可见NC 对肺癌的治疗作用可能是通过其对AKT/ERK1/2 通路磷酸化的抑制作用实现的。
综上所述,在体外NC 可抑制肺癌细胞生长、运动并提高其抗炎能力,在体内NC 可抑制肿瘤形成,其潜在机制可能与NC 对AKT/ERK1/2 通路磷酸化的抑制有关。以上研究结果可为肺癌治疗提供思路和依据。