马钱苷联合miR-3619-5p靶向迁移侵袭增强因子1对宫颈癌SiHa细胞迁移和凋亡的影响
2022-07-21冯双苗张化莲袁有华
冯双苗,张化莲,袁有华
马钱苷联合靶向迁移侵袭增强因子1对宫颈癌SiHa细胞迁移和凋亡的影响
冯双苗1,张化莲1,袁有华2*
1. 驻马店市中心医院 产科,河南 驻马店 463000 2. 河南省人民医院 检验科,河南 郑州 450000
研究马钱苷联合靶向迁移侵袭增强因子1(migration and invasion enhancer 1,MIEN1)对宫颈癌SiHa细胞迁移和凋亡的影响。采用qRT-PCR法检测宫颈癌SiHa、Hela、CasKi细胞和正常宫颈上皮Ect1/E6E7细胞中mRNA表达。在宫颈癌SiHa细胞中转染mimics上调的表达,给予马钱苷处理,采用CCK-8法分析细胞增殖;流式细胞术分析细胞凋亡;Transwell小室分析细胞迁移和侵袭能力的变化;Western blotting法分析剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cystein-asparate protease-3,cleaved Caspase-3)和基质金属蛋白酶-2(matrix metalloprotease-2,MMP-2)蛋白表达。生物信息学软件预测的靶基因,利用荧光素酶报告系统鉴定二者的靶向关系。在宫颈癌SiHa细胞中共转染mimics和MIEN1过表达载体,考察细胞增殖、凋亡、迁移和侵袭能力的变化。宫颈癌SiHa、Hela、CasKi细胞中mRNA表达水平低于正常宫颈上皮Ect1/E6E7细胞(<0.05),并且宫颈癌SiHa细胞中表达水平最低。上调、马钱苷处理或二者联合处理后的宫颈癌SiHa细胞增殖、迁移和侵袭能力均下降(<0.05),细胞凋亡升高(<0.05),细胞cleaved Caspase-3蛋白表达水平升高(<0.05),MMP-2蛋白表达水平降低(<0.05),并且二者联合处理后对细胞增殖、凋亡、侵袭和迁移的作用更强。靶向促进MIEN1表达。MIEN1过表达载体逆转马钱苷联合对宫颈癌SiHa细胞增殖、凋亡、迁移和侵袭的作用(<0.05)。马钱苷联合靶向MIEN1能够抑制宫颈癌SiHa细胞增殖、迁移、侵袭能力,并促进细胞凋亡。
马钱苷;宫颈癌;miR-3619-5p;迁移侵袭增强因子1;凋亡;侵袭
宫颈癌是引起女性死亡的主要恶性肿瘤之一,是目前世界范围内的第4大癌症,严重威胁着广大女性的生命健康[1-2]。中药以及靶向基因治疗在肿瘤中的研究最为广泛,二者有不良反应小、安全性高等特点,可能是未来肿瘤治疗的重要途径。
马钱苷是从山茱萸Sieb. et Zucc.中提取出的一种环烯醚萜类化合物,具有营养神经、免疫调节、改善氧化应激等作用[3]。研究发现,马钱苷能够诱导肿瘤细胞凋亡并抑制其转移,马钱苷处理后的肝癌细胞凋亡水平增加,胃癌细胞转移能力降低[4-5]。
miRNA是非编码RNA,在很多生理以及病理过程中均有调节作用,与胚胎发育、细胞生长、细胞运动等有关[6]。研究显示,miRNA和肿瘤的关系十分密切,miRNA是未来肿瘤治疗的分子靶点[7]。是一个在前列腺癌、甲状腺癌等肿瘤中表达下调的调控因子,在肿瘤进展中发挥抑制作用[8-9]。目前马钱苷联合对宫颈癌细胞生物学行为的影响尚不清楚。本研究以宫颈癌SiHa细胞为研究对象,探讨马钱苷联合在体外宫颈癌细胞恶性表型中的功能,为马钱苷联合治疗宫颈癌提供理论基础。
1 材料
1.1 细胞
正常宫颈上皮Ect1/E6E7细胞(批号QCB1077)购自上海钦诚生物科技有限公司;宫颈癌SiHa(批号CL-0210)、HeLa(批号CL-0101)、CasKi(批号CL-0048)细胞购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂
mirVanan miRNA试剂盒(批号638369)、mir-X miRNA qRT-PCR SYBR试剂盒(批号638314)购自美国Clontech公司;剪切型半胱氨酸天冬氨酸蛋白酶-3(cleaved cystein-asparate protease-3,cleaved Caspase-3)抗体(批号ab179517)购自美国Abcam公司;mimics、mimics control、迁移侵袭增强因子1(migration and invasion enhancer 1,MIEN1)过表达载体(pcDNA3.1-MIEN1)、阴性对照载体(pcDNA3.1)均由北京安必奇生物科技有限公司构建合成;基质金属蛋白酶-2(matrix metalloprotease-2,MMP-2)抗体(批号ml085664)、MIEN1抗体(批号ml091507)购自上海酶联生物科技有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、羊抗兔二抗购自北京中杉金桥公司;马钱苷(批号BP0884,质量分数>98%)购自成都普瑞法科技开发有限公司。
1.3 仪器
荧光定量PCR仪(美国ABI公司);Varioskan LUX酶标仪(美国Thermo Fisher Scientific公司);C6型流式细胞仪(美国BD公司);微管离心机(美国Axygen公司);1-14K型低温离心机(美国Sigma公司);垂直电泳槽、电泳仪(北京六一生物科技有限公司);显微镜(日本Olympus公司)。
2 方法
2.1 qRT-PCR分析宫颈癌细胞miR-3619-5p表达
分别收集处于对数生长期的宫颈癌SiHa、HeLa、CasKi细胞和正常宫颈上皮Ect1/E6E7细胞,按照试剂盒说明书提取细胞中总RNA并合成cDNA,进行qRT-PCR分析。将作为的内参。引物序列:上游引物5’-ACAACTTTGGTATCGTGGAAGG-3’,下游引物5’-GCCATCACGCCACAGTTTC-3’;上游引物5’-TTGAGGCTCTGCAGCTTAG-3’,下游引物5’-CTGTGGTGGTTTACAAAGTAATT-3’。
2.2 CCK-8检测马钱苷对宫颈癌细胞增殖的影响
将宫颈癌SiHa细胞以3000个/孔接种到96孔板内,于37 ℃、5% CO2培养箱内培养过夜,吸去培养基,分别加入含有马钱苷最终质量浓度为10、25、50、100、200 μg/mL的培养基,对照组加入不含药物的培养基,培养24 h后,每孔加入10 μL的CCK-8溶液,于振荡仪充分混合1 min,37 ℃继续孵育3 h。采用酶标仪测定每孔在490 nm处的吸光度()值,计算细胞存活率。
细胞存活率=实验/对照
2.3 实验分组
宫颈癌SiHa细胞分成对照组、马钱苷+miR-NC组、miR-NC组、组和马钱苷+组,马钱苷+miR-NC组和miR-NC组均为转染mimics control后的细胞,组和马钱苷+组均为转染mimics后的细胞,马钱苷+miR-NC组和马钱苷+组细胞在实验开始时加入最终质量浓度为100 μg/mL的马钱苷处理,对照组细胞不进行处理。
按“2.1”项下方法检测对照组、miR-NC组和组细胞mRNA表达。
2.4 CCK-8检测马钱苷联合miR-3619-5p对宫颈癌细胞增殖的影响
对照组、马钱苷+miR-NC组、miR-NC组、组和马钱苷+miR-3619-5p组细胞培养24 h后,按照“2.2”项下方法检测细胞存活率。
2.5 流式细胞术分析马钱苷联合miR-3619-5p对宫颈癌细胞凋亡的影响
对照组、马钱苷+miR-NC组、miR-NC组、组和马钱苷+miR-3619-5p组细胞培养24 h后,弃去上清液,以PBS溶液洗涤,加入0.25%胰蛋白酶消化后,离心,收集细胞沉淀。以PBS溶液将细胞润洗3次,加入500 μL的Binding Buffer溶液(细胞密度为1×106个/mL),加入5 μL Annexin V-FITC,室温避光孵育10 min;加入5 μL碘化丙啶(PI),室温避光孵育10 min,立即采用流式细胞仪检测各组细胞的凋亡情况。
2.6 Transwell小室分析马钱苷联合miR-3619-5p对宫颈癌细胞迁移和侵袭的影响
2.6.1 迁移实验 对照组、马钱苷+miR-NC组、miR-NC组、组和马钱苷+组细胞分别用无血清的细胞培养基悬浮(细胞密度为1×106个/mL),吸取200 μL各组细胞加入到Transwell小室的上室中,同时吸取500 μL含血清的细胞培养基加入到小室的下室内,于37 ℃的CO2培养箱中培养24 h。取出小室,用棉签小心地把上室底膜中的细胞擦除,以4%多聚甲醛固定上室底膜内的细胞,用0.1%结晶紫染色,加入PBS溶液洗涤2次。将小室放在显微镜下并随机选择5个视野,分别计数穿膜的细胞数量,计算平均值,为细胞迁移数目。
2.6.2 侵袭实验 按1∶9比例将基质胶和D-hanks液混合,吸取20 μL上述溶液加入到Transwell小室的上室内,于37 ℃培养箱中孵育4 h,待基质胶凝固后,吸除残留的液体。按“2.6.1”项下方法处理并计算细胞侵袭数目。
2.7 Western blotting检测马钱苷联合miR-3619-5p对宫颈癌细胞cleaved Caspase-3和MMP-2蛋白表达的影响
对照组、马钱苷+miR-NC组、miR-NC组、组和马钱苷+组细胞培养24 h后,弃去上清液,加入RIPA裂解液,于冰上裂解20 min,4 ℃、12 000×离心10 min,吸取上清液,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%牛血清白蛋白溶液,室温封闭2 h。分别加入相应抗体,4 ℃孵育过夜;加入二抗,室温孵育2 h。加入ECL发光液显影,采用Image J软件分析条带灰度值。
2.8 miR-3619-5p与MIEN1靶向关系预测和鉴定
利用生物信息学软件Targetscan分析可能的靶基因,根据荧光素酶报告系统对靶向关系进行鉴定。将含有MIEN1的3’-UTR端结合位点的WT荧光素酶报告载体和含有突变后的MIEN1的3’-UTR端结合位点的MUT荧光素酶报告载体分别和mimics、mimics control共转染到宫颈癌SiHa细胞中,培养24 h后,利用荧光素酶活性测定试剂盒对细胞荧光素酶活性进行检测分析。WT和MUT均由武汉巴菲尔生物技术服务有限公司构建。收集对照组、miR-NC组、miR-3619-5p组细胞,利用Western blotting法检测细胞MIEN1蛋白表达。
2.9 MIEN1过表达载体的逆转作用检测
宫颈癌SiHa细胞分别共转染mimics与阴性对照载体、mimics与MIEN1过表达载体,然后用含有100 μg/mL的马钱苷处理24 h,记为马钱苷++Vector组和马钱苷++MIEN1组。按“2.4”项下方法检测细胞存活率,按“2.5”项下方法检测细胞凋亡枪口,按“2.6”项下方法检测细胞的迁移和侵袭能力,按“2.7”项下方法检测细胞cleaved Caspase-3、MMP-2和MIEN1蛋白表达情况。
2.10 统计学分析
3 结果
3.1 miR-3619-5p在宫颈癌细胞中相对低表达
如表1所示,宫颈癌SiHa、Hela、CasKi细胞mRNA表达水平明显低于正常宫颈上皮Ect1/E6E7细胞(<0.05),并且宫颈癌SiHa细胞中表达水平最低。
3.2 马钱苷抑制宫颈癌SiHa细胞增殖
如表2所示,与对照组比较,马钱苷(25、50、100、200 μg/mL)组SiHa细胞存活率显著降低(<0.05),100 μg/mL的马钱苷处理后的细胞存活率接近50%,因此选择100 μg/mL马钱苷进行后续实验。
3.3 miR-3619-5p mimics上调宫颈癌SiHa细胞中miR-3619-5p mRNA表达
如表3所示,组SiHa细胞mRNA表达水平显著高于miR-NC组(<0.05)。表明mimics上调宫颈癌SiHa细胞中mRNA表达水平。
表1 宫颈癌SiHa、Hela、CasKi细胞和正常宫颈上皮Ect1/E6E7细胞中miR-3619-5pmRNA表达(, n = 9)
Table 1 miR-3619-5p mRNA expression in cervical cancer SiHa, Hela, CasKi cells and normal cervical epithelial Ect1/E6E7 cells(, n = 9)
细胞miR-3619-5p mRNA相对表达量 Ect1/E6E71.00±0.11 SiHa0.35±0.04* Hela0.46±0.05* CasKi0.68±0.07*
与Ect1/E6E7组比较:*<0.05
*< 0.05Ect1/E6E7 group
表2 马钱苷对宫颈癌SiHa细胞增殖的影响(, n = 9)
Table 2 Effect of loganin on proliferation of cervical cancer SiHa cells(, n = 9)
组别质量浓度/(μg·mL−1)存活率/% 对照—100.00±12.02 马钱苷1093.25±8.15 2586.32±5.16* 5075.49±6.33* 10052.01±6.14* 20040.21±4.78*
与对照组比较:*<0.05
*< 0.05control group
表3 miR-3619-5p mimics转染后的宫颈癌SiHa细胞中miR-3619-5pmRNA表达(, n = 9)
Table 3 miR-3619-5p mRNA expression in cervical cancer SiHa cells transfected with miR-3619-5p mimics(, n = 9)
组别miR-3619-5p mRNA相对表达量 对照1.00±0.11 miR-NC0.98±0.09 miR-3619-5p2.65±0.23*
与miR-NC组比较:*<0.05
*< 0.05miR-NC group
3.4 马钱苷联合miR-3619-5p对宫颈癌SiHa细胞增殖、凋亡、迁移、侵袭和cleaved Caspase-3和MMP-2蛋白表达的影响
如图1、2和表4所示,与miR-NC组比较,组、马钱苷+miR-NC组和马钱苷+组宫颈癌SiHa细胞存活率显著降低(<0.05),细胞凋亡率升高(<0.05),细胞迁移和侵袭数目增多(<0.05),cleaved Caspase-3蛋白表达水平升高(<0.05),MMP-2蛋白表达水平下降(<0.05);与组和马钱苷+miR-NC组比较,马钱苷+组宫颈癌SiHa细胞存活率降低(<0.05),细胞凋亡率升高(<0.05),细胞迁移和侵袭数目增多(<0.05),cleaved Caspase-3蛋白表达水平升高(<0.05),MMP-2蛋白表达水平下降(<0.05)。
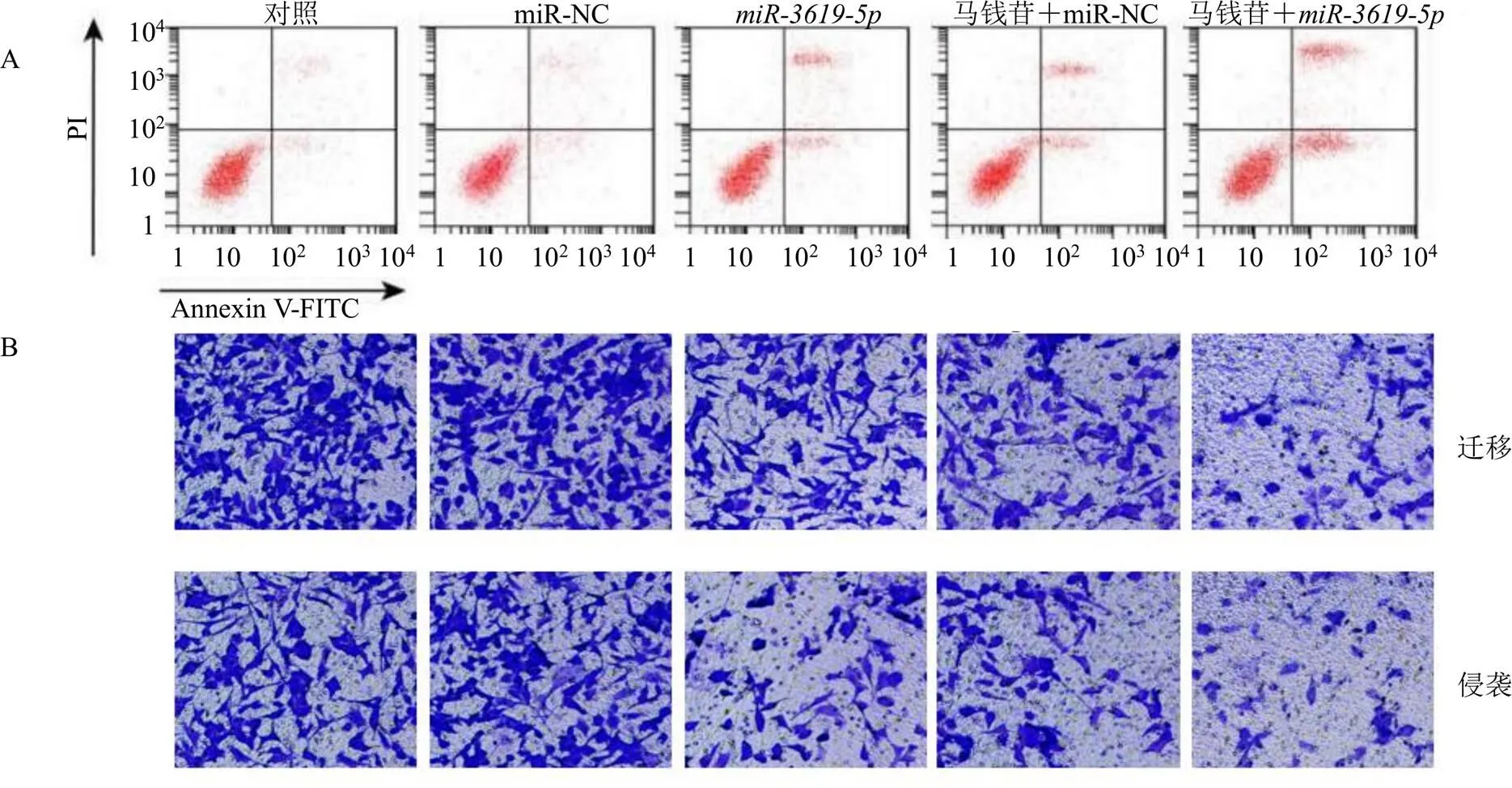
图1 马钱苷联合miR-3619-5p对宫颈癌SiHa细胞凋亡 (A)、迁移及侵袭 (B) 的影响
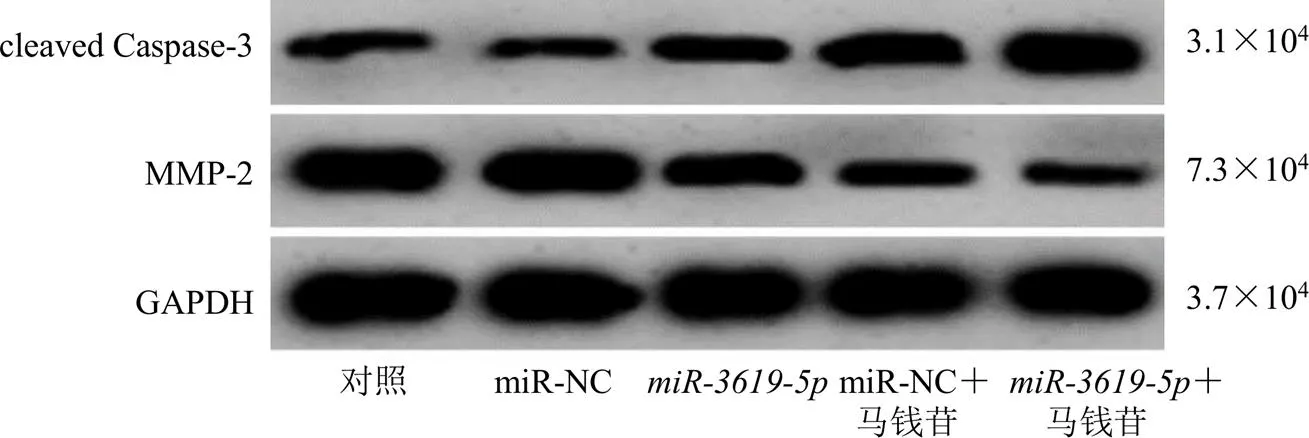
图2 马钱苷联合miR-3619-5p对宫颈癌SiHa细胞cleaved Caspase-3和MMP-2蛋白表达的影响
表4 马钱苷联合miR-3619-5p对宫颈癌SiHa细胞存活率、凋亡率、侵袭数目、迁移数目及cleaved Caspase-3和MMP-2蛋白表达的影响(, n = 9)
Table 4 Effect of loganin combined with miR-3619-5p on survival rate, apoptosis rate, invasion number, migration number and cleaved Caspase-3 and MMP-2 protein expressions in cervical cancer SiHa cells(, n = 9)
组别剂量/(μg·mL−1)存活率/%凋亡率/%侵袭数目迁移数目cleaved Caspase-3蛋白表达量MMP-2蛋白表达量 对照—100.00±9.964.11±0.3093.96±9.94136.84±12.450.32±0.030.90±0.10 miR-NC—99.51±9.784.26±0.4396.23±8.76134.36±12.080.31±0.040.89±0.07 miR-3619-5p—63.23±5.58*19.68±1.74*69.20±5.14*100.16±10.53*0.45±0.05*0.65±0.06* 马钱苷+miR-NC10053.41±5.26*21.56±2.50*60.42±4.36*90.32±8.77*0.63±0.07*0.47±0.04* 马钱苷+miR-3619-5p10032.05±2.95*#&29.36±2.75*#&42.74±4.45*#&63.23±5.70*#&0.88±0.08*#&0.38±0.03*#&
与miR-NC组比较:*<0.05;与组比较:#<0.05;与马钱苷+miR-NC组比较:&<0.05
*< 0.05miR-NC group;#< 0.05group;&< 0.05loganin + miR-NC group
3.5 miR-3619-5p靶向促进MIEN1表达
生物信息学软件分析和MIEN1的3’-UTR端结合位点见图3;WT和mimics共转染后的细胞荧光素酶活性降低(表5)。如图4和表6所示,组SiHa细胞MIEN1蛋白表达水平显著低于miR-NC组(<0.05)。
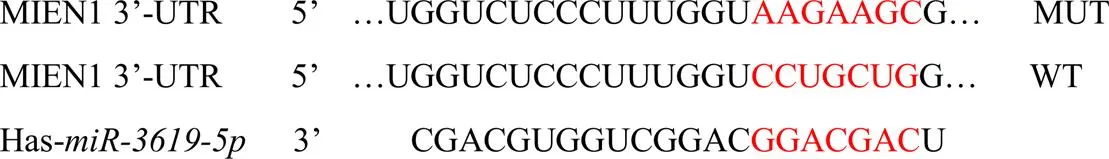
图3 miR-3619-5p靶向调控MIEN1
表5 各组荧光素酶活性(, n = 9)
Table 5 Luciferase activity in each group (, n = 9)
组别WTMUT miR-NC1.00±0.081.00±0.09 miR-3619-5p0.43±0.05*0.98±0.13
与miR-NC组比较:*<0.05
*< 0.05miR-NC group

图4 Western blotting检测MIEN1蛋白表达
表6 miR-3619-5p mimcis转染后的宫颈癌SiHa细胞中MIEN1蛋白表达水平(, n = 9)
Table 6 MIEN1 protein expression level in cervical cancer SiHa cells transfected with miR-3619-5p mimcis (, n = 9)
组别MIEN1蛋白相对表达量 对照0.96±0.10 miR-NC0.95±0.11 miR-3619-5p0.53±0.04*
与miR-NC组比较:*<0.05
*< 0.05miR-NC group
3.6 上调MIEN1对马钱苷联合miR-3619-5p调控宫颈癌SiHa细胞细胞增殖、凋亡、迁移、侵袭和cleaved Caspase-3、MMP-2和MIEN1蛋白表达的影响
如图5和表7所示,与马钱苷++Vector组比较,马钱苷++MIEN1组SiHa细胞存活率明显升高(<0.05),细胞凋亡率降低(<0.05),细胞侵袭和迁移数目增加(<0.05),细胞MMP-2、MIEN1蛋白表达水平升高(<0.05),cleaved Caspase-3蛋白表达水平降低(<0.05)。
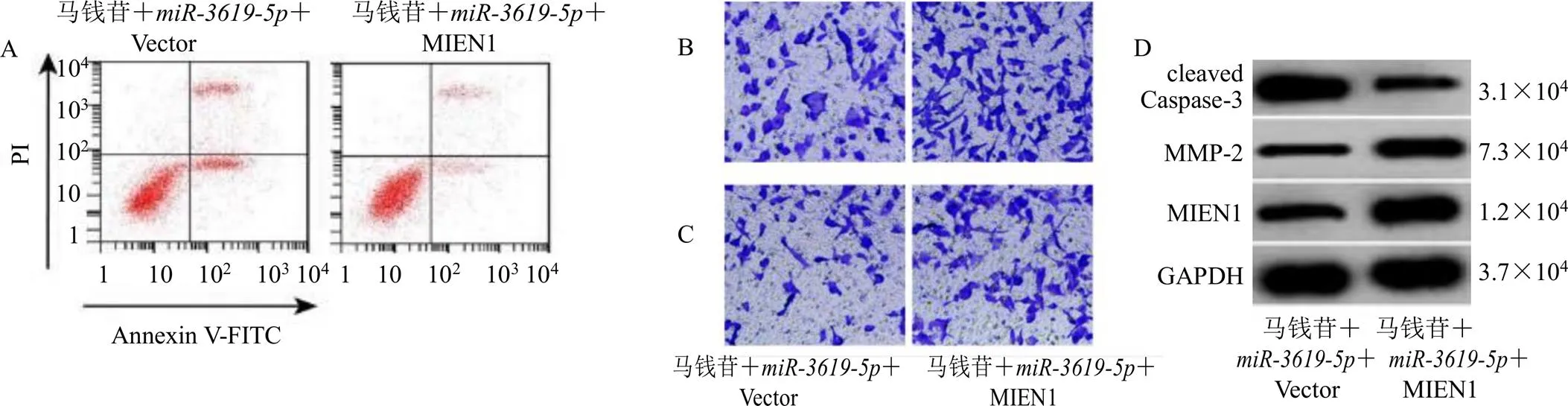
图5 MIEN1对马钱苷联合miR-3619-5p影响宫颈癌SiHa细胞凋亡 (A)、迁移 (B)、侵袭 (C) 及cleaved Caspase-3、MMP-2和MIEN1蛋白表达 (D) 的作用
表7 MIEN1过表达载体、mimics转染后经马钱苷处理的宫颈癌SiHa细胞存活率、凋亡率、侵袭数目、迁移数目及cleaved Caspase-3、MMP-2和MIEN1蛋白表达水平(,= 9)
Table 7 Survival rate, apoptosis rate, invasion number, migration number and cleaved Caspase-3, MMP-2 and MIEN1 protein expression levels in cervical cancer SiHa cells transfected with MIEN1 overexpression vector andmimics and treated with loganin(,= 9)
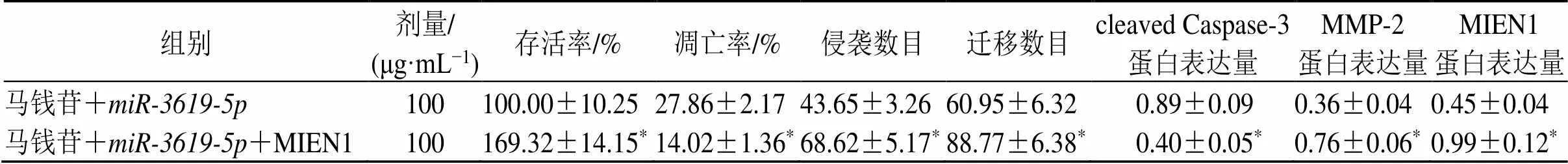
组别剂量/(μg·mL−1)存活率/%凋亡率/%侵袭数目迁移数目cleaved Caspase-3蛋白表达量MMP-2蛋白表达量MIEN1蛋白表达量 马钱苷+miR-3619-5p100100.00±10.2527.86±2.1743.65±3.2660.95±6.320.89±0.090.36±0.040.45±0.04 马钱苷+miR-3619-5p+MIEN1100169.32±14.15*14.02±1.36*68.62±5.17*88.77±6.38*0.40±0.05*0.76±0.06*0.99±0.12*
与马钱苷+组比较:*<0.05
*< 0.05loganin +group
4 讨论
研究发现,马钱苷对糖尿病、帕金森病等多种疾病均有改善作用[10-11];马钱苷能够激活肝癌细胞中的凋亡通路[4];马钱苷抑制胃癌细胞转移能力[5];马钱苷可以降低结肠癌细胞的增殖能力[12]。本研究结果显示,马钱苷能够抑制宫颈癌细胞增殖、侵袭和迁移,促进细胞凋亡,提示马钱苷具有抑制宫颈癌的作用。
细胞的迁移、侵袭以及凋亡发生是一个多基因、多步骤的复杂调控过程。肿瘤细胞迁移和侵袭过程中,需要先将细胞外基质降解[13]。MMPs是存在于人体组织中的基质降解酶,包含多个成员,能够将细胞外基质中的不同组分降解[14]。MMP-2是MMPs成员之一,其表达改变和肿瘤的转移能力有关,MMP-2表达水平越高,细胞转移能力越强[15]。Caspase是细胞凋亡进展中的凋亡相关蛋白家族,其蛋白成员只有被剪切后形成活化的Caspase才能激活细胞凋亡[16]。Caspase-3是位于Caspase凋亡反应中的下游因子,在细胞凋亡中有执行作用,Caspase-3活化形成cleaved Caspase-3,从而不可逆地激活细胞凋亡[17]。结果显示,马钱苷上调cleaved Caspase-3蛋白表达,下调MMP-2蛋白表达,提示马钱苷促进细胞凋亡,并抑制细胞侵袭、迁移,这与细胞凋亡、侵袭和迁移检测结果一致。
宫颈癌的发生和其他肿瘤一样,均受到基因的调节作用,这些基因通过复杂的网络最终影响了肿瘤进程[18]。研究显示,miRNA作为一种没有开放阅读框的小分子RNA,具有十分广泛的作用,在细胞生长、衰老、代谢等生理进展中发挥功能[19]。miRNA在肿瘤中的作用引起人们的广泛关注,肿瘤组织有着与正常组织不同的miRNA表达谱,差异表达的miRNA可能是肿瘤治疗的靶点[20]。研究发现,在肺癌、膀胱癌、前列腺癌等多种肿瘤中发挥抑制作用,其在肿瘤组织中表达下调,可能是一个肿瘤抑制因子[8,21-22]。结果显示,在宫颈癌细胞中低表达,并且上调可以降低宫颈癌细胞增殖、迁移和侵袭能力,激活细胞凋亡途径,提示在宫颈癌进展中可能发挥抑癌基因的作用。此外,本研究发现,和马钱苷联合处理后的宫颈癌细胞增殖、迁移和侵袭能力进一步被抑制,细胞凋亡水平更高,提示和马钱苷联合可能是未来宫颈癌治疗的潜在途径。
miRNA发挥作用和调控下游靶基因的表达有关,其能够和靶mRNA的3’-UTR端互补结合,降低下游靶蛋白的表达[23]。miRNA能够和多个靶基因作用,一个靶基因可以同时受到很多miRNA的靶向调节作用,因此,miRNA通过这个复杂的网络影响生理和病理进程[24]。研究显示,靶向促进宫颈癌细胞中MIEN1的表达。MIEN1是和肿瘤转移有关的调节因子,已知MIEN1在宫颈癌中高表达,并且下调MIEN1抑制宫颈癌细胞恶性生物学行为[25]。本研究发现,上调MIEN1能够逆转马钱苷联合对宫颈癌细胞增殖、侵袭、迁移和凋亡的作用,提示马钱苷联合靶向MIEN1影响宫颈癌生物学行为。
综上,马钱苷联合具有抑制宫颈癌进展的作用,其可以在体外抑制宫颈癌细胞的侵袭、增殖、迁移,激活细胞凋亡途径,作用机制与靶向调控MIEN1有关。
利益冲突 所有作者均声明不存在利益冲突
[1] Saei Ghare Naz M, Kariman N, Ebadi A,. Educational interventions for cervical cancer screening behavior of women: A systematic review [J]., 2018, 19(4): 875-884.
[2] Kovachev S M. Cervical cancer and vaginal microbiota changes [J]., 2020, 202(2): 323-327.
[3] 甘啸阳, 王威, 吕杨, 等. 马钱苷对AGEs致巨噬细胞极化的影响 [J]. 南京中医药大学学报, 2020, 36(1): 46-50.
[4] 张聪, 胡娜, 李珊, 等. 马钱苷对肝癌细胞HepG2增殖与凋亡的影响及机制研究 [J]. 中国药房, 2020, 31(7): 782-788.
[5] 张艺, 张卓奇, 程华, 等. 马钱苷对胃癌细胞上皮-间充质转化的影响及其机制 [J]. 中华实验外科杂志, 2019, 36(11): 2004-2007.
[6] Chen L, Heikkinen L, Wang C L,. Trends in the development of miRNA bioinformatics tools [J]., 2019, 20(5): 1836-1852.
[7] Shao T T, Wang G J, Chen H,. Survey of miRNA-miRNA cooperative regulation principles across cancer types [J]., 2019, 20(5): 1621-1638.
[8] Li S M, Wang C H, Yu X,. miR-3619-5p inhibits prostate cancer cell growth by activating CDKN1A expression [J]., 2017, 37(1): 241-248.
[9] Wang G, Wang X, Jin Y.//feedback loop regulates papillary thyroid carcinoma cell proliferation and apoptosis [J]., 2019, 34(9): 572-580.
[10] 赵文望, 皮文霞, 蔡宝昌, 等. 马钱苷、莫诺苷对高糖致心肌细胞损伤的保护机制研究 [J]. 中成药, 2016, 38(1): 160-163.
[11] 汪林芳, 黄术兵, 徐一达, 等. 马钱苷对MPTP诱导的PC12细胞自噬的作用研究 [J]. 神经药理学报, 2016, 6(5): 14-21.
[12] 胡小红, 王美玲, 谌江城, 等. 马钱苷对结肠癌SW480细胞增殖的影响及机制初探 [J]. 广东药学院学报, 2015, 31(1): 80-83.
[13] Ganguly S S, Hostetter G, Tang L,. Notch3 promotes prostate cancer-induced bone lesion development via MMP-3 [J]., 2020, 39(1): 204-218.
[14] Zhang S, Yang Y, Huang S,. SIRT1 inhibits gastric cancer proliferation and metastasis via STAT3/MMP-13 signaling [J]., 2019, 234(9): 15395-15406.
[15] Cowell S, Carroll L, Lavdas I,. Towards an MMP-2-activated molecular agent for cancer imaging [J]., 2018, 47(5): 1530-1534.
[16] Zhou M, Liu X, Li Z,. Caspase-3 regulates the migration, invasion and metastasis of colon cancer cells [J]., 2018, 143(4): 921-930.
[17] Bernard A, Chevrier S, Beltjens F,. Cleaved caspase-3 transcriptionally regulates angiogenesis-promoting chemotherapy resistance [J]., 2019, 79(23): 5958-5970.
[18] Laengsri V, Kerdpin U, Plabplueng C,. Cervical cancer markers: Epigenetics and microRNAs [J]., 2018, 49(2): 97-111.
[19] Tiwari A, Mukherjee B, Dixit M. MicroRNA key to angiogenesis regulation: MiRNA biology and therapy [J]., 2018, 18(3): 266-277.
[20] 蒋雪梅, 权毅. 上调miRNA-27a-3p对乳腺癌MCF-7细胞增殖、侵袭和迁移能力的影响 [J]. 郑州大学学报: 医学版, 2019, 54(2): 279-283.
[21] Niu X C, Liu S, Jia L,. Role of MiR-3619-5p in β-catenin-mediated non-small cell lung cancer growth and invasion [J]., 2015, 37(4): 1527-1536.
[22] Zhang Q, Miao S, Han X,. MicroRNA-3619-5p suppresses bladder carcinoma progression by directly targeting β-catenin and CDK2 and activating p21 [J]., 2018, 9(10): 960.
[23] Lu T X, Rothenberg M E. MicroRNA [J]., 2018, 141(4): 1202-1207.
[24] Kappel A, Keller A. miRNA assays in the clinical laboratory: Workflow, detection technologies and automation aspects [J]., 2017, 55(5): 636-647.
[25] 姚慧欣, 王钧峰, 吴金涛, 等. miR-136-5p靶向MIEN1对宫颈癌细胞侵袭和迁移的调节及机制研究 [J]. 西安交通大学学报: 医学版, 2020, 41(3): 362-368.
Effect of loganin combined withtargeting MIEN1 on migration and apoptosis of cervical cancer SiHa cells
FENG Shuang-miao1, ZHANG Hua-lian1, YUAN You-hua2
1. Department of Production, Zhumadian Central Hospital, Zhumadian 463000, China 2. Department of Laboratory Medicine, Henan Provincial People’s Hospital, Zhengzhou 450000, China
To investigate the effect of loganin combined withtargeting migration and invasion enhancer 1 (MIEN1) on migration and apoptosis of cervical cancer SiHa cells.mRNA expression in cervical cancer SiHa, Hela, CasKi cells and normal cervical epithelial Ect1/E6E7 cells were detected by qRT-PCR. Cervical cancer SiHa cells were transfected withmimics to up-regulate the expression ofand treated with loganine. Cell proliferation was analyzed by CCK-8 method; Cell apoptosis was analyzed by flow cytometry; Migration and invasion abilities of cells were analyzed by Transwell chamber; Cleaved cystein-asparate protease-3 (cleaved Caspase-3) and matrix metalloprotease-2 (MMP-2) protein expressions were detected by Western blotting. Bioinformatics software was used to predict the target genes of, and luciferase reporter system was used to identify the targeting relationship between the two. Cervical cancer SiHa cells were co-transfected withmimics and MIEN1 overexpression vector to investigate the changes in cell proliferation, apoptosis, migration and invasion.mRNA expression level in cervical cancer SiHa, Hela and CasKi cells was lower than that in normal cervical epithelial Ect1/E6E7 cells (< 0.05), and miR-3619-5p expression level in cervical cancer SiHa cells was the lowest. After up-regulation of, given loganin or a combination of two treatments, cells proliferation, migration and invasion abilities were decreased (< 0.05), cell apoptosis was increased (< 0.05), cleaved Caspase-3 protein expression was increased (< 0.05), and MMP-2 protein expression was decreased (< 0.05). And combined treatment of two had a stronger effect on cells proliferation, apoptosis, invasion and migration.targeted MIEN1 expression. MIEN1 overexpression vector reversed the effects of loganin combined withon proliferation, apoptosis, migration and invasion of cervical cancer SiHa cells (< 0.05).Loganin combined withtargeting MIEN1 can inhibit the proliferation, migration and invasion of cervical cancer SiHa cells, and promote cell apoptosis.
loganin; cervical cancer; miR-3619-5p; migration and invasion enhancement factor 1; apoptosis; invasion
R285.5
A
0253 - 2670(2022)14 - 4409 - 08
10.7501/j.issn.0253-2670.2022.14.020
2022-01-21
冯双苗,硕士,副主任医师,研究方向为妇科肿瘤。E-mail: fsmiao0607@163.com
袁有华,本科,副主任技师,研究方向为肿瘤细胞凋亡。E-mail: yuanyouhua1968@163.com
[责任编辑 李亚楠]
