抗肿瘤作用的海洋中药
2022-07-21李泽宇郝二伟王嘉玉李心鑫庄培钧韦柳溢杜正彩侯小涛邓家刚
李泽宇,郝二伟#,李 卉,王嘉玉,李心鑫,曹 瑞,庄培钧,肖 倩,韦柳溢,杜正彩,侯小涛*,邓家刚*
抗肿瘤作用的海洋中药
李泽宇1, 2,郝二伟1, 2#,李 卉3,王嘉玉3,李心鑫4,曹 瑞1, 2,庄培钧1, 2,肖 倩1, 2,韦柳溢1, 2,杜正彩1, 2,侯小涛1, 2*,邓家刚1, 2*
1. 广西中医药大学 中国-东盟传统医学研究国际合作联合实验室,广西 南宁 530200 2. 广西中医药大学海洋药物研究院,广西 南宁 530000 3. 中国中医科学院望京医院,北京 100102 4. 北京市隆福医院,北京 100010
海洋中药应用历史悠久,是海洋生物资源和中医药研究中的重要组成部分。肿瘤一直以来都是人类面临的重大难题,化疗药物不良反应大、易耐药等问题日渐突出,现代研究已证实多种海洋中药具有显著的抗肿瘤作用,开发潜力较大,因此从该领域筛选合适的抗肿瘤药物意义重大。通过文献挖掘《海洋中药学》中记载的250种经典海洋中药,发现抗肿瘤作用已得到验证的有47种,清热解毒类、补虚类、化痰止咳平喘类、祛风湿类海洋中药占比较大,其药效物质主要为多肽、多糖类成分。综述具有抗肿瘤作用的海洋中药,为海洋中药更深层次的抗肿瘤研究提供一定的借鉴意义和思路方法。
海洋中药;抗肿瘤;多肽;多糖;清热解毒类;补虚类;化痰止咳平喘类;祛风湿类
21世纪是世界各国公认的海洋世纪,我国海洋资源丰富,在海洋中药领域的研究开发价值较大[1]。从古代的《山海经》《神农本草经》《本草纲目》到当代的《中华本草》《中华海洋本草》等著作共收录了数百种功效明确的海洋中药,其提取物及分离的化学物质具有广泛的药理活性。肿瘤一直以来都是人类需要克服的重大难题,化疗药物具有不良反应大、易耐药等问题,因此从海洋中药领域筛选合适的抗肿瘤药物潜力较大。随着研究的深入,学者发现了大量具有抗肿瘤作用的海洋中药,但目前仍缺少该领域的综述。本文以《海洋中药学》[2]中收录的250种经典海洋中药为研究主体,通过查阅相关文献,共确定了具有明确记载的抗肿瘤海洋中药47种,其中清热解毒类、补虚类、化痰止咳平喘类、祛风湿类海洋中药占比较大,并发现其抗肿瘤药效物质主要来源于多肽和多糖类成分。
目前在这些抗肿瘤海洋中药中,牡蛎、玳瑁、海藻、昆布、瓦楞子、蔓荆子、海参、文蛤肉的临床应用较为广泛。其中牡蛎广泛应用于方剂配伍中,其经典方剂桂枝甘草龙骨牡蛎汤以及《医学衷中参西录》中的镇肝熄风汤、《太平恵民和剂局方》中的牡蛎散等已拥有较长的应用历史,也有研究证明牡蛎莪术汤对子宫肌瘤具有良好的疗效;玳瑁配伍三七、丹参等也可有效抑制原发性肝癌的发展进程,其配伍甘寒质润益气养阴中药也可有效抑制癌症的发热症状;昆布常与海藻配伍用于抗肿瘤治疗;海参、文蛤肉等作为药食两用海洋中药,也有较大的研究开发潜力与价值。本文通过对这些抗肿瘤海洋中药进行系统阐述,为其后期深入研究及临床开发提供一定的借鉴意义。
1 解表类海洋中药
肿瘤缺氧微环境是实体肿瘤的重要特征,其线粒体功能受限、氧含量降低等特点与中医理论中“气机郁闭”的病机特点相一致。而郁者发之,解表中药可通过打破“气机郁闭”,恢复五脏元气,有效干预肿瘤缺氧微环境。解表类海洋中药蔓荆子、海滨莎具有一定的抗肿瘤作用。
1.1 蔓荆子
蔓荆子为马鞭科植物单叶蔓荆L. var.Cham.或蔓荆L.的干燥成熟果实,具有疏散风热、清利头目之功。蔓荆子总黄酮能够抑制肝癌SMMC-7721、MHCC97H细胞和肺癌NCI-H446细胞的自我更新,这可能与其上调环磷酸腺苷依赖的蛋白激酶表达,下调蛋白激酶B(protein kinase B,Akt)蛋白表达以及抑制细胞自我更新转录因子Bmi-l有关[3-4]。蔓荆子黄素能显著抑制人肺癌H322细胞的增殖,促进癌细胞凋亡,这与其阻滞细胞G2/M周期,抑制周期素依赖性激酶1、c-myc和survivin的表达有关[5-6]。蔓荆子黄素也可通过下调转录因子叉头框O3A诱导乳腺癌MDA-MB-231、MCF-7细胞凋亡[7],通过激活线粒体调控的凋亡通路诱导人白血病K562细胞凋亡[8]。最新研究也显示,蔓荆子抗肿瘤作用的发挥也与其中的槲皮素、山柰酚成分密切相关,其主要的作用靶点为核受体辅激活蛋白2、核受体辅激活蛋白1、孕酮受体,且可通过调节肿瘤坏死因子、p53等信号通路发挥治疗肝癌的作用[9]。Gong等[10]证实了蔓荆子能抑制宫颈癌HeLa和SiHa细胞增殖,并促进其凋亡,这可能与其影响磷脂酰肌醇-3-激酶(phosphatidylinositide-3-kinases,PI3K)/Akt信号通路有关,同时确定了蔓荆子发挥抗乳腺癌细胞的潜在靶点为重组人富半胱氨酸蛋白61。
1.2 海滨莎
海滨莎为莎草科植物海滨莎Aubl.的干燥全草,擅于发汗解表、利水消肿。海滨莎40%乙醇提取物能够促进人肺癌NCI-H385N细胞、人卵巢癌OVCAR-8细胞、人前列腺癌PC-3M细胞的凋亡,这可能与其提取物中的异牡荆素-2′--β--吡喃葡萄糖苷、牡荆素-2′--β--吡喃葡萄糖苷、木犀草素-7--葡萄糖醛酸和1--()-咖啡酰-β--葡萄糖成分有关[11]。此外,有研究也显示海滨莎对小鼠黑色素瘤B16F10细胞也具有抗增殖作用[12]。
2 清热解毒类海洋中药
肿瘤以热毒盛者较为常见,邪热瘀毒、阴虚热毒蕴结于体内,久而为癌。肿瘤初期邪盛而正虚不显,此时以清热解毒之法先攻之可有效抑制其发展,现代研究也表明清热解毒药能够抑制肿瘤细胞核酸及蛋白质的合成,限制肿瘤细胞的增殖。清热解毒类海洋中药白骨壤、木榄、角果木、老鼠簕、沙菜、海巴戟、碱蓬、中国鲎、紫海胆、海蚯蚓具有一定的抗肿瘤作用。
2.1 白骨壤
白骨壤为马鞭草科植物海榄雌(Forsk.) Vierh的叶及果实,清热解毒能力较强,Huang等[13]发现白骨壤醋酸乙酯提取物对人乳腺癌AU565、MDA-MB-231和BT483细胞的抗肿瘤活性较强,这可能与其中的avicennone D和avicennone E成分有关。白骨壤醋酸乙酯提取物也能够抑制MCF-7细胞生长并诱导其凋亡,其凋亡模式可能与诱导活性氧、改变线粒体膜电位有关,此外其也能引起细胞的自噬[14]。肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis inducting ligand,TRAIL)是一种抗肿瘤药物,具有较强的凋亡诱导能力,但大多数癌细胞对TRAIL诱导的凋亡产生了抗性。有研究发现白骨壤叶甲醇提取物能显著增加基因表达,这可能与其中的异槲皮苷成分有关[15]。白骨壤正己烷提取物对人结肠癌HCT-116细胞、人肝癌HepG2细胞和MCF-7细胞株表现出较强的细胞抑制作用,但诱导凋亡作用较弱。此外,HCT-116细胞在G0/G1期、HepG2细胞在S期、MCF-7细胞在G0/G1期均表现出明显的细胞周期抑制能力[16]。白骨壤叶甲醇提取物对人HeLa细胞有抗增殖作用[17]。目前,白骨壤生物合成纳米粒有较大的开发潜力,能够通过p53依赖和非依赖的半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)介导的信号通路诱导人肺癌A549细胞凋亡[18]。
2.2 木榄
木榄为红树科植物木榄(L.) Poir的树皮及根皮,具有清热解毒、收敛止痛之功,其多种活性部位及化合物抗肿瘤作用显著。木榄甲醇提取物、三氯甲烷提取物、醋酸乙酯提取物具有抑制HepG2细胞增殖的作用,木榄叶己烷提取物对MCF-7细胞的选择性毒性作用[19-20],木榄水提物对人乳腺癌MDA-MB-435S细胞的毒性显著[21]。从木榄中分离得到的2,3-二氢苯并呋喃型新木脂素、对映-13,16β,17-三羟基贝壳杉-9(11)-烯-19-酸甲酯、贝叶-19-醛-16-酮、16,17-二氢-17--13′-二聚甜菊醇、brugnanin、甜菊醇成分能显著抑制人鼻咽癌CNE-1细胞增殖[22-23],甜菊醇也能显著抑制皮肤肿瘤的生长情况[24]。易湘茜等[25]从木榄胚轴分离得到的莨菪亭、开环异落叶松脂素以及lyoniresinol-3α--β--glucopyranosides能够抑制A549细胞体外增殖。此外,从木榄中提取到3′,4′,5′-三羟基-7-羟基-5-甲氧基黄酮也具有一定的抑制肿瘤生长的作用[26]。
2.3 角果木
角果木为红树科植物角木果(Perr.) C. B. Rob.的树皮,多用于疮疡溃烂、外伤出血。从角果木中分离的tagalsins、isopimar-8(14)-en-16-hydroxy-15-one、isopimar-8(14)-en-15,16-diol、白桦脂醇、羽扇豆醇、桦木酸成分能够通过上调Caspase-3的表达诱导肿瘤细胞的凋亡[27-28]。此外,tagalsins还能通过下调Survivin、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2),上调Bax的表达来抑制人肝癌H22细胞、人肺癌Lewis细胞的生长情况,且具有一定的免疫调节作用[29-31]。
2.4 其他
清热类海洋中药老鼠簕、沙菜、海巴戟、碱蓬、中国鲎、紫海胆、海蚯蚓也对肿瘤有一定的抑制作用。老鼠簕为爵床科植物L.的根或树枝,其叶的乙醇提取物对皮肤乳头状瘤、道尔顿淋巴腹水肿瘤细胞和艾氏腹水肿瘤细胞具有一定的抑制作用,其抗肿瘤作用的发挥与其抑制肿瘤细胞增殖有关[32]。7,12-二甲基苯并蒽(7,12-dimethylbenz[a]anthracene,DMBA)是公认的特定部位致癌物的来源。沙菜为沙菜科植物长枝沙菜Lamx.、鹿角沙菜J. Ag、冻沙菜Tanaka的藻体,其乙醇提取物能够显著降低DMBA大鼠的肿瘤发生率和肿瘤体积,具有预防乳腺癌作用,这可能与其自由基猝灭作用和调节生物转化酶潜力有关[33]。沙菜也能够显著抑制MCF-7细胞和人神经母细胞瘤SH-SY5Y细胞的增殖[34]。海巴戟为茜草科植物滨海木巴戟L.的根、果实、叶及树皮,能够显著抑制肿瘤细胞生长,这可能与其诱导肿瘤细胞凋亡、抑制其增殖有关,研究也表明,海巴戟叶乙醇提取物对MCF-7细胞具有抗增殖作用[35-36]。碱蓬为藜科植物碱蓬Bunge的全草,其中分离出的一种酸性多糖SSP2-2可以通过激活MCF-7细胞中的线粒体途径诱导肿瘤细胞凋亡。这可能与凋亡相关蛋白Bax、细胞色素C、钙蛋白酶Ⅰ、Caspase-9的表达升高和Bcl-2表达降低有关[37]。中国鲎为鲎科动物中华鲎Leach的壳、尾、尾珠或肉,其中的鲎素可诱导人前列腺癌TSU细胞凋亡,这可能与其激活Caspase-9、Caspase-8和Caspase-3,并增加Fas配体、Caspase-7和Caspase-6的表达有关[38]。有学者从紫海胆(长海胆科动物紫海胆A. Agassiz的壳)中分离出成分ACT(分子式为C16H32O2),该成分抑癌活性较强,对MCF-7细胞、人乳腺癌SKBR-3细胞、人结肠癌SW620细胞均有显著的抑制作用[39]。海蚯蚓为沙蠋科动物巴西沙蠋Nonato的全体,抗肿瘤作用也较强,其抗肿瘤作用的发挥多来源于其酶成分,纤溶酶能够诱导人胃癌BGC823细胞、人乳腺癌B37细胞、人食道癌ECA109细胞、人肝癌SMMC-7721和HCCLM3细胞凋亡[40];抗氧化酶能够在体内外抑制小鼠腹水瘤S180细胞生长,诱导肿瘤细胞凋亡[41];蛋白酶也可显著抑制HeLa细胞、人食管癌Eca-109细胞和人大肠癌SW480细胞的增殖[42]。
3 祛风湿类海洋中药
湿为阴邪,易阻滞气机,导致气机不畅,风湿久聚而为痰,痰凝可阻滞人体气血津液的运行,进而胶结发为瘿瘤。祛风湿类海洋中药厚藤、海萝、匍匐滨藜、枪乌贼、海蛇、鲨鱼骨、海燕具有一定的抗肿瘤作用。
3.1 厚藤
厚藤为旋花科植物厚藤(Linn.) Sweet的全草或根,擅于消痈散结、拔毒消肿,抗炎作用较强。厚藤水提物和甲醇提取物能够促进B16F10细胞的凋亡,使肿瘤内血管长度和肿瘤体积显著减小,这可能与其中的白桦脂酸成分有关[43]。研究表明,厚藤脂溶性树脂糖苷与阿霉素联用也能够抑制MCF-7细胞的增长[44]。
3.2 海萝
海萝为内枝藻科植物海萝(Post. et Rupr.) J. Agardh、鹿角海萝(Turner) Decaisne的藻体,擅于软坚化痰、止泻。海萝甲醇提取物对HepG2、HeLa、MCF-7、结直肠癌HT-29细胞系有较强的生长抑制作用[45],能诱导HepG2细胞周期G2/M期阻滞,这与细胞周期蛋白A的下调、细胞周期蛋白依赖激酶抑制剂p21的上调和细胞分裂周期蛋白25C的去磷酸化有关。此外,其还能降低环氧合酶2 mRNA表达水平,这可能与前列腺素E2合成的减少有关[46]。研究也显示,海萝的体外抗肿瘤活性可能与其硫酸盐和糖醛酸含量大小有关[47]。
3.3 其他
匍匐滨藜、枪乌贼、海蛇、鲨鱼骨、海燕这些祛风湿类海洋中药也具有一定的抗肿瘤作用。匍匐滨藜为藜科植物匍匐滨藜Roth的全草,其醋酸乙酯萃取部位对人肝癌BEL-7402细胞有一定的抑制活性[48]。枪乌贼为枪乌贼科动物中国枪乌贼Gray、剑尖枪乌贼Hoyle、日本枪乌贼Hoyle等的肉,其墨黑色提取物能够抑制HCT-116细胞、HeLa细胞、HepG2细胞、MCF-7细胞和PC-3细胞增殖,并具有抑制肿瘤细胞非定向迁移的作用[49]。枪乌贼消化明胶水解物能够抑制MCF-7和MDA-MB-231细胞生长,促进肿瘤细胞凋亡,这可能与其上调Caspase-3、多聚ADP-核糖聚合酶、p53表达,下调基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9、Ki67表达有关[50]。海蛇为海蛇科动物环纹海蛇Guenther、深灰海蛇Gray、青环海蛇Daudin的肉和皮,其中的海蛇毒素对艾氏腹水癌细胞表现出较强的抗肿瘤活性,可显著降低肿瘤生长,延长患癌鼠寿命[51]。软骨素是一种具有多种生物学功能的食品源性生物活性物质,目前对鲨鱼骨(真鲨科动物阔口真鲨Fang et Wang或其他鲨鱼的骨骼)中的软骨素及硫酸软骨素成分抗肿瘤研究较多,其在结肠癌[52]、非小细胞肺癌[53]、胰腺癌[54]、大肠癌[55]、乳腺癌[56]、卵巢癌[57]等多种癌症治疗方面都具有较大的开发潜力,软骨素能够通过影响DNA复制、细胞周期进展和细胞凋亡等方式显著抑制肿瘤的发生发展。海燕为海燕科动物海燕Muller et Troschel、林氏海燕G. A. Smith、贝氏海燕Goto的全体,也具有一定的抗肿瘤作用,其中的蛋白与人类免疫缺陷病毒Tat49-57结合形成的新肽能够显著抑制人食管癌EC-9706细胞和HCT-116细胞增殖,将癌细胞阻滞于G2/M期,促进癌细胞凋亡[58]。海燕极性类固醇能够抑制结肠癌DLD-1、HCT116、HT-29细胞集落的形成,促使Caspase活化和DNA降解,诱导细胞凋亡[59]。
4 利水渗湿类海洋中药
湿邪阻滞于脾,痰浊困阻经络,湿浊不降而清阳不升,利水渗湿药可通过利水湿、健脾气抑制肿瘤的发生发展。利水渗湿类海洋中药中的巨藻、水松、石帆抗肿瘤作用显著。巨藻为巨藻科植物黎形巨藻(L.) C. Ag中的褐藻糖胶,能够增加免疫细胞活性,增敏其对淋巴瘤YAC-1细胞的作用[60]。水松为松藻科植物刺松藻(Sur.)、长松藻Holm的藻体,其甲醇提取物能够通过下调肿瘤坏死因子-α诱导的MMP-9表达来降低MDA-MB-231细胞的侵袭能力,这可能与其抑制核因子-κB(nuclear factor-κB,NF-κB)活性有关[61]。研究显示,水松乙醇提取物中的黄酮类成分可诱导TRAIL耐药的结直肠癌细胞凋亡,这可能与其下调细胞FADD样白细胞介素-1β转换酶-抑制蛋白(Caspase-8抑制剂)来增敏TRAIL对结肠癌细胞作用有关[62]。研究显示石帆(软柳珊瑚科动物网状软柳珊瑚Ellis et Solander群体的石灰质骨骼)乙醇提取物也具有一定的抑癌活性,能够抑制C3H小鼠MCF-7细胞的生长[63]。
5 理气类海洋中药
气机不畅易致脉络瘀阻,蕴结久则成肿瘤积块,肿瘤患者正气不足,易致脏腑亏损,痰湿内生,而痰阻气滞,气畅则痰消。角叉菜为杉藻科植物角叉菜Holmes的藻体,具有理气和胃、润肠通便之功。角叉菜多糖抑瘤作用显著,4-硒代硫酸酯角叉菜多糖具有抑制BEL-7402细胞生长、增强免疫功能的作用[64]。有研究通过考察角叉菜多糖对H22细胞的抑制效果,发现相对分子质量是影响角叉菜多糖抗肿瘤作用的重要因素,角叉菜多糖的相对分子质量适当减小可使抑瘤率升高,但相对分子质量太小又会使抑瘤率迅速降低,因此只有适中相对分子质量的角叉菜多糖抑瘤作用才较强[65]。λ-角叉菜卡拉胶能增强树突状细胞的肿瘤抑制作用,抑制肿瘤小鼠荷瘤B16-F10和4T1细胞生长[66-67]。
6 活血止血类海洋中药
“瘀血不去则新血不生”,血瘀久则会化热化燥,易致邪毒炽盛,肿瘤早期邪盛未衰,活血化瘀中药可通过缓解肿瘤病程中的血瘀化热化燥之势有效施治。活血止血类海洋中药海杧果、乌贼墨、石花菜、黄瑾具有一定的抗肿瘤作用。
6.1 海杧果
海杧果为夹竹桃科植物海杧果Linnaeus的种子、树液、树皮及叶等,散瘀止痛能力较强,海杧果抗肿瘤药效的发挥与其中豆蔻内酯苷成分密切相关。Chang等[68]从海杧果根中分离的2种强心苷成分(−)-14-羟基-3β-(3--甲基-6-脱氧-α--鼠李糖基)-11α,12α-环氧-(5β,14β,17β)-card-20(22)-烯醇化物、(−)-14-羟基-3β-(3--甲基-6-脱氧-α--吡喃葡糖基)-11α,12α-环氧-(5β,14β,17β)-card-20(22)-烯醇化物能显著抑制人体结肠癌Co12细胞的增殖。Laphookhieo等[69]从海杧果种子的二氯甲烷提取物中分离到的黄夹次苷乙、海果苷成分对口腔人类表皮样癌KB细胞、人类乳腺癌BC细胞、人肺癌NCI-H187细胞具有显著的抑癌活性。冯波[70]从海杧果种子中提取的强心苷成分2′--2′--acetylthevetin B可选择性控制人HepG2细胞增殖,这可能与其调控S和G2期阻滞、诱导Ca2+介导的线粒体通路和活性氧的产生,从而促进癌细胞凋亡有关。多形性胶质母细胞瘤(gliobIastoma multifonne,GBM)是一种高度复发的恶性肿瘤,黄夹次苷乙可作为GBM细胞系及其肿瘤细胞生长和迁移的有效抑制剂,其可有效抑制GBM肿瘤细胞的生长和集落形成,导致细胞周期G1期阻滞,促进诱导GBM肿瘤细胞凋亡,可作为治疗GBM的药物先导化合物[71]。
6.2 乌贼墨
乌贼墨为乌贼科动物无针乌贼de Rochebrune、金乌贼Hoyle、白斑乌贼Quoy et Gaimard等乌贼墨囊肿的墨汁,可用于温经止血、活血化瘀。乌贼墨寡肽、乌贼墨多肽、乌贼墨胃蛋白酶水解物、乌贼墨多糖均有一定的抗癌活性。乌贼墨寡肽是从乌贼墨中提取的一种三肽,能够显著抑制A549细胞和肺癌H1299细胞的增殖,同时可刺激线粒体途径、死亡受体途径和内质网应激诱导的细胞凋亡,这可能与其阻滞细胞S期和G2/M期,上调促凋亡蛋白p53和Caspase-3的表达,下调抗凋亡蛋白Bcl-2、Bax的表达有关[72-74]。乌贼墨多肽能够通过上调p53、Caspase-3表达,下调Bcl-2/Bax值和血管内皮生长因子(vascular endothelial growth factor,VEGF)表达来促进人前列腺癌DU-145细胞凋亡[75]。乌贼墨多糖对MDA-MB-231细胞生长有抑制作用,其不仅抑制MDA-MB-231细胞的增殖和迁移以及MMP-2和MMP-9蛋白的表达,还促进顺铂对MDA-MB-231细胞增殖、迁移和MMPs表达的抑制,因此可考虑其作为辅助药物与化疗药一起用于治疗乳腺癌[76]。从乌贼墨胃蛋白酶水解物中分离出的多肽成分(氨基酸序列为Leu‑Lys‑Glu‑Glu‑Asn‑ Arg‑Arg‑Arg‑Arg‑Asp)能够显著抑制PC-3细胞的增殖,诱导细胞凋亡,这与其上调p53、Caspase-3、Bax水平,下调Bcl-2水平有关[77]。
6.3 其他
石花菜为石花菜科植物石花菜(Lamx.) Lamx.、细毛石花菜(Turn.) Lamx、凝花菜(Forsskal) Feldmann et Hamel等的藻体,甲醇提取物对A549细胞、小鼠肝癌Hepa细胞、白血病HL-60细胞抑制作用显著,石花菜二甲基亚砜提取物也能够抑制Hepa细胞的生长,诱导细胞凋亡[78-79]。石花菜醋酸乙酯提取物也可通过上调Caspase-3表达来抑制HeLa细胞增殖[80]。黄瑾为锦葵科植物黄瑾L.的叶、树皮或花,其水提物对大鼠结肠癌IEC-6细胞、MCF7细胞也具有一定的生长抑制活性[81]。
7 化痰止咳平喘类海洋中药
痰凝湿聚可作为肿瘤的病理产物,其也是继发性致病因素,化痰止咳平喘中药可通过消痰软坚以散痰积块。化痰止咳平喘类海洋中药海藻、半叶马尾藻、匍枝马尾藻、龙须菜、麒麟菜、海漆具有一定的抗肿瘤作用。
7.1 海藻
海藻为马尾藻科植物羊栖菜(Harv.) Okamur、海蒿菜Ag.的藻体,软坚散结、利水通淋作用强,海藻衍生的海洋天然产物根据其来源分为褐藻、红藻、蓝藻、绿藻等[82]。褐藻聚糖是一种从棕色海藻中提取的多糖,长期以来一直被用作某些膳食补充剂产品的成分,褐藻聚糖对A549细胞具有抗转移作用,这可能与其下调细胞外调节蛋白激酶、Akt-哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)以及NF-κB信号通路有关[83]。褐藻聚糖具有抗结直肠癌和乳腺癌活性的作用[84],其能够通过增加活性氧生成、切割线粒体膜和细胞核损伤、增加Caspase-3/9活性诱导MCF-7细胞和MDA-MB-231细胞凋亡,同时通过调节微小RNA(microRNA,miR)-29c/解整合素和MMP-12、miR-17-5p/磷酸酶和张力蛋白同源物、酸肌醇3-激酶/Akt通路抑制乳腺癌细胞上皮间质转化,从而抑制乳腺癌的发展进程[85-86]。红藻中分离的水溶性硫酸多糖也能够抑制MCF-7细胞的增殖,介导癌症细胞凋亡[87],红藻糖衍生物也可显著抑制人结肠癌细胞的增殖并诱导其凋亡[88]。褐藻中的硫酸多糖葡聚糖硫酸乙酰肝素和纤维素硫酸酯能够阻断人乳头瘤病毒感染细胞的能力,褐藻中的萜类化合物也是很有前景的具有抗宫颈癌活性的药物[89]。研究显示,从褐藻和微藻中提取的岩藻黄素能够诱导细胞生长阻滞、凋亡和自噬,抑制转移相关的迁移、侵袭、上皮间质转化和血管生成。岩藻黄素还可影响DNA修复途径,参与肿瘤细胞的耐药表型,从而降低药物耐药性[90]。调查发现膳食海藻的摄入能在一定程度上降低结直肠癌的发生,说明其具有一定的预防癌症作用,值得推广[91]。
7.2 昆布
昆布为海带科植物海带Aresch.或翅藻科植物昆布(鹅掌菜)Okam.的干燥叶状体,具有消痰软坚、利水消肿之功,在临床中昆布常与海藻配伍用于抗肿瘤治疗。昆布中的岩藻黄质可有效抑制恶性肿瘤细胞,其抑制A549细胞的机制可能与调控p53、Caspase-3、Bcl-2相关凋亡通路有关[92]。昆布多糖的抗肿瘤作用也较强,现多对其进行硫酸酯化修饰形成具有更强生物活性的昆布多糖硫酸酯(laminarin sulfate,LAMS),LAMS能有效抑制PC-3细胞、人结肠癌LOVO细胞的生长,诱导其S/G2期阻滞,并诱导其凋亡,LAMS也可通过抑制肿瘤组织血管生成、增强机体免疫功能、增敏化疗药物等发挥抗肿瘤作用[93-94]。海藻昆布汤治疗子宫肌瘤的有效率较高[95],含昆布的汤剂(天葵子、地丁、昆布、海藻)治疗直肠癌、宫颈癌、食管癌的临床效果显著[96]。
7.3 其他
瓦楞子、半叶马尾藻、匍枝马尾藻、龙须菜、麒麟菜、海漆的抗肿瘤作用也较显著。瓦楞子为蚶科动物毛蚶Lischke、泥蚶Linnaeus或魁蚶Reeve的贝壳,纯化蛋白G-6和G-4-2能够有效抑制人肿瘤细胞的增殖,其中G-4-2对HeLa细胞、HL-60细胞、KB细胞抑制作用显著,G-6对HL-60细胞抑制作用显著[97]。半叶马尾藻为马尾藻科植物半叶马尾藻Turn的全草,其丙酮、二氯甲烷、甲醇提取物对HT-29细胞和人胃腺癌AGS细胞生长具有一定的抑制作用[98]。匍枝马尾藻为马尾藻科植物匐枝马尾藻C. Ag.的全藻,正己烷提取物能够通过降低凝血酶浓度来降低HeLa细胞的存活率,其作用的发挥与其中苯丙酸类化合物有关[99]。从马尾藻中分离的岩藻糖胶也具有一定的抗癌活性,能够通过线粒体介导的凋亡途径对HL-60细胞和MCF-7细胞发挥抗增殖作用[100-101]。龙须菜为江蓠科植物真江蓠Zhang et Xia、脆江蓠(Gmel.) Silva、芋根江蓠Harv等的藻体,其多糖与胶质瘤细胞中过度表达的αvβ3整合素具有很高的结合亲和力,龙须菜多糖纳米粒可通过诱导癌细胞p53、丝裂素活化蛋白激酶(mitogen-activated protein kinases,MAPKs)和Akt信号通路促进细胞凋亡。龙须菜多糖也可抑制A549细胞的增殖能力,降低细胞活力、改变细胞形态、诱导细胞凋亡[102-103]。龙须菜藻红蛋白能够诱导人卵巢癌SKOV-3细胞凋亡,这可能与其上调c-Jun氨基末端激酶、生长停滞和DNA损伤、芽殖酵母同源物表达水平和下调X框结合蛋白1、骨肉瘤扩增表达水平有关[104]。麒麟菜为红翎菜科植物麒麟菜(N. L. Burman) Collins et Hervey、耳突卡帕藻(Weber-van Bosse) Doty、异枝卡帕藻(Schmitz) Doty的藻体,其正己烷、醋酸乙酯、乙醇和氯仿提取物对MCF-7和HCT-116细胞的生长具有一定的抑制活性[105]。麒麟菜凝集素可诱导HeLa细胞和结肠癌Colo201细胞死亡[106-107]。硒化麒麟菜多糖可通过阻滞HeLa细胞S和G2/M期抑制肿瘤细胞增殖,通过上调Fas表达来促进肿瘤细胞凋亡[108]。麒麟菜多糖对H22荷瘤小鼠也有一定的抗肿瘤和增强免疫的作用[109]。海漆为大戟科植物海漆L.的树皮、枝叶、木材或乳汁,是分布广泛的药用红树林植物,海漆叶醇提物能够抑制MCF-7细胞增殖,这可能与其阻滞细胞G1/G2周期有关[110-111]。海漆合成纳米颗粒对MCF-7细胞也表现出良好的细胞毒性作用[112]。
8 平肝熄风类海洋中药
毒邪入侵过极而化火,火毒热极则生风,引起肝风内动,而邪热火毒蕴结于脏腑经络易致肿瘤的产生,如中医把脑瘤归为“头风”的范畴,其产生原因则为脑络痹阻较久,化热为风,从而导致毒邪凝结。平肝熄风药可平抑肝阳、熄风止痉,在一定程度上抑制肿瘤的发生发展。平肝熄风类海海洋中药牡蛎和玳瑁均可用于甘阳上亢引起的头晕发热诸症,也具有一定的抗肿瘤作用。牡蛎为牡蛎科动物近巨牡蛎(近江牡蛎)Wakiga、长巨牡蛎(长牡蛎、大连湾牡蛎)Thumberg的贝壳,其酶解物能够促进Lewis细胞凋亡,这可能与其增加T淋巴细胞和NK细胞功能有关[113]。临床中牡蛎配伍应用较广泛,如牡蛎莪术汤治疗子宫肌瘤疗效较好[114-115]。此外,Warburg效应是癌细胞的特征性代谢重编程过程,能够允许癌细胞根据其在肿瘤内遇到的微环境来满足其生长、增殖和抵抗凋亡的特殊能量需求。研究显示牡蛎能够自然地将其新陈代谢重编程为Warburg效应,所以基于其适应微环境极端变化的特殊能力,牡蛎有潜力成为一种新的无脊椎动物癌症研究和控制Warburg效应模型[116]。玳瑁为海龟科动物玳瑁Linnaeus的背甲,抗癌研究多集中于其配伍应用中,玳瑁、白花蛇、三七配伍能够有抑制肝癌[117],玳瑁、白花蛇、舌草、丹参配伍能够有效缓解原发性肝癌的发展进程[118],癌性发热是癌症晚期的一种常见症状,玳瑁结合甘寒质润益气养阴之品治疗癌性发热效果也较显著[119]。
9 补虚类海洋中药
正气亏虚、阴阳失衡是肿瘤发生发展的重要诱因,且肿瘤作为消耗性疾病,易致正气大伤,因此当以补为主,通过扶正培本协调阴阳偏盛偏衰,从而改善和调整机体体质,纠正人体内环境紊乱,抑制肿瘤的发展。补阳类海洋中药海马、海龙、海参、七鳃鳗,补阴类海洋中药文蛤肉、海鹞鱼、淡菜、干贝、吐铁具有一定的抗肿瘤作用。
9.1 补阳类海洋中药
9.1.1 海马 海马为海龙科动物线纹海马Jordan et Snuder、刺海马Kaup、大海马Bleeker、三斑海马Leach或小海马(海蛆)Kaup等除去内脏的干燥体,具有补肾助阳、益精血之功,早在《本草纲目》中就记载海马能够增强肾脏功能,对男性健康有益。最新有团队考证了其说法,发现海马脂提取物能够降低二氢睾酮诱导的前列腺癌LNCaP细胞雄激素受体和前列腺特异性抗原表达。进一步研究发现海马的活性成分菜籽甾醇能够通过Akt在雄激素受体非依赖性肿瘤和依赖性细胞中发挥抗癌作用[120]。
9.1.2 海龙 海龙为海龙科动物刁海龙Gray、拟海龙Bloch或尖海龙Linnaeus的干燥体,擅于温肾助阳,其抗肿瘤活性物质可能来源于其中的大分子水溶性物质[121]。粗吻海龙对肝癌BEL-7402细胞、A549细胞、HL-60细胞、白血病P388细胞具有一定的杀伤作用[122]。粗吻海龙蛋白质对人A549细胞、白血病CCRF-CEM细胞、白血病L1210细胞、LOVO细胞的生长具有显著的抑制作用[123]。尖海龙对宫颈癌HeLa细胞、乳腺癌SK-RB-3细胞也具有一定的抑制作用[124]。海龙抗肿瘤作用的发挥与其促凋亡蛋白Bax、p53含量升高、抑凋亡蛋白Bcl-2含量降低、提高免疫功能有关[125]。
9.1.3 海参 海参为刺参科动物仿刺参Selenka、花刺参Semper、糙刺参Brandt、梅花参Jaeger的干燥全体,补肾益精、壮阳疗痿作用较强。海参糖胺聚糖(holothurian glycosaminoglycan,HGAG)是一种从海参中提取的具有强大抗凝活性的硫酸化多糖,对肿瘤转移非常有效,hGAG能够有效地抑制B16F10细胞转移,这可能与其减弱活化因子Xa的生成、减少纤维蛋白的形成、下调组织因子的转录和蛋白表达、阻止NF-κB胞浆中的核转位、抑制转移相关基质金属蛋白酶表达、激活中枢调节因子p38 MAPK和细胞外调节蛋白激酶1/2信号通路有关[126]。研究表明hGAG能够减少血小板和乳腺癌细胞之间的黏附,去除黏附纤维蛋白原的血小板和癌细胞,减弱血小板-癌细胞复合体的形成[127]。P-选择素介导的肿瘤细胞与血小板黏附是肿瘤转移过程中一个重要阶段,hGAG也可通过破坏P-选择素与细胞表面受体的结合和激活肿瘤细胞迁移的下游调节器的方式阻断P-选择素介导的肿瘤转移[128]。综上,hGAG的抗血小板特性和细胞黏附分子水平的减轻都有助于其抗癌作用,是一种很有前途的转移癌治疗剂,可用于临床辅助治疗以减轻肿瘤血行转移。Mou等[129]设计了一个新的纳米给药系统,发现负载阿霉素与解聚多阴离子海参糖胺聚糖的纳米复合物可以提高阿霉素对HepG2细胞、MCF-7细胞和A549细胞的杀伤能力,并在细胞内发挥缓释作用。
9.1.4 其他 七鳃鳗为七鳃鳗科动物日本七鳃鳗Martens的全体,其中分离的十肽促性腺激素释放激素III对人MDA-MB-231细胞、MCF-7细胞、HT-29细胞和胰腺癌PANC-1细胞有直接的抗增殖作用[130]。且在不同的癌细胞中表现出不同的信号转导途径[131]。重组七鳃鳗免疫蛋白LIP可通过识别细胞上的GPI-APs靶点来杀伤MCF-7细胞,这是造成癌细胞死亡的一种新途径[132]。此外,LIP能在不伴随健康细胞损伤的情况下发挥高效的杀瘤作用,LIP也能够破坏微管、线粒体、内质网等细胞器,诱导某些肺癌细胞膜的分解,从而打破稳态维持作用,其还能够通过控制内质网应激信号通路调控肺癌细胞凋亡[133]。
9.2 补阴类海洋中药
9.2.1 文蛤肉 文蛤肉为帘蛤科动物文蛤Linnaeus的肉,具有润燥止渴、软坚消肿之功。文蛤肉中的文蛤多肽对SMMC-7721细胞、HeLa细胞抑制作用显著[134-135]。从文蛤体腔液中提取纯化的蛋白MML能够通过改变细胞膜通透性和抑制微管蛋白聚合来抑制BEL-7402细胞、MCF-7细胞和HCT116细胞[136]。从文蛤中提取的多肽Mere15是一种广谱抗癌多肽,能够抑制人K562细胞,这可能与其诱导癌细胞凋亡、阻滞细胞周期和微管解体有关[137]。Mere15也能够下调MMP-2和MMP-9的表达,通过促凋亡和抗转移途径抑制A549细胞肿瘤生长[138]。研究显示,Mere15能够抑制非小细胞肺癌细胞的侵袭和迁移,显著抑制PI3K、Akt和mTOR的磷酸化,使Snail表达下调,钙黏附蛋白E表达增加。Mere15也能够在体内明显抑制裸鼠肺癌NCI-H460细胞的生长。Mere15有潜力作为一种新型的抗转移剂用于非小细胞肺癌患者的治疗[139]。
9.2.2 其他 海鹞鱼、淡菜、干贝、吐铁具有抗肿瘤作用。海鹞鱼来源于魟科动物赤魟Muller et Henle、花点魟Forskal的肉,研究表明赤魟皮肤、软组织和软骨粗提物能够抑制S180细胞和H22细胞的生长[140]。淡菜为贻贝科动物紫贻贝Lamarke、厚壳贻贝Gould、翡翠股贻贝Linnaeus及各种贻贝,肌贝,石蛏等的肉,其甲醇、氯仿、正己烷提取物能够抑制PC3细胞、HepG2细胞、MDA-MB-231细胞、A549细胞的生长,诱导癌细胞凋亡[141]。淡菜对AGS细胞、DLD-1细胞、HeLa细胞也表现出较强的细胞毒性[142]。淡菜中分离的凝集素MytiLec对淋巴瘤Raji细胞存在一定的细胞毒性[143]。干贝为扇贝科动物栉孔扇贝Preston、华贵类栉孔扇贝Reeve、海湾扇贝Lamarck、雀栉孔扇贝Sowerby的闭壳肌,能够抑制MCF-7细胞增殖,促进癌细胞凋亡,通过上调p53和p21,下调细胞周期蛋白D1/CDK4和细胞周期蛋白E1/CDK2,从而诱导G0/G1期阻滞;干贝也能够通过下调Bcl-2表达、释放细胞色素C、减少蛋白酶原-3和增加ADP-核糖诱导线粒体凋亡[144]。吐铁为地螺科动物吐铁(泥鳅)Philippi的肉,其中分离纯化的多肽能抑制PC-3细胞的增殖,促进癌细胞凋亡[145-146]。从吐铁中分离的硫酸多糖BEP3对HeLa细胞、乳腺癌Bcap37细胞和胰腺癌SW1990细胞的生长有明显的抑制作用[147]。
10 驱虫类海洋中药
驱虫类海洋中药多兼有解毒之功,而肿瘤成因多归结为邪热瘀毒、阴虚热毒蕴结于体内。驱虫类海洋中药驱虫苔为松节藻科植物多管藻Howe、松节藻(Woodward) C. agardh的藻体,现代研究表明松节藻乙醇提取物抑癌作用显著,且具有增强机体免疫功能的作用。从松节藻中分离的4,4′-亚甲基-二(5,6-二溴-1,2-二苯酚)、3-溴-4-[2,3-二溴-4,5-二羟基苯基]甲基-5-(甲氧基甲基)-1,2-二苯酚、3-溴-4,5-二(2,3-二溴-4,5-二羟基苯甲基)-1,2-二苯酚、二(2,3-二溴-4,5-二羟基苯甲基)醚和3-溴-4-[2,3-二溴-4,5-二羟基苯基]甲基-5-(乙氧基)-1,2-二苯酚5种单体化合物对人A549细胞具有一定的细胞毒性作用[148]。从松节藻乙醇提取物的极性组分中分离的苯乙醇硫酸盐溴酚对A549细胞、BEL-7402细胞、人结肠癌HCT-8细胞、胃癌BGC-823细胞和人卵巢癌A2780细胞也具有一定的细胞毒性[149]。松节藻中分离的双-(2,3-二溴-4,5-二羟基苯基)-甲烷成分抗肿瘤作用显著,且对正常细胞毒性较低,有较大的开发潜力[150]。
抗肿瘤海洋中药具体作用类型及活性物质见表1。
表1 抗肿瘤海洋中药具体作用类型及活性物质
Table 1 Specific action types and active substances of antitumor marine traditional Chinese medicine
海洋中药名称抗肿瘤类型可能的活性成分/组分文献 解表类海洋中药蔓荆子SMMC-7721细胞、MHCC97H细胞、肺癌NCI-H466细胞、H322细胞,MDA-MB-231细胞、MCF-7细胞,K562细胞、HeLa细胞、SiHa细胞总黄酮、蔓荆子黄素、槲皮素、山柰酚3-10 海滨莎NCI-H385N细胞、OVCAR-8细胞、PC-3M细胞、B16F10细胞40%乙醇提取物、异牡荆素-2′-O-β-D-吡喃葡萄糖苷、牡荆素-2′-O-β-D-吡喃葡萄糖苷、木犀草素-7-O-葡萄糖醛酸和1-O-(E)-咖啡酰-β-D-葡萄糖11-12 清热类海洋中药白骨壤AU565细胞、MDA-MB-231细胞、BT483细胞、MCF-7细胞、HCT-116细胞、HepG2细胞、HeLa细胞、A549细胞醋酸乙酯提取物、甲醇提取物、正己烷提取物、异槲皮苷、avicennone D、avicennone E13-18 木榄HepG2细胞、MCF-7细胞、MDA-MB-435S细胞、CNE-1细胞、A549细胞甲醇提取物、三氯甲烷提取物、醋酸乙酯提取物、水提取物、甜菊醇、brugnanin、2,3-二氢苯并呋喃型新木脂素、对映-13,16β,17-三羟基贝壳杉-9(11)-烯-19-酸甲酯、贝叶-19-醛-16-酮、16,17-二氢-17-O-13′-二聚甜菊醇、3′,4′,5′-三羟基-7-羟基-5-甲氧基黄酮、莨菪亭、开环异落叶松脂素、lyoniresinol-3α-O-β-D-glucopyranosides19-26 角果木H22细胞、Lewis细胞tagalsins、isopimar-8(14)-en-16-hydroxy-15-one、isopimar-8(14)-en-15,16-diol、白桦脂醇、羽扇豆醇、桦木酸27-31 老鼠簕皮肤乳头状瘤、道尔顿淋巴腹水肿瘤细胞、艾氏腹水肿瘤EAC细胞叶乙醇提取物32 沙菜MCF-7细胞、SH-SY5Y细胞乙醇提取物33-34 海巴戟MCF-7细胞叶乙醇提取物35-36 碱蓬MCF-7细胞酸性多糖SSP2-237 中国鲎TSU细胞鲎素38 紫海胆SKBR-3细胞、MCF-7细胞、SW620细胞壳中含双键的C16H32O2成分39 海蚯蚓S180细胞、BGC823细胞、B37细胞、ECA109细胞、SMMC-7721细胞、HCCLM3细胞、HeLa细胞、Eca-109细胞、SW480细胞蛋白酶、抗氧化酶、纤溶酶40-42
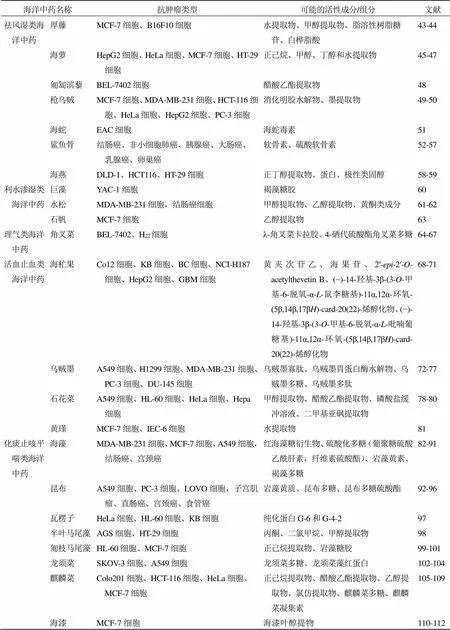
续表1
续表1
海洋中药名称抗肿瘤类型可能的活性成分/组分文献 平肝熄风类海洋中药牡蛎Lewis细胞牡蛎酶解物113-116 玳瑁原发性肝癌水提取物117-119 补阳类海洋中药海马LNCaP细胞海马脂提取物、菜籽甾醇120 海龙BEL-7402细胞、A549细胞、HL-60细胞、P388细胞、HeLa细胞、SK-RB-3细胞水提取物、醇提取提物、PBS提取物、海龙蛋白质121-125 海参B16F10细胞、HepG2细胞、MCF-7细胞、A549细胞海参糖胺聚糖126-129 七鳃鳗MDA-MB231细胞、MCF-7细胞、HT-29细胞、A549细胞、Calu-1细胞、PANC-1细胞十肽促性腺激素释放激素Ⅲ、食饵免疫蛋白130-133 补阴类海洋中药文蛤肉BEL-7402细胞、SMMC-7721细胞、MCF-7细胞、HCT116细胞、K562细胞、NCI-H460细胞、A549细胞、HeLa细胞多肽粉、多肽Mere15、高度纯化蛋白MML134-139 淡菜PC3细胞、MDA-MB-231细胞、NCI-A549细胞、HepG2细胞、Raji细胞、AGS细胞、DLD-1细胞、HeLa细胞甲醇提取物、氯仿提取物、正己烷提取物、凝集素MytiLec140-142 海鹞鱼H22细胞、S180细胞赤魟三种组织(皮肤、软组织和软骨)粗提物143 干贝MCF-7细胞扇贝肉提取物144 吐铁PC-3细胞、Bcap37细胞、SW1990细胞、HeLa细胞多肽,硫酸多糖BEP1、BEP2和BEP3145-147 驱虫类海洋中药驱虫苔HCT-8细胞、BEL-7402细胞、BGC-823细胞、A549细胞、A2780细胞乙醇提取物、苯乙醇、苯乙醇硫酸盐溴酚、双-(2,3-二溴-4,5-二羟基苯基)-甲烷148-150
11 结语与展望
海洋中药和现代海洋药物的药源均是海洋天然药物,而现代海洋药物偏于运用现代科学和技术研制而成的药,海洋中药偏于传统中医药理论下用于防治疾病和养生保健的药,两者的研究对象虽一致,但研究思维、研究方法和研究范围却截然不同,海洋中药研究属于传统医药学的范畴,海洋药物研究属于现代药物学的范畴,当然两者也可进行有机结合,海洋中药研究可以归属为一个具有传统医药学专属特性的海洋药物研究分支。从海洋生物中寻找海洋抗肿瘤活性化合物一直是海洋天然产物研究的重点,而海洋中药作为海洋生物资源这一“蓝色药库”的核心组成部分,存在巨大的开发潜力。目前我国海洋中药资源基础研究亟待加强,如在质量标准的建立等方面还较薄弱,这严重限制了其发展和应用。中药因其多成分、多靶点、安全性高、不良反应低、不易耐药等特性在肿瘤方面极具开发价值,在传统中医药理论中,肿瘤多归于“癥瘕”“积聚”,而现代研究下具有抗肿瘤作用的海洋中药如厚藤、海萝、海藻等兼有“消积散结”之功,这也与中医药传统理论相印证。本文通过综述具有抗肿瘤作用的海洋中药,发现清热解毒类、补虚类、化痰止咳平喘类、祛风湿类海洋中药占比较大,且其抗肿瘤药效物质以多肽、多糖类为主。海洋中药与传统陆地中药相比,其抗肿瘤化学物质差异较大,这可能是由于其长期处在一个高压、高盐、低温、低氧、低光照、低营养的特殊环境中,在生长繁殖、新陈代谢等方面具有显著的特异性。目前抗肿瘤海洋中药药效研究多局限于体外实验,在体内验证方面研究还较少,随着抗肿瘤海洋中药研究的深入,海洋中药成方制剂、保健食品、药膳食品、创新药物的开发价值和意义愈发重大。
目前,其在以下几个方面还有较大的开发潜力:通过古籍记载及相关药效和成分验证等方式来挖掘更多具有抗肿瘤潜力的海洋中药;通过“溯源-工艺-成分”一体化流程构建科学合理抗肿瘤中药的质量标准,为进一步提升药效奠定基础;通过更深层次的药理研究确定抗肿瘤海洋中药的具体药效物质及相关作用机制;通过严格的实验验证和安全性评价后,应用方剂配伍等方式发挥其临床价值。基于以上分析,拟构建抗肿瘤海洋中药具体研究思路见图1。海洋中药在抗肿瘤方面具有一定的研究潜力,因此在保护好这一“蓝色药库”的前提下,对其进行深层次的开发研究有着较大的现实意义。
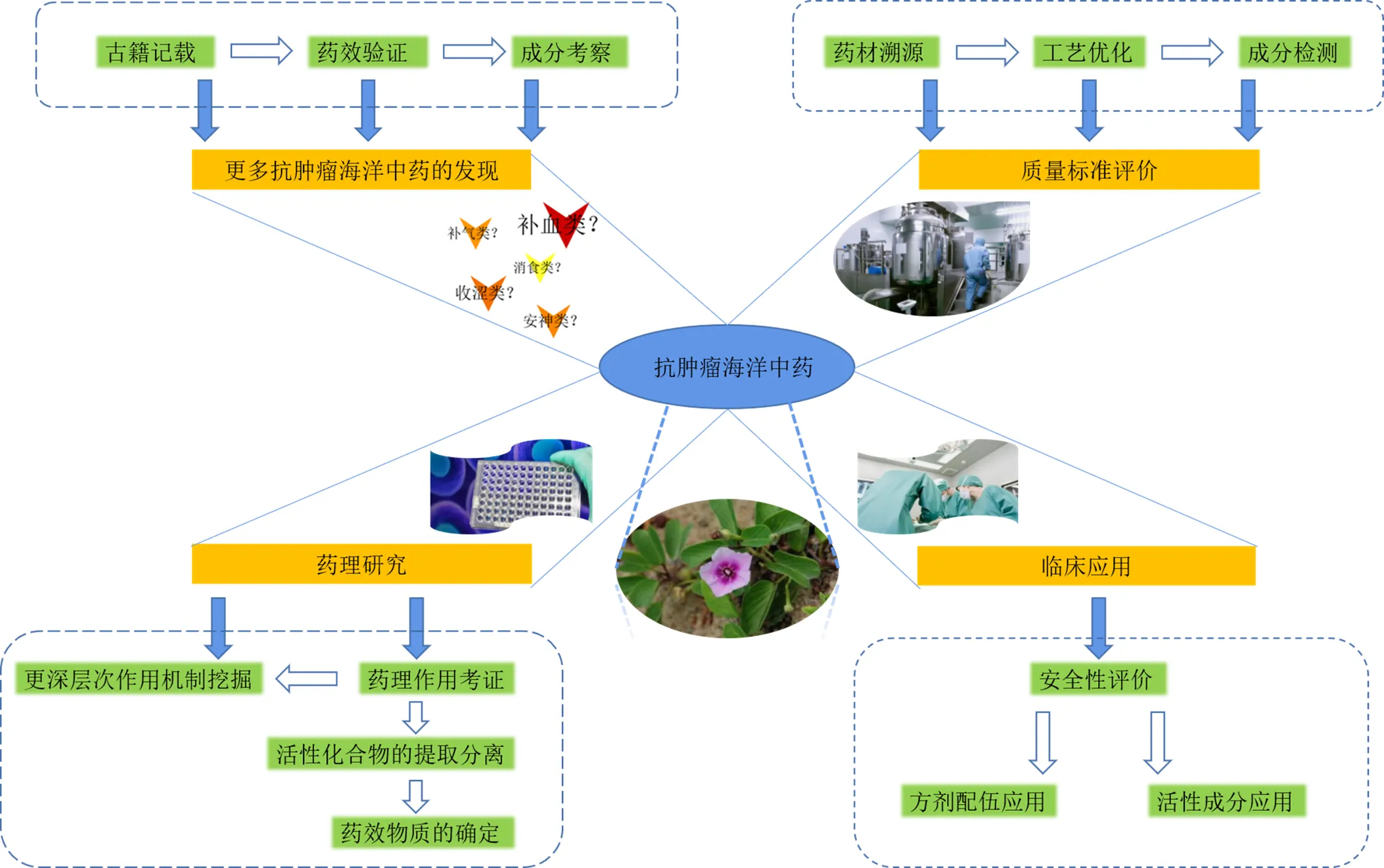
图1 抗肿瘤海洋中药研究思路
利益冲突 所有作者均声明不存在利益冲突
[1] 秦昆明, 史大华, 董自波, 等. 海洋中药资源综合开发利用现状与对策研究 [J]. 中草药, 2020, 51(19): 5093-5098.
[2] 邓家刚, 侯小涛, 郝二伟. 海洋中药学 [M]. 南宁: 广西科学技术出版社, 2018: 3-6.
[3] 李辉, 陈碧, 邹辉, 等. 蔓荆子总黄酮抑制肝细胞癌球形成与激活AMPK抑制AKT相关 [J]. 湖南师范大学学报: 医学版, 2016, 13(3): 5-7.
[4] 曹晓诚, 肖立红, 肖荞, 等. 蔓荆子总黄酮抑制NCI-H446细胞系肺癌干细胞自我更新 [J]. 中草药, 2014, 45(9): 1284-1287.
[5] 李遂新, 雷光焰, 马晓军, 等. 蔓荆子黄素对人非小细胞肺癌细胞H322的作用及机制研究 [J]. 现代肿瘤医学, 2020, 28(7): 1072-1076.
[6] 许刚, 张云锋, 孟磊, 等. 蔓荆子黄素抑制p53突变型人肺癌细胞生长及其机制研究 [J]. 西北药学杂志, 2016, 31(2): 161-164.
[7] Liu L P, Cao X C, Liu F,. Casticin induces breast cancer cell apoptosis by inhibiting the expression of forkhead box protein M1 [J]., 2014, 7(5): 1711-1717.
[8] 王海燕, 蔡兵, 崔承彬, 等. 蔓荆子活性成分vitexicarpin诱导K562细胞凋亡的机制 [J]. 药学学报, 2005, 40(1): 27-31.
[9] 卜鑫珏, 孙梅, 罗则华. 蔓荆子治疗肝癌的潜在作用机制研究 [J]. 现代医药卫生, 2021, 37(12): 2015-2019.
[10] Gong G, Shen Y L, Lan H Y,. The Cyr61 is a potential target for rotundifuran, a natural labdane-type diterpene fromL., to trigger apoptosis of cervical cancer cells [J]., 2021, 2021: 6677687.
[11] Dória G A, Menezes P P, Lima B S,.antitumor effect, induction of apoptosis and safety ofAubl. (Cyperaceae) extracts [J]., 2016, 23(9): 914-922.
[12] Dória G A, Santos A R, Bittencourt L S,. Redox-active profile characterization ofextracts and its cytotoxic effect in mouse fibroblasts (L929) and melanoma (B16F10) cells [J]., 2015, 20(7): 11699-11718.
[13] Huang C, Lu C K, Tu M C,. Polyphenol-richleaf extracts induce apoptosis in human breast and liver cancer cells and in a nude mouse xenograft model [J]., 2016, 7(24): 35874-35893.
[14] Esau L, Sagar S, Bajic V,. Autophagy inhibition enhances the mitochondrial-mediated apoptosis induced by mangrove () extract in human breast cancer cells [J]., 2015, 5(3): 304-317.
[15] Arumugam S, Bandil K, Proksch P,. Effects of a.marina-derived isoquercitrin on TNF-related apoptosis-inducing ligand receptor (TRAIL-R) expression and apoptosis induction in cervical cancer cells [J]., 2017, 182(2): 697-707.
[16] Albinhassan T H, Saleh K A, Barhoumi Z,. Anticancer, anti-proliferative activity ofplant extracts [J]., 2021, 17(4): 879-886.
[17] Eldohaji L M, Fayed B, Hamoda A M,. Potential targeting of Hep3B liver cancer cells by lupeol isolated from[J]., 2021, 354(9): e2100120.
[18] Varunkumar K, Anusha C, Saranya T,.engineered nanoparticles induce apoptosis in adenocarcinoma lung cancer cell line through p53 mediated signaling pathways [J]., 2020, 94: 349-358.
[19] Ark R, Grace.evaluation of antioxidant activity of methanolic extracts of selected mangrove plants [J]., 2016, 5(3): 1-5.
[20] Samarakoon S, Shanmuganathan C, Ediriweera M,. Screening of fifteen mangrove plants found in Sriforcytotoxic properties on breast (MCF-7) and hepatocellular carcinoma (HepG2) cells [J]., 2016, 14(4): 1-11.
[21] Uddin S J, Grice I D, Tiralongo E. Cytotoxic effects of Bangladeshi medicinal plant extracts [J]., 2011, 2011: 578092.
[22] 尚随胜. 红树林植物木榄化学成分及生物活性研究 [D]. 南宁: 广西医科大学, 2006.
[23] 谢蕾卉, 侯小涛, 邓家刚, 等. 木榄化学成分和药理活性研究进展 [J]. 中国实验方剂学杂志, 2018, 24(21): 225-234.
[24] Yasukawa K, Kitanaka S, Seo S. Inhibitory effect of stevioside on tumor promotion by 12--tetradecanoylphorbol-13-acetate in two-stage carcinogenesis in mouse skin [J]., 2002, 25(11): 1488-1490.
[25] 易湘茜, 高程海, 何碧娟, 等. 红树植物木榄胚轴中苯丙素类化学成分研究 [J]. 广西植物, 2013, 33(2): 191-194.
[26] 胡亚欧, 叶波平, 王大勇. 利用模式动物线虫进行木榄提取物3′,4′,5′-三羟基-7-羟基-5-甲氧基黄酮生物活性的评价研究 [J]. 中国海洋药物, 2007, 26(3): 20-26.
[27] Chacha M. Terpenoids from the roots ofinduces apoptosis through activation of caspase-3 enzyme [J]., 2011, 5(2): 402.
[28] Chacha M. Comparative anticancer activity of dolaborane diterpenes from the roots of(Rhizophoraceae) [J]., 2012, 6(2): 913-919.
[29] 宋修岐, 邢智远, 郭云良, 等. 角果木提取物Tagalsin对H22荷瘤小鼠Survivin和Caspase-3表达的影响 [J]. 中国临床研究, 2010, 23(9): 748-751.
[30] 王秀美, 姚如永, 孙蓓, 等. 角果木二萜Tagalsin的抗肿瘤作用 [J]. 山东医药, 2011, 51(1): 4-6.
[31] 郭允振, 宋修岐, 薛伟山, 等. 角果木提取物Tagalsin对小鼠艾氏腹水瘤抑制作用的研究 [J]. 齐鲁医学杂志, 2012, 27(2): 107-109.
[32] 彭兴, 龙盛京. 老鼠簕的化学成分和药理作用 [J]. 现代药物与临床, 2004, 19(6): 231-234.
[33] Souza R B, Frota A F, Silva J,.activities of kappa-carrageenan isolated from red marine alga: Antimicrobial, anticancer and neuroprotective potential [J]., 2018, 112: 1248-1256.
[34] Balamurugan M, Sivakumar K, Mariadoss A V,. Modulating effect of(red seaweed) on lipid peroxidation, antioxidants and biotransforming enzymes in 7,12-dimethylbenz (a) anthracene induced mammary carcinogenesis in experimental animals [J]., 2017, 9(1): 108-115.
[35] Taşkin E I, Akgün-Dar K, Kapucu A,. Apoptosis-inducing effects ofL. and doxorubicin on the Ehrlich ascites tumor in Balb-c mice [J]., 2009, 27(8): 542-546.
[36] Boontha S, Buranrat B, Pitaksuteepong T. Cytotoxic and antimigratory effects on Michigan cancer foundation-7 cells ofL. leaf extract and formulation of tablets from extract [J]., 2020, 12(1): 24.
[37] Liu X X, Liu F, Zhao S,. Purification of an acidic polysaccharide fromplant and its anti-tumor activity by activating mitochondrial pathway in MCF-7 cells [J]., 2019, 215: 99-107.
[38] Chen Y, Xu X, Hong S,. RGD-tachyplesin inhibits tumor growth [J]., 2001, 61(6): 2434-2438.
[39] 朱春芃. 紫海胆壳中化学成分的分离鉴定及其活性研究 [D]. 大连: 大连海洋大学, 2014.
[40] 李锐, 廖鹏运, 韩燃, 等. 蚯蚓纤溶酶的分离纯化及临床作用研究进展 [J]. 经济动物学报, 2012, 16(1): 38-42.
[41] 肖湘. 蚯蚓抗氧化酶抑瘤效果及诱导肿瘤细胞凋亡机理的研究 [D]. 长沙: 湖南农业大学, 2012.
[42] 于文静, 鞠吉雨, 初金鑫, 等. 海蚯蚓蛋白酶基因的原核表达及其抗肿瘤活性 [J]. 中国生物制品学杂志, 2015, 28(5): 488-492.
[43] Manigauha A, Kharya M D, Ganesh N.antitumor potential ofpes-caprae on melanoma cancer [J]., 2015, 11(42): 426-433.
[44] Yu B W, Luo J G, Wang J S,. Pentasaccharide resin glycosides frompes-caprae [J]., 2011, 74(4): 620-628.
[45] Park S Y, Jung B M, Choi Y H,. Growth inhibition effects of cancer cell lines byfractions[J]., 2005, 34(6): 771-775.
[46] Bae S J, Choi Y H. Methanol extract of the seaweedinduces G2/M arrest and inhibits cyclooxygenase-2 activity in human hepatocarcinoma HepG2 cells [J]., 2007, 21(1): 52-57.
[47] Shao P, Chen X X, Sun P L.antioxidant and antitumor activities of different sulfated polysaccharides isolated from three algae [J]., 2013, 62: 155-161.
[48] 马宁宁. 匍匐滨藜的化学成分及其药理活性研究 [D]. 海口: 海南师范大学, 2013.
[49] 刘亮, 曹少谦, 刘合生, 等. 鱿鱼墨黑色素提取物对肿瘤细胞的抑制作用 [J]. 核农学报, 2017, 31(10): 1972-1978.
[50] Shahidi S, Jamili S, Ghavam Mostafavi P,. Assessment of the inhibitory effects of ficin-hydrolyzed gelatin derived from squid () on breast cancer cell lines and animal model [J]., 2018, 17(5): 436-452.
[51] Karthikeyan R, Karthigayan S, Balasubashini M S,. Inhibition of Hep2 and HeLa cell proliferationand EAC tumor growthby(Shaw 1802) venom [J]., 2008, 51(1): 157-161.
[52] Zhou Y Y, Li X Y, Morita Y,. Identification of the effects of chondroitin sulfate on inhibiting CDKs in colorectal cancer based on bioinformatic analysis and experimental validation [J]., 2021, 11: 705939.
[53] Oo H Z, Lohinai Z, Khazamipour N,. Oncofetal chondroitin sulfate is a highly expressed therapeutic target in non-small cell lung cancer [J]., 2021, 13(17): 4489.
[54] Ren Q, Wang J, Liu C,. Exploring the sulfate patterns of chondroitin sulfate/dermatan sulfate and keratan sulfate in human pancreatic cancer [J]., 2021, 205: 114339.
[55] Wu R Y, Shen Q, Li G Y,. The regulatory network of sturgeon chondroitin sulfate on colorectal cancer inhibition by transcriptomic and proteomic analysis [J]., 2021, 22(17): 9395.
[56] Tan T T, Yang Q, Chen D,. Chondroitin sulfate-mediated albumin corona nanoparticles for the treatment of breast cancer [J]., 2021, 16(4): 508-518.
[57] Biskup K, Stellmach C, Braicu E I,. Chondroitin sulfate disaccharides, a serum marker for primary serous epithelial ovarian cancer [J]., 2021, 11(7): 1143.
[58] Lou H P, Gao Y F, Zhai M X,. A novel peptide from alpha5 helix ofcyclin B conjugated to HIV-Tat49-57with cytotoxic and apoptotic effects against human cancer cells [J]., 2008, 18(16): 4633-4637.
[59] Malyarenko O S, Malyarenko T V, Kicha A A,. Effects of polar steroids from the starfish()in combination with X-ray radiation on colony formation and apoptosis induction of human colorectal carcinoma cells [J]., 2019, 24(17): E3154.
[60] Zhang W, Oda T, Yu Q,. Fucoidan fromhas powerful immune-modulatory effects compared to three other fucoidans [J]., 2015, 13(3): 1084-1104.
[61] Dilshara M G, Jayasooriya R G, Kang C H,. Methanol extract ofinhibits tumor necrosis factor-α-induced matrix metalloproteinase-9 and invasiveness of MDA-MB-231 cells by suppressing nuclear factor-κB activation [J]., 2016, 9(6): 535-541.
[62] Park S H, Kim J L, Jeong S,.F2sensitize colorectal cancer cells to TRAIL-induced apoptosis via c-FLIP ubiquitination [J]., 2019, 508(1): 1-8.
[63] Trianto A, Andriyas Y, Ridlo A,. The ethanolic extracts the Gorgonianinhibited the induced mammary carcinoma growth in C3H mice [J].:, 2018, 116: 012104.
[64] 索金良. 4-硒(代)硫酸酯多糖的抗肿瘤免疫调节作用及其机制研究 [J]. 生理科学进展, 1996, 27(1): 43-46.
[65] 师然新, 徐祖洪, 李智恩. 降解的角叉菜多糖的抗肿瘤活性 [J]. 海洋与湖沼, 2000, 31(6): 653-656.
[66] Luo M, Shao B, Nie W,. Antitumor and adjuvant activity of λ-carrageenan by stimulating immune response in cancer immunotherapy [J]., 2015, 5: 11062.
[67] Li J Y, Aipire A, Li J Y,. Λ-Carrageenan improves the antitumor effect of dendritic cellbased vaccine [J]., 2017, 8(18): 29996-30007.
[68] Chang L C, Gills J J, Bhat K P,. Activity-guided isolation of constituents ofwith antiproliferative and antiestrogenic activities [J]., 2000, 10(21): 2431-2434.
[69] Laphookhieo S, Cheenpracha S, Karalai C,. Cytotoxic cardenolide glycoside from the seeds of[J]., 2004, 65(4): 507-510.
[70] 冯波. 海芒果种子提取物对人肝癌HepG2细胞增殖、周期和凋亡的影响及其作用机制 [D]. 上海: 第二军医大学, 2009.
[71] Tsai J C, Liu W S, Tseng Y T,. Extracts ofL. effectively inhibit the viability of glioblastoma cell lines and their cancer stemloidsand in mouse xenograft model [J]., 2018, 48: 283-296.
[72] Huang F F, Yang Z S, Yu D,.ink oligopeptide induces apoptosis in prostate cancer cell lines via caspase-3 activation and elevation of Bax/Bcl-2 ratio [J]., 2012, 10(10): 2153-2165.
[73] Zhang Z, Sun L, Zhou G R,. Sepia ink oligopeptide induces apoptosis and growth inhibition in human lung cancer cells [J]., 2017, 8(14): 23202-23212.
[74] Wang X H, Chen C, Zhou G R,. Sepia ink oligopeptide induces apoptosis of lung cancer cells via mitochondrial pathway [J]., 2018, 45(5): 2095-2106.
[75] 景奕文, 杨最素, 黄芳芳, 等. 乌贼墨多肽诱导人前列腺癌DU-145细胞凋亡的机制研究 [J]. 现代食品科技, 2014, 30(9): 1-6.
[76] Liu H Z, Xiao W, Gu Y P,. Polysaccharide fromink and cisplatin inhibit synergistically proliferation and metastasis of triple-negative breast cancer MDA-MB-231 cells [J]., 2016, 19(12): 1292-1298.
[77] Huang F F, Jing Y W, Ding G F,. Isolation and purification of novel peptides derived from sepia ink: Effects on apoptosis of prostate cancer cell PC‑3 [J]., 2017, 16(4): 4222-4228.
[78] 牛荣丽, 范晓, 韩丽君, 等. 海藻抗A-549和HL-60肿瘤细胞及抗菌活性研究 [J]. 中国海洋药物, 2003, 22(4): 1-4.
[79] Chen Y H, Tu C J, Wu H T. Growth-inhibitory effects of the red algaon cultured cells [J]., 2004, 27(2): 180-184.
[80] 蔡海莹. 石花菜提取物对宫颈癌细胞凋亡及Caspase-3活性的影响 [J]. 广东医学, 2011, 32(18): 2388-2389.
[81] Einbond L S, Negrin A, Kulakowski D M,. Traditional preparations of kava () inhibit the growth of human colon cancer cells[J]., 2017, 24: 1-13.
[82] Ruan B F, Ge W W, Lin M X,. A review of the components of seaweeds as potential candidates in cancer therapy [J]., 2018, 18(3): 354-366.
[83] Lee H, Kim J S, Kim E. Fucoidan from seaweedinhibits migration and invasion of human lung cancer cell via PI3K-Akt-mTOR pathways [J]., 2012, 7(11): e50624.
[84] Wang C C, Yatsuya H, Li Y Y,. Prospective study of seaweed consumption and thyroid cancer incidence in women: The Japan collaborative cohort study [J]., 2016, 25(3): 239-245.
[85] Wu S Y, Wu A T H, Yuan K S P,. Brown seaweed fucoidan inhibits cancer progression by dual regulation of mir-29c/ADAM12 and miR-17-5p/PTEN axes in human breast cancer cells [J]., 2016, 7(15): 2408-2419.
[86] Vaikundamoorthy R, Krishnamoorthy V, Vilwanathan R,. Structural characterization and anticancer activity (MCF-7 and MDA-MB-231) of polysaccharides fractionated from brown seaweed[J]., 2018, 111: 1229-1237.
[87] Ghannam A, Murad H, Jazzara M,. Isolation, Structural characterization, and antiproliferative activity of phycocolloids from the red seaweedon MCF-7 human breast cancer cells [J]., 2018, 108: 916-926.
[88] Yun E J, Yu S, Kim Y A,.prebiotic and anti-colon cancer activities of agar-derived sugars from red seaweeds [J]., 2021, 19(4): 213.
[89] Moga M A, Dima L, Balan A,. Are bioactive molecules from seaweeds a novel and challenging option for the prevention of HPV infection and cervical cancer therapy? -A review [J]., 2021, 22(2): E629.
[90] Méresse S, Fodil M, Fleury F,. Fucoxanthin, a marine-derived carotenoid from brown seaweeds and microalgae: A promising bioactive compound for cancer therapy [J]., 2020, 21(23): E9273.
[91] Santos S, Ferreira T, Almeida J,. Dietary supplementation with the red seaweedprotects against DNA damage and pre-malignant dysplastic skin lesions in HPV-transgenic mice [J]., 2019, 17(11): E615.
[92] 徐戎. 昆布有效成分岩藻黄质对人非小细胞肺癌的生长抑制作用及其机制研究 [D]. 武汉: 华中科技大学, 2010.
[93] 邹明畅, 崔飞伦, 盛玉清, 等. 昆布多糖硫酸酯对非激素依赖型人前列腺癌细胞PC-3的作用研究 [J]. 现代中药研究与实践, 2010, 24(1): 33-36.
[94] 汲晨锋, 孟德友, 季宇彬. 昆布多糖硫酸酯的制备及抗肿瘤活性研究 [J]. 中国海洋药物, 2013, 32(2): 1-6.
[95] 贾文芳. 海藻昆布汤治疗子宫肌瘤34例 [J]. 现代中医药, 2006, 26(6): 7-8.
[96] 褚耀军, 苏爱香, 郭亦鹏. 中西医结合治疗癌症16例 [J]. 内蒙古中医药, 2013, 32(16): 60.
[97] Song L Y, Ren S F, Yu R M,. Purification, characterization andanti-tumor activity of proteins fromsubcrenata Lischke [J]., 2008, 6(3): 418-430.
[98] Choi H J, Seo Y W, Lim S Y. Effect of solvent extracts fromon inhibition of growth of human cancer cell lines and antioxidant activity [J]., 2007, 17(11): 1533-1538.
[99] Firdaus M, Setijawati D, Islam I,. The reducibility of heLa cell viability byextracts [J]., 2018, 137(1): 12064.
[100] Palanisamy S, Vinosha M, Manikandakrishnan M,. Investigation of antioxidant and anticancer potential of fucoidan from[J]., 2018, 116: 151-161.
[101] Fernando I P S, Sanjeewa K K A, Lee H G,. Fucoidan purified frominduces apoptosis through mitochondria-mediated pathway in HL-60 and MCF-7 cells [J]., 2020, 18(4): E196.
[102] Jiang W T, Fu Y T, Yang F,.lemaneiformis polysaccharide as integrin-targeting surface decorator of selenium nanoparticles to achieve enhanced anticancer efficacy [J]., 2014, 6(16): 13738-13748.
[103] 康亚妮, 陆俊, 徐晓婷, 等. 龙须菜多糖对肺癌细胞增殖能力及形态的影响 [J]. 水产学报, 2015, 39(9): 1405-1411.
[104] Ying J, Tang Z H, Zhao G N,. Transcriptionomic study on apoptosis of SKOV-3 cells induced by phycoerythrin fromlemaneiformis [J]., 2021, 21(10): 1240-1249.
[105] Arsianti A A, Fadilah F, Suid K,. Phytochemical composition and anticancer activity of seaweedsandagainst breast mcf-7 and colon hct-116 cells [J]., 2016, 9(6): 115.
[106] Sugahara T, Ohama Y, Fukuda A,. The cytotoxic effect of(ESA) on cancer cells and its application to molecular probe for drug delivery system using lipid vesicles [J]., 2001, 36(1/2/3): 93-99.
[107] Omokawa Y, Miyazaki T, Walde P,.andanti-tumor effects of novel Span 80 vesicles containing immobilizedserra agglutinin [J]., 2010, 389(1/2): 157-167.
[108] 刘玥, 江振友, 施珊珊, 等. 硒化麒麟菜多糖对宫颈癌细胞株生长和凋亡的影响 [J]. 暨南大学学报: 医学版, 2007, 28(6): 546-549.
[109] Tang J, Kong Z, Liu D,. Polysaccharide fromgelatinae enhance immunocompetence against murine H22 tumor[J]., 2014, 989-994: 1056-1059.
[110] Patil R C, Manohar S M, Katchi V I,. Ethanolic stem extract ofinduces G1arrest or apoptosis in human lung cancer cells depending on their P53 status [J]., 2012, 57(2): 89-98.
[111] Hari R, Kumar Reddy P, Durairaj P,. Effect of ethanolic extract ofleaves on the cytotoxic activity and cell cycle arrest of human breast cancer cell lines-MCF-7 [J]., 2019, 15(64): 346.
[112] Bhuvaneswari R, Xavier R J, Arumugam M. Facile synthesis of multifunctional silver nanoparticles using mangrove plantL. for its antibacterial, antioxidant and cytotoxic effects [J]., 2017, 41(1): 180-187.
[113] 武美彤, 张海欣, 张梦, 等. 牡蛎酶解物对Lewis肺癌的抑制作用及机制 [J]. 食品与发酵工业, 2020, 46(11): 98-104.
[114] 盛晓波, 赵强. 牡蛎莪术汤治疗子宫肌瘤46例 [J]. 浙江中医杂志, 2004, 39(3): 113.
[115] 潘琳, 殷东风, 高宏, 等. 生脉散合牡蛎散加减治疗晚期恶性肿瘤盗汗32例疗效观察 [J]. 实用中医内科杂志, 2011, 25(11): 83-84.
[116] Corporeau C, Huvet A, Pichereau V,., une huître au service de la recherche sur le cancer [J]., 2019, 35(5): 463-466.
[117] 陈超, 饶娅琦. 肝纤克对实验性肝损伤及肝纤维化的干预作用 [J]. 中国临床康复, 2006, 10(3): 96-98.
[118] 白广德. 中医及中西医结合治疗原发性中晚期肝癌的研究进展 [J]. 辽宁中医药大学学报, 2008, 10(3): 148-151.
[119] 李鹏, 单宇鹏, 齐海燕. 陈光伟治疗癌性发热的经验 [J]. 现代中医药, 2008, 28(1): 11-12.
[120] Xu Y Z, Ryu S, Lee Y K,. Brassicasterol from edible aquaculturalexerts an anti-cancer effect by dual-targeting AKT and AR signaling in prostate cancer [J]., 2020, 8(9): E370.
[121] 张朝晖, 倪庆桂, 吴立云, 等. 粗吻海龙抗肿瘤作用的研究 [J]. 中国海洋药物, 1998, 17(4): 10-12.
[122] 王梦月, 秦孙星, 张朝晖, 等. 粗吻海龙抗肿瘤活性部位研究 [J]. 中草药, 2007, 38(5): 673-675.
[123] 何芬, 马旭东, 王梦月, 等. 粗吻海龙蛋白质组分体外抗肿瘤活性的研究 [J]. 中国药学杂志, 2008, 43(12): 903-906.
[124] 陈玉芹, 李春香, 石洪凌, 等. 尖海龙几种不同提取物抗癌作用的比较 [J]. 医学动物防制, 2002, 18(7): 352-354.
[125] 孙康, 陈勉, 刘霞, 等. 海龙的抗肿瘤生物活性成分研究现状 [J]. 食品与药品, 2016, 18(2): 145-149.
[126] Zhao Y, Zhang D H, Wang S,. Holothurian glycosaminoglycan inhibits metastasis and thrombosis via targeting of nuclear factor-κB/tissue factor/Factor Xa pathway in melanoma B16F10 cells [J]., 2013, 8(2): e56557.
[127] Qian W H, Tao L, Wang Y Y,. Downregulation of integrins in cancer cells and anti-platelet properties are involved in holothurian glycosaminoglycan-mediated disruption of the interaction of cancer cells and platelets in hematogenous metastasis [J]., 2015, 52(3): 197-209.
[128] Yue Z Q, Wang A Y, Zhu Z J,. Holothurian glycosaminoglycan inhibits metastasis via inhibition of P-selectin in B16F10 melanoma cells [J]., 2015, 410(1/2): 143-154.
[129] Mou J J, Wu Y, Bi M J,. Polyanionic holothurian glycosaminoglycans-doxorubicin nano complex as a delivery system for anticancer drugs [J]., 2018, 167: 364-369.
[130] Herédi-Szabó K, Lubke J, Toth G,. Importance of the central region of lamprey gonadotropin-releasing hormone III in the inhibition of breast cancer cell growth [J]., 2005, 26(3): 419-422.
[131] Herédi-Szabó K, Murphy R F, Lovas S. Different signal responses to lamprey GnRH-III in human cancer cells [J]., 2006, 12(4): 359-364.
[132] 梁宏芳. 重组七鳃鳗LIP对肿瘤细胞杀伤机制: 基于胞内信号通路研究[D]. 大连: 辽宁师范大学, 2016.
[133] Song X P, Xu X T, Lu J L,. Lamprey immune protein mediates apoptosis of lung cancer cells via the endoplasmic reticulum stress signaling pathway [J]., 2021, 11: 663600.
[134] 郑国兴, 范成成, 康劲翮, 等. 文蛤多肽粉对人肝癌细胞SMMC-7721的抑制作用及免疫调节作用 [J]. 厦门大学学报: 自然科学版, 2008, 47(S2): 135-137.
[135] 张剑, 康劲翮, 刘凤娇, 等. 文蛤多肽对体外培养宫颈癌Hela细胞的抑制作用 [J]. 厦门大学学报: 自然科学版, 2009, 48(5): 729-732.
[136] Ning X X, Zhao J M, Zhang Y Y,. A novel anti-tumor protein extracted fromLinnaeus induces cell death by increasing cell permeability and inhibiting tubulin polymerization [J]., 2009, 35(4): 805-812.
[137] Liu M, Zhao X Z, Zhao J,. Induction of apoptosis, G₀/G₁ phase arrest and microtubule disassembly in K562 leukemia cells by Mere15, a novel polypeptide fromLinnaeus [J]., 2012, 10(11): 2596-2607.
[138] Wang H, Wei J T, Wu N,. Mere15, a novel polypeptide from, inhibits adhesion, migration and invasion of human lung cancer A549 cells via down-regulating MMPs [J]., 2013, 51(2): 145-151.
[139] Xu B T, Guo M Y, Ma L,. Mere15, a novel polypeptide from, inhibits proliferation and metastasis of human non-small cell lung cancer cells through regulating the PI3K/Akt/mTOR signaling pathway [J]., 2021, 68(6): 1181-1189.
[140] Kim E K. Effect of partially purified lipid from the musselon apoptosis in cancer cells [J]., 2011, 54(1): 59-65.
[141] Wikarta J M, Kim S M. Nitric oxide synthesis inhibition and cytotoxicity of Korean horse musselextracts on cancer cells in culture [J]., 2016, 68(4): 879-890.
[142] Terada D, Kawai F, Noguchi H,. Crystal structure of MytiLec, a galactose-binding lectin from the musselwith cytotoxicity against certain cancer cell types [J]., 2016, 6: 28344.
[143] 廖铭能, 于立坚, 马润娣, 等. 赤魟组织粗提物的抗肿瘤作用 [J]. 广东海洋大学学报, 2008, 28(1): 53-56.
[144] Lee C, Chun W, Zhao R J,. Anticancer effects of an extract from the scallopon MCF-7 human breast carcinoma cells [J]., 2017, 14(2): 2207-2217.
[145] Lin H L, Li Z Y, Chen B,. Anti-tumor activity of the peptide from[J]., 2012, 2(3): 19-22.
[146] Ma J Y, Huang F F, Lin H L,. Isolation and purification of a peptide fromand its impaction of apoptosis on prostate cancer cell [J]., 2013, 11(1): 266-273.
[147] Zhang D H, Wu H X, Xia Z M,. Partial characterization, antioxidant and antitumor activities of three sulfated polysaccharides purified from[J]., 2012, 4(4): 784-792.
[148] 史大永, 韩丽君, 贺娟, 等. 松节藻抗肿瘤活性 [J]. 中草药, 2005, 36(2): 229-233.
[149] Ma M, Zhao J L, Wang S J,. Bromophenols coupled with methyl gamma-ureidobutyrate and bromophenol sulfates from the red alga[J]., 2006, 69(2): 206-210.
[150] Wang S, Wang L J, Jiang B,. Anti-angiogenic properties of BDDPM, a bromophenol from marine red alga, with multi receptor tyrosine kinase inhibition effects [J]., 2015, 16(6): 13548-13560.
Marine traditional Chinese medicine with antitumor effects
LI Ze-yu1, 2, HAO Er-wei1, 2, LI Hui3, WANG Jia-yu3, LI Xin-xin4, CAO-Rui1, 2, ZHUANG Pei-jun1, 2, XIAO Qian1, 2, WEI Liu-yi1, 2, DU Zheng-cai1, 2, HOU Xiao-tao1, 2, DENG Jia-gang1, 2
1. China-ASEAN Joint Laboratory for International Cooperation in Traditional Medicine Research, Guangxi University of Chinese Medicine, Nanning 530200, China 2. Institute of Marine Medicine, Guangxi University of Traditional Chinese Medicine, Nanning 530000, China 3. Wangjing Hospital, Chinese Academy of Traditional Chinese Medicine, Beijing 100102, China 4. Beijing Longfu Hospital, Beijing 100010, China
Marine traditional Chinese medicine (TCM) has a long history of application, and is an important part of marine biological resources and TCM research. Tumor has always been a major challenge for mankind. The problems of large adverse reactions and easy drug resistance to chemotherapeutic drugs are becoming increasingly prominent. Modern research has confirmed that a variety of marine TCMs have significant antitumor effects and great development potential. Therefore, it is significant to screen appropriate antitumor drugs from this field. In this paper, through the literature mining of 250 classical marine TCM recorded in “”, it is found that 47 kinds of antitumor effects have been verified, the proportion of marine TCMs such as heat clearing and toxin removing classes, tonify deficiency classes, resolving phlegm and relieving cough and asthma classes, and dispel rheumatism classes are relatively large, and their pharmacodynamic substances are mainly peptides and polysaccharides. The review of marine TCM with the anti-tumor effects will provide some reference significance and ideas and methods for the deeper anti-tumor research of marine TCM.
marine traditional Chinese medicine; antitumor; polypeptide; polysaccharide; heat-clearing and toxin-removing classes; tonify deficiency classes; resolving phlegm and relieving cough and asthma classes; dispel rheumatism classes
R282.710.5
A
0253 - 2670(2022)14 - 4527 - 18
10.7501/j.issn.0253-2670.2022.14.031
2022-02-05
中国-东盟传统药物研究国际合作联合实验室建设(二期)新中心建设项目(CICAR2017-Z1);广西科技基地和人才专项(桂科AD191101553);广西创新驱动重大专项(桂科AA181180492);广西创新驱动重大专项(桂科AA192540334)
李泽宇(1998—),男,硕士研究生,研究方向为中药理论与药效筛选。E-mail:937748197@qq.com
邓家刚,博士生导师,教授,研究方向为中药理论与药效筛选。E-mail: dengjg53@126.com
侯小涛,博士生导师,教授,研究方向为中药活性成分与质量控制。E-mail: xthou@126.com
#共同第一作者:郝二伟,博士,研究员,研究方向为中药基础理论与药效筛选。E-mail: 516110493@qq.com
[责任编辑 崔艳丽]
