基于网络药理学及实验验证探究芪苈强心胶囊治疗射血分数保留型心衰的作用机制
2022-07-21郝佳梦常丽萍周璐恒侯云龙
郝佳梦,常丽萍,王 璐,刘 焕,陈 檬,侯 斌, 4,周璐恒,侯云龙, *
基于网络药理学及实验验证探究芪苈强心胶囊治疗射血分数保留型心衰的作用机制
郝佳梦1, 2,常丽萍4, 5,王 璐3, 5,刘 焕3,陈 檬3, 5,侯 斌3, 4,周璐恒3,侯云龙1, 2, 3*
1. 河北医科大学,河北 石家庄 050017 2. 河北以岭医院 国家中医药管理局重点研究室(心脑血管络病),河北 石家庄 050023 3. 石家庄以岭药业股份有限公司,河北 石家庄 050023 4. 络病研究与创新中药国家重点实验室,河北 石家庄 050023 5. 河北省络病重点实验室,河北 石家庄 050023
基于网络药理学及实验验证探讨芪苈强心胶囊治疗射血分数保留型心衰(heart failure with preserved ejection fraction,HFpEF)的作用机制。将44个明确鉴定的芪苈强心胶囊体内代谢物检识有效成分,利用Swisstargetprediction、pharmmapper平台预测化合物靶点,OMIM、DisGenet、GenCard数据库中检索HFpEF疾病靶点;取交集靶点,利用String数据库和Cytoscape 3.7.2软件进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)和拓扑分析;Metescape平台对共同靶点进行基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。构建醋酸脱氧皮质酮(deoxycorticosterone acetate,DOCA)盐敏感型HFpEF大鼠模型,给予沙库巴曲缬沙坦或芪苈强心胶囊进行干预,给药8周后,利用小动物超声成像系统、ELISA、免疫荧光、Western blotting、qRT-PCR方法进行药效学评估和环磷酸鸟苷(cyclic guanosinc monophosphate,cGMP)-蛋白激酶G1(protein kinase G1,PKG1)信号通路相关靶点验证。芪苈强心胶囊有效成分和HFpEF分别筛选出38个相同作用靶点;GO功能及KEGG通路富集分析得出其在血液循环、循环系统、心脏收缩等生物过程,膜筏、轴突、细胞质区等细胞成分,α-葡萄糖苷酶活性、内肽酶活性、水解酶活性等分子功能上起作用,涉及cGMP-PKG信号通路、肾素分泌、钙信号通路等。体内实验证实芪苈强心能够提高HFpEF大鼠射血分数,降低室壁肥厚程度,缩短等容舒张时间(isovolumic relaxation time,IVRT),提升左室舒张期充盈速度比值(<0.05);提高血清一氧化氮(nitric oxide,NO)、cGMP水平(<0.05);增强心肌组织内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)荧光表达(<0.05、0.01);增加eNOS、PKG1、心肌肌浆网Ca2+-ATP酶(sarco/endoplasmic reticulum Ca2+-ATPase,SERCA)、可溶性鸟苷酸环化酶α(soluble guanylate cyclase α,sGCα)蛋白表达水平(<0.05、0.01),降低cGMP特异性磷酸二酯酶5A(cGMP-specific phosphodiesterase 5A,PDE5A)蛋白表达水平(<0.05);减少心肌组织B型脑钠肽(B-type brain natriuretic peptide,)、β-肌球蛋白重链(myosin heavy chain β,)的mRNA表达(<0.05)。芪苈强心胶囊可通过成分-多靶点-多环节发挥HFpEF的治疗作用,其机制与调节cGMP-PKG信号通路有关。
网络药理学;芪苈强心胶囊;射血分数保留型心衰;内皮功能;脉络学说;环磷酸鸟苷-蛋白激酶G1通路
射血分数保留型心衰(heart failure with preserved ejection fraction,HFpEF)是指左室射血分数≥50%的心力衰竭,特征是左室等容舒张延长、左室僵硬度增加、左室舒张末压增加和左室充盈缓慢[1]。HFpEF是一个具有高发病率和高死亡率的紧迫临床事件[2],已经成为一个主要的公共健康问题,其患病率现在已经超过了射血分数降低型心衰(heart failure with reduced ejection fraction,HFrEF)[3]。HFpEF患者的预后较差[4],到目前为止,没有任何治疗显示可以有效降低其发病率或死亡率[5],成为国际医学研究的难点和热点。
内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)/一氧化氮(nitric oxide,NO)/环磷酸鸟苷(cyclic guanosinc monophosphate,cGMP)/蛋白激酶G1(protein kinase G1,PKG1)通路在防止心肌损伤、心室重塑和心肾综合征方面起着重要作用[6],该通路的损伤是HFpEF的病理生理学基础。cGMP及其主要靶激酶PKG是公认的心脏功能和慢性应激反应的调节剂,介导NO和利钠肽的生理功能,在心血管系统的维持中发挥重要功能:它们的增强能够引起心肌制动,减少不适应性肥大,增强细胞存活信号和线粒体功能,防止缺血/再灌注损伤,并减弱儿茶酚胺的刺激作用[7-8]。激活cGMP/PKG信号通路已成为治疗心力衰竭的有效治疗策略[9],可能成为HFpEF治疗的一个新靶点[10]。
中医脉络学说理论指导下研制的芪苈强心胶囊是治疗慢性心衰的代表中成药,循证医学研究证实其治疗慢性心力衰竭的安全性及有效性[11-12]。前期临床研究报道芪苈强心胶囊对HFpEF患者临床症状和中医证候评分、明尼苏达心力衰竭生活质量量表(MLHFQ)评分、6 min步行试验(6WMT),E/E’值、左房容积指数(LAVI)、左室舒张期充盈速度比值(E/A)均有明显改善,提高患者的生活质量[13]。芪苈强心胶囊是首个进入《舒张性心力衰竭诊断和治疗专家共识》的中成药[14],然而其治疗HFpEF的基础研究及机制探讨尚未完全开展。本研究基于网络药理学方法[15]对芪苈强心治疗HFpEF的关键靶点和信号通路预测,采用醋酸脱氧皮质酮(deoxycorticosterone acetate,DOCA)-盐敏感性高血压大鼠建立HFpEF模型,通过体内实验验证网络药理学的预测结果,以探索芪苈强心胶囊治疗HFpEF可能的作用机制。
1 材料
1.1 动物
SPF级雄性SD大鼠50只,6周龄,体质量(200±10)g,购自北京维通利华实验动物技术有限公司,合格证号SCXK2016-0006。饲养于屏障环境内,12 h明暗循环光照,湿度(50±10)%,温度(23±2)℃,自由进食饮水,适应性喂养1周。动物实验由河北以岭医药研究院动物伦理委员会负责批准(批准号2021024)。
1.2 药品与试剂
芪苈强心胶囊(批号S-130901)购自石家庄以岭药业股份有限公司,利用UPLC-Q-TOF/MSE技术[16]从芪苈强心胶囊中鉴定了40个化合物,其中黄酮类化合物3种,人参皂苷类化合物19种,C21甾糖苷类化合物7种,黄芪皂苷类化合物7种,以及丹酚酸类2种,二萜醌类2种;沙库巴曲缬沙坦钠片(批号J20190001,50 mg/片)购自北京诺华制药有限公司;醋酸去氧皮质酮(批号D129628)、氯化钠(批号WXBD3635V)购自上海阿拉丁生化科技股份有限公司;NO测定试剂盒(A013-2-1)购自南京建成;cGMP ELISA试剂盒(E-EL-0083c)购自Elabscience;eNOS、CD31、cGMP特异性磷酸二酯酶5A(cGMP-specific phosphodiesterase 5A,PDE5A)兔抗(批号分别为GB12086、GB11063-2、GB111522)购自武汉赛维尔生物科技有限公司;可溶性鸟苷酸环化酶α(soluble guanylate cyclase α,sGCα)抗体(批号bs-13544R)购自Bioss公司;肌浆网Ca2+-ATP酶(sarco/endoplasmic reticulum calcium ATPase,SERCA2)抗体(批号ab150435)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号ab181602)、羊抗兔二抗IgG-H&L Alexa Fluor®488(批号ab150077)、羊抗兔二抗IgG-H&L Alexa Fluor®594(批号ab150080)、羊抗兔二抗IgG-H&L IRDye®800CW(批号ab216773)、羊抗兔二抗IgG-H&L IRDye®680RD(批号ab216777)购自英国Abcam公司;总RNA提取试剂盒、反转录试剂盒购自日本Takara公司。
1.3 仪器
Vevo 3100LT型小动物超声(加拿大FUJIFILM公司);RM2235型组织切片染色机(日本Sakura公司);SynergyH4型多功能酶标仪(美国Bio Tek公司);Trans-Blot SD型半干电转膜仪、C1000型反转录热循环仪(美国Bio-Rad公司);Oddessy型双色红外激光扫膜仪(美国LI-COR公司);LSM710型激光共聚焦显微镜(德国ZEISS公司);7900HT型实时荧光定量PCR仪(美国ABI公司)。
2 方法
2.1 网络药理学预测芪苈强心胶囊治疗HFpEF的作用机制
2.1.1 芪苈强心胶囊主要活性成分靶点预测 本课题组前期对芪苈强心胶囊11味药材通过自建化合物数据库完成对其化学成分的全面检识,共发现包括黄酮、生物碱、皂苷等在内的多种化合物,通过大鼠体内代谢物检识,其中44个化合物利用对照品进行了确认[17]。将这44个活性成分,分别输入PubChem平台(https://pubchem.ncbi.nlm.nih.gov)保存化合物的mol2结构,未查询到的根据文献检索确定其化合物结构,在Swisstargetprediction(http://www.swisstargetprediction.ch)和Pharmmapper(http://www.lilab-ecust.cn/pharmmapper)平台中上传化合物结构图,搜索的输入格式为Homo sapiens[organism],得到相应预测靶点。
2.1.2 HFpEF疾病相关靶点信息 在OMIM(https://omim.org/)、DisGeNET(https://www. disgenet.org/)、GenCard(https://www.genecards.org/)数据库中检索“射血分数保留型心衰”“HFpEF”“射血分数保留型心衰”“舒张性心衰”的疾病相关靶点,去除重复值。应用R软件将得到的疾病靶点和筛选出的药物活性成分及潜在靶点进行比较,得到二者共同靶点并制作韦恩图,得到药物和疾病共同靶点。
2.1.3 芪苈强心胶囊-HFpEF蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建 在String(https://string-db.org/)数据库导入共同基因数据,选择“homo sapiens”物种,将medium confidence(0.7)设置为最低相互作用分数,其余参数默认,导出PPI网络图和TSV文件。利用Cytoscape 3.7.2软件构建PPI拓扑网络。
2.1.4 基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 运用Metescape(https://metascape.org)平台对38个活性成分和疾病的共同靶点进行GO功能和KEGG通路富集分析,分析类型为H.sapiens(38),设置<0.01,取排名前10和前20的结果分别绘制GO柱状图和KEGG气泡通路图,运用R软件进行结果可视化。
2.2 实验验证
2.2.1 造模、分组及给药 HFpEF采用DOCA-盐敏感大鼠模型:大鼠麻醉后右侧卧位固定,消毒后沿脊柱左侧十二肋游离缘做2 cm纵形切口,手术缝合线结扎整个肾动静脉及输尿管,剪去肾脏,ip 10 000 U青霉素以抗感染。生命体征稳定后放回鼠笼中饲养,1%盐水饮水,同时sc DOCA(25 mg/kg,每4天1次),自由饮食。4周后使用小动物超声仪检测大鼠心功能,射血分数(ejection fractions,EF)大于50%且E/A值降低视为HFpEF模型建立成功。
芪苈强心胶囊剂量选择参考国家973计划“基于微血管病变性疾病的营卫‘由络以通、交会生化’研究”实验用药推荐剂量,其中0.5 g/kg剂量为临床等效剂量,本研究选择该剂量为低剂量组,4倍临床剂量2 g/kg为高剂量组,以观察量效关系。沙库巴曲缬沙坦剂量参考药品说明书,换算为大鼠每日给药剂量20 mg/kg进行后续实验。
设10只未行手术大鼠为对照组,选择40只成模大鼠分为模型组、沙库巴曲缬沙坦(20 mg/kg)组和芪苈强心胶囊低、高(0.5、1.0 g/kg)剂量组,每组10只,各给药组ig相应药物,对照组和模型组ig等体积羧甲基纤维素钠,1次/d,连续8周。
2.2.2 超声心动图检测各组大鼠心功能 大鼠在1%异氟醚氧气混合物中麻醉,在胸骨旁长轴切面获得标准M型成像,获得获得心率(heart rate,HR)、EF、左心室前/后壁厚度(left ventricular anterior/posterior wall thickness,LVAW/LVPW)、左室舒张末期内径/收缩末期内径(end-diastolic left ventricular internal dimension/end-systolic left ventricular internal dimension,LVIDd/LVIDs)。四腔心切面的二尖瓣多普勒血流图像中获得等容舒张时间(isovolumic relaxation time,IVRT)、等容收缩时间(isovolumic contraction time,LVCT)、被动左室充盈峰值速度(E)和心房收缩期峰值流速(A)。M型和多普勒研究的扫描速度为100 mm/s,心率保持在250~350次/min。
2.2.3 血清NO、cGMP水平的检测 在12周实验结束时,从腹主动脉采集血样,轻轻翻转10次以上置于在冰上。1800×离心10 min,获得上层血清,转移至1.5 mL离心管中;再以13 000×离心2 min,取血清,按试剂盒操作说明检测NO、cGMP含量。
2.2.4 免疫荧光染色观测心肌组织eNOS、CD31蛋白表达情况 动物处死后,将心脏固定在10%福尔马林溶液,乙醇脱水后进行石蜡包埋。组织切片(4 μm)平行于根尖-基底轴进行。脱蜡和复水后,免疫荧光法测量eNOS和CD31评估心肌细胞内皮功能及密度。盲法评估随机选择的5个视野,并选择1个代表性图像。
2.2.5 Western blotting检测心肌组织eNOS、PKG1、PDE5A、SERCA、sGCα蛋白表达 各组大鼠心脏组织加入裂解液,提取蛋白并进行BCA定量。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用5%牛血清白蛋白封闭1 h,加入一抗,4 ℃孵育过夜,洗涤后孵育二抗结合。用Bio-Rad校准密度计扫描薄膜,将免疫印迹条带的灰度值强度与内参对照。
2.2.6 qRT-PCR检测心肌组织B型脑钠肽(B-type brain natriuretic peptide,)和β-肌球蛋白重链(β-myosin heavy chain,)mRNA表达 参照RNA提取试剂盒说明书获得大鼠心脏组织中总RNA并合成cDNA,扩增后完成qRT-PCR分析。引物序列:上游引物5’-ACCTGGGCAAGTCCAACAAC-3’,下游引物5’-CGGACACGGTCTGAAAGGAT;上游引物5’-AGCCAGTCTCTCCAGAACAATCCA-3’,下游引物5’-CCGGTCTATCTTCTGCCCAAA-3’;上游引物5’-CTGGAGAAACCTGCCAAGTATG-3’,下游引物5’-GGTGGAAGAATGGGAGTTGCT-3’。
2.3 统计学方法
3 结果
3.1 网络药理学分析
3.1.1 芪苈强心胶囊治疗HFpEF的网络分析结果及靶点预测 44个活性成分(表1)在Swisstargetprediction和Pharmmapper平台上共得到(去除重复值)530个潜在作用靶点;在OMIM、DisGenet、GenCard数据库中检索“射血分数保留型心衰”“HFpEF”“舒张性心衰”,3者取并集,去除重复值共得到672个作用靶点。利用Venn图在线平台得到药物和疾病共同作用靶点38个,见图1。
将38个共同靶点输入STRING 11.0在线平台得到的药物-疾病靶点PPI网络,共得到51条边,平均节点度2.68。通过Cytoscape 3.7.2内置Network Analyzer插件进行PPI网络拓扑分析。其中,发现网络中较为重要的靶基因与G蛋白偶联受体、内皮素受体、β肾上腺能受体相关。
表1 芪苈强心胶囊中明确鉴定的活性成分
Table 1 Active components identified in Qili Qiangxin Capsule
活性成分CAS号活性成分CAS号 丹参酮IIA568-72-9 杠柳毒苷13137-64-9 talatizamine20501-56-8川陈皮素478-01-3 宋果灵509-24-0 尼奥宁466-26-2 丹参素钠67920-52-9柚皮苷10236-47-2 sinapine thiocyanate7431-77-8新乌头碱2752-64-9 丹酚酸B115939-25-8丹酚酸A96574-01-5 isorhamnetin-3-O-β-D-glucopyranoside5041-82-7异鼠李素-3,7-二-O-β-D-葡萄糖苷6758-51-6 芦丁153-18-4 hesperidin520-26-3 迷迭香酸20283-92-5次乌头碱6900-87-4 quercetin-3-O-β-D-glucopyranosyl-7-O-β-gentiobioside1309067-39-7kaempferol-3-O-β-D-glucopyranosyl-7-O-β-gentiobioside16290-07-6 quercetin-3-O-β-D-glucopyranoside491-50-9 毛蕊异黄酮-7-O-β-D-葡萄糖苷20633-67-4 人参皂苷Re51542-56-4 毛蕊异黄酮20575-57-9 人参皂苷Rd52705-93-8 苯甲酰乌头原碱63238-67-5 人参皂苷Rc11021-14-0 黄芪甲苷IV84687-43-4 人参皂苷Rb211021-13-9 黄芪甲苷II84676-89-1 人参皂苷Rb141753-43-9 黄芪甲苷I84680-75-1 附子灵80665-72-1 泽泻醇F155521-45-2 刺芒柄花素485-72-3 泽泻醇B18649-93-9 隐丹参酮35825-57-1泽泻醇B 23-乙酸酯26575-95-1 肉桂酸621-82-9 泽泻醇A19885-10-0 chlorogenic acid1049703-62-9 20(S)-人参皂苷Rg267400-17-3 人参皂苷Rg122427-39-020(S)-人参皂苷F262025-49-4
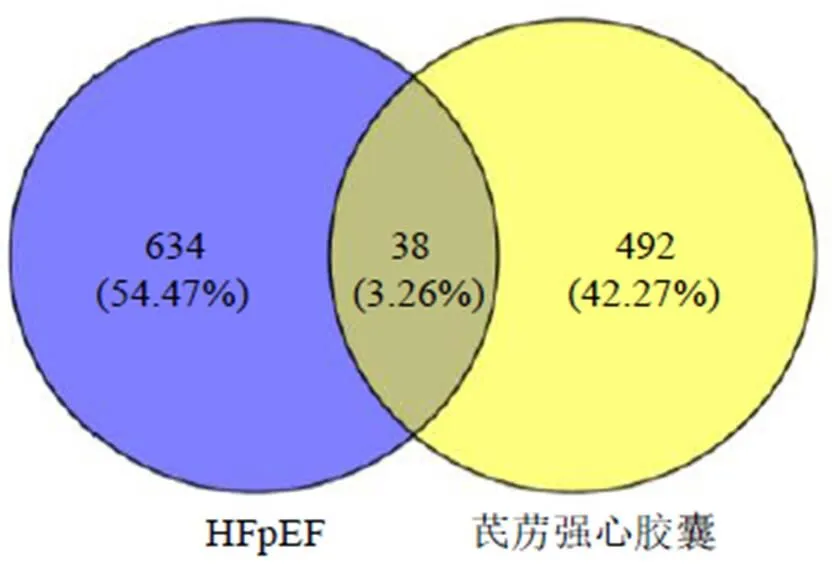
图1 芪苈强心胶囊与HFpEF靶点Venn图
3.1.2 GO功能及KEGG通路富集分析 借助Metescape分析平台,共得到芪苈强心胶囊作用于HFpEF治疗的499个生物过程,30个细胞成分,31个分子功能。筛选<0.01排名前10的GO注释结果做柱形图展示如图2。根据分析结果,芪苈强心胶囊可能参与调控了血液循环、循环系统、心脏收缩等生物过程;在膜筏、轴突、细胞质区等细胞组分中起作用;激活了α-葡萄糖苷酶活性、内肽酶活性、水解酶活性等分子功能。
KEGG共富集到52条通路,按照<0.01,富集值≥1.5筛选前20条通路结果如图2所示,芪苈强心胶囊治疗HFpEF的潜在途径可能为cGMP-PKG信号通路、心肌细胞中的肾上腺素能信号传导、神经活性配体受体相互作用、cAMP信号通路、肾素分泌、钙信号通路等。其中富集度最高的cGMP-PKG信号通路是HFpEF治疗的重要靶点[18],本研究选用该通路进行体内实验验证探讨芪苈强心胶囊治疗HFpEF的作用机制。
3.1.3 网络可视化分析 应用Cytoscape 3.7.2软件对QLQX有效成分,疾病-药物共有的38个潜在靶基因、生物过程、KEGG通路进行可视化网络构建,如图3所示。该网络说明芪苈强心胶囊通过多组分、多靶点、多环节发挥对HFpEF的治疗作用。
3.2 实验验证
3.2.1 各组大鼠一般状态变化情况 对照组大鼠一般状态良好,毛色光泽、行动敏捷、饮食及饮水量正常,尿量正常;模型组精神状态欠佳,毛色粗糙,无光泽,行动迟缓,饮水量增多,尿量增多;各给药组大鼠精神状态及一般状况有所改善。如表2所示,经药物干预8周后,与对照组相比,模型组心脏质量和心脏指数均明显提升(<0.01);与模型组相比,各给药组心脏质量和心脏指数均显著降低(<0.01);各组大鼠体质量无明显差异。
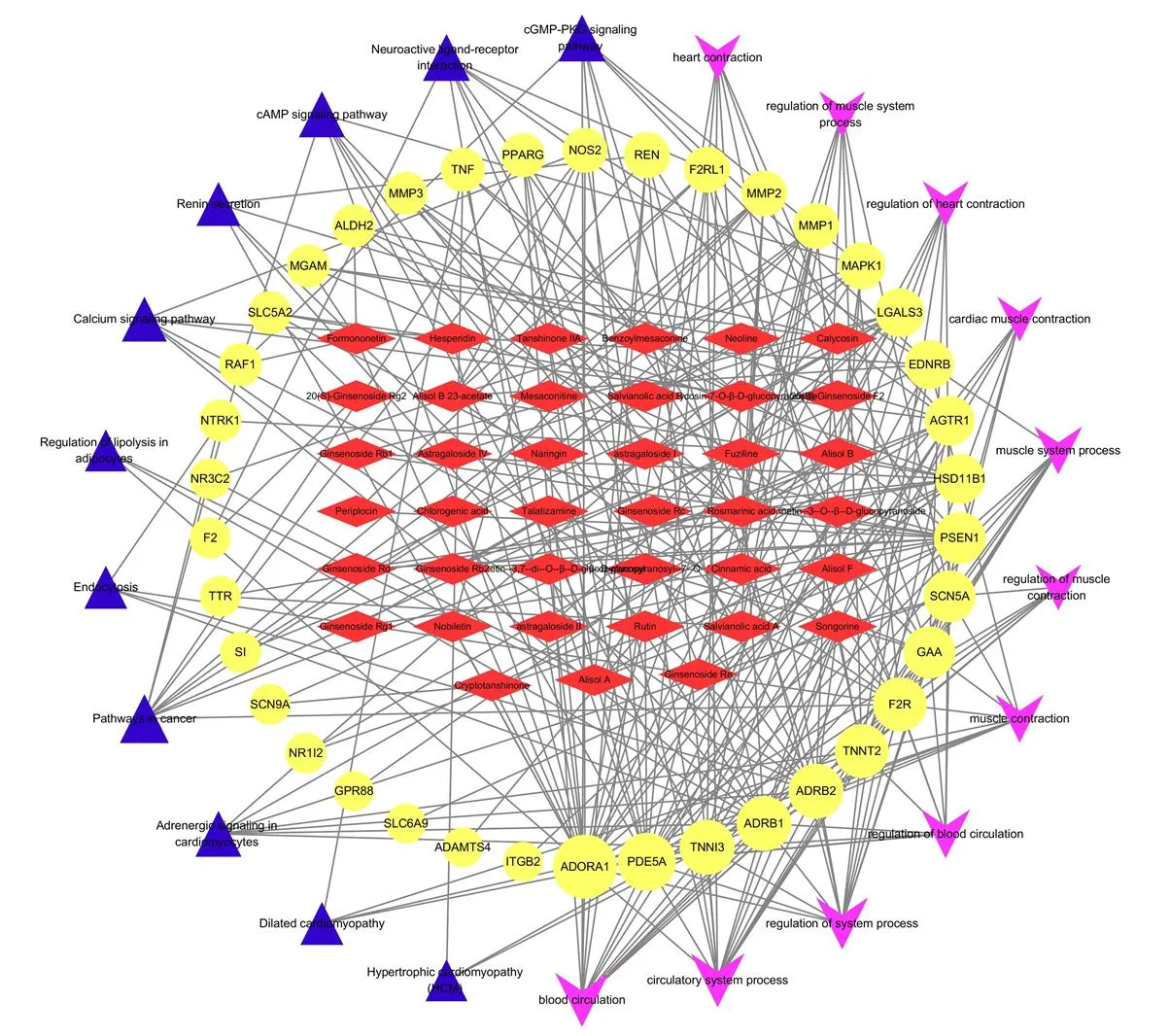
菱形节点为活性成分,圆形节点为作用靶点,四边形节点为生物过程,三角形节点为信号通路
表2 各组大鼠体质量和心脏指数比较(, n = 10)
Table 2 Comparison of body weight and cardiac index of rats in each group (, n = 10)
组别剂量/(g·kg−1)体质量/g心脏质量/g心脏指数 对照—508.00±14.901.44±0.122.78±0.26 模型—509.86±53.491.86±0.37##3.64±0.49## 沙库巴曲缬沙坦0.02494.69±42.431.54±0.20*3.11±0.32** 芪苈强心胶囊0.5496.42±62.451.53±0.30**3.07±0.39** 2.0496.73±66.451.52±0.28**3.05±0.27**
与对照组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01,下表同
#< 0.05##< 0.01control group;*< 0.05**< 0.01model group, same as below tables
3.2.2 芪苈强心胶囊对DOCA盐敏感型HFpEF大鼠心功能影响 如图4和表3所示,与对照组比较,模型组大鼠EF显著降低(<0.05),LVAW、LVPW显著升高(<0.05),提示心室壁肥厚,心功能下降;IVRT时间延长、E/A值下降(<0.05),提示舒张功能障碍,EF尚处于正常范围,IVCT无明显差异,表明收缩功能未明显损伤。沙库巴曲缬沙坦组EF较对照组明显降低(<0.05),也处于正常范围;LVAW较模型组降低(<0.05),E/A比值显著提升(<0.01);各组LVIDs、LVIDd无统计学差异,提示心室未增大。芪苈强心胶囊低剂量组EF、E/A值较模型组升高(<0.05),未能降低室壁厚度。芪苈强心胶囊高剂量组较模型组明显提高EF,IVRT时间缩短,E/A值提升(<0.05),提示心室舒张功能明显恢复,同时LVAW、LVPW降低(<0.05),减轻了室壁肥厚程度。
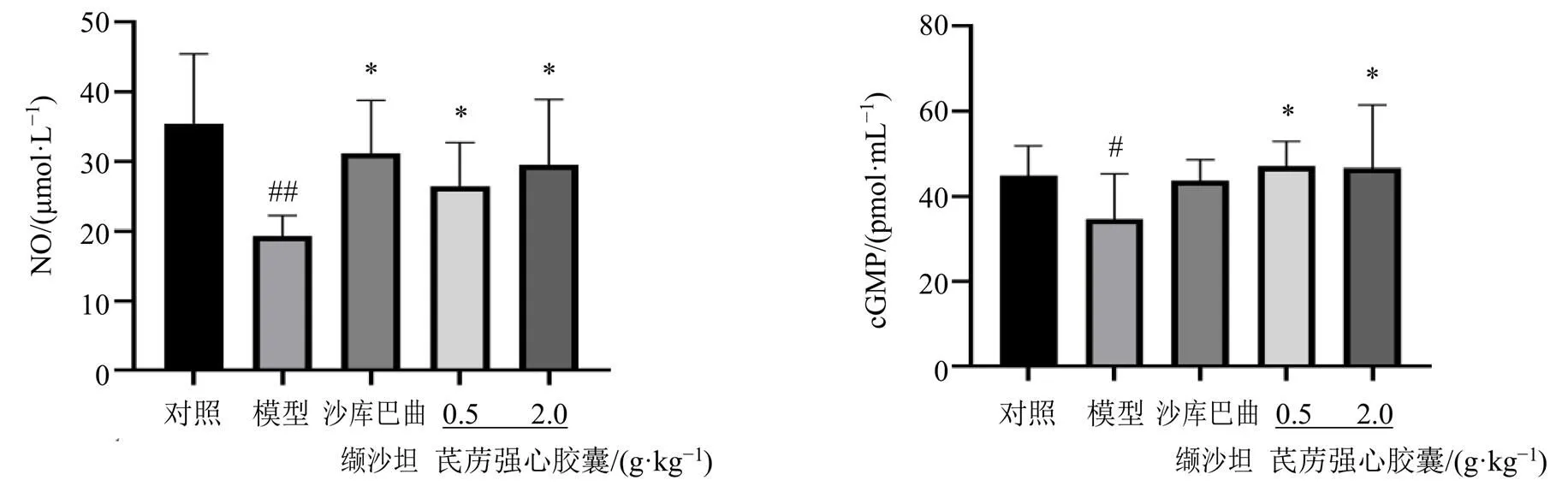
3.2.3 芪苈强心胶囊对DOCA盐敏感型HFpEF大鼠血清NO、cGMP水平的影响 如图5所示,与对照组相比,模型组大鼠血清NO和cGMP水平均显著下降(<0.05、0.01);与模型组相比,沙库巴曲缬沙坦组血清NO水平显著升高(<0.05),芪苈强心胶囊低、高剂量组血清NO和cGMP水平均显著升高(<0.05)。
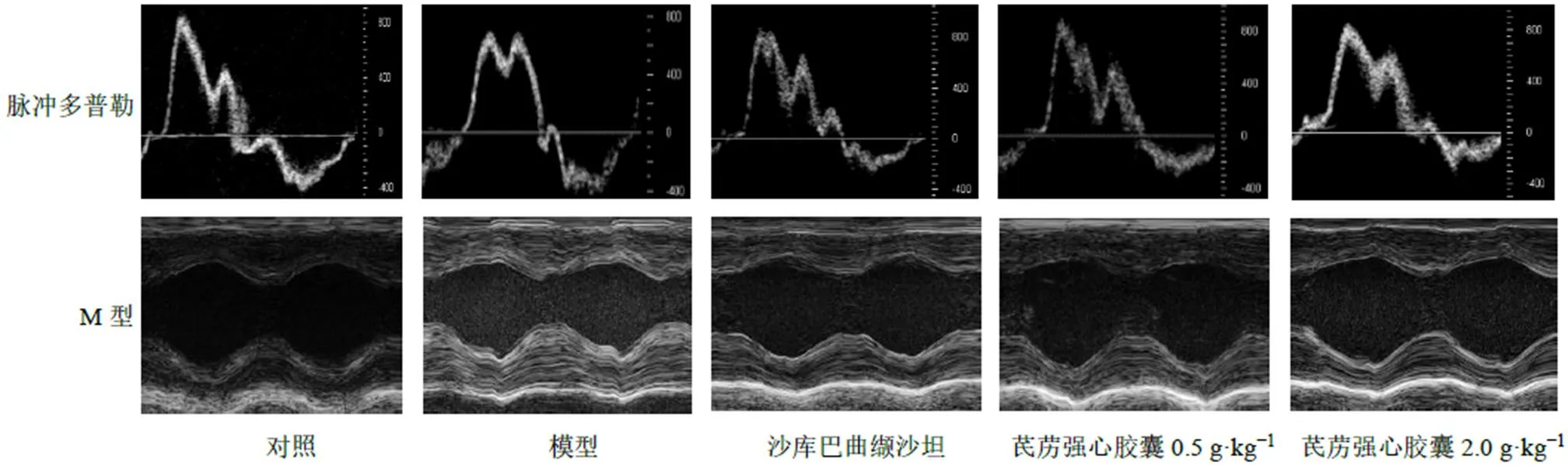
图4 各组大鼠超声心动图典型图像对比
表3 各组大鼠超声心动图参数比较(, n = 10)
Table 3 Comparison of echocardiographic parameters of rats in each group (, n = 10)
组别剂量/(g·kg−1)HREF/%LVAW/mmLVPW/mmIVRT/msIVCT/msE/ALVIDs/mmLVIDd/mm 对照—366.57±25.0578.68±9.733.19±0.603.39±0.7318.17±3.6918.39±6.311.15±0.224.74±0.618.49±0.64 模型—359.31±15.9767.28±6.04#3.66±0.44#3.81±0.50#20.86±2.98#18.49±3.841.02±0.26#4.68±0.538.21±0.67 沙库巴曲缬沙坦0.02350.11±33.3168.86±2.983.32±0.31*3.63±0.3219.44±2.8719.69±3.081.18±0.15**4.66±0.578.32±0.49 芪苈强心胶囊0.5355.69±15.7872.34±5.36*3.52±0.373.63±0.3318.97±2.9719.55±4.031.15±0.18*4.70±0.778.55±0.79 2.0360.55±30.6273.85±6.91*3.39±0.28*3.60±0.39*18.23±2.14*19.05±4.351.10±0.17*4.85±0.668.56±0.53
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同
3.2.4 大鼠心肌组织eNOS和CD31免疫荧光染色 内皮功能障碍被认为是HFpEF病理生理学的中心机制[19]。如图6所示,绿色荧光为eNOS,红色为CD31,二者均为内皮细胞标志物,共表达处呈现黄色。如图7所示,与对照组相比,模型组大鼠心肌组织血管周围eNOS荧光表达量显著降低(<0.01),而各给药组均能明显恢复大鼠心肌组织内皮功能(<0.05),芪苈强心胶囊高剂量组效果更为明显(<0.01)。
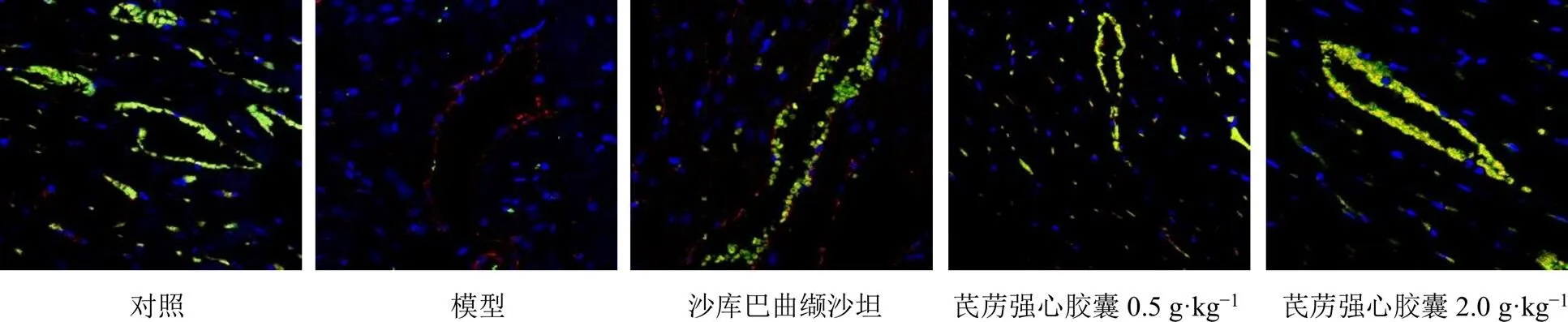
图6 各组大鼠心肌组织eNOS(绿色)、CD31 (红色)、DAPI (蓝色) 定位的免疫荧光图像(×400)
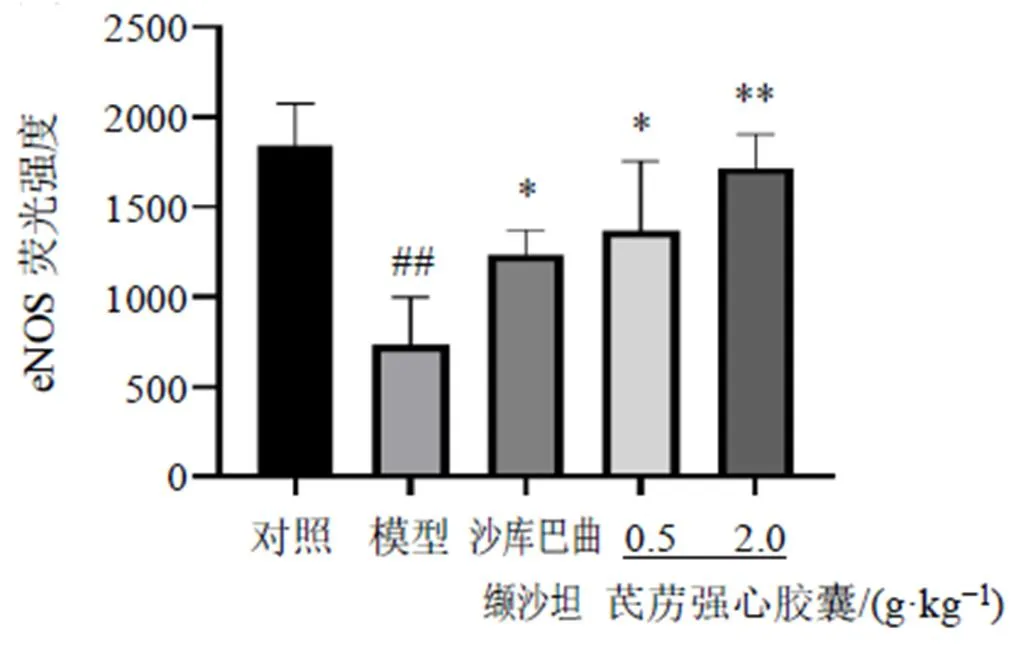
图7 各组大鼠心肌组织eNOS荧光强度比较
3.2.5 芪苈强心胶囊对心肌组织eNOS、PKG1、PDE5A、SERCA和sGCα蛋白表达的影响 如图8和表4所示,与对照组相比,模型组大鼠心肌组织eNOS、PKG1和SERCA蛋白表达水平均显著降低(<0.05、0.01),PDE5A蛋白表达水平显著升高(<0.05),sGCα蛋白表达水平降低但无统计学差异;与模型组相比,沙库巴曲缬沙坦组eNOS、SERCA、sGCα蛋白表达水平均显著升高(<0.05),PDE5A蛋白表达水平显著降低(<0.05);芪苈强心胶囊低剂量组eNOS、PKG1、sGCα蛋白表达水平均显著升高(<0.05、0.01),PDE5A蛋白表达水平显著降低(<0.05);芪苈强心胶囊高剂量组eNOS、PKG1、SERCA和sGCα蛋白表达水平均显著升高(<0.05、0.01),PDE5A蛋白表达水平显著降低(<0.05)。
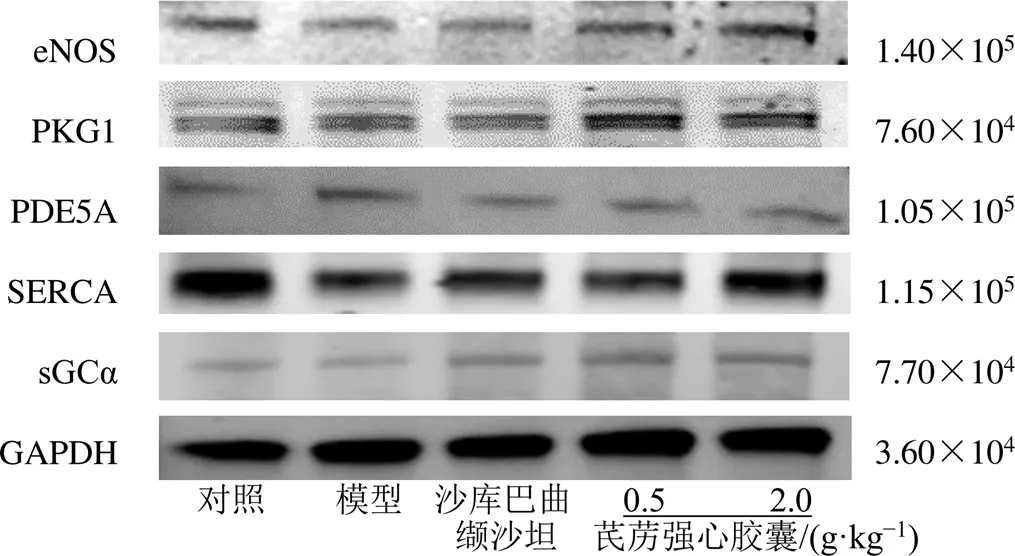
图8 各组大鼠心肌组织eNOS、PKG1、PDE5A、SERCA和sGCα蛋白的WB图
表4 各组大鼠心肌组织eNOS、PKG1、PDE5A、SERCA和sGCα的蛋白表达(, n = 3)
Table 4 eNOS,PKG1,PDE5A,SERCA and sGCα proteins in myocardium of rats in each group(, n = 3)
组别剂量/(g·kg−1)蛋白相对表达量 eNOSPKG1PDE5ASERCAsGCα 对照—1.00±0.001.00±0.001.00±0.001.00±0.001.00±0.00 模型—0.88±0.08#0.77±0.27#1.60±0.41#0.61±0.05##0.88±0.07 沙库巴曲缬沙坦0.021.32±0.17*0.99±0.231.25±0.29*0.94±0.25*1.31±0.59* 芪苈强心胶囊0.51.35±0.09*1.56±0.30**1.24±0.40*0.76±0.111.53±0.63* 2.01.39±0.30**1.44±0.19*1.30±0.17*1.02±0.21**1.53±0.46*
3.2.6 芪苈强心胶囊对心肌组织和mRNA表达的影响 如图9所示,与对照组相比,模型组心肌组织和mRNA表达水平均显著升高(<0.05、0.01);与模型组相比,各给药组心肌组织和mRNA表达水平均显著降低(<0.05)。
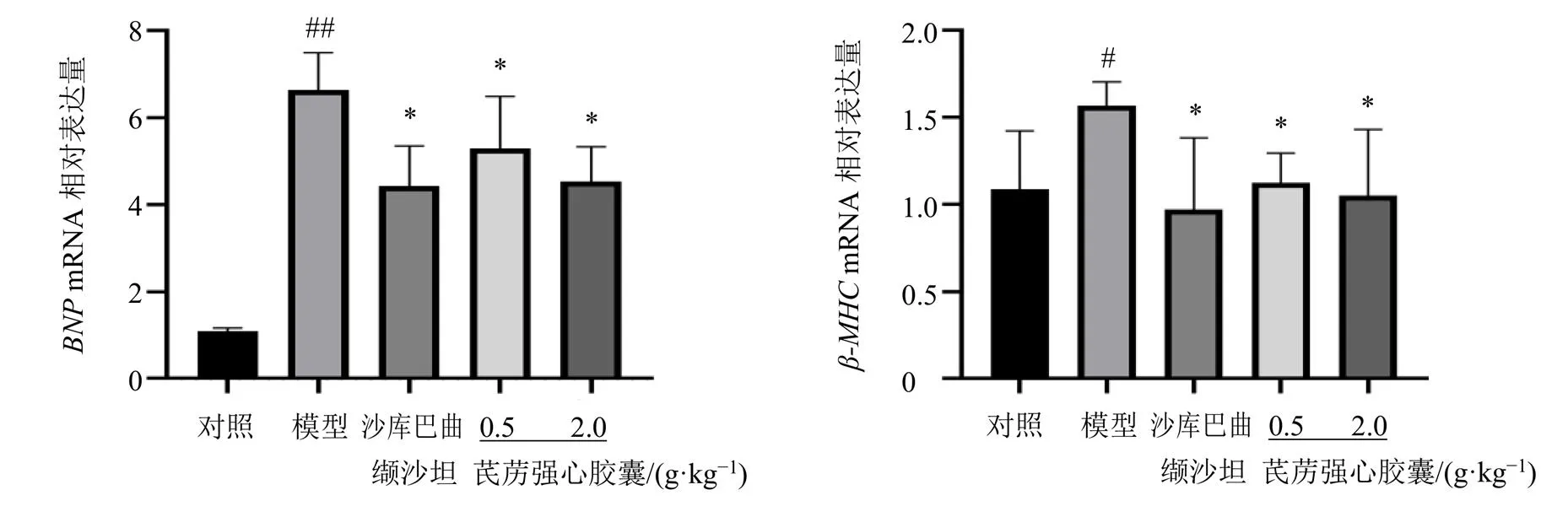
图9 各组大鼠心肌组织BNP和β-MHC mRNA表达(, n = 4)
4 讨论
HFpEF与左室舒张功能障碍密切相关,舒张功能障碍可由肥厚和间质纤维化导致的左室僵硬度增加以及钙循环受损导致的左室舒张异常引起[20]。内皮炎症及其继发的内皮功能障碍被认为是HFpEF其重要病理机制[21]。肥胖、糖尿病、高脂血症等全身促炎状态可导致冠状动脉微血管内皮炎症,其级联反应始于内皮细胞,通过抑制eNOS使内源性NO生物利用度降低,继而影响cGMP含量及其下游PKG活性。这种低活性造成肌浆网上受磷蛋白和SERCA-2a活性降低,使Ca2+在肌浆网中积累,心肌无法正常松弛,继发心肌细胞僵硬,舒张功能障碍。
中医将心衰归于“心积”“心水”等范畴,脉络学说提出,心积、心水病机多为宗气亏虚,心气虚乏,营卫交汇生化障碍为本,营卫气化失常瘀血阻滞脉络津聚为水为主要病理过程[22]。宗气亏虚,心脏气阳虚乏、脉道无力,血无以运而形成脉络瘀阻,同时营卫交汇生化失司,阳虚不能化水,致使水饮停滞,气、血、水三分合而发病,痰瘀互结,阻滞脉络,导致络息成积的的病理变化,可引起心脏组织肿大变形,室壁肥厚、纤维增生,致使心脏扩大和重塑,心功能恶化。脉络学说将HFpEF病机归纳为“气阳虚乏、络瘀水停、络息心积”,在“络以通为用”治疗原则指导下,进一步提出了“益气温阳、活血通络、利水消肿”治法并研制了芪苈强心胶囊。本药以黄芪、附子、人参、陈皮益气温阳,丹参、红花活血通络,葶苈子、香加皮、泽泻、玉竹利水消肿,桂枝佐使以辛温通络,温阳化气,诸药配伍使心慌气短、不能平卧、尿少水肿诸症自消,抑制心室重构,改善心脏功能,对HFpEF有较好的疗效[23]。
本研究采用网络药理学方法,通过公共数据库对芪苈强心胶囊明确鉴定的成分及HFpEF的共同作用靶点,利用生物信息学技术进行网络构建,寻找芪苈强心治疗HFpEF的可能作用靶点。既往亦有研究[24-26]通过网络药理学方法探究芪苈强心胶囊的作用机制,而所探讨的疾病多为慢性心衰(HFrEF)、糖尿病性心肌病、充血性心力衰竭等,尚无HFpEF的网络药理学研究;同时,这些研究多通过TCMSP、BAT-MAN TCM等平台直接检索芪苈强心胶囊中11味药物所有成分的各自靶点,未通过药物代谢研究探索其在体内真正发挥药效的物质成分,缺乏针对性,本研究弥补了这一缺陷。本课题组前期对芪苈强心胶囊11味药材通过自建化合物数据库完成对其化学成分的全面检识,共发现包括黄酮类22种、二萜生物碱33种、三萜皂苷类44种,苯丙素类21种,其他类化合物11种,其中44个化合物利用对照品进行了确认[17],又确认了毛蕊异黄酮-7--β--葡萄糖苷、人参皂苷Re、人参皂苷Rg1、杠柳苷G等成分为芪苈强心胶囊强心、利尿及扩血管的重要活性成分[27]。芪苈强心胶囊组方中黄芪、附子、人参、陈皮益气温阳,助阳化气,针对气阳虚乏的基本病机,本研究中鉴定的主要有效成分包括黄芪甲苷、异鼠李素、新乌宁碱、次乌头碱、人参皂苷、橙皮苷等,具有非正性肌力洋地黄类作用,能改善心肌收缩、扩血管、增加细胞搏动频率和幅度、改善心功能[28];丹参、红花活血化瘀以通脉络,主要有效成分包括丹酚酸、丹参素钠、丹参酮、毛蕊异黄酮、槲皮素等,可扩张冠状动脉、减少红细胞聚集、改善血黏度和血液流变等[29];泽泻、葶苈子、香加皮、玉竹养阴利水消肿以缓其症,主要有效成分包括泽泻醇、异鼠李素、杠柳毒苷、槲皮素-吡喃葡萄糖等,具有强心、利尿、抗炎、免疫调节等多种生物功能[30]。这些药理作用为芪苈强心胶囊治疗HFpEF奠定了基础。
KEGG通路富集结果显示,cGMP-PKG信号通路为芪苈强心胶囊治疗HFpEF的高敏感通路,对此本研究进行了深入探讨。NO-sGC-cGMP-PKG轴被描述为心脏舒缩的重要调节器[31]。在生理条件下,内皮细胞在一级联反应中的关键作用是通过eNOS的活性生成NO,并激活sGC作为其靶细胞(如心肌细胞和血管平滑肌细胞)中的气体递质。作为回应,sGC产生cGMP,这是下游效应器PKG酶的关键调节因子,能够调节血管紧张、松弛和收缩[32]。该系统的4个基本调节因子是磷酸二酯酶(GMP-binding cGMP-specific phosphodiesterase,PDE),PDE5A对cGMP分子具有特异性能够将cGMP降解为5′-GMP,如果PDE上调加上增强的硝基氧化应激,可能显著导致HFpEF患者心肌中cGMP-PKG信号受损[33]。舒张功能障碍还可能由于该通路中SERCA-2a活性降低有关,导致肌浆网清除Ca2+功能降低,舒张期Ca2+增加,心肌松弛异常[34]。总的来说,cGMP增加和PKG激活导致细胞内游离钙减少,导致血管平滑肌细胞松弛,这是该通路主要生理效应之一。
常丽萍[35]研究发现芪苈强心胶囊可以提高心梗后心衰大鼠主动脉组织中降钙素基因相关肽(calcitonin gene related peptide,CGRP)、cGMP、eNOS蛋白表达,同时增强主动脉组织、mRNA表达水平,提示芪苈强心胶囊可以通过舒张血管而增强心肌供血,其扩展血管机制可能与eNOS-sGC-cGMP-PKG通路相关,证实了芪苈强心胶囊可以通过调控cGMP-PKG通路改善心脏/血管舒张功能。本研究亦证实,芪苈强心胶囊能降低HFpEF大鼠心脏指数,提高EF,降低室壁肥厚程度,缩短IVRT时间,提高E/A值,提示心室舒张功能明显恢复;同时增加HFpEF血清中NO水平,提高eNOS表达量,增强内皮功能;可降低PDE5A对cGMP的水解作用增加心脏cGMP水平,同时增强PKG活性,这些过程改善了肌丝功能,降低了心肌细胞的被动僵硬度,从而改善了舒张功能。此外,芪苈强心胶囊还能降低该通路下游心肌肥厚相关因子和mRNA相对表达量增加,提示其能够增强大鼠排钠利尿和血管平滑肌松弛,改善心室重构的重要作用。
综上所述,本研究基于网络药理学构建“药物-有效成分-靶点-疾病”网络,阐明了芪苈强心胶囊多组分-多靶点-多环节治疗HFpEF的作用机制。通过体内实验,发现芪苈强心胶囊可以多维度、全面的激活cGMP-PKG信号通路,增强内皮功能,改善心肌被动僵硬程度,增强Ca2+转运功能,减轻心室重构,验证了网络药理学的预测结果。这些数据对于阐明芪苈强心胶囊介导的舒张性心功能障碍改善的潜在机制有重要意义,并为HFpEF治疗提供了有力佐证。
利益冲突 所有作者均声明不存在利益冲突
[1] Ponikowski P, Voors A A, Anker S D,. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC [J]., 2016, 18(8): 891-975.
[2] Groenewegen A, Rutten F H, Mosterd A,. Epidemiology of heart failure [J]., 2020, 22(8): 1342-1356.
[3] Lam C S, Donal E, Kraigher-Krainer E,. Epidemiology and clinical course of heart failure with preserved ejection fraction [J]., 2011, 13(1): 18-28.
[4] Brouwers F P, de Boer R A, van der Harst P,. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND [J]., 2013, 34(19): 1424-1431.
[5] McMurray J J V, Adamopoulos S, Anker S D,. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC [J]., 2012, 33(14): 1787-1847.
[6] Gheorghiade M, Marti C N, Sabbah H N,. Soluble guanylate cyclase: A potential therapeutic target for heart failure [J]., 2013, 18(2): 123-134.
[7] Rainer P P, Kass D A. Old dog, new tricks: Novel cardiac targets and stress regulation by protein kinase G [J]., 2016, 111(2): 154-162.
[8] Takimoto E. Cyclic GMP-dependent signaling in cardiac myocytes [J]., 2012, 76(8): 1819-1825.
[9] Armstrong P W, Pieske B, Anstrom K J,. Vericiguat in patients with heart failure and reduced ejection fraction [J]., 2020, 382(20): 1883-1893.
[10] Breitenstein S, Roessig L, Sandner P,. Novel sGC stimulators and sGC activators for the treatment of heart failure [J]., 2017, 243: 225-247.
[11] 吴以岭, 谷春华, 徐贵成, 等. 芪苈强心胶囊治疗慢性心力衰竭随机双盲、多中心临床研究 [J]. 疑难病杂志, 2007, 6(5): 263-266.
[12] 朱青梅, 潘慧敏, 赵海霞, 等. 芪苈强心胶囊联合沙库巴曲缬沙坦治疗慢性心力衰竭的系统评价[J]. 药物评价研究, 2022, 45(1): 144-155.
[13] 田野, 李彦霞, 任君霞, 等. 芪苈强心胶囊治疗舒张性心衰的疗效观察 [J]. 中国临床药理学杂志, 2011, 27(9): 666-668.
[14] 廖玉华, 杨杰孚, 张健, 等. 舒张性心力衰竭诊断和治疗专家共识 [J]. 临床心血管病杂志, 2020, 36(1): 1-10.
[15] 牛明, 张斯琴, 张博, 等.《网络药理学评价方法指南》解读 [J]. 中草药, 2021, 52(14): 4119-4129.
[16] 康利平, 赵阳, 余河水, 等. 采用UPLC-Q-TOF/MSE鉴别芪苈强心胶囊有效部位中的化学成分 [J]. 药学学报, 2011, 46(10): 1231-1236.
[17] Yun W J, Yao Z H, Fan C L,. Systematic screening and characterization of Qi-Li-Qiang-Xin Capsule-related xenobiotics in rats by ultra-performance liquid chromatography coupled with quadrupole time-of-flight tandem mass spectrometry [J]., 2018, 1090: 56-64.
[18] Breitenstein S, Roessig L, Sandner P,. Novel sGC stimulators and sGC activators for the treatment of heart failure [J]., 2017, 243: 225-247.
[19] Shah S J, Lam C S P, Svedlund S,. Prevalence and correlates of coronary microvascular dysfunction in heart failure with preserved ejection fraction: PROMIS-HFpEF [J]., 2018, 39(37): 3439-3450.
[20] Lourenço A P, Leite-Moreira A F, Balligand J L,. An integrative translational approach to study heart failure with preserved ejection fraction: A position paper from the Working Group on Myocardial Function of the European Society of Cardiology [J]., 2018, 20(2): 216-227.
[21] Chadderdon S M, Belcik J T, Bader L,. Proinflammatory endothelial activation detected by molecular imaging in obese nonhuman primates coincides with onset of insulin resistance and progressively increases with duration of insulin resistance [J]., 2014, 129(4): 471-478.
[22] 吴以岭. 脉络论 [M]. 北京: 中国科学技术出版社, 2010: 189-190.
[23] 王朝远, 胡秀文. 芪苈强心胶囊联合左西孟旦治疗扩张型心肌病心力衰竭的临床研究[J]. 现代药物与临床, 2020, 35(11): 2238-2242.
[24] 赵达, 赵振宇, 叶嘉豪, 等. 基于网络药理学和分子对接技术探讨芪苈强心胶囊治疗慢性心力衰竭的作用机制 [J]. 湖南中医药大学学报, 2022, 42(6): 950-957.
[25] 朱慧明, 乔莉, 冯小龙, 等. 基于网络药理学探讨芪苈强心胶囊治疗充血性心力衰竭的作用机制 [J]. 世界科学技术-中医药现代化, 2021, 23(11): 3986-3996.
[26] 李立凤, 杨志华, 王居平, 等. 芪苈强心胶囊治疗慢性充血性心力衰竭作用机制的网络药理学研究 [J]. 长治医学院学报, 2021, 35(2): 89-94.
[27] 刘奕训, 余河水, 康利平, 等. 芪苈强心胶囊活性部位中的组成成分研究 [J]. 中草药, 2010, 41(7): 1060-1065.
[28] Cho J Y, Jeong M H, Ahn Y K,. Comparison of outcomes of patients with painless versus painful ST-segment elevation myocardial infarction undergoing percutaneous coronary intervention [J]., 2012, 109(3): 337-343.
[29] 代晓光, 苏长兰. 丹参化学成分及药理研究进展 [J]. 中医药信息, 2018, 35(4): 126-129.
[30] 张慧娟, 龚苏晓, 许浚, 等. 泽泻药材的研究进展及其质量标志物的预测分析[J]. 中草药, 2019, 50(19): 4741-4751.
[31] Zhao C Y, Greenstein J L, Winslow R L. Roles of phosphodiesterases in the regulation of the cardiac cyclic nucleotide cross-talk signaling network [J]., 2016, 91: 215-227.
[32] Maurice D H, Wilson L S, Rampersad S N,. Cyclic nucleotide phosphodiesterases (PDEs): Coincidence detectors acting to spatially and temporally integrate cyclic nucleotide and non-cyclic nucleotide signals [J]., 2014, 42(2): 250-256.
[33] Das A, Durrant D, Salloum F N,. PDE5 inhibitors as therapeutics for heart disease, diabetes and cancer [J]., 2015, 147: 12-21.
[34] Lovelock J D, Monasky M M, Jeong E M,. Ranolazine improves cardiac diastolic dysfunction through modulation of myofilament calcium sensitivity [J]., 2012, 110(6): 841-850.
[35] 常丽萍. 芪苈强心胶囊治疗慢性心力衰竭的作用机理及代谢组学研究 [D]. 石家庄: 河北医科大学, 2017.
Mechanism of Qili Qiangxin Capsule in treatment of heart failure with preserved ejection fraction based on network pharmacology and experimental verification
HAO Jia-meng1, 2, CHANG Li-ping4, 5, WANG Lu3, 5, LIU Huan3, CHEN Meng3, 5, HOU Bin3, 4, ZHOU Lu-heng3, HOU Yun-long1, 2, 3
1. Hebei Medical University, Shijiazhuang 050017, China 2. Key Research Office of State Administration of Traditional Chinese Medicine (Cardiovascular and Cerebrovascular Diseases), Hebei Yiling Hospital, Shijiazhuang 050023, China 3. Shijiazhuang Yiling Pharmaceutical Co., Ltd., Shijiazhuang 050023, China 4. State Key Laboratory of Collateral Disease Research and Innovative Chinese Medicine, Shijiazhuang 050023, China 5. Hebei Key Laboratory of Collateral Diseases, Shijiazhuang 050023, China
To explore the mechanism of Qiliqiangxin Capsule (芪苈强心胶囊, QLQX) in treatment of heart failure with preserved ejection fraction (HFpEF) based on network pharmacology and experimental verification.Forty-four clearly identified exogenous substances in QLQX were identified as active ingredients, and targets of compounds were predicted by Swisstarget prediction and Pharmmapper platforms, HFpEF disease targets were retrieved from OMIM, Disgenet and Gencard databases. Intersection targets were collected, String database and Cytoscape 3.7.2 software were uses to perform protein-protein interaction network analysis (PPI) and topology analysis. Metescape platform were used to perform gene ontology (GO) and Kyoto encyclopedia of genes and genomes (KEGG) pathway enrichment analysis for common targets. A salt-sensitive HFpEF rat model with deoxycorticosterone acetate (DOCA) was constructed and given sacubitril-valsartan or QLQX for intervention. After eight weeks of administration, small animal ultrasound imaging system, ELISA, immunofluorescence, Western blotting, qRT-PCR methods were used for pharmacodynamic evaluation and cyclic guanosinc monophosphate (cGMP)-protein kinase G1 (PKG1) signaling pathway related target validation.Thirty-eight identical targets were screened out from active ingredients of QLQX and HFpEF; GO function and KEGG pathway enrichment analysis showed that they were involved in biological process (such as blood circulation, circulatory system, cardiac contraction), cellular components (such as membrane rafts, axons, cytoplasmic region) and molecular function (such as α-glucosidase activity, endopeptidase activity, hydrolase activity), involving cGMP-PKG signaling pathway, renin secretion, calcium signaling pathway.experiments confirmed that QLQX increased ejection fraction, reduced degree of ventricular wall hypertrophy, shortened isovolumic relaxation time (IVRT), and increased ratio of left ventricular diastolic filling velocity in HFpEF rats (< 0.05), increased nitric oxide (NO) and cGMP levels in serum (< 0.05), enhanced myocardial endothelial nitric oxide synthase (eNOS) fluorescence expression (< 0.05, 0.01), increased eNOS, PKG1, cardiac sarcoplasmic reticulum Ca2+-ATPase (SERCA), soluble guanylate cyclase α (sGCα) protein expressions (< 0.05, 0.01), decreased cGMP-specific phosphodiesterase 5A (PDE5A) protein expression level (< 0.05), decreased B-type brain natriuretic peptide () and β-myosin heavy chain () mRNA expressions in myocardial tissue (< 0.05).QLQX can exert the therapeutic effect of HFpEF through component-multi-target-multi-link, and its mechanism is related to the regulation of cGMP-PKG signaling pathway.
network pharmacology; Qili Qiangxin Capsule; heart failure with preserved ejection fraction; endothelial function; choroid theory; cGMP-PKG1 pathway
R285.5
A
0253 - 2670(2022)14 - 4365 - 11
10.7501/j.issn.0253-2670.2022.14.016
2022-02-23
国家重点研发计划“中医药现代化研究”重点专项资助项目(2017YFC1700501);河北省自然科学基金资助项目(H2019106059);河北省中医药管理局科研计划项目(Z2022020)
郝佳梦(1992—),女,博士研究生,从事心血管病中西医结合研究。E-mail: sweet_dreams0502@yeah.net
侯云龙,男,博士,教授,博士生导师,从事中药药理学研究。E-mail: houyunlonghrb@hotmail.com
[责任编辑 李亚楠]
