多中心切割二维液相色谱法同时测定九味熄风颗粒中10种成分
2022-07-21沈灿杰陈夏霖王振中
沈灿杰,马 阳,陈夏霖,高 霞,曹 亮,王振中,肖 伟
多中心切割二维液相色谱法同时测定九味熄风颗粒中10种成分
沈灿杰1, 2, 3,马 阳1, 2,陈夏霖1, 2,高 霞1, 2,曹 亮1, 2,王振中1, 2,肖 伟1, 2*
1. 江苏康缘药业股份有限公司,江苏 连云港 222001 2. 中药制药过程新技术国家重点实验室,江苏 连云港 222001 3. 中国药科大学,江苏 南京 211198
采用在线多中心切割二维液相色谱法,建立同时测定九味熄风颗粒中10种成分的含量测定方法。第一维采用Acquity BEH C18(100 mm×3.0 mm,1.7 µm)为色谱柱,第二维色谱柱为X Select HSS T3(250 mm×4.6 mm,5 µm);流动相均采用甲醇-乙腈(95∶5)混合溶液-磷酸水体系,梯度洗脱;体积流量分别为0.2、1.0 mL/min;柱温35 ℃。同时测定了九味熄风颗粒中次黄嘌呤、天麻素、有机酸类(原儿茶酸、新绿原酸、绿原酸、隐绿原酸)、环烯醚萜苷类(马钱苷酸、獐芽菜苦苷、龙胆苦苷、当药苷)10种成分的含量,各成分在考察的质量浓度范围内线性关系良好(≥0.999),精密度RSD均小于2%,重复性RSD均小于5%,供试品溶液室温24 h内稳定,平均加样回收率为97.45%~104.82%,13批制剂中次黄嘌呤、天麻素、原儿茶酸、新绿原酸、绿原酸、马钱苷酸、隐绿原酸、獐芽菜苦苷、龙胆苦苷、当药苷质量分数分别为0.034~0.111、1.224~2.078、0.032~0.055、0.010~0.066、0.202~0.341、1.052~1.542、0.016~0.080、0.151~0.333、4.560~7.354、0.343~0.518 mg/g,其中天麻素、总有机酸、总环烯醚萜苷类成分的批间一致性良好。建立的方法操作简便,结果准确、可靠,可用于九味熄风颗粒的质量控制和评价。
九味熄风颗粒;二维液相色谱;中心切割;同时测定;次黄嘌呤;天麻素;有机酸类;原儿茶酸;新绿原酸;绿原酸;隐绿原酸;环烯醚萜苷类;马钱苷酸;獐芽菜苦苷;龙胆苦苷;当药苷;质量控制
九味熄风颗粒(Jiuwei Xifeng Granules,JXG)是由江苏康缘药业股份有限公司研制生产的中药复方制剂,由天麻、熟地黄、钩藤、龙胆、法半夏、僵蚕、龟甲、龙骨、青礞石9味药材组成,具有滋阴平肝、熄风化痰的功效[1],临床上用于轻中度小儿多发性抽动症,证属肾阴亏损、肝风内动证者[2]。多指标的定量测定对该制剂的质量控制、保证临床疗效具有重要意义。然而JXG成分复杂,含有生物碱、环烯醚萜、有机酸等多类活性成分,进行一维色谱分析时,样品中目标成分多存在共流出峰,或达不到基线分离,无法对目标分析物实现同时定量分析。
近年来,多维液相色谱分离成为液相色谱发展的一个重要方向,它将不同性能或特点的色谱体系进行联用,具有高分离效果和高峰容量的特点[3],《中国药典》2020年版中也新增了多维液相分析技术[4]。采用2个合适的色谱联用(二维液相色谱)可满足大多数难分离样品的分离要求。二维液相色谱根据切割全部还是部分的一维洗脱液进入二维分离,可分为全二维色谱(LC×LC)和中心切割色谱(LC-LC)[4-5]。二者中的选择性全二维(sLC×LC)和多中心切割式二维(mLC-LC)可以解决多个峰重叠的难题,对多个目标成分进行定量分析[6],已经广泛用于分析食品、环境、中药、生物样本等复杂基质样品或手性化合物等难分离混合物[7-13]。二维多中心切割模式一般通过阀的切换将第一维中感兴趣的部分依次切割,临时储存在定量环或捕获柱或者直接转移进入选择性不同的第二维进行分离[14-15]。
本实验基于二维液相多中心切割技术,成功建立了JXG中多成分的快速分析方法。此方法第一维对绿原酸、隐绿原酸、马钱苷酸、龙胆苦苷、当药苷进行分析,第二维根据次黄嘌呤、天麻素、原儿茶酸、新绿原酸、獐芽菜苦苷的一维出峰时间,设置切割时间窗口,在第二维色谱柱上进行进一步分离,实现对制剂中10种成分进行含量测定。
1 仪器与材料
Agilent 1290 Infinity II二维液相色谱系统,配备2台1290 Infinity II高速泵,1290 Infinity II自动进样器,1290 Infinity II柱温箱以及2台1290 Infinity II二极管阵列检测器,外置2位/4通双向阀及阀驱动,美国Agilent公司;KH-300DB型数控超声波清洗器,昆山禾创超声波仪器有限公司;Pacific TII7超纯水仪,美国Thermo公司;ME104E型电子天平、XS205DU型电子天平,Mettler Toledo公司。
对照品天麻素(质量分数96.8%,批号110807-201306)、原儿茶酸(质量分数99.9%,批号110809-201205)、绿原酸(质量分数99.3%,批号110753-201716)、马钱苷酸(质量分数97.4%,批号11865-201704)、獐芽菜苦苷(质量分数98.3%,批号110785-201404)、龙胆苦苷(质量分数97.1%,批号110770-201918)、当药苷(质量分数100%,批号111742-200501)均购自中国食品药品检定研究院;对照品次黄嘌呤(质量分数99.3%,批号6057)、新绿原酸(质量分数99.4%,批号4974)均购自上海诗丹德生物技术有限公司;对照品隐绿原酸(质量分数98.0%,批号15121702),购自成都普菲德生物技术有限公司。
JXG(6 g/袋),江苏康缘药业股份有限公司,批号190102、190103、190701、190702、190901、190902、191002、191003、200501、200503、210301、210302、210303,分别编号为S1~S13。乙腈、甲醇,色谱纯,美国Tedia公司;无水甲醇、磷酸,分析纯,南京化学试剂有限公司;水为超纯水。
2 方法与结果
2.1 对照品溶液制备
取次黄嘌呤、天麻素、原儿茶酸、新绿原酸、绿原酸、马钱苷酸、隐绿原酸、獐芽菜苦苷、龙胆苦苷、当药苷对照品适量,精密称定,加50%甲醇制成质量浓度分别为25.6、701.8、15.9、32.3、97.7、420.3、33.7、61.4、2 502.8、277.8 µg/mL的混合对照品储备液。精密移取1 mL置10 mL量瓶,加50%甲醇稀释至刻度,即得混合对照品溶液。
2.2 供试品溶液制备
取JXG适量,研细,取约1 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25 mL,密塞,称定质量,超声处理(频率40 kHz、功率500 W)30 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.3 阴性对照样品溶液的制备
按JXG处方比例和工艺,分别制备缺少天麻、半夏药材的阴性对照样品;缺少龙胆药材的阴性对照样品;缺少僵蚕药材的阴性对照样品;缺少钩藤药材的阴性对照样品;并按“2.2”项下方法制备各阴性对照样品溶液。
2.4 色谱条件及系统适用性试验
2.4.1 一维色谱条件 以Acquity UPLC BEH C18(100 mm×3 mm,1.7 µm)为色谱柱;柱温35 ℃;体积流量0.2 mL/min;检测波长为220、250、327 nm;以0.05%磷酸水溶液为流动相A,甲醇-乙腈(95∶5)混合溶液为流动相B,梯度洗脱程序:0~6 min,1%~1.75% B;6~8 min,1.75%~6% B;8~16 min,6%~12% B;16~35 min,12% B;35~40 min,12%~20% B;40~50 min,20%~27% B;50~51 min,27%~95% B;51~58 min,95% B;58~60 min,95%~1% B;进样体积1 µL。
2.4.2 二维色谱条件 色谱柱为XSelect HSS T3柱(250 mm×4.6 mm,5 µm);柱温35 ℃;体积流量1.0 mL/min;检测波长:220、250、327 nm;流动相A为0.015%磷酸水溶液,流动相B为甲醇-乙腈(95∶5)混合溶液。梯度洗脱程序:0~6 min,0 B;6~13 min,0~1% B;13~15 min,1% B;15~25 min,1%~12% B;25~35 min,12%~21% B;35~42 min,21%~30% B;42~51 min,30%~40% B;51~52 min,40%~95% B;52~59 min,95% B;59~60 min,95%~0 B。
2.4.3 系统流路 系统流路连接见图1,其中接口采用2位/4通双向阀可以实现流路的完全对称,减小阀切换时系统压力的变化[16]。阀在位置A时,组分经第一维洗脱进入废液,至目标组分时阀切换到位置B,目标组分暂时储存于定量环中;然后阀切换至位置A,定量环中的切割组分随第二维流动相进入第二维色谱柱进行分析,至下一次切割时阀切换回位置B。
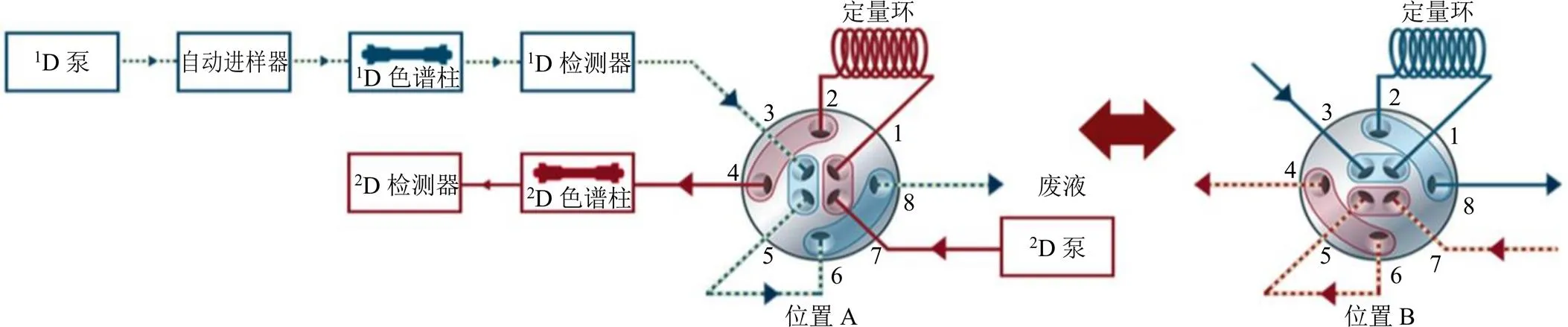
图1 多中心切割二维液相系统连接示意图
2.4.4 二维切割时间 考虑到一维液相各色谱峰的峰宽差异,保证不造成切割过程中的损失,选择200 µL定量环进行储存,在一维体积流量为0.2 mL/min条件下收集时间为0.8 min。阀切换时间为0 min(位置A);4.10 min(位置B),4.90 min(位置A);12.00 min(位置B),12.80 min(位置A);14.85 min(位置B),15.65 min(位置A);19.00 min(位置B),19.80 min(位置A);42.00 min(位置B),42.80 min(位置A)。
2.4.5 系统适用性试验 精密移取混合对照品溶液和供试品样品溶液适量,按照本色谱条件测定,对照品和供试品溶液的一维及二维分离色谱图如图2所示。本方法第一维在250 nm波长下对马钱苷酸、龙胆苦苷、当药苷进行分析,在327 nm下对隐绿原酸、绿原酸进行分析;第二维在220 nm波长下对天麻素、原儿茶酸进行分析,在250 nm下对次黄嘌呤、獐芽菜苦苷进行分析,在327 nm下对新绿原酸进行分析。在60 min内一维和二维色谱图基线平稳,各成分分布均匀,与相邻色谱峰的分离度均不低于1.5,拖尾因子在0.8~1.5,理论塔板数以各色谱峰计均在4000以上,可进行准确定量。
2.5 专属性试验
精密移取“2.1~2.3”项下的各溶液适量,按照本色谱条件测定,结果见图3。各阴性样品溶液在所测成分相应的位置处未见色谱峰,说明阴性样品溶液对测定成分没有干扰。
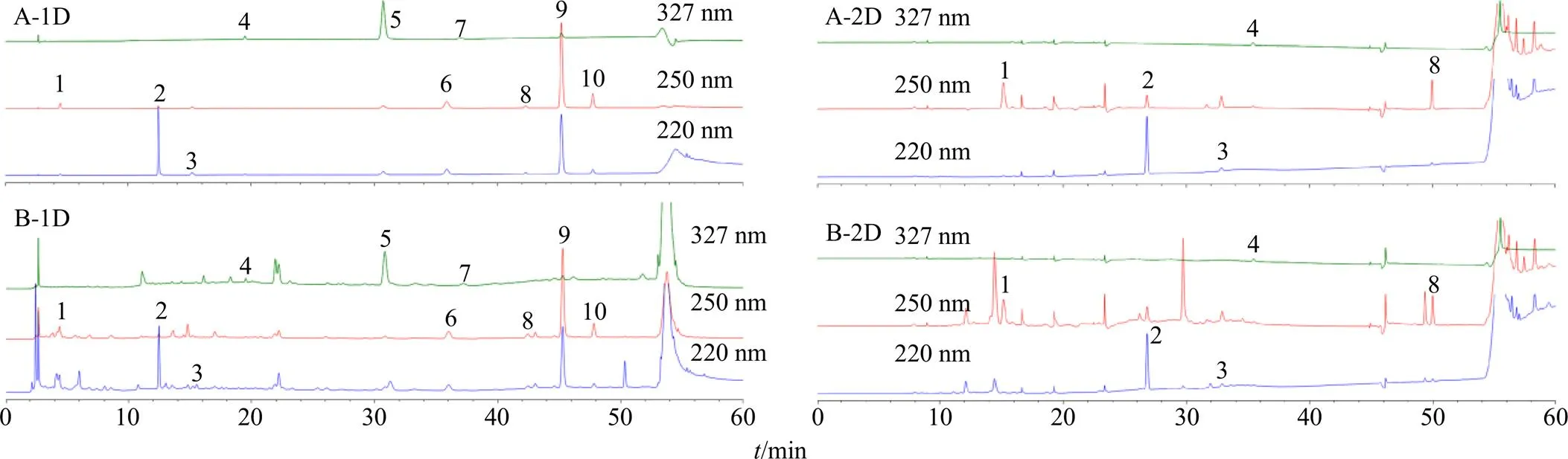
1-次黄嘌呤 2-天麻素 3-原儿茶酸 4-新绿原酸 5-绿原酸 6-马钱苷酸 7-隐绿原酸 8-獐芽菜苦苷 9-龙胆苦苷 10-当药苷,下图同
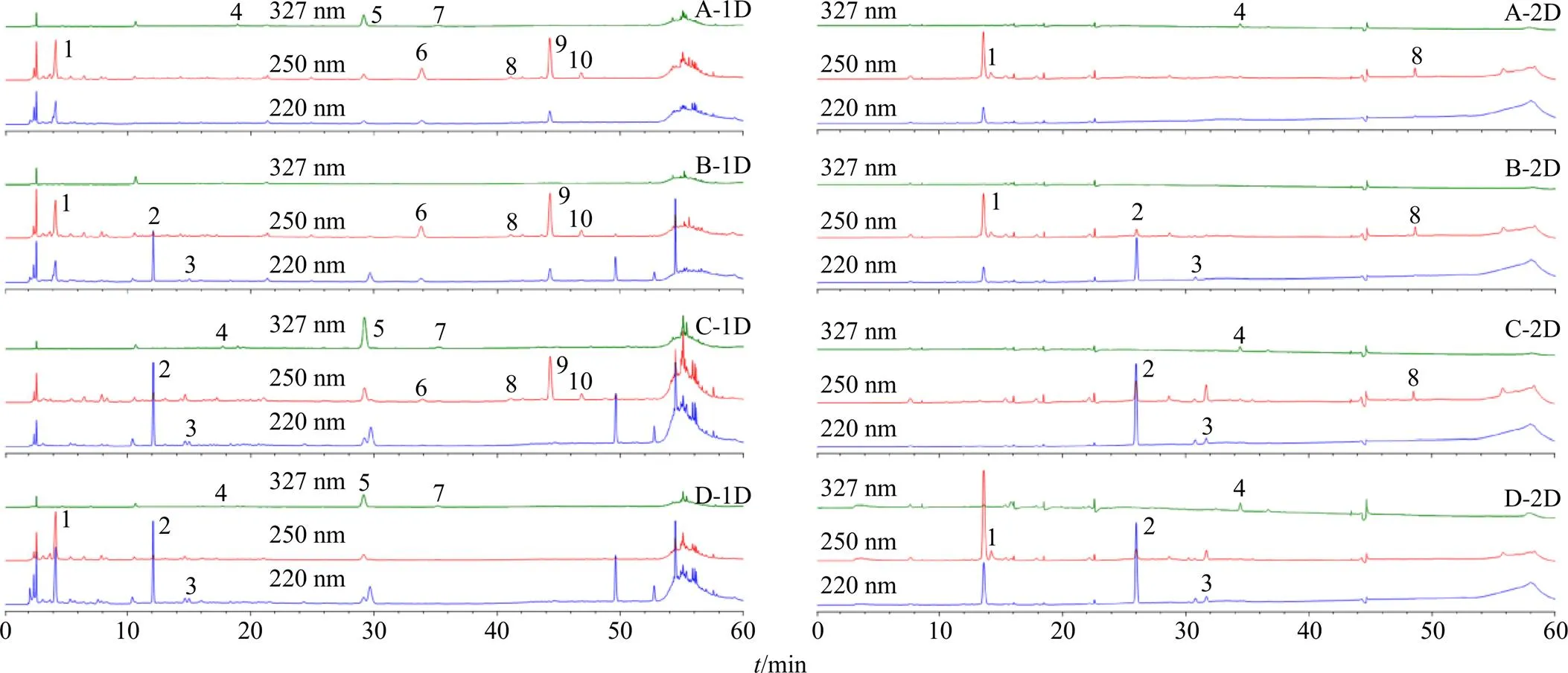
图3 缺天麻和半夏(A)、缺钩藤(B)、缺僵蚕(C)、缺龙胆(D) 阴性样品的一维(1D) 和二维(2D) 分离色谱图
2.6 线性关系考察
精密移取“2.1”项下混合对照品储备液,50%甲醇逐级稀释,制得系列质量浓度对照品溶液。按“2.3”项下色谱条件进样分析,记录各色谱峰的峰面积。以对照品质量浓度为横坐标(),峰面积为纵坐标(),绘制标准曲线,以信噪比不小于10确定目标化合物的定量限,10种成分的回归方程、线性范围与定量限见表1。
2.7 精密度试验
取“2.1”项下混合对照品溶液,按“2.3”项下色谱条件进行测定峰面积,连续进样6次,结果次黄嘌呤、天麻素、原儿茶酸、新绿原酸、绿原酸、马钱苷酸、隐绿原酸、獐芽菜苦苷、龙胆苦苷、当药苷峰面积的RSD分别为0.19%、0.13%、1.03%、1.59%、0.29%、0.29%、1.09%、0.33%、0.15%、0.16%,表明方法精密度较好。
表1 10种成分的回归方程、线性范围与定量限
Table 1 Regression equation, linear range, and limits of quantification of 10 components
成分线性方程r线性范围/(μg∙mL−1)定量限/(μg∙mL−1) 次黄嘌呤y=25.462 x+0.169 30.999 80.51~5.110.26 天麻素y=10.738 x+3.004 60.999 814.04~140.360.56 原儿茶酸y=33.069 x-0.201 70.999 70.32~3.180.22 新绿原酸y=18.619 x+0.066 70.999 80.32~3.230.19 绿原酸y=13.658 x-0.631 20.999 71.95~19.540.49 马钱苷酸y=4.899 4 x+0.679 40.999 98.41~84.051.12 隐绿原酸y=13.214 x+0.470 80.999 70.34~3.370.23 獐芽菜苦苷y=6.902 x-0.325 90.999 81.23~12.290.46 龙胆苦苷y=6.293 x+10.230.999 750.06~500.550.63 当药苷y=8.573 9 x+1.142 60.999 95.56~55.550.37
2.8 稳定性试验
取JXG(S4)约1 g,精密称定,按“2.2”项下方法制备供试品溶液,分别室温放置0、2、4、8、12、18、24 h,按“2.3”项下色谱条件进行测定,记录各待测成分的峰面积,结果供试品溶液中次黄嘌呤、天麻素、原儿茶酸、新绿原酸、绿原酸、马钱苷酸、隐绿原酸、獐芽菜苦苷、龙胆苦苷、当药苷的峰面积RSD分别为0.41%、0.73%、1.38%、1.90%、0.34%、0.50%、1.69%、1.10%、0.32%、0.31%,均小于2%,表明供试品溶液在24 h内稳定。
2.9 重复性试验
分别取同一批号的JXG(S4)约1 g,精密称定,按“2.2”项下方法制备供试品溶液,平行制备6份,取“2.1”项下混合对照品溶液,按“2.3”项下色谱条件进行测定,按外标法计算各待测成分的含量及RSD。计算得到次黄嘌呤、天麻素、原儿茶酸、新绿原酸、绿原酸、马钱苷酸、隐绿原酸、獐芽菜苦苷、龙胆苦苷、当药苷的平均质量分数分别为0.056、1.574、0.032、0.010、0.202、1.069、0.016、0.151、5.893、0.638 mg/g,RSD分别为1.55%、0.66%、2.53%、2.10%、0.93%、0.66%、1.88%、1.61%、0.94%、0.42%,结果表明该方法重复性较好。
2.10 加样回收率试验
取已测知含量的样品(S4)9份,每份约0.5 g,精密称定,分成3组,分别加入相当于样品中待测成分质量分数的50%、100%、150% 3个水平的混合对照品溶液,按“2.2”项下方法制备,即得低(50%)、中(100%)、高(150%)质量浓度的回收率供试品溶液,测定含量,计算各成分的加样回收率,结果次黄嘌呤、天麻素、原儿茶酸、新绿原酸、绿原酸、马钱苷酸、隐绿原酸、獐芽菜苦苷、龙胆苦苷、当药苷的平均加样回收率分别为98.27%、98.50%、104.82%、103.08%、97.45%、98.84%、98.94%、102.79%、100.37%、103.01%,RSD分别为1.56%、1.39%、2.14%、3.68%、2.62%、1.48%、3.52%、1.28%、1.67%、1.34%,表明该方法准确度较好。
2.11 耐用性试验
保持其他条件不变,分别考察波长、体积流量、柱温、不同色谱柱、流动相磷酸水溶液浓度等微小变动对测定结果的影响。分别改变一维色谱条件中体积流量(0.20±0.01)mL/min、柱温(35±2)℃、磷酸水溶液体积分数(0.050±0.005)%、不同批号色谱柱,二维色谱条件中体积流量(1.0±0.1)mL/min、柱温(35±2)℃、磷酸水溶液体积分数(0.015±0.002)%、不同批号色谱柱,在初始条件及上述各条件下,分别进样对照品溶液、供试品溶液,按“2.3”项下色谱条件测定,按外标法计算样品中各成分含量。结果发现初始条件与各色谱条件变化下含量RSD均不大于5%。
2.12 样品测定
分别取13批样品适量,精密称定,平行制备2份,按照“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件,按外标法计算样品中各成分质量分数,结果见表2。JXG中测定的成分主要分为以下几类:有机酸类包括酚酸类(原儿茶酸)和咖啡酰奎尼酸类(新绿原酸、绿原酸、隐绿原酸)、环烯醚萜苷类(马钱苷酸、獐芽菜苦苷、龙胆苦苷、当药苷)、糖苷类(天麻素)及嘌呤类(次黄嘌呤)。各成分含量差异较大,异构体之间存在相互转化,因此,采用总量用于评价批次之间的差异。各成分含量与其平均含量的比值为纵坐标,化合物类型为横坐标,作箱线图,结果见图3。13批制剂中天麻素、总环烯醚萜苷、总有机酸数据均分布在±30%区间内,且RSD均小于20%,表明不同批次间一致性良好。次黄嘌呤含量较低,在20~120 μg/g,各批次间差异较大,不纳入批间一致性评价指标。
3 讨论
3.1 色谱条件的优化
对供试品进行常规一维液相分析方法开发时,发现样品中极性成分较多,次黄嘌呤在普通C18色谱柱上保留较弱,且出峰位置色谱峰堆积,干扰严重;采用DAD检测器对天麻素、新绿原酸的光谱纯度进行分析,峰纯度小于990,提示可能存在包峰;原儿茶酸与相邻组分分离度未达到1.5,不满足分离要求;而獐芽菜苦苷在一维色谱中则易与相邻组分共洗脱,因此,有必要对上述化合物进行第二维的分离。
为一维和二维分离选择合适的色谱柱和流动相,是建立有效的二维色谱方法的第一步[10]。色谱柱选择上,通常选择颗粒填充粒径较小、口径较窄的色谱柱进行第一维分离,以实现良好的色谱分离度,并避免第二维色谱的峰展宽,同时可以得到较窄的峰形保证目标峰一维洗脱液不超过二维定量环体积[17-18]。
表2 13批样品中10种成分测定结果
Table 2 Content of 10 ingredients in 13 batches of samples
批号质量分数/(mg∙g−1) 次黄嘌呤天麻素原儿茶酸新绿原酸绿原酸马钱苷酸隐绿原酸獐芽菜苦苷龙胆苦苷当药苷 S10.0411.8540.0540.0240.2961.5420.0440.2795.4290.518 S20.1111.2240.0330.0240.2161.4810.0300.1574.9690.513 S30.0661.8030.0420.0230.2791.0520.0300.2507.3000.463 S40.0561.5750.0320.0100.2021.0690.0160.1515.8930.638 S50.0721.4960.0550.0360.3411.3080.0560.2716.2420.401 S60.0461.2710.0530.0660.2921.1210.0800.2505.4010.431 S70.0391.7180.0490.0500.2801.0970.0620.2614.7400.432 S80.0371.6170.0450.0440.2611.0580.0560.2484.5600.428 S90.0341.5760.0500.0240.2661.3600.0410.2505.1960.425 S100.0341.5960.0500.0240.2681.3780.0410.2535.2610.429 S110.0801.8930.0320.0210.2451.3900.0340.3067.1110.437 S120.0671.9720.0350.0270.2651.1290.0370.2776.2810.341 S130.0632.0780.0330.0260.2571.0950.0330.3337.3540.343
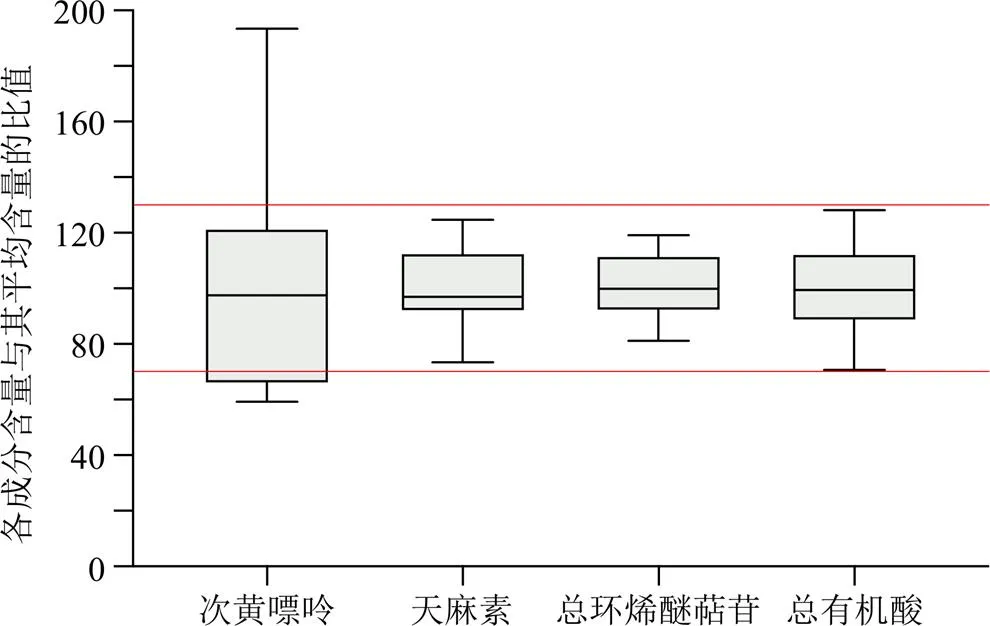
图3 不同化合物平均含量百分比箱线图
本研究中测试了Zorbax Eclipse Plus C18(50 mm×2.1 mm,1.8 μm)、Zorbax SB-C18(100 mm×2.1 mm,1.8 μm)以及Acquity UPLC BEH C18(100 mm×3.0 mm,1.7 µm)3种反相色谱柱,最后选择分离效果最佳的Acquity BEH C18作为第一维色谱柱。第二维色谱柱应与第一维有一定的正交性,实验尝试了Cortecs C18(50 mm×4.6 mm,2.7 µm)、Xselect CSH C18(150 mm×4.6 mm,3.5 µm)、Zorbax SB-Aq(150 mm×2.1 mm,3.5 μm)、XSelect HSS T3(250 mm×4.6 mm,5 µm)等色谱柱,结果表明,XSelect HSS T3色谱柱对高比例水相流动相有较好的耐受性,且从一维洗脱的组分多属于极性成分,在该色谱柱上有较好的分离度,因此作为第二维色谱柱。
就流动相而言,第一维采用甲醇-乙腈混合溶液和0.05%磷酸水溶液分别作为有机相和水相,为化合物提供了更适合的保留时间、更良好的分离度和峰形。实验比较了乙腈与第一维相同溶剂作为第二维有机相的区别,发现虽然乙腈背压会更低,且有更高的正交性,但选用与第一维相同的溶剂有更好的兼容性,可以避免出现较高的溶剂峰并保持基线平稳。在第二维水相的选择上,由于次黄嘌呤在此系统中受pH影响较大,因此,需对水相的磷酸体积分数进行考察,比较了0.05%、0.03%、0.015%磷酸体积分数后发现,0.015%磷酸可使次黄嘌呤与相邻组分完全分离。
3.2 供试品制备方法的选择
实验比较了样品回流提取和超声提取的提取效率,结果测得回流提取的绿原酸含量较低而新绿原酸含量较高,其他成分无明显差别,可能是因为绿原酸及其同分异构体在高温下进行了转化[19-20],因此选择超声提取进行后续考察;考察了不同浓度的甲醇和乙醇作为溶剂的提取效果,确定50%甲醇的提取效果最佳;考察了超声时间、溶剂用量,在考察范围内,两者对提取效果无明显影响,综合考虑确定了最终的供试品溶液制备方法。
JXG中10个成分极性与含量差异大,不同类型的色谱柱均难以达到全部分离,因此建立二维液相分析方法。本实验基于多中心切割二维液相色谱技术建立了同时测定JXG中10种成分的分析方法,并进行了系统地方法学验证。结果表明,该方法专属性、稳定性、重复性、准确度均较好,测定结果稳定、可靠,可有效地反映JXG质量,二维液相的分离能力明显优于一维液相,并可作为一维HPLC的补充方法为类似性质产品的质量控制方法提供新的思路。
利益冲突 所有作者均声明不存在利益冲突
[1] 付娟, 李家春, 张海弢, 等. 九味熄风颗粒生物碱类成分指纹图谱建立及其多指标成分定量分析 [J]. 中国实验方剂学杂志, 2016, 22(19): 43-47.
[2] 杜春雁, 胡思源, 赵宾江, 等. 九味熄风颗粒治疗小儿抽动障碍肾阴亏损、肝风内动证的疗效观察 [J]. 现代药物与临床, 2017, 32(4): 718-722.
[3] 张艳海, 张大伟, 孟兆青, 等. 在线二维液相色谱法快速测定桂枝茯苓胶囊中芍药苷、丹皮酚、苦杏仁苷和肉桂酸的含量 [J]. 中国中药杂志, 2013, 38(23): 4088-4093.
[4] 中国药典[S]. 四部. 2020: 65.
[5] 张艳海, 金燕, 王峥涛. 在线二维多中心切割液相色谱法测定三七、人参及其相关产品中8种人参皂苷 [J]. 中草药, 2017, 48(5): 894-901.
[6] Stoll D R, Carr P W. Two-dimensional liquid chromatography: A state of the art tutorial [J]., 2017, 89(1): 519-531.
[7] Qiao X, Wang Q, Song W,. A chemical profiling solution for Chinese medicine formulas using comprehensive and loop-based multiple heart-cutting two-dimensional liquid chromatography coupled with quadrupole time-of-flight mass spectrometry [J]., 2016, 1438: 198-204.
[8] Pursch M, Buckenmaier S. Loop-based multiple heart- cutting two-dimensional liquid chromatography for target analysis in complex matrices [J]., 2015, 87(10): 5310-5317.
[9] Campone L, Rizzo S, Piccinelli A L,. Determination of mycotoxins in beer by multi heart-cutting two-dimensional liquid chromatography tandem mass spectrometry method [J]., 2020, 318: 126496.
[10] Yao C L, Yang W Z, Wu W Y,. Simultaneous quantitation of fivesaponins by multi heart-cutting two-dimensional liquid chromatography: Method development and application to the quality control of eightcontaining Chinese patent medicines [J]., 2015, 1402: 71-81.
[11] Xu F, Xu Y, Liu G Z,. Separation of twelve posaconazole related stereoisomers by multiple heart- cutting chiral-chiral two-dimensional liquid chromatography [J]., 2020, 1618: 460845.
[12] Wang S Y, Zhou L N, Wang Z C,. Simultaneous metabolomics and lipidomics analysis based on novel heart-cutting two-dimensional liquid chromatography- mass spectrometry [J]., 2017, 966: 34-40.
[13] 李郭帅, 马阳, 耿婷, 等. 超高效二维液相色谱法测定复方南星止痛膏中双酯型乌头生物碱的含量 [J]. 药物分析杂志, 2019, 39(2): 249-256.
[14] 高雯, 宋慧鹏, 杨华, 等. 在线二维液相色谱技术在中药研究中的应用进展 [J]. 色谱, 2017, 35(1): 121-128.
[15] Iguiniz M, Heinisch S. Two-dimensional liquid chromatography in pharmaceutical analysis. Instrumental aspects, trends and applications [J]., 2017, 145: 482-503.
[16] 王智聪, 傅荣杰, 吉建国, 等. 高分辨采样二维液相色谱法同时测定金银花中绿原酸和木犀草苷含量 [J]. 色谱, 2019, 37(2): 201-206.
[17] 张艳海, 其布勒哈斯, 金燕, 等. 在线二维液相色谱法同时测定婴幼儿和成人配方营养品中的维生素A、D3和E [J]. 色谱, 2015, 33(3): 291-297.
[18] Qiao X, Song W, Ji S,. Separation and detection of minor constituents in herbal medicines using a combination of heart-cutting and comprehensive two- dimensional liquid chromatography [J]., 2014, 1362: 157-167.
[19] Dawidowicz A L, Typek R. Formation of ester and amine derivatives of 5--caffeoylquinic acid in the process of its simulated extraction [J]., 2012, 60(50): 12289-12295.
[20] Dawidowicz A L, Typek R. Thermal transformation of-5--caffeoylquinic acid (-5-CQA) in alcoholic solutions [J]., 2015, 167: 52-60.
Simultaneous quantitation of 10 components in Jiuwei Xifeng Granules by multiple heart-cutting two dimensional liquid chromatography
SHEN Can-jie1, 2, 3, MA Yang1, 2, CHEN Xia-Lin1, 2, GAO Xia1, 2, CAO Liang1, 2, WANG Zhen-zhong1, 2, XIAO Wei1, 2
1. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China 2. State Key Laboratory of New-Tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China 3. China Pharmaceutical University, Nanjing 211198, China
To develop an online multiple heart-cutting two-dimensional liquid chromatography method for the simultaneous determination of 10 components from the Jiuwei Xifeng Granules (JXG).The first dimensional column was Acquity UPLC BEH C18(100 mm × 3.0 mm, 1.7 µm) and the second dimensional column was X Select HSS T3 (250 mm × 4.6 mm, 5 μm). The mobile phase was methanol-acetonitrile mixed solution (95:5) and phosphoric acid-water solution. The flow rates were 0.2 mL/min and 1.0 mL/min respectively in two dimensions. And column temperature controled at 35 ℃.The contents of hypoxanthine, gastrodin, organic acids (protocatechuic acid, neochlorogenic acid, chlorogenic acid, cryptochlorogenic acid) and iridoid glycosides (loganic acid, swertiamarine, gentiopicroside, sweroside) in JXG were determined simultaneously. Each component had a good linear relationship within the investigated concentration range (≥ 0.999), the RSD of precision were less than 2%, the RSD of repeatability were less than 5%, and the sample solution was stable within 24 h at room temperature, the average recovery were 97.45%—104.82%, and the consistency of 13 batches of test samples are good. The concentration of hypoxanthine, gastrodin, protocatechuic acid, neochlorogenic acid, chlorogenic acid, loganic acid, cryptochlorogenic acid, swertiamarine, gentiopicroside, sweroside in 13 batches of samples were 0.034—0.111, 1.224—2.078, 0.032—0.055, 0.010—0.066, 0.202—0.341, 1.052—1.542, 0.016—0.080, 0.151—0.333, 4.560—7.354, 0.341—0.638 mg/g, respectively, and the consistency of gastrodin, total organic acid and total iridoid glycosides were good.The estabilshed method is simple, accurate and reliable, which can be used for the quality control and evaluation of JXG.
Jiuwei Xifeng Granules; two-dimensional liquid chromatography; heart-cutting; simultaneous differmination; hypoxanthine; gastrodin; organic acids; protocatechuic acid; neochlorogenic acid; chlorogenic acid; cryptochlorogenic acid; iridoid glycosides; loganic acid; swertiamarine; gentiopicroside; sweroside; quality control
R286.02
A
0253 - 2670(2022)14 - 4333 - 07
10.7501/j.issn.0253-2670.2022.14.013
2021-11-30
江苏省工信厅2020年度工业和信息产业转型升级专项资金项目-多组分中药研究关键技术
沈灿杰,硕士,研究方向为中药分析。Tel: 18013945296 E-mail: shencanjie@163.com
肖 伟,中国工程院院士,博士,主要研究方向为中药新药的研究与开发。Tel: (025)86587935 E-mail: kanionxw2010@126.com
[责任编辑 郑礼胜]
