基于TCGA数据库探索POLA2基因在肝癌中的表达及其与预后的相关性
2022-07-20阳建超程兆瑞刘兴贵
阳建超,程兆瑞,喻 超,张 艾,刘兴贵
(贵州医科大学a.临床医学院; b.附属医院肝胆外科,贵阳 550004)
肝细胞癌(HCC)是全世界发病较高的恶性肿瘤之一,现已成为全球第三大恶性肿瘤疾病[1],与肝细胞癌相关的死亡率有逐年上升趋势[2],这主要因为肝癌患者大多在晚期才被确诊,现有的治疗措施有限且治疗效果较差[3]。目前HCC的主要发病因素包括病毒性肝炎、摄入黄曲霉素等有毒物质、非酒精性脂肪性肝炎、酒精相关性肝病等[4-5]。近年来,虽然根治性手术(如肝切除术和肝移植)和姑息治疗(分子靶向治疗和免疫治疗)是治疗HCC患者的常用方法,但HCC发生转移和复发的概率极高并最终导致预后不良[6]。因此,寻找一种有效的特异性标志物来确定肝癌患者的预后具有重要意义。
DNA聚合酶α亚基B(POLA2)是DNA聚合酶(pols)α、δ和ε家族成员之一,主要参与DNA聚合酶α引物酶复合物与细胞复制机制相偶联的活动,在染色体DNA复制、修复、重组及调控细胞周期发挥了重要作用[7-8]。WILLIS等[9]研究发现,POLA2可作为卵巢癌发生的驱动因素并与患者不良预后相关。KOH等[10]发现POLA2是厄洛替尼的一种新型互补靶蛋白,在临床上可以作为评估非小细胞肺癌患者耐药性的标志物,并且敲低POLA2可抑制厄洛替尼耐药株H1299的增殖能力。本研究拟基于肿瘤基因组图谱(TCGA)和肿瘤免疫评估资源(TIMER)数据库探讨POLA2在肝癌中的潜在作用及机制,并为肝癌提供新的标志物或治疗靶点。
1 材料与方法
1.1 细胞和试剂
人正常肝细胞LO2和人肝癌细胞株Hep3B、Huh-7细胞均购自上海富衡生物科技有限公司,胎牛血清、胰蛋白酶、DMEM培养液购自美国Gibco公司;RNA提取试剂TRIzol购自美国Invitrogen公司,反转录试剂盒及SYBR Premix ExTaq试剂盒均购自日本TaKaRa公司。POLA2基因和内参GAPDH引物由上海生工生物工程股份有限公司设计完成,POLA2基因上游序列:5′-AGTTGGGTGGGAAAGGAG-3′、下游序列:5′-GCATGGACTGAGAAGCAAG-3′,GAPDH基因上游序列:5′-GGAGCGAGATCCCTCCAAAAT-3′、下游序列:5′-GGCTGTTGTCATACTTCTCATGG-3′。
1.2 细胞培养
人正常肝细胞LO2和人肝癌细胞株Hep3B、Huh-7细胞均用含15%的胎牛血清DMEM培养基,置于37 ℃、5%CO2恒温培养箱中进行培养。
1.3 qRT-PCR检测人正常肝细胞与肝癌细胞中POLA2基因的表达水平
收集人肝癌细胞Hep3B和Huh-7细胞及正常肝细胞LO2,分别加入1 mL Trizol,吹打静止10 min。先后加入氯仿、异丙醇,并于12 000 r·min-1离心15 min,弃去上清液。RNA沉淀经75%乙醇洗涤后,加入25 mL无酶水稀释,测量RNA浓度,根据TaKaRa试剂盒说明书进行逆转录及实时荧光定量PCR扩增检测POLA2基因的表达量。POLA2基因以GAPDH为内参,PCR扩增条件:95 ℃ 30 s;95 ℃ 5 s、60 ℃ 30 s,共40个循环。以2-ΔΔct值表示目的基因的相对表达水平。
1.4 TCGA数据库POLA2表达水平和临床数据收集
从TCGA数据库(https://cancergenome.nih.gov/)下载HCC患者POLA2 mRNA的表达数据及临床资料信息,用R软件(v3.6.3)和Perl语言处理并整合数据,共得到374例肝癌和50例正常肝组织的数据。将374例肝癌以POLA2 mRNA表达量中位值为界,分为高表达组和低表达组。
1.5 TIMER数据库评估POLA2对HCC免疫浸润的影响
通过TIMER数据库(http://cistrome.shinyapps.io/timer),评估肿瘤-免疫相互作用的分子特征,计算在HCC中POLA2表达水平与六种肿瘤浸润性免疫亚群(CD8+T细胞、CD4+T细胞、巨噬细胞、B细胞、树突状细胞、中性粒细胞)丰度的相关性。
1.6 HPA数据库分析POLA2蛋白的表达
选取人类蛋白表达图谱(HPA)数据库(https://www.proteinatlas.org/)中免疫组织化学抗体(HPA037570),分析肝癌组织和正常肝组织中POLA2蛋白的表达及染色程度。
1.7 TCGA数据库肝癌中POLA2共表达基因及富集分析
利用TCGA数据库mRNA表达数据,以|cor|>0.4和P<0.05为阈值,用R软件“stat”包分析肝癌中POLA2的共表达基因,以FDR<0.2和P<0.05为阈值,“cluster Profiler”包进行基因本体(GO)生物功能及京都基因与基因组百科全书(KEGG)通路富集分析,“ggplot2”包可视化结果。用STRING数据库(https://string-db.org)构建与POLA2蛋白互相作用的调节网络。
1.8 统计学方法
使用R(v3.6.3)和IBM SPSS Sta-tistics 25.0软件进行统计学分析。ROC曲线由“pROC”包生成,POLA2基因在肝癌组织与正常肝组织间的表达差异采用Mann-WhitneyU检验,计量资料配对样本间的比较采用配对t检验,POLA2 mRNA表达水平与病理参数之间的相关性采用Logistic回归分析,生存分析采用Kaplan-Meier法、单及多因素Cox回归模型分析。通过Spearman相关分析在TIMER数据库中进行基因表达校正。以P<0.05为差异有统计学意义。
2 结果
2.1 肝癌组织、癌旁正常组织及肝癌细胞中POLA2基因表达水平
Mann-WhitneyU检验分析显示,肝癌中POLA2的表达水平明显高于正常肝组织及配对的肝组织(P<0.001,图1A—B);同时qRT-PCR检测显示,POLA2在肝癌细胞中表达水平均显著高于正常肝细胞(P<0.05,图1C);T分期中T3+T4期患者POLA2的表达水平显著高于T1+T2期患者(P<0.05,图1D);临床分期中Ⅲ+Ⅳ期患者POLA2的表达水平显著高于Ⅰ+Ⅱ期患者(P<0.05,图1E);POLA2诊断肝癌的ROC曲线下面积为0.954(图1F)。
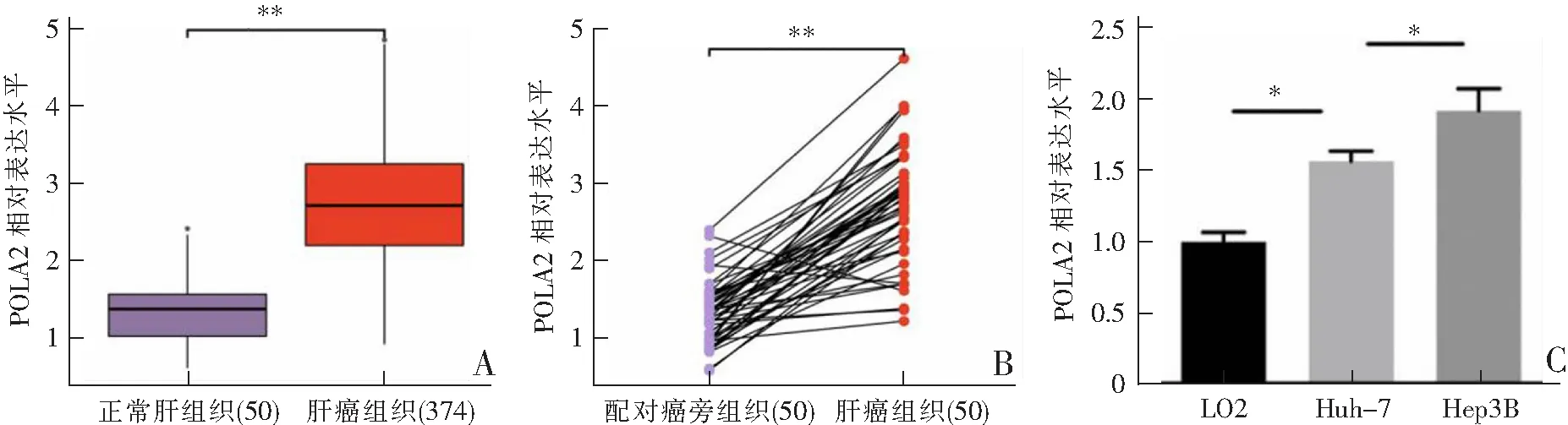
A:POLA2在正常肝组织与肝癌组织中的表达;B:POLA2在肝癌组织与癌旁组织中的表达;C:POLA2在正常肝细胞与肝癌细胞中的表达;*P<0.05,**P<0.001。
2.2 POLA2蛋白在肝癌组织中呈高表达
根据HPA(https://www.proteinatlas.org/ENSG00000014138-POLA2/pathology/liver+cancer#img)数据库结果显示POLA2主要在肝癌细胞核表达,肝癌组织中POLA2蛋白表达水平显著高于正常肝组织。见图2。
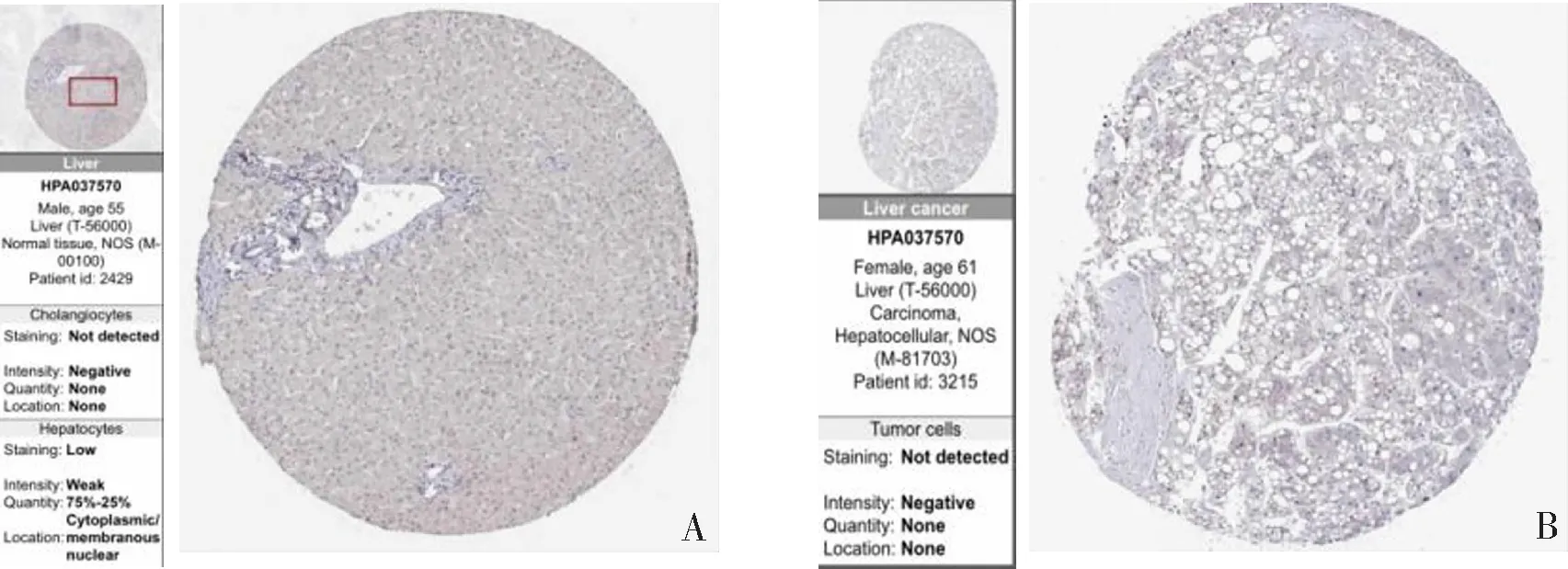
A:POLA2在正常肝组织中的表达;B:POLA2在肝癌组织中的表达。
2.3 TCGA数据库中POLA2表达与肝癌患者临床病理特征的关系
Logistic回归分析显示,POLA2高表达与临床分期、T分期、组织学分级、患者年龄、甲胎蛋白(AFP)水平及是否伴血管侵犯密切相关(P<0.05或P<0.001),见表1。
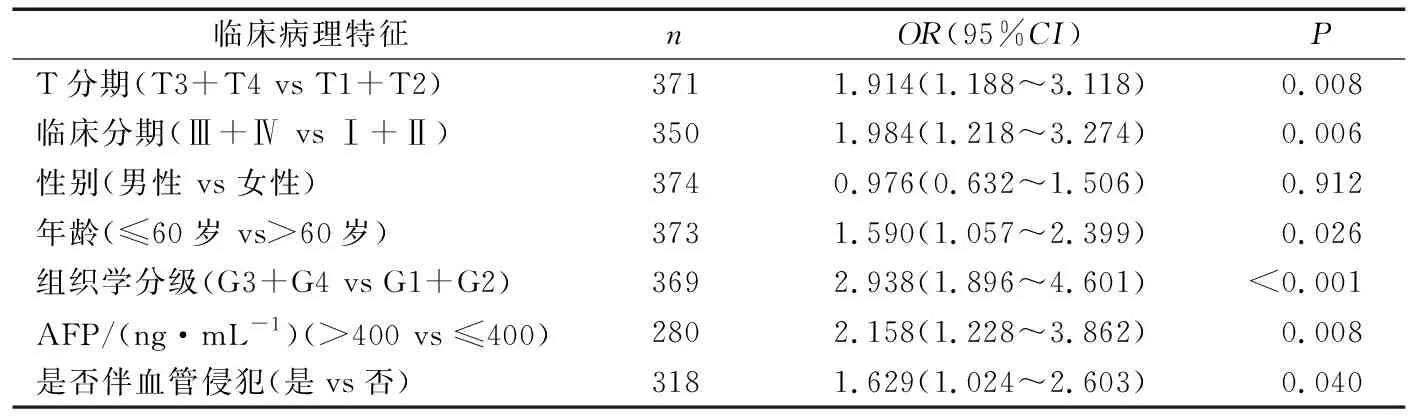
表1 POLA2表达水平与肝癌临床病理特征的相关性分析
2.4 TCGA数据库中POLA2高表达与肝癌患者不良预后有关
Kaplan-Meier分析发现POLA2基因高表达的总生存率(OS)(P=0.005)、特异性生存率(DSS)(P=0.016)和无进展生存率(PFI)(P=0.041)均显著降低(图3A—C)。单因素Cox回归显示,临床分期、T分期以及POLA2表达水平可有效地预测肝癌患者的生存状态(P<0.01);多因素Cox回归显示,POLA2表达水平与肝癌患者预后不良相关(P<0.01),可成为预测肝癌患者的独立预后因子,见表2。
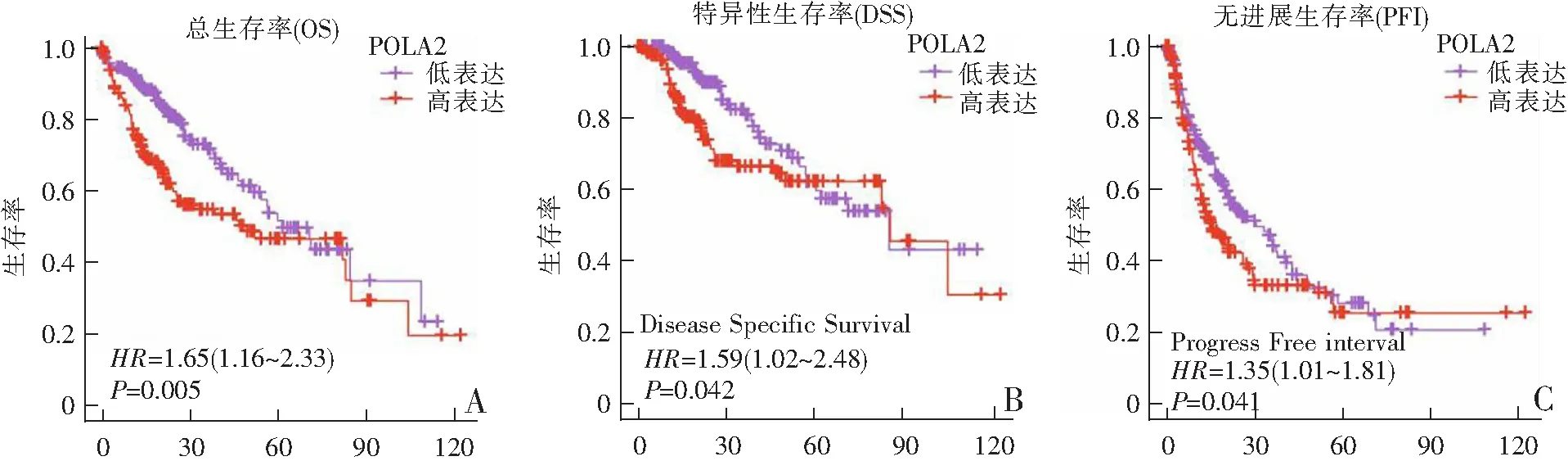
t/个月 t/个月 t/个月

表2 肝癌预后影响因素单、多因素Cox回归分析
2.5 肝癌POLA2共表达基因功能富集分析
为了探究肝癌中POLA2基因的潜在分子机制,本研究利用TCGA数据库进行了共表达基因功能富集分析,以Pearson相关系数>0.4且P<0.05作为筛选条件,结果显示与POLA2正相关的基因有5143个,热图展示了前50个与POLA2正相关的共表达基因(图4A);选取前400个共表达基因进行功能富集分析,结果显示共表达基因主要富集于细胞周期、DNA复制和范可尼贫血通路,其主要的分子功能是保持DNA解旋酶的活性和DNA依赖的ATP酶的活性(图4B)。
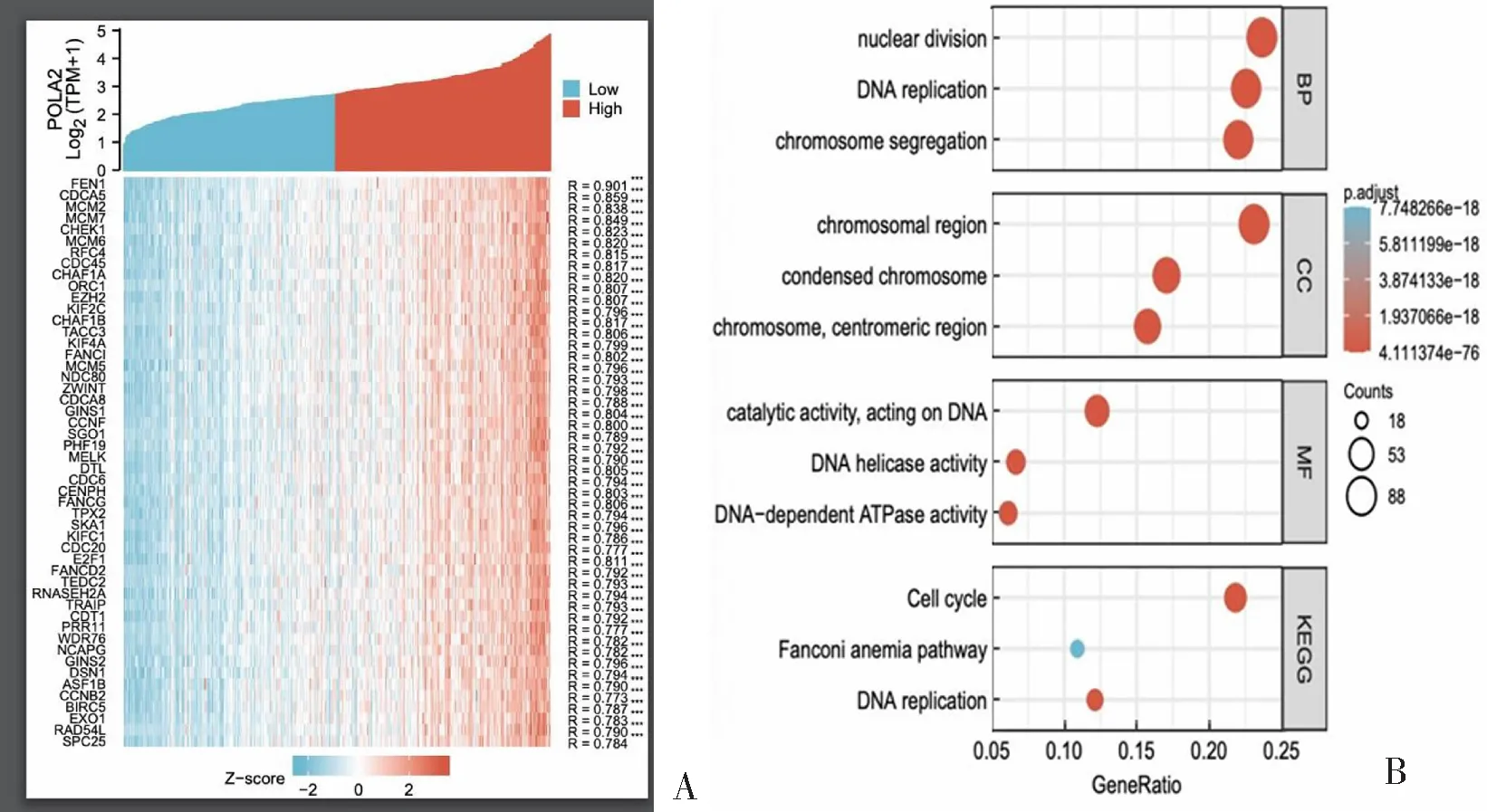
A:POLA2共表达基因热图;B:POLA2生物学功能富集分析。
2.6 POLA2表达水平与肝癌免疫细胞浸润水平相关
本研究先基于Spearman相关分析POLA2的表达水平(TPM)与免疫细胞富集水平(由ssGSEA产生)之间的相关性,发现与POLA2正相关系数最高的是Th2细胞(r=0.632、P<0.01,图5A—B)。然后利用TIMER数据库分析了POLA2表达水平与HCC免疫浸润细胞的关联性,结果表明POLA2的表达与肿瘤纯度、CD8+T细胞、巨噬细胞、CD4+T细胞、中性粒细胞和B细胞呈显著正相关(均P<0.05,图5C)。本研究进一步分析了HCC组织中POLA2表达与免疫细胞表面标记物之间的相关性,结果显示,POLA2表达与B细胞、巨噬细胞、CD8+T细胞、中性粒细胞、树突状细胞、Th2细胞、调节性T细胞和耗竭T细胞标志基因的表达显著相关(均P<0.05,表3)。

A—B:POLA2表达水平与TH2细胞富集程度的相关性;C.POLA2与肝癌免疫浸润的相关性。

表3 HCC组织中POLA2表达与免疫细胞表面标记物之间的相关性
3 讨论
肝癌与全世界高死亡率有关。尽管医学技术高速发展,肝癌的高复发率和远处转移仍无法解决。预后生物学标志物在癌症诊断和治疗中表现出光明前景,他们可以帮助预测肿瘤患者的预后,以改善临床治疗决策并筛选出对特定治疗最有效的患者。因此,寻找可靠的预后标志物对肝癌的诊断和治疗具有重要意义[11]。近年来,生物信息学技术为肿瘤的诊断和治疗提供重要的生物标志物,可以帮助分析肝癌基因层面的变化,探究肝癌发生发展机制,并为其治疗提供理论参考。
POLA2是POLα其中的一个亚基,在参与DNA复制的起始、DNA修复、同源重组中发挥了关键作用。有研究[12-13]表明,POLA2的缺失会影响DNA延伸能力,从而导致DNA双键断裂形成外源性DNA损伤。同时,NHEJ(非同源末端连接)和HR(同源重组)修复途径在调控细胞周期具有重要作用,POLA2的缺失会导致细胞HR或NHEJ修复功能缺陷,从而DNA解旋后因无法延伸而引发基因组的毒性应激。因此,POLA2在维持基因组完整性和调控细胞周期方面都发挥了重要作用,POLA2表达失调可促进细胞增殖以及肿瘤发生。
研究显示POLA2参与了多种肿瘤(膀胱癌、乳腺癌、非小细胞肺癌、卵巢癌、胃肠道间质瘤、多形性胶质母细胞瘤)的发生发展过程并作为患者预后标志物。DANG等[12]的研究表明,POLA2在多形性胶质母细胞瘤中表达显著上调并且与患者较差的生存率有关;CAO等[14]的研究同样发现,POLA2可作为膀胱癌的致癌因子促进肿瘤的血管新生和细胞分裂导致患者不良预后;ALBOGAMI等[15]的研究发现,乳腺癌中下调POLA2可在体外抑制乳腺癌细胞DNA的复制能力。目前POLA2基因已被证实对各种癌症的预后有显著的影响,本研究结合多种生物信息学方法,证实了POLA2在肝癌组织中的表达水平高于正常肝组织及配对的癌旁组织,在蛋白水平上同样验证了POLA2在肝癌组织中高表达。利用qRT-PCR技术进一步验证了POLA2在肝癌细胞株Hep3B、Huh-7中表达水平同样高于人正常肝细胞株LO2。ROC曲线分析显示POLA2对肝癌具有较高的诊断价值,这些结果表明POLA2是一个诊断肝癌的潜在分子靶标。进一步探究POLA2与肝癌患者临床特征的相关性发现,POLA2的高表达与患者OS、DSS、PFI相关,单、多因素Cox回归和Logistic回归结果显示POLA2表达水平与肝癌患者临床分期、组织学分级以及T分期密切相关,这些结果均表明POLA2可能是HCC的一个潜在治疗靶点。为了寻找POLA2在肝癌中可能发挥的作用机制,本研究利用TCGA数据库进行POLA2共表达基因筛选,筛选前400个共表达基因进行了GO/KEGG富集分析,发现其可能的机制是通过影响细胞周期、DNA复制和范可尼贫血通路而导致了肝癌的发生发展。本研究还发现POLA2表达水平与HCC中多种免疫细胞浸润相关,其中与Th2具有显著正相关,Th1/Th2漂移一直与HCC发生发展相关并导致患者预后不良[16],因此POLA2可能通过上调Th2细胞浸润水平促使肝癌的恶性进展。更重要的是POLA2与肿瘤纯度、B细胞浸润、CD4+和CD8+、T细胞、巨噬细胞、中性粒细胞也呈显著正相关。此外,研究还发现POLA2表达水平与B细胞标志物、Th2细胞标志物、调节性T细胞标志、中性粒细胞标志物、巨噬细胞标志物、耗竭T细胞标志物等仍然具有显著相关性,这表明POLA2可能通过调节免疫细胞浸润水平并帮助肿瘤细胞免疫逃逸而影响HCC患者预后。
综上所述,POLA2在肝癌组织及肝癌细胞中高表达,并且其表达与患者临床病理信息、预后以及免疫细胞浸润水平具有相关性。因此,可以推测POLA2具有作为诊断肝癌并预测患者预后的分子标记物的潜力,虽然本研究使用TCGA数据库对POLA2基因在肝癌中的作用进行探索,但未进行临床样本收集及细胞水平验证,后期将在肝癌细胞系中进行其生物学功能及机制的研究,为肝癌的诊断和预后提供新的生物标志物。
