枇杷叶粉对植物乳杆菌生长特性的影响
2022-07-15沈智峰潘虹胡钢亮姜荷肖舒珺袁海娜肖功年
沈智峰,潘虹,胡钢亮,姜荷,肖舒珺,袁海娜,肖功年*
(1.浙江科技学院 生物与化学工程学院,浙江 杭州 310023;2.浙江省食品工业协会,浙江 杭州 310009;3.杭州千岛湖康诺邦健康产品有限公司,浙江 杭州 311705;4.杭州市食品药品检验研究院 浙江省市场局乳及乳制品监管重点实验室,浙江 杭州 310052)
近年来,关于乳酸菌的研究主要集中在乳酸菌的筛选和功能探究方面,植物乳杆菌(Lactobacillusplantarum)是一类典型的乳酸菌,属于乳杆菌科乳杆菌属,革兰氏阳性菌、兼性厌氧菌。环境适应能力较强,能在10 ℃环境下生长,但温度到达45 ℃不生长,最适生长温度为30~35 ℃。耐酸碱性强,在pH 4.5~9.5环境下均能生长,最适pH为6.5左右。植物乳杆菌呈短杆状,少数呈链状,不产生芽孢,在MRS琼脂培养基中呈乳白色不透明、中间凸起、光滑、细小密集的菌落,属于同型发酵菌,能利用葡萄糖、蔗糖、麦芽糖、乳糖等多种糖类产酸。该类菌的活菌数较其他乳酸菌高,在繁殖过程中能产生特有的乳酸杆菌素[1]。
目前关于功能性固体饮料开发的企业越来越多,也有部分企业开始关注乳酸菌与一些枇杷叶、抹茶粉、麦苗粉等新食品原料相结合,开发具有地方特色的新产品。枇杷叶[2]为蔷薇科植物枇杷(Eriobotryajaponica)的叶子,又名巴叶、芦桔叶,含有三萜酸、黄酮、多酚、多糖等成分,具有清肺止咳、和胃利尿、止渴、降血糖、降血脂、抗氧化、抗炎等功效,是卫生部公告批准的新资源食品[3]。枇杷叶粉为枇杷叶干燥研磨后的产物,呈棕黄色粉末状,能溶于水[4-5]。本文以植物乳杆菌(LactobacillusplantarumKCTC3104)为研究对象,分析枇杷叶粉对其生长特性的影响,探索碳源、氮源的生物转化,以期为开发相关产品奠定基础。
1 材料与方法
1.1 材料
菌种为植物乳杆菌(LactobacillusplantarumKCTC3104),为本实验室自筛。
MRS肉汤、MRS琼脂购自杭州百思生物技术有限公司;琼脂购自北京奥博星生物技术有限公司;枇杷叶粉购自杭州千岛湖康诺邦健康产品有限公司;蔗糖(分析纯AR)购自上海展云化工有限公司;脲(尿素)(分析纯AR)购自国药集团化学试剂有限公司;胰蛋白和大豆蛋白购自上海博微生物试剂有限公司;酵母浸膏购自杭州微生物试剂有限公司
1.2 主要仪器与设备
YXQ-LS-50SII立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;洁净工作台、HWS型恒温恒湿器,宁波东南仪器有限公司;FA2004N电子天平,上海菁海仪器有限公司;HH-6数显恒温水浴锅,国华电器有限公司;UV-5200PC紫外可见分光光度计,上海元析仪器有限公司;尼康YS100电子显微镜,上海泽仕光电科技有限公司。
1.3 方法
1.3.1 菌落特性观察
将去离子水滴在干净的载玻片中间,用灼烧后冷却的接种环挑取菌落至载玻片上,在室温下待水分自然蒸发后,用革兰氏染色法对装片进行染色。
将染色完成后的装片放置在电子显微镜下先用低倍镜寻找菌落,后旋转物镜调至高倍镜,调节细准焦螺旋至图像清晰,确保能看清相应观察目标后对单个细菌进行观察。
1.3.2 单菌落分离试验
称取MRS肉汤5.2 g至锥形瓶中,加入0.1 L水,振荡摇匀,使其完全溶解,分装到若干试管中,塞上橡胶塞裹上牛皮纸灭菌,待灭菌完成后的培养基冷却后,在超净台上用灼烧后冷却的接种环蘸取菌液至试管中,将接种的试管放置在35 ℃恒温培养箱中培养12 h[6-7]。
称取MRS琼脂6.4 g和相应量的枇杷叶粉于装有0.1 L水的锥形瓶中,塞上橡胶塞、振荡摇匀后放入高压蒸汽灭菌锅121 ℃灭菌15 min。灭菌完毕取出冷却至45 ℃左右,在超净工作台倒平板,待培养基冷却凝固后倒置。梯度浓度枇杷叶粉MRS琼脂培养基配料见表1。
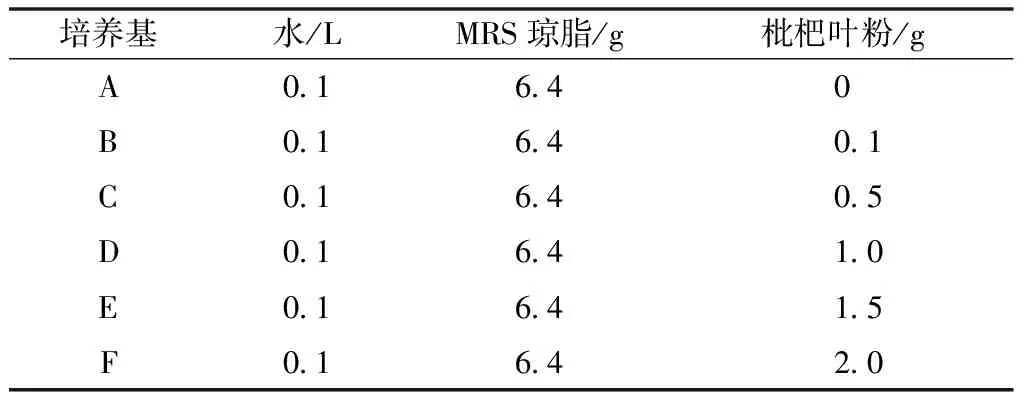
表1 梯度浓度枇杷叶粉MRS固体培养基配料
用移液枪移取1 mL菌液于9 mL无菌水中进行梯度稀释,共稀释10-1、10-2、10-3、10-44个梯度进行涂布分离,稀释后各取0.5 mL菌液至含有不同浓度枇杷叶粉的平板上,用灭菌过的涂布器将菌液均匀涂抹开,倒置后放入35 ℃恒温培养箱培养,12 h后观察单菌落形态并记录。
1.3.3 生长动力试验
在超净台用灼烧后冷却的穿刺针蘸取菌液后垂直穿入MRS半固体培养基进行接种,并置于35 ℃恒温培养箱培养。12 h后观察试管内植入乳杆菌的生长情况并记录。培养基的配置如表2所示。

表2 梯度浓度枇杷叶粉MRS液体培养基配料
1.3.4 生长曲线初步测定
用接种环蘸取菌液接种到各个试管中,并设置不接种菌液的培养基为对照组,接种完后用无枇杷叶粉的培养基作为对照组对分光光度计(D595)进行调零,对各浓度试管进行吸光值的测量,每隔2~4 h测量1次。
1.3.5 枇杷叶粉浓度对植物乳杆菌生长的影响
重复1.3.4中步骤用接种环蘸取菌液接种到各个试管中,每个梯度浓度均设置一组对照组,每组测量均用对应的对照组进行调零后进行吸光值测量,绘制菌种进行0~12 h的生长曲线(测量时间取接种后0、4、8、12 h)。
1.3.6 额外碳、氮源作用下枇杷叶粉对植物乳杆菌生长的影响
配置MRS液体培养基于锥形瓶,待完全溶解后分装到若干试管中,标注A~F,加塞后放入高压蒸汽灭菌锅,121 ℃灭菌15 min[8],灭菌完毕后置于试管架上冷却后接种。添加枇杷叶粉和额外碳、氮源的MRS液体培养基配料见表3。试验步骤参考Fatmawati等[9-10]。
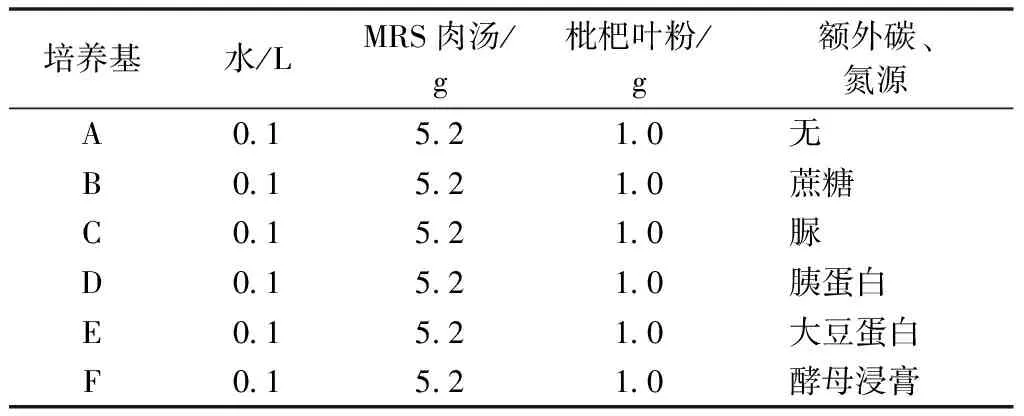
表3 梯度浓度枇杷叶粉MRS液体培养基
1.4 数据处理
采用Origin 2021对试验数据进行绘图分析。
2 结果与分析
2.1 菌落特性
植物乳杆菌菌种为直或稍有弯曲的杆状,单个、偶有成对或成链状,无鞭毛,革兰氏阳性菌。对菌落进行显微观察,目标菌种以直杆状为主,少数呈弯杆状,偶有成对和成链状菌,菌种四周光滑,无鞭毛等结构;通过革兰氏染色法染色后,菌种在显微镜(×100油镜)下呈现蓝色或蓝紫色(图1),是明显的革兰氏阳性性状。
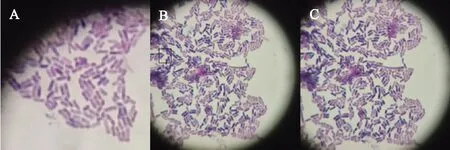
图1 电子显微镜下的植物乳杆菌
对电子显微镜下菌种形态对比分析可见,图1中A菌种呈紫色、杆状,特性明显,个体清晰,菌种边缘光滑,无鞭毛等器官;图1中B和C菌种呈紫色,少数呈蓝紫色,杆状,形态明显,个体较为清晰,菌种边缘光滑,无鞭毛,少数有杆状连续个体。综合图1中A、B、C,此菌种性状符合植物乳杆菌菌种形态特征,确定为本试验所需菌种。
2.2 植物乳杆菌的菌落形态
植物乳杆菌单菌落形态为凸起,呈圆形,表面光滑、细密、色白,偶有浅黄或深黄色。对目标菌进行单菌落分离试验,目标菌单菌落呈现白色圆形凸起状,偶有淡黄色,菌落表面光滑,周围光滑无明显锯齿,细密。综合所观察到的单菌落特点,符合植物乳杆菌单菌落形态特征(图2~4)。
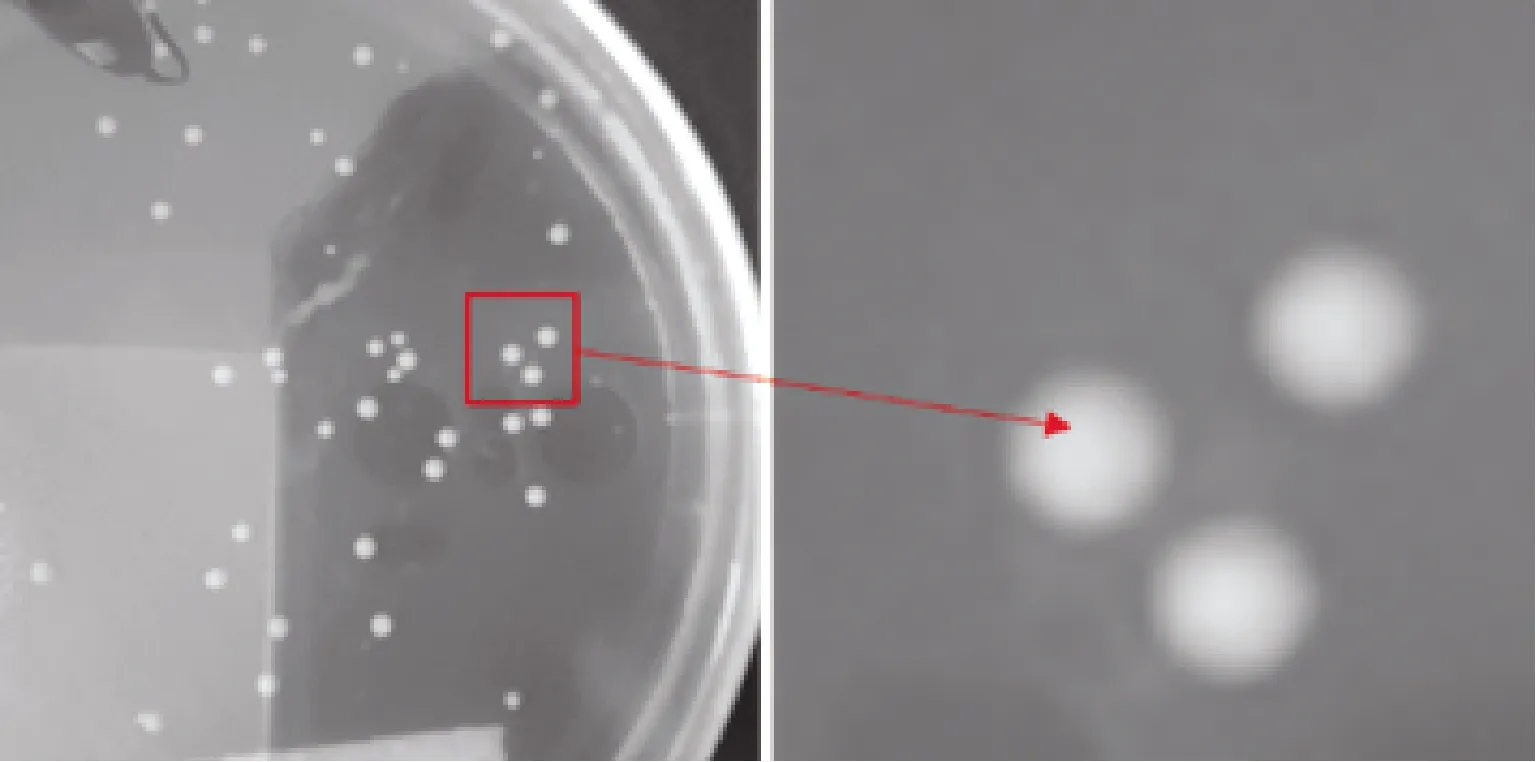
图2 植物乳杆菌单菌落形态
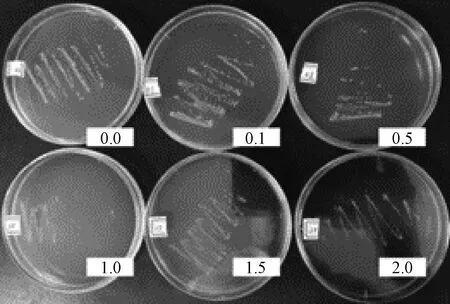
图3 划线分离
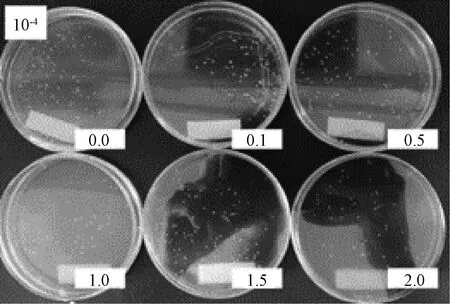
图4 涂布分离
2.3 涂布分离单菌落
植物乳杆菌单菌落分离实验通过改变培养基所含枇杷叶粉浓度,用控制变量法探究枇杷叶粉对植物乳杆菌菌落形成的影响。如图5在0~20.0 g·L-1枇杷叶粉下,培养基上均生长出一定数量的单菌落,当不添加枇杷叶粉时,植物乳杆菌单菌落分离状况最佳,菌落分布均匀且菌落间区分明显,计数清晰便捷。当枇杷叶粉浓度提高,相同浓度的菌液所分离出的单菌落少于同等浓度下不加枇杷叶粉的组别。所以植物乳杆菌能在含有枇杷叶粉的环境下进行正常的生长繁殖,但是会受到枇杷叶粉的抑制作用,且枇杷叶粉浓度越高抑制作用越显著。
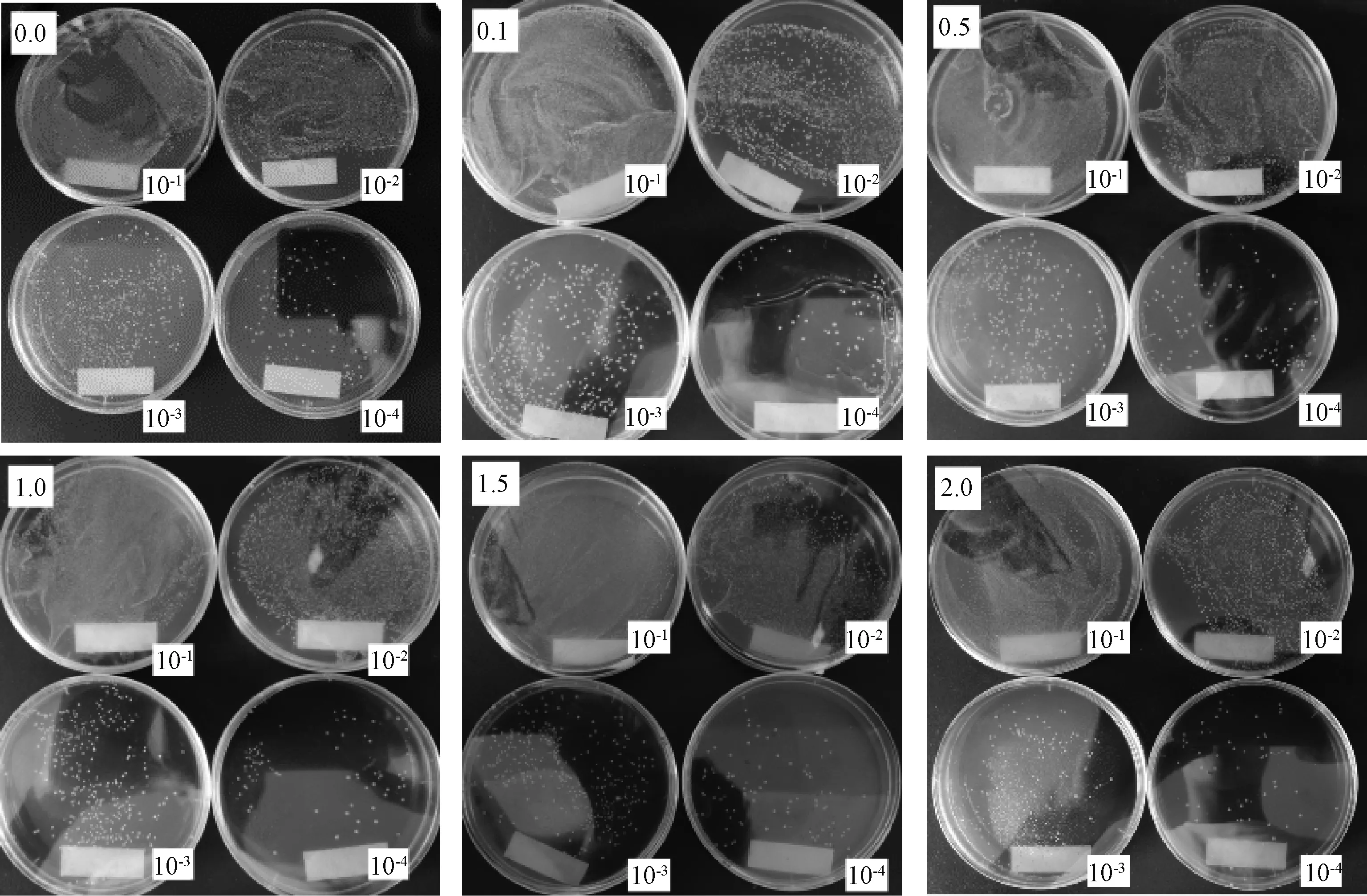
图5 枇杷叶粉浓度梯度涂布分离
2.4 生长动力试验结果
植物乳杆菌生长动力采用半固体培养基细菌穿刺试验开展,试验结果见表4。试验两组在不同浓度的枇杷叶粉环境下,半固体培养基内接种的植物乳杆菌均呈现出沿穿刺路径生长,并未向四周生长开来的现象,生长路径整体呈现由粗至细的针状,粗细变化较小。该现象说明,植物乳杆菌在枇杷叶粉条件下细菌运动性能较差[11-12]。
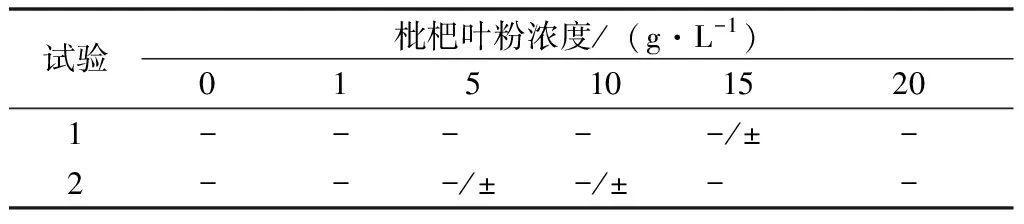
表4 枇杷叶粉浓度对植物乳杆菌生长动力的影响
2.5 生长曲线
以枇杷叶粉为培养基配料,探索不同浓度枇杷叶粉对植物乳杆菌生长特性的影响,试验结果见图6。从图中可以看出,添加枇杷叶粉的植物乳杆菌与未添加枇杷叶粉的植物乳杆菌相比生长情况较慢,说明枇杷叶粉对植物乳杆菌的生长有一定的抑制作用,当添加量为20.0 g·L-1时,植物乳杆菌基本上呈平缓曲线上升,而不添加枇杷叶粉时,植物乳杆菌基本呈陡直线上升,不添加枇杷叶粉在培养10 h后繁殖较快,快于5.0、10.0 g·L-1和20.0 g·L-1组,这可能是由于培养基中含有的枇杷叶粉对植物乳杆菌的生长繁殖或代谢活动产生了抑制作用,并且随着枇杷叶粉浓度的上升,抑制作用也更加显著。
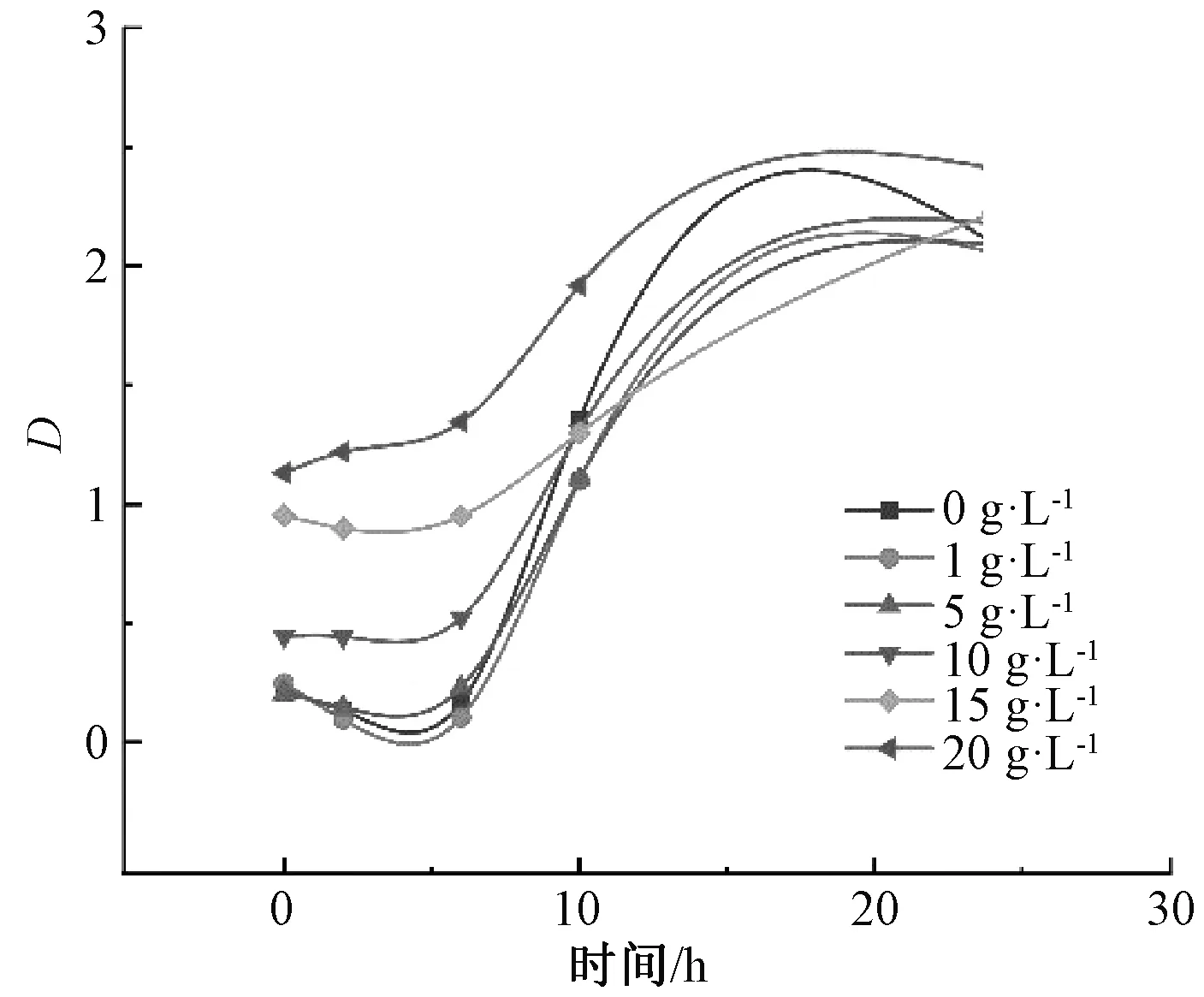
图6 不同枇杷叶粉浓度对植物乳杆菌生长曲线的影响
2.6 额外碳、氮源对植物乳杆菌生长曲线的影响
在添加了额外碳、氮源后植物乳杆菌的生长特性曲线如图7。从中可知,在10 h后不添加额外碳、氮源的实验组吸光值低于添加额外碳、氮源的组别,生长速率也在10 h后低于其他组,说明额外的碳、氮源能够促进植物乳杆菌的生长繁殖[13]。

图7 额外碳源、氮源作用下0~12 h植物乳杆菌生长曲线
同时添加额外碳、氮源与枇杷叶粉,探究在添加枇杷叶粉后额外碳、氮源对植物乳杆菌生长特性的影响。如图8,试验各组生长速率差距较小,在10 h后,植物乳杆菌的生长趋于平稳,并将逐渐到达稳定,添加枇杷叶粉后植物乳杆菌更快进入稳定期,细菌的生长繁殖速率和衰亡速率趋于相等,说明添加枇杷叶粉后的微生物环境容量降低,枇杷叶粉对于植物乳杆菌的生长繁殖起到了抑制作用。此外,添加枇杷叶粉后各组别吸光值差异较小,额外碳、氮源对于植物乳杆菌的促进作用不显著,说明在添加枇杷叶粉后,植物乳杆菌的生长繁殖受到抑制。
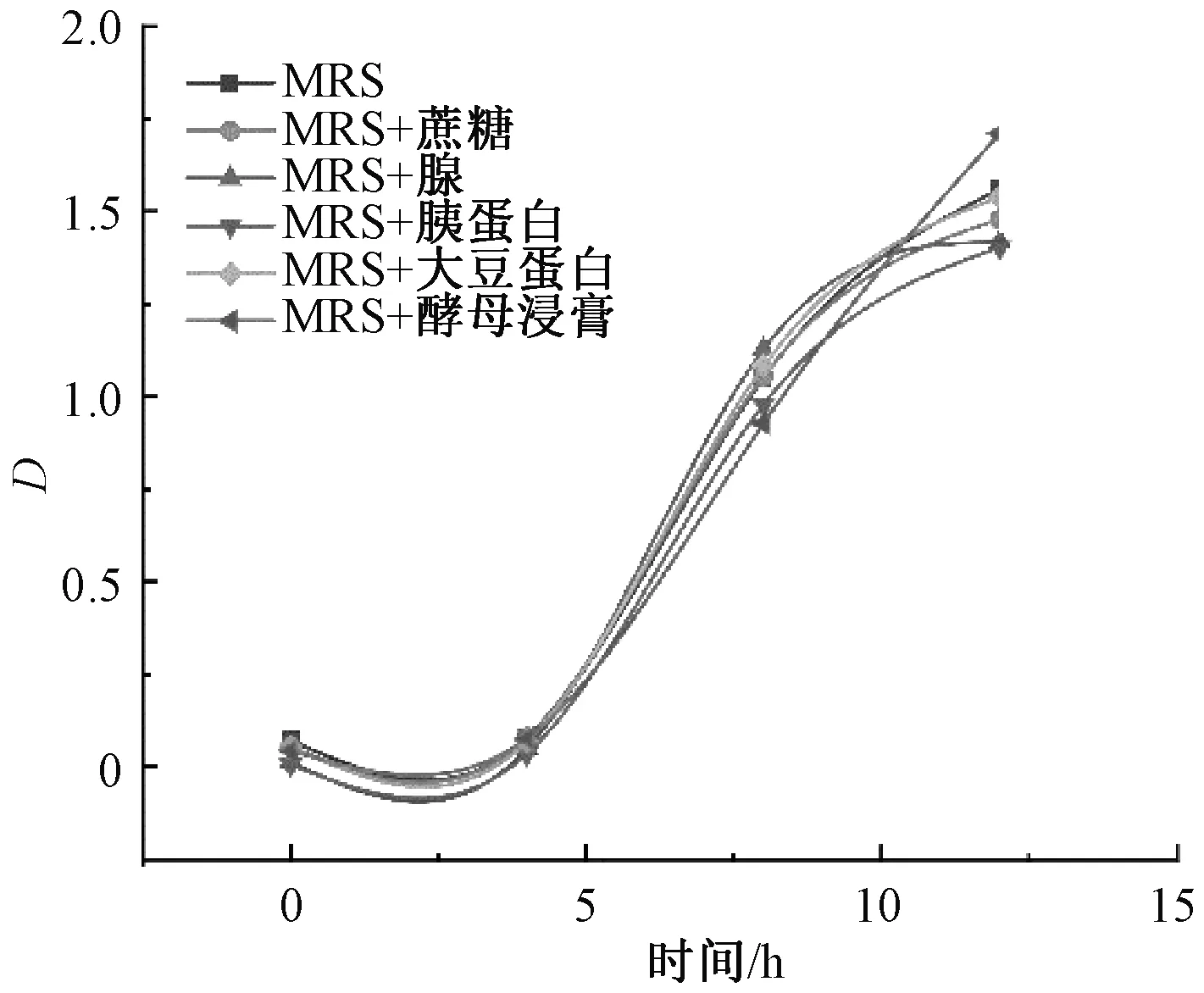
图8 梯度浓度枇杷叶粉环境中额外碳、氮源作用下0~12 h植物乳杆菌生长曲线
3 小结
本文以植物乳杆菌(LactobacillusplantarumKCTC3104)为研究对象,研究表明,植物乳杆菌能够在有枇杷叶粉的环境下进行生长繁殖,并且植物乳杆菌的分裂周期不受到影响,但枇杷叶粉的环境会抑制植物乳杆菌生长活性,使菌种的生长速率和最大环境容量降低,并且在试验所用浓度梯度下,枇杷叶粉浓度越高抑制作用越显著,并在试验所设计浓度20.0 g·L-1时抑制作用最强,添加外源的蔗糖、脲、胰蛋白、大豆蛋白、酵母浸膏等碳、氮源物质可促进其生长。
