miRNA-30C减轻高糖诱导H9c2大鼠心肌细胞损伤研究
2022-07-15李欣欣张明宇田莉娜郭素芬韩昊丞成永霞
李欣欣,张明宇,田莉娜,郭素芬,吴 琦,张 欣,韩昊丞,成永霞
(1.牡丹江医学院基础医学院病理教研室;2.牡丹江医学院附属第二医院功能科,黑龙江 牡丹江 157011;3.佳木斯大学宏大医院神经外科,黑龙江 佳木斯 154005;4.佳木斯大学医学部19级临床医学六班,黑龙江 佳木斯 154007)
糖尿病心肌病(diabetic cardiomyopathy,DCM)作为糖尿病引发的一种重要并发症,其主要的病理特征为心脏肥大、心室结构改变以及舒张和收缩功能障碍[1]。DCM会增加糖尿病患者心力衰竭的发生风险,这主要是由于心肌细胞大量凋亡引发的[2]。心肌细胞凋亡与糖尿病心肌病密切相关,而p53与心肌细胞凋亡相关[3]。MicroRNAs (miRNAs) 是一类单链小分子的非编码单链RNA,通过与目标mRNA 的3'-非翻译区 (3'-UTR) 结合,诱导 mRNA 降解或翻译抑制,从而对基因表达的调控具有显著的影响[4]。有研究表明,miR-30c的高水平可以降低心肌细胞肥大,从而在糖尿病心肌代谢中具有保护作用[5]。有报道指出,miR-30c可以通过下调p53的表达,进而降低心肌缺血再灌注损伤中心肌细胞凋亡的程度[6]。因此,我们将更近一步研究miR-30c通过调控p53减轻高糖诱导的心肌细胞凋亡研究。
1 材料与方法
1.1 材料H9c2大鼠心肌细胞株(上海酶研生物科技有限公司);DMEM(美国Gibico公司)和胎牛血清(德国 PAN公司);CCK-8试剂盒(日本同仁化学研究所);miR-30c mimics、mimics control和Bulge-LoopTM miRNA qRT-PCR Primer试剂盒(广州市锐博生物科技有限公司);DCFH-DA、JC-1荧光探针和Annexin V检测试(上海碧云天生物技术有限公司);β-actin、p53、Bcl-2和Cleaved Caspase-3抗体(上海碧云天生物技术有限公司)。
1.2 方法
1.2.1 H9c2大鼠心肌细胞培养及分组处理方法 将H9c2大鼠心肌细胞株在DMEM培养基(含有10%胎牛血清、1%青霉素/链霉素)中培养。细胞置于5% CO2及37℃恒温培养箱中培养。H9c2大鼠心肌细胞给予35 mM高糖(HG组)孵育48 h,5.0 mM葡萄糖处理48 h作为对照(NG组)。以每孔20000细胞密度接种于6孔板中,按照lipofectamineTM2000 操作说明进行细胞转染,将miR-30c mimics和mimics control转染至H9c2细胞中,转染后各组细胞给予35 mM HG孵育48 h。根据不同的处理方法将所有细胞分为四组:5.0 mM葡萄糖组(NG组);35 mM葡萄糖刺激组(HG组);转染miR-30c mimics后再进行35 mM葡萄糖刺激组(miR-30c mimics+HG组);转染mimics control再进行35 mM葡萄糖刺激组(mimics control+HG组)。
1.2.2 miR-30c表达水平检测方法 以每孔20000细胞的密度接种于6孔板中,用含10%胎牛血清的DMEM制成单细胞悬液,在5% CO2及37 ℃恒温培养箱中培养过夜,把培养细胞的6孔板每孔换成2 mL无血清培养基培养12 h后,在HG组加入高糖培养48 h,收集细胞,根据Total RNA Kit 说明书从培养细胞中分离获得总RNA。并使用1 μg总RNA利用Bulge-LoopTM miRNA qRT-PCR Primer试剂盒进行逆转录合成cDNA,再通过引物序列进行扩增。U6 为作为内参,采用2-△△Ct法分析miR-30c的相对表达量。
1.2.3 CCK-8细胞活性检测 以每孔3000细胞的密度接种于96孔板中,用含10%胎牛血清的DMEM制成单细胞悬液,在5% CO2及37 ℃恒温培养箱中培养过夜,把培养有细胞的96板每孔换成100 μL无血清培养基培养12 h后,HG组、mimics control+HG组、miR-30c mimics+HG组加入高糖培养48 h,向每孔加入10 μL CCK-8溶液,孵育1 h后,应用酶标仪在450 nm处检测光密度OD值。
1.2.4 DCFH-DA活性氧、JC-1线粒体膜电位与Annexin V细胞凋亡检测方法 以每孔10000细胞的密度接种于激光共聚焦小皿中,用含10%胎牛血清的DMEM制成单细胞悬液,在5% CO2、37 ℃恒温培养箱中培养过夜,向HG组、mimics control+HG组、miR-30c mimics+HG组加入高糖培养48 h,按照试剂盒操作说明进行检测,用激光共聚焦显微镜进行观察、拍照,应用Image J软件对荧光图片进行半定量分析。
1.2.5 Western blot检测 以每孔20000细胞的密度接种于6孔板中,用含10%胎牛血清的DMEM制成单细胞悬液,在5% CO2及37 ℃恒温培养箱中培养过夜,把培养有细胞的6孔板每孔换成2 mL无血清培养基培养12 h后,向HG组、mimics control+HG组、miR-30c mimics+HG组加入高糖培养48 h,收集细胞,离心弃上清,RIPA裂解液重悬细胞,在4 ℃冰箱摇床孵育5 min,4 ℃下12000 rpm离心10 min,取上清,Nano Drop 2000测浓度,用上样缓冲液稀释蛋白,100 ℃沸水中煮10 min,取40 μg蛋白上样,进行SDS-PAGE电泳,转模、封闭、一抗β-actin、p53、Bcl-2和Cleaved Caspase-3(1∶1000)4 ℃孵育过夜、洗膜,二抗1∶10000室温1 h,洗膜、显色。
1.3 统计学处理实验数据采用SPSS 21.0版软件用于统计分析,采用“均数±标准差”表示实验中的数据。两个组以上的比较采用单向方差分析(ANOVA),两组间比较采用t检验,P<0.01被认为是有统计学意义,独立实验至少重复3次。
2 结果
2.1 高糖对H9c2大鼠心肌细胞miR-30c的表达水平的影响与NG组相比,HG组处理的心肌细胞miR-30c的表达水平明显降低,有统计学意义(P<0.01)。说明高糖环境会抑制miR-30c的表达。见表1。
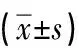
表1 两组大鼠心肌细胞中miR-30c的表达情况
2.2 转染后H9c2大鼠心肌细胞miR-30c表达水平与mimics control+HG组相比,miR-30c mimics+HG组可以显著的增加H9c2细胞中miR-30c的表达水平,统计学差异明显(P<0.001),证明miR-30c转染成功。见表2。
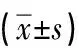
表2 转染后两组大鼠心肌细胞中miR-30c的表达情况
2.3 miR-30c过表达对高糖处理H9c2大鼠心肌细胞活力的影响与NG组相比,HG组显著的抑制H9c2细胞的活力,有统计学意义(P<0.01);与mimics control+HG组相比,miR-30c mimics+HG组可以一定程度增加细胞的活力水平(P<0.01)。提示miR-30c对高糖处理的H9c2心肌细胞起到保护作用。见表3。
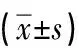
表3 各组大鼠心肌细胞中细胞存活率的情况
2.4 miR-30c过表达对高糖处理H9c2大鼠心肌细胞活性氧水平的影响与NG组相比,HG组心肌细胞绿色荧光显著增强,半定量结果显示胞内的活性氧水平显著升高,统计学差异明显(P<0.001);与mimics control+HG组相比,miR-30c mimics+HG组心肌细胞绿色荧光明显减弱,半定量结果显示胞内的活性氧水平显著被抑制,统计学差异明显(P<0.001)。以上结果表明miR-30c过表达可以抑制高糖诱导的H9c2大鼠心肌细胞活性氧水平的升高。见图1,表4。
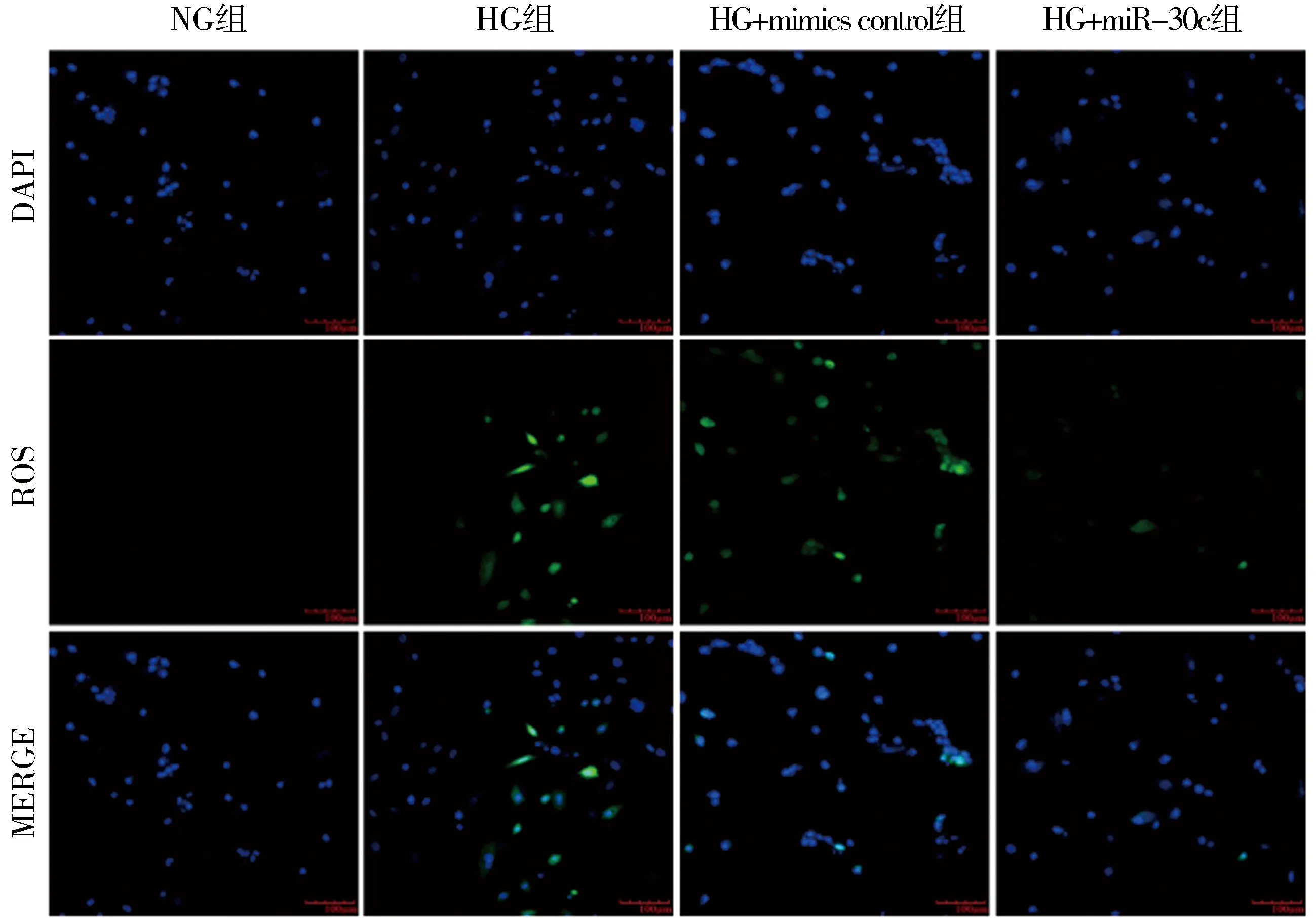
图1 DCFH-DA荧光探针检测各组细胞活性氧的水平(×200)
表4 各组大鼠心肌细胞中活性氧相对荧光强度的表达情况
2.5 miR-30c过表达对高糖处理H9c2大鼠心肌细胞线粒体膜电位水平的影响NG组红色荧光较强,表明细胞线粒体功能较好,与NG组相比,HG组心肌细胞红色荧光明显减弱,半定量结果显示细胞线粒体膜电位下降,统计学差异明显(P<0.001);与mimics control+HG组相比,miR-30c mimics+HG组心肌细胞红色荧光增强,半定量结果显示细胞线粒体膜电位降低被改善,有统计学意义(P<0.05)。以上结果表明miR-30c过表达可以抑制高糖诱导的H9c2大鼠心肌细胞线粒体功能障碍。见图2,表5。
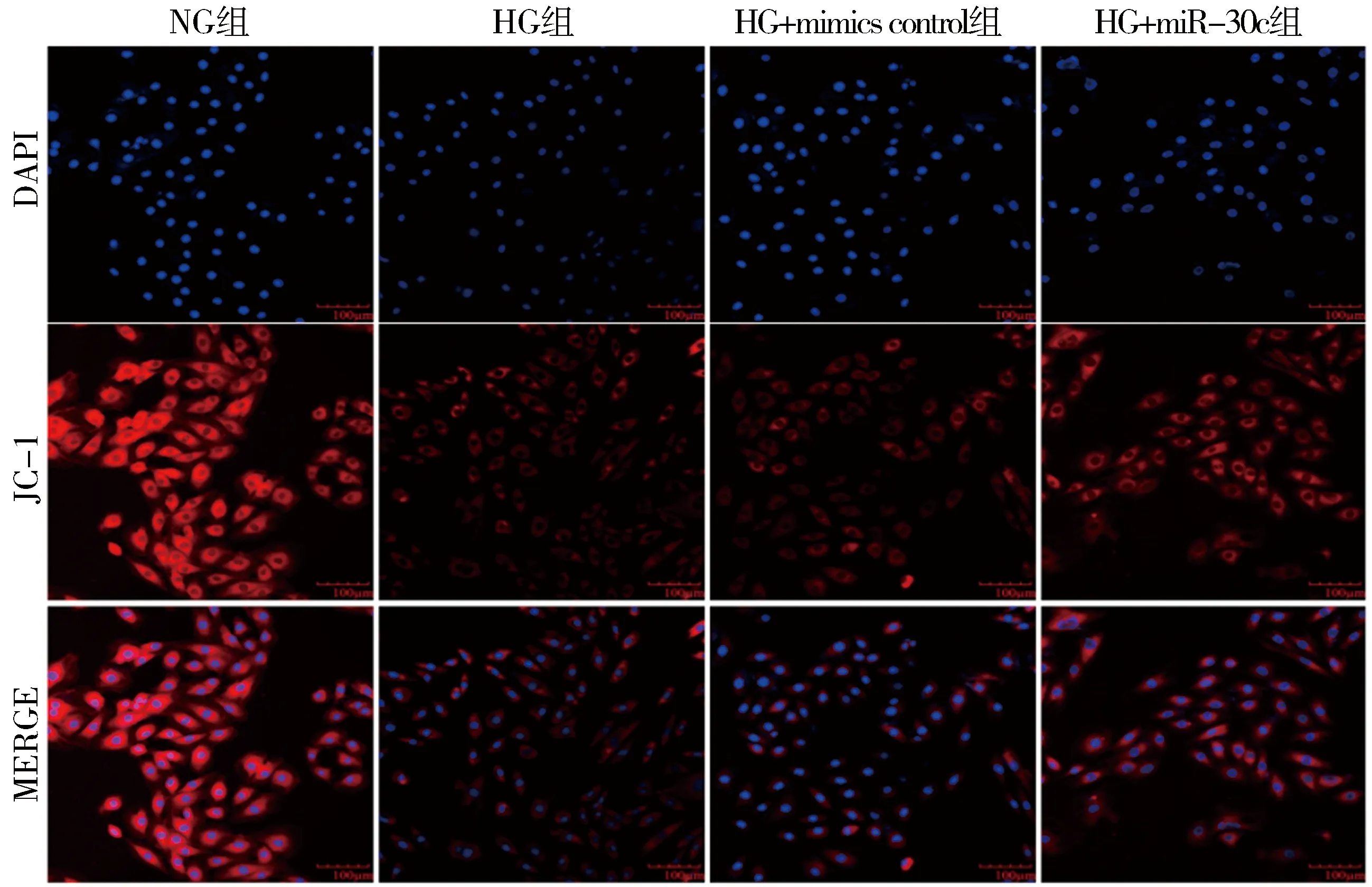
图2 JC-1荧光探针检测各组细胞线粒体膜电位的水平(×200)

表5 各组大鼠心肌细胞中线粒体膜电位相对荧光强度的表达情况
2.6 miR-30c过表达对高糖处理H9c2大鼠心肌细胞凋亡水平的影响与NG组相比,HG组心肌细胞的绿色荧光显著增强,半定量结果显示细胞发生凋亡增加,统计学差异明显(P<0.001);与mimics control+HG组相比,miR-30c mimics+HG组心肌细胞绿色荧光明显减弱,半定量结果显示细胞凋亡被抑制,有统计学意义(P<0.01)。以上结果表明miR-30c过表达可抑制高糖诱导的H9c2大鼠心肌细胞发生凋亡反应。见图3,表6。

图3 Annexin V荧光探针检测各组细胞凋亡的水平(×200)
表6 各组大鼠心肌细胞中细胞凋亡相对荧光强度的表达情况
2.7 miR-30c过表达对高糖处理H9c2大鼠心肌细胞凋亡相关蛋白p53、Bcl-2和Cleaved Caspase-3的影响与NG组相比,HG组心肌细胞抗凋亡相关蛋白Bcl-2的表达明显下降,有统计学意义(P<0.01),促凋亡蛋白p53和Cleaved Caspase-3的表达明显上调,统计学差异明显(P<0.001);与mimics control+HG组相比,miR-30c mimics+HG组心肌细胞抗凋亡蛋白Bcl-2的表达上调,有统计学意义(P<0.05),促凋亡相关蛋白p53和Cleaved Caspase-3的表达显著下降,统计学差异明显(P<0.001)。以上结果表明miR-30c过表达可负性调节p53蛋白,证明其可以减轻高糖诱导的H9c2大鼠心肌细胞凋亡损伤。见图4,表7。
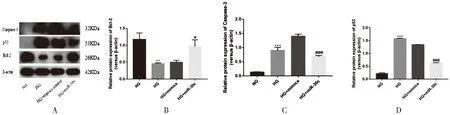
图4 Western blot检测各组细胞p53、Bcl-2和Cleaved Caspase-3蛋白表达情况
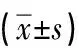
表7 各组大鼠心肌细胞中凋亡相关蛋白Bcl-2、p53和Cleaved Caspase-3表达情况
3 讨论
糖尿病心肌损伤的发生发展是一个复杂的过程,尽管多数研究认为高血糖是导致糖尿病心肌损伤的主要危险因素,目前尚未完全了解诱导心肌细胞损伤的分子作用机制[7]。既往研究表明高血糖会导致p53的表达上调,从而引发的心肌细胞凋亡与DCM的进程密不可分[8]。糖尿病心肌病的代谢异常涉及多种机制,其中氧化应激被认为是重要的途径之一,细胞内ROS的水平可以反映细胞内氧化应激的程度[9]。过量的 ROS 产生可诱导心肌细胞的线粒体功能障碍,进一步导致细胞出现凋亡。线粒体的完整性对于维持线粒体的生物功能非常重要,线粒体功能障碍作为DCM 的一个重要特征,在异常糖脂暴露后,线粒体膜电位和细胞内 ATP 浓度降低,引起心脏组织和功能的损伤[10]。
miRNA是DCM发展的关键参与者[11]。大量的实验表明,miRNA可以通过调控其靶基因从而调节心肌纤维化、和线粒体功能障碍以及心肌细胞凋亡[12]。已有证据显示miR-30c可以调控不同的通路及靶点在糖尿病心肌病和肾病中发挥着重要的作用[13-14]。在糖尿病模型的心脏组织中,miR-30c的表达受到抑制,提示miR-30c可能与糖尿病心肌病的发生发展关系密切[5]。有研究表明,miR-30c 可以通过靶向p53-p21 通路介导高血糖诱导的心肌细胞肥大和凋亡,但具体的作用机制还未完全阐明[13]。在本次研究中,我们证实了高糖环境可以抑制miR-30c的表达,引起细胞内活性氧的积累,转染miR-30c可以缓解高糖诱导的细胞内活性氧的积累以及线粒体的损伤。miR-30c可以通过调节p53的表达减少高糖诱导的H9c2 细胞损伤、起到抗凋亡的作用,对心肌细胞凋亡有一定的保护作用。
综上所述,本研究确定了miR-30c在高糖诱导心肌细胞损伤中的保护作用,为DCM
的治疗提供了一种新的策略,但是,miR-30c在线粒体功能的潜在作用机制还有待进一步研究。
