建兰红草红荷的组织培养研究
2022-07-15袁汇明侯晓杰梁魁景于占晶谢李晏刘佳倍刘宇冲
袁汇明 侯晓杰 梁魁景 于占晶 谢李晏 刘佳倍 刘宇冲
(衡水学院 河北 衡水 053000)
兰花作为“四君子”之一,自古便深受人们的喜爱与追捧,孔子称誉它为“王者之香”,并言“芝兰生于幽谷,不以无人而不香”[1];“扈江离与辟芷兮,纫秋兰以为佩”,屈原以兰为友,以兰为饰,以表达其高尚品德和崇高理想;王羲之练字借鉴兰花,将兰叶的各种姿态运用到书法中,使他的书法结构、笔法、章法的技巧达到精熟的高度[2]。
中国传统名花中的兰花仅指分布在中国植物中的若干种地生兰,如春兰、惠兰、建兰、墨兰和寒兰等[3]。建兰叶片宽窄适合,葱翠飘逸,在众多兰花中属娇媚型。建兰品种较多,根据建兰的花型和颜色来判断其珍贵程度:兰花的花型以荷瓣最为珍贵,其次是梅瓣或者水仙瓣等一些奇花;花色以纯一色及淡绿者为好,深绿者次之,瓣、唇有红丝红点者更次,初开时为红色而后转为绿色者又次之;叶色以油润光泽者为好。
建兰红草红荷为被子植物门微子目兰科兰属植物,是建兰“金荷”与“红草”的人工杂交品种[4],红草红荷是它的品种的一个总称,因为它发出来的芽呈红色,苗子在成苗前也会呈红色,因此称为红草,瓣型为荷瓣且为粉红色,即为红荷,故称红草红荷。红草红荷既是荷瓣且花色是难得的红色,发红芽,观赏性极强,是集艺草、红花以及荷瓣于一体的佳品,十分具有观赏价值和科学研究价值,市场前景广阔。红草红荷是为人们所观赏把玩的网红产品,但在成株后红色叶片变为绿色,观赏价值有所降低。为探索其变色原因,我们展开了系列试验研究。
组织培养指用植物各部分组织进行培养从而获得再生植株[5]。本试验通过用建兰红草红荷的叶片、根尖、假鳞茎等作为外植体进行组织培养[6],研究各个器官的组织培养效果,选择效果好的进行大量繁殖并商业运作。
1 材料与方法
1.1 试剂与仪器设备
1.1.1 试剂。无菌水、MS 培养基、95%酒精、75%酒精、1%次氯酸钠、30%过氧化氢等。
1.1.2 仪器设备。移液枪及枪头、电子天平、容量瓶、超净工作台、光照培养箱、加热套、pH 控制仪、高温灭菌锅、冰箱等。
1.2 试验方法
1.2.1 母液的配制。①10 倍母液Ⅰ(大量元素):分别称量硝酸16.5 g、硝酸钾19 g、二水氯化钙4.4 g、硫酸镁3.7 g、磷酸二氢钾1.7 g。②200 倍母液Ⅱ(微量元素):分别称量碘化钾0.166 g、硫酸锰4.46 g、硫酸锌1.72 g、钼酸钠0.05 g、硫酸铜0.05 g、氯化钴0.05 g、硼酸1.24 g。③200 倍母液Ⅲ(铁盐):分别称量四乙酸二钠7.46 g、5.56 g。④母液Ⅳ(有机):200 倍有机母液A 的配制,依次称量烟酸0.1g、盐酸硫胺素0.02g、盐酸吡哆素0.1 g;200 倍有机母液B 的配制,称量肌醇5 g;200 倍有机母液C 的配制,称量甘氨酸0.4 g。以上母液称量后均取少量蒸馏水进行溶解,将溶解完毕的液体依次注入1 L 的容量瓶中加蒸馏水定容,做好标记,于4 ℃冰箱冷藏储存。
1.2.2 植物激素的配制。①0.1 mg/ml 6-BA 溶液:称量25 mg 的6-苄氨基腺嘌呤,用少量1 mol/L 的盐酸溶液溶解后,再加入蒸馏水倒入250 ml 的三角瓶中定容至250 ml 并做好标记。②0.1 mg/ml NAA 溶液:称量25 mg 的萘乙酸,用热水溶解后,再加入蒸馏水倒入250 ml 的三角瓶中定容至250 ml 并做好标记。③0.1mg/ml 2,4 -D溶液:称量20 mg 的2,4-二氯苯氧乙酸,用少量95%酒精溶解后,加入蒸馏水倒入200 ml 的三角瓶中定容至200 ml 并做好标记[7]。
1.2.3 1/2MS 培养基的配制。分别量取母液Ⅰ50 ml、母液Ⅱ2.5 ml、母液Ⅲ2.5 ml、有机母液A 2.5 ml、有机母液B 2.5 ml、有机母液C 2.5 ml、0.1 mg/ml 6-BA溶液30 ml、0.1 mg/ml NAA 溶液20 ml、0.1 mg/ml 2,4-D 溶液10 ml,取大烧杯1 只,将所有的溶液依次加入其中备用。称量琼脂粉10 g、蔗糖30 g 备用。用搪瓷杯量取600 ml 蒸馏水在电磁炉上加热,倒入琼脂粉与蔗糖搅拌使其充分溶解[8]。将溶解好的琼脂粉蔗糖溶液倒入装有母液的大烧杯中充分混合,用蒸馏水定容至1 L 并调节pH 值至6.0。趁热将培养基分装至组培瓶中用封口膜封住,再放置在高温灭菌锅中121 ℃灭菌15 min,冷却凝固后即得到所需的培养基。
1.2.4 外植体的获取。选取红草红荷的红色幼叶、绿色成熟叶、鳞茎芽、根尖分别装入纱布中包好,置于流水下冲洗2 h,在已灭过菌的超净工作台中用浓度为75%的酒精浸泡2 min,后用无菌水冲洗3 次,再用1%的次氯酸钠溶液浸泡10 min,最后用无菌水冲洗5 次,即可获得所需的外植体[9]。
1.2.5 接种。组培室紫外灯灭菌2 h,超净工作台灭菌2 h,工作台用酒精擦拭1 遍,用镊子与手术剪剪取叶片1 cm2、鳞茎芽、根尖等插入培养基中,接种完毕后及时封口[10]。
1.2.6 光照培养箱中静置观察。设定光照培养箱为25℃±2 ℃全日光照模式,将接种好的组培苗放入观察。
2 结果与分析
从表1 可以看出,以建兰红草红荷组织培养的多组处理,以红色叶片(幼叶)为外植体的12 组(每组中有3~5 小片)处理,分3 批经过30 d 的连续观察,30 d时成活率为75.00%;以绿色叶片(成熟叶)为外植体的12 组(每组中有3~5 小片)处理,分3 批经过30 d 的连续观察,发现30 d 时成活率为50.00%;以鳞茎芽为外植体的12 组处理,分3 批经30 d 的连续观察,30 d 时成活率达83.33%;以根尖(水晶根)为外植体的12 组处理,分3 批经30 d 的连续观察,30 d 时的成活率仅为16.67%。
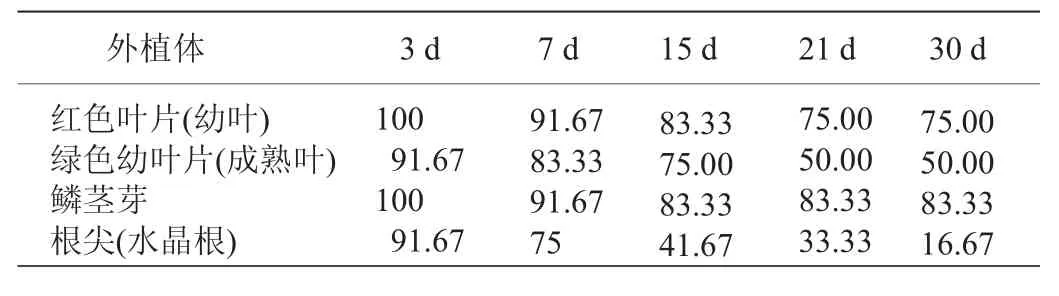
表1 建兰红草红荷外植体各部位各时间段组培成活率 (单位: %)
3 结论与讨论
在以建兰红草红荷叶片、根尖、鳞茎芽等作为外植体进行组织培养的各处理中,鳞茎芽处理优于叶片,叶片处理优于根尖处理,红色幼叶诱导成功率高于绿色成熟叶。究其原因是因为过小的外植体不易存活,而且分裂增殖的部位少;而过大的外植体污染率高、容易褐化死亡[11]。
兰科植物通过组织培养能够在短期内获得大量幼小植株,是现阶段最经济有效的快速繁殖方法,也是工厂化育苗的重要途径之一[12]。但目前我国兰花还尚未真正实现工厂化生产的地步,可能是因为组培技术快繁的试管苗在移栽后生长慢、试管苗易变异、根状茎增殖速度慢、芽分化率低等主要问题尚未得到突破,尤其是用茎尖诱导形成的根状茎初期的增殖速度更缓慢,严重阻碍了组培快繁技术在国兰种苗生产中的应用[13]。建兰红草红荷作为时代新品,相信在科学技术的不断完善下,一定可以使其大量繁育,并进一步打开市场,将科技福利送入千家万户。

