1型糖尿病伴认知功能损伤小鼠脑组织肠道菌群代谢物的改变
2022-07-14边南南丁小雨常晓娜
安 宇 边南南 丁小雨 常晓娜 刘 佳 王 广
(首都医科大学附属北京朝阳医院内分泌科,北京 100020)
1型糖尿病(type 1 diabetes mellitus,T1DM)是由胰岛β细胞的破坏和胰岛素分泌障碍而诱发的以高血糖为特征的自身免疫性疾病。T1DM可引起一系列糖尿病并发症,其中认知功能障碍较少受到关注,但严重影响了患者的生活质量。此外,T1DM患者罹患痴呆的风险明显高于2型糖尿病(type 2 diabetes mellitus,T2DM)患者[1]。因此,糖尿病相关的认知功能障碍得到了受到了越来越多的关注,但与T1DM相关认知功能下降的潜在机制尚不清楚,严重影响了其在临床上的诊断和治疗。
目前已有研究[2-3]报道了肠道菌群与T1DM的发生、发展密切相关。Gao等[2]发现T1DM大鼠的肠道微生物群被破坏,并伴有认知能力下降。通过万古霉素改变肠道菌群,减少了非肥胖糖尿病小鼠的T1DM发病率。而Zheng等[3]使用不可吸收的抗生素万古霉素来改变链脲佐菌素(streptozocin,STZ)诱导的T1DM小鼠模型的肠道菌群,并观察肠道菌群变化对T1DM小鼠认知功能的影响,发现万古霉素可导致产生乙酸的细菌的减少,从而加速了T1DM小鼠的认知能力下降,而长期的乙酸盐缺乏会减少海马的突触蛋白,并促进小鼠的认知障碍,揭示了肠道菌群代谢物通过调节肠道-大脑轴在认知功能中的重要作用。
肠道菌群作为生物体内重要的代谢“器官”,影响着宿主的整体代谢,宿主和菌群之间的“共代谢”影响机体代谢稳态。肠道菌群代谢物涵盖短链脂肪酸、中长链脂肪酸、胆汁酸、氨基酸、苯基或苄基衍生物、吲哚、碳水化合物等多种代谢物类群,涉及脂肪酸代谢、胆汁酸代谢、苯丙氨酸代谢、色氨酸代谢、糖代谢等多条重要代谢通路[4]。因此,运用代谢组学检测T1DM认知障碍小鼠脑组织肠菌代谢物的浓度变化,清晰展示小鼠肠道菌群分泌的通过外周进入脑组织的差异代谢物及潜在代谢通路,可更加直观地研究肠道菌群与T1DM诱导的认知功能障碍发生、发展的关系,从而为疾病的预防和治疗提供新的思路。
1 材料与方法
1.1 实验动物
6周龄C57BL/6雄性小鼠20只购自北京维通利华实验动物技术有限公司[实验动物许可证号:SCXK(京)2019-0010],体质量18~21g,饲养在首都医科大学附属北京朝阳医院SPF级动物房,室温(22±1)℃,湿度55%±5%,维持12 h/12 h光照-黑暗周期昼夜节律。小鼠自由饮食和饮水,饲料和饮用水在使用前分别进行了辐照和蒸汽高压灭菌处理。实验前适应性饲养观察1周,随后采用数字表法随机分为2 组:对照组(Control组,n=10)和T1DM模型组(DM组,n=10)。全部研究方法及流程均符合首都医科大学动物伦理委员会相关要求及规定(伦理编号:AEEI-2021-032)。
1.2 主要试剂与仪器
STZ购自美国Sigma公司;血糖仪及血糖试纸(卓越型)为美国罗氏公司产品;Morris水迷宫及其记录分析系统由北京众实迪创科技发展有限公司提供。代谢检测的标准品购自美国Sigma和加拿大TRC Chemicals公司。甲酸(质谱纯)购自美国Sigma公司,甲醇(质谱纯)、 乙腈(质谱纯)和异丙醇(质谱纯)购自美国赛默飞科技公司。超纯水是由装有LC-MS Pak过滤器的Mill-Q仪器所制。代谢检测采用超高效液相色谱-串联质谱联用仪进行定量测定。
1.3 T1DM小鼠模型制备
实验前小鼠禁食不禁水12 h,随后连续5 d给予STZ 40 mg/kg腹腔注射建立T1DM小鼠模型,STZ注射前溶于经高压灭菌的 0.1 mol/L、pH4.3的柠檬酸缓冲液。对照组注射等量的柠檬酸缓冲液。注射3 d后使用罗氏血糖仪尾静脉采血测定血糖,以连续2 d随机血糖稳定并>11.1 mmol/L视为造模成功。
1.4 Morris水迷宫
所有小鼠于成模后8周进行Morris水迷宫实验,来检测两组小鼠空间学习记忆水平。Morris水迷宫使用直径为150 cm、高50 cm的圆形不锈钢水池装置及追踪定位摄像系统构成,将圆形水池注满水,水温恒定在(21±1)℃并放入钛白粉,水池4周的每个象限上方固定一个参照标志物,水面被人为等分成4个象限,在第一象限的中心放置一个直径10 cm、高38 cm的圆形的平台,稍低于水平面1.0 cm。在整个Morris水迷宫实验检测过程中保持实验室内的环境安静并关闭室内灯光。
Morris水迷宫实验分成空间学习实验与记忆探索实验两个部分。前者是训练小鼠根据水迷宫四周固定参照物的空间线索,学习寻找水面下隐藏的圆形平台,从而测量小鼠的空间学习能力。整个训练期共计5 d,每天训练3次,每次训练将小鼠从圆形水池的3个不同象限面向池壁放入水中,同时开始记录小鼠探索路线及登上圆形平台所花费的时间、距离与速度,即逃避潜伏期、游泳距离与游泳速度。如果小鼠在60 s内无法找到平台,实验者将帮助其到达平台,并让小鼠在平台上停留15 s,记录逃避潜伏期为60 s。学习训练完成之后,绘制小鼠的空间学习曲线图。训练5 d完成的小鼠第6天开始记忆探索实验。通过移除水面之下的圆形平台,从圆形水池的第三象限将小鼠面向池壁放入水池内,使小鼠自由游泳60 s。记录小鼠在原平台目标象限的停留时间及穿越平台次数等数据。
1.5 小鼠脑组织宏代谢组检测
将宏代谢组检测所需的标准品精确称重,溶于水、甲醇、氢氧化钠溶液或盐酸溶液,分别配制成浓度为5.0 mg/mL的原液。选取每个标准品适量的原液混合,配制成校准溶液。行为学实验结束后,所有小鼠腹腔注射10%(体积分数)水合氯醛麻醉,拟进行宏代谢组检测的小鼠用剪刀快速断头后置于冰台上,沿小鼠颅骨矢状缝剪开颅骨,迅速取出全脑,用冰冷的0.9%(质量分数)氯化钠注射液漂洗,除去血液,滤纸拭干,置于冻存管内-80 ℃冰箱冷冻保存。选取DM组中空间记忆能力最差的6只小鼠和对照组6只小鼠脑组织进行宏代谢组检测,检测时取出脑组织样品在冰浴下解冻,称取约10 mg样品分装进1.5 mL离心管中,加入20 μL的去离子水,用10粒氧化锆珠匀浆3 min。加入120 μL预冷的含内标的甲醇溶液,匀浆 3 min,并采用18 000g转速离心20 min,完成后取将20 μL上清液转移至96孔板中。每个孔中加入20 μL新鲜配制的衍生化试剂,将板密封,置于 30 ℃进行60 min的衍生化。随后加入330μL 冰浴的50%甲醇溶液稀释样品,在 4 ℃ 下以4 000g离心30 min,吸取 135 μL上清液,转移至新的96孔板,每个孔中加入10 μL的内标。在左边孔中加入衍生化的标准品原液的梯度稀释液,最后将板密封,用于液相质谱-色谱分析。
1.6 统计学方法
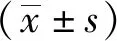
多维的数据采用主成分分析法 (principal component analysis, PCA)、偏最小二乘法判别分析(partial least square discriminant analysis, PLS-DA)及正交偏最小二乘判别分析(orthogonal partial least square discriminant analysis, OPLS-DA)进行模式识别分析, 筛选差异性代谢物。选取OPLS-DA模型第一主成分变量权重值(variable important in projection, VIP)>1的代谢物有重要贡献的变量,结合t检验或者秩和检验结果(P<0.05)筛选差异代谢物,并计算代谢物在两组中的变化倍数(fold change,FC),将筛选出的差异代谢物绘制火山图,并利用Metaboanalyst 在线代谢数据分析平台进行代谢通路分析。
2 结果
2.1 2组小鼠体质量和空腹血糖变化情况
在进行STZ腹腔注射处理前,2组小鼠体质量对照组为(22.78±0.65)g,DM组为(22.44±0.69)g,两组比较,差异无统计学意义(P=0.271)。空腹血糖对照组为(4.28±0.70)mmol/L,DM组为(4.38±0.7)mmol/L,两组比较差异无统计学意义(P=0.753)。在STZ腹腔注射后,对照组小鼠体质量逐渐增加,DM组小鼠体质量逐渐减低,STZ注射后8周两组小鼠体质量相比,差异均有统计学意义(均P<0.01,图1A)。另外,DM组STZ注射后8周空腹血糖浓度均显著较对照组小鼠升高(P<0.01,图1B)。实验过程中,DM组小鼠高血糖状态持续存在,且出现明显多尿、多饮、多食症状,T1DM小鼠模型建立成功。
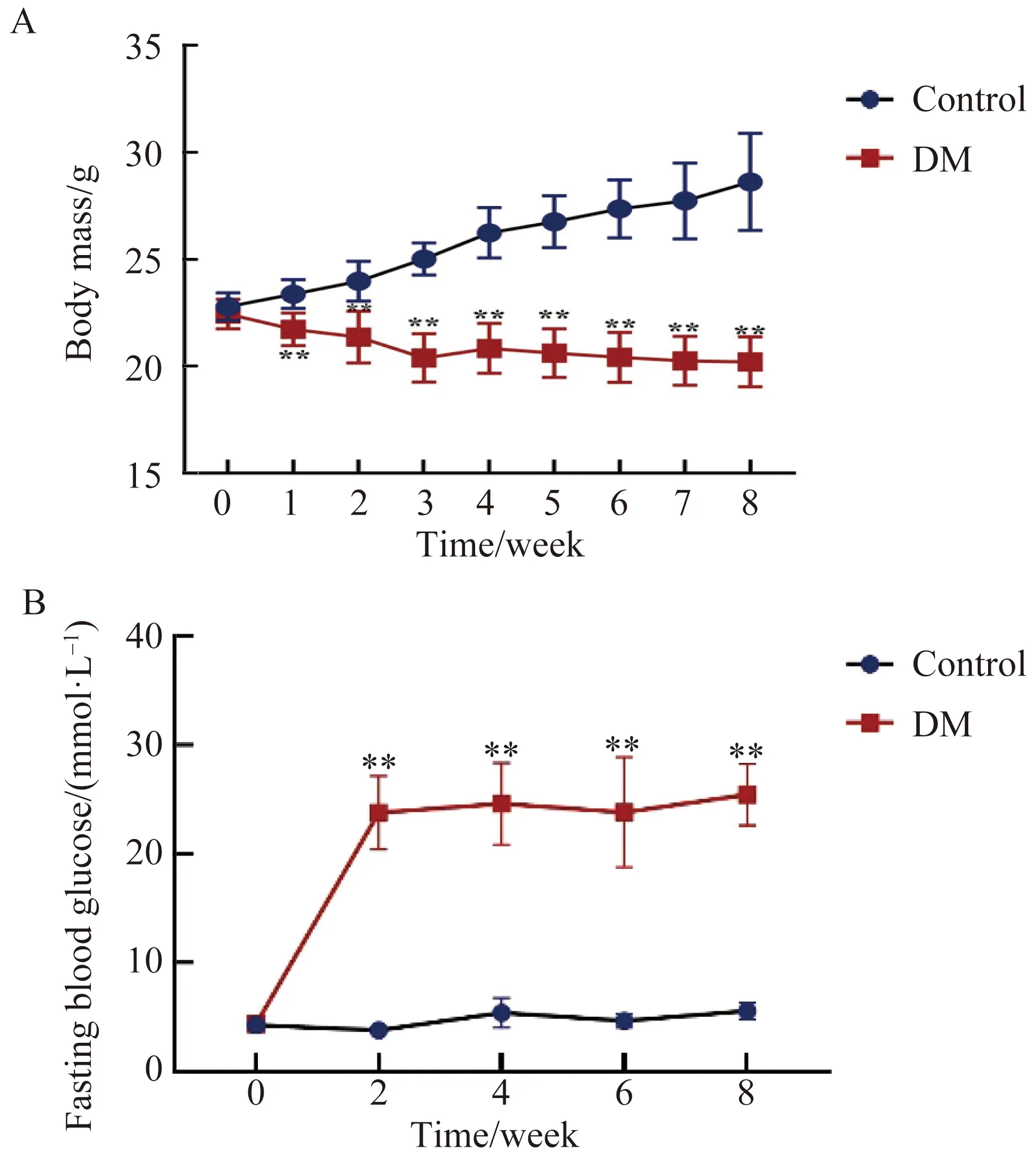
图1 两组小鼠造模前后体质量与空腹血糖变化比较Fig.1 Comparison of changes in body mass and fasting blood glucose between two groups of mice before and after modeling
2.2 2组小鼠Morris水迷宫行为学测试结果
在STZ注射8周后,在空间学习实验中,与对照组比较,DM组小鼠第2~5天逃避潜伏期显著增加(第2天P=0.002,第3~5天P<0.001,图2),5 d内的平均游泳路程显著增加(P=0.001,图3A),但游泳速度差异无统计学意义(P=0.254,图3B),而在第6天的记忆探索实验中,DM组小鼠的目的象限所在时间(P=0.043,图3C)和穿越平台次数显著减少(P=0.004,图3D)。
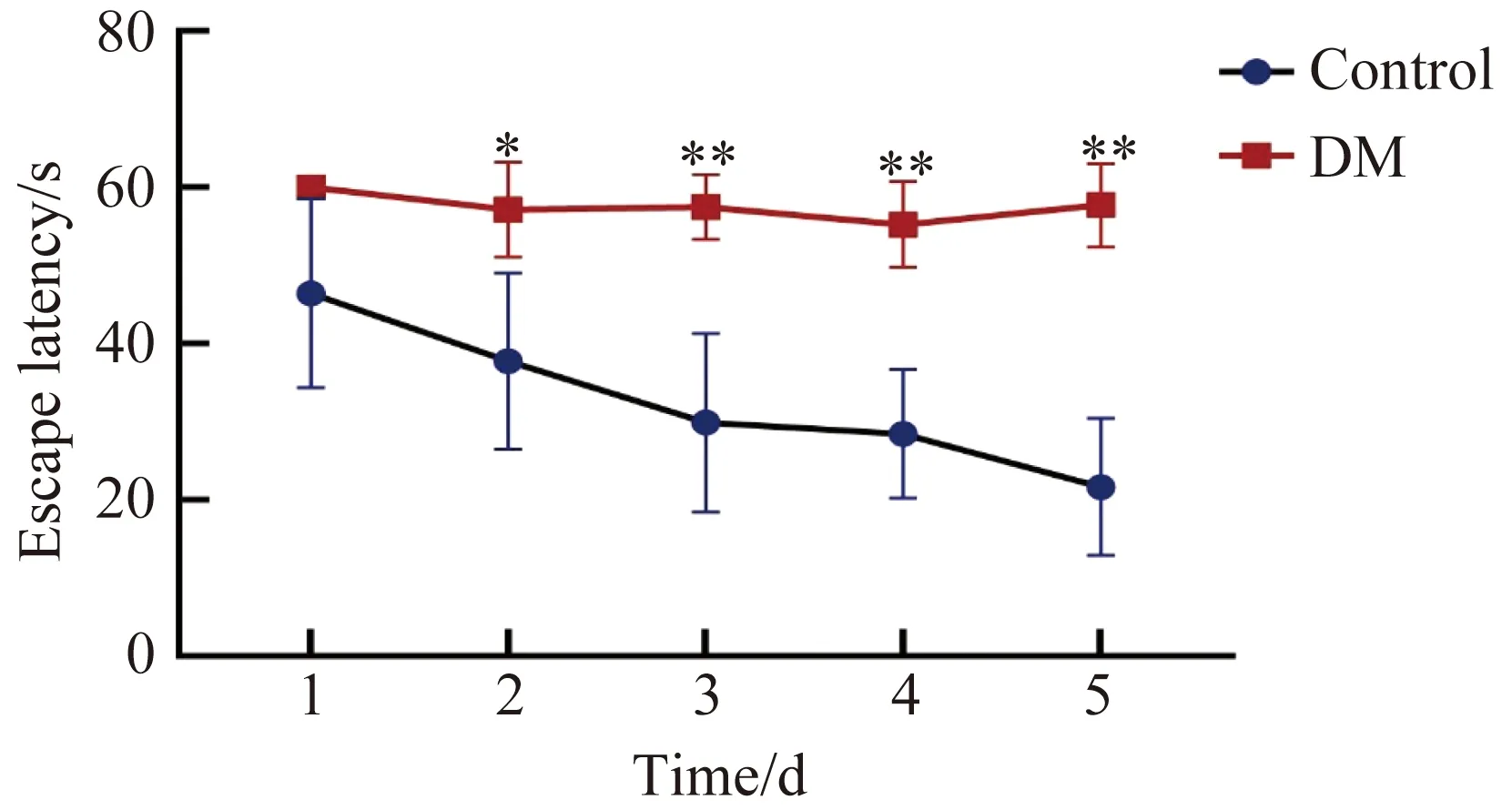
图2 两组小鼠Morris水迷宫空间学习实验逃避潜伏期比较Fig.2 Comparison of escape latency in Morris water maze spatial learning experiment between two groups of mice *P<0.05, **P<0.01 vs control group; DM: diabetes mellitus.
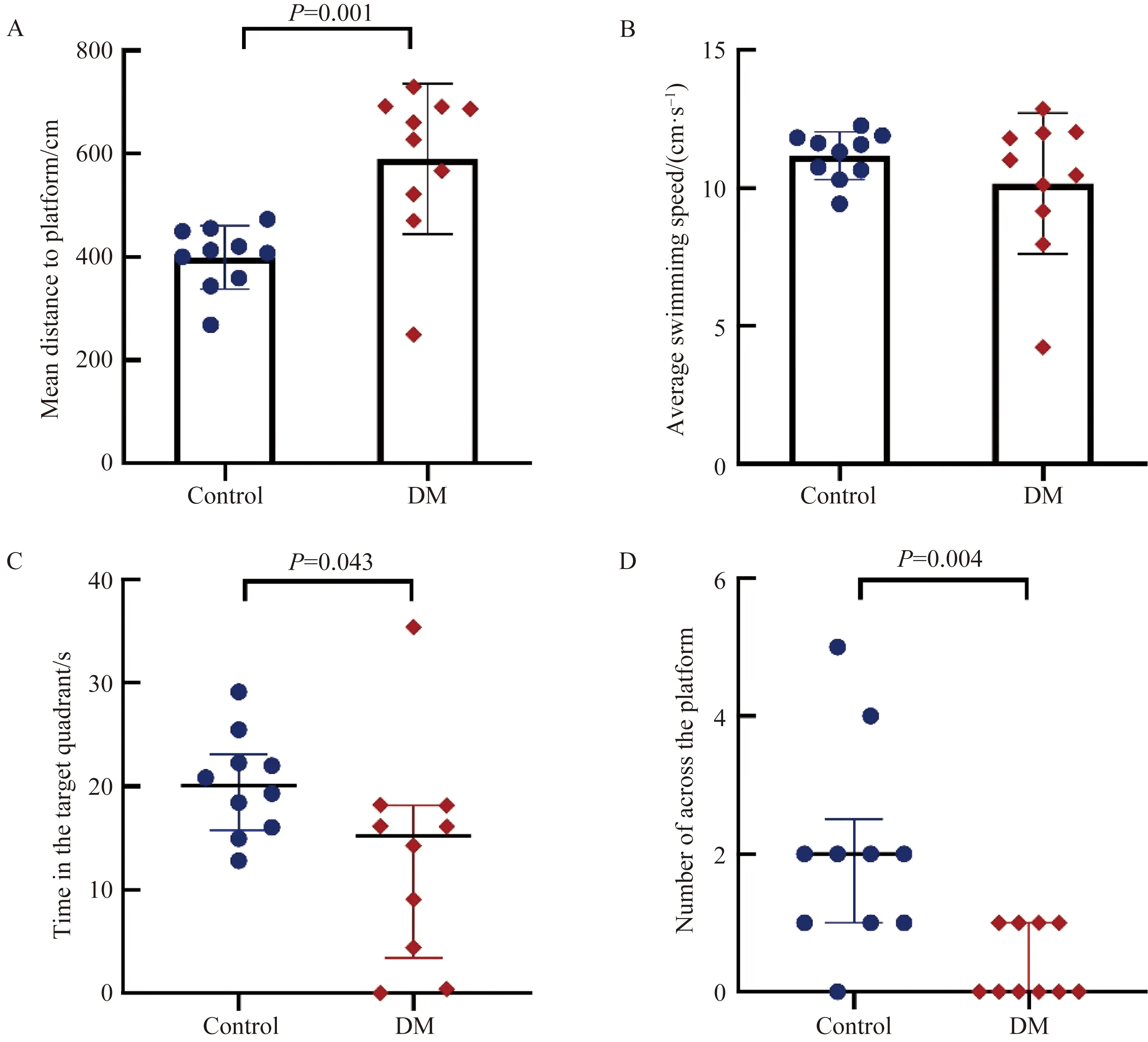
图3 两组小鼠Morris水迷宫空间学习实验 Fig.3 Comparison of spatial probe test between the two groups of mice in the Morris water maze
2.3 2组小鼠脑组织宏代谢组学检测结果
本次宏代谢组检测在小鼠脑组织中共鉴定到123种代谢物,主要涉及氨基酸、有机酸、脂肪酸、短链脂肪酸、碳水化合物、肉碱、苯丙烷类、吡啶类、苯丙酸、苯甲酸、酚类、胆汁酸、咪唑类、吲哚类和苯类15个种类的代谢物,其中氨基酸类代谢物占比最多达75%,其次依次为有机酸、胆汁酸和短链脂肪酸(图4)。
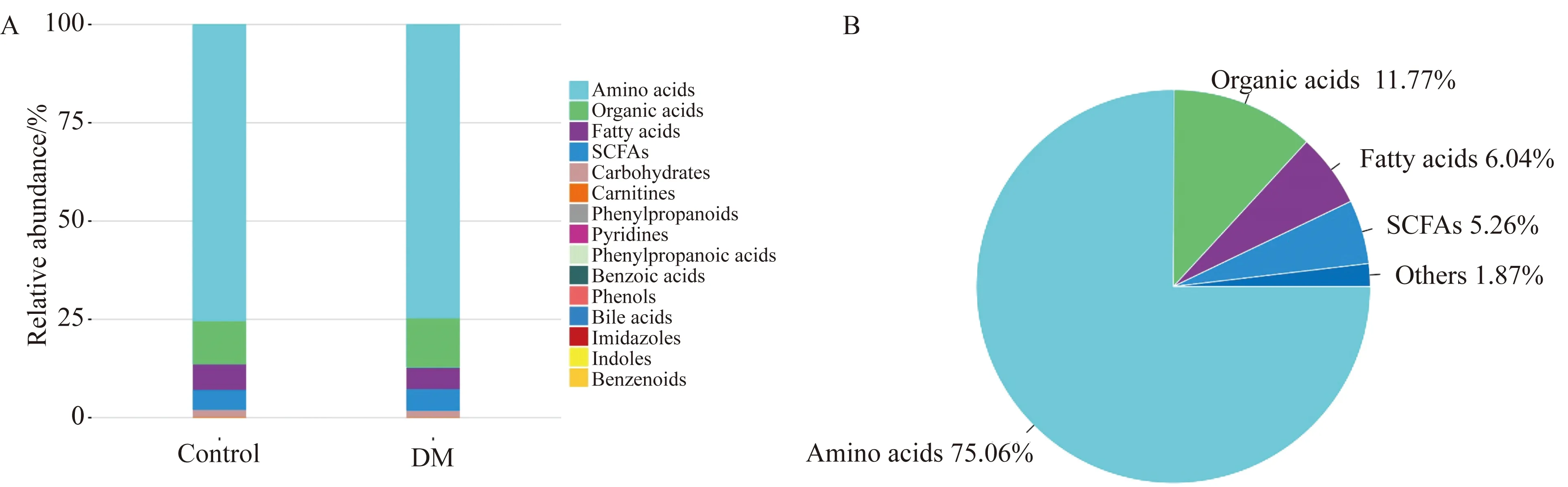
图4 两组样本中各类代谢物的中位值的相对丰度Fig.4 Stacked bar chart of average abundance ratio of metabolite classes
采用PLS-DA法分析对照组和DM组小鼠脑组织的代谢谱差异结果见图5A,其中两组脑组织样本点可以完全区分开,说明小鼠脑内肠道菌群代谢状况已经发生了明显的改变。为了验证PLS-DA模型的可靠性,采用OPLS-DA法对两组样本重新建模分析(图5B),结果仍发现2组之间有明显的分离情况,基于本次宏代谢组检测建立的OPLS-DA 模型, 能较好地解释两组之间的差异。选择具有多维统计分析VIP>1和单变量统计分析P<0.05的代谢物作为差异有统计学意义的代谢物并根据变化倍数和P值绘制火山图(图6),与对照组比较共获得11种显著差异潜在标志物中,其中氨基酸类的谷氨酰胺(Log2FC=0.262,P=0.002)、碳水化合物类的酒石酸(Log2FC=0.847,P=0.017)、有机酸类的乳酸(Log2FC=0.326,P=0.002)和苯甲酸类的间氨基苯甲酸(Log2FC=1.028,P=0.046)4种代谢物在DM组小鼠脑组织中含量显著上调;而氨基酸类的3-氨基异丁酸(Log2FC=-1.466,P=0.049)、碳水化合物类的葡萄糖酸内酯(Log2FC=-0.796,P=0.043)和苏糖酸(Log2FC=-0.310,P=0.042)、吲哚类的吲哚乳酸(Log2FC=-1.252,P=0.030)、有机酸类的酮亮氨酸(Log2FC=-0.922,P=0.040)和3-羟基丁酸(Log2FC=-0.372,P=0.009)以及脂肪酸类的肉豆蔻酸(Log2FC=-0.563,P=0.035)7种代谢物在DM组小鼠脑组织中含量显著下调。
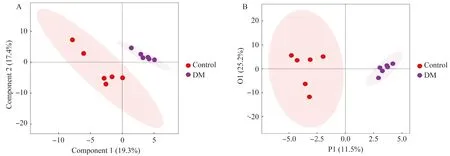
图5 两组样本PLS-DA分析Fig.5 PLS-DA analysis of two groups of samples
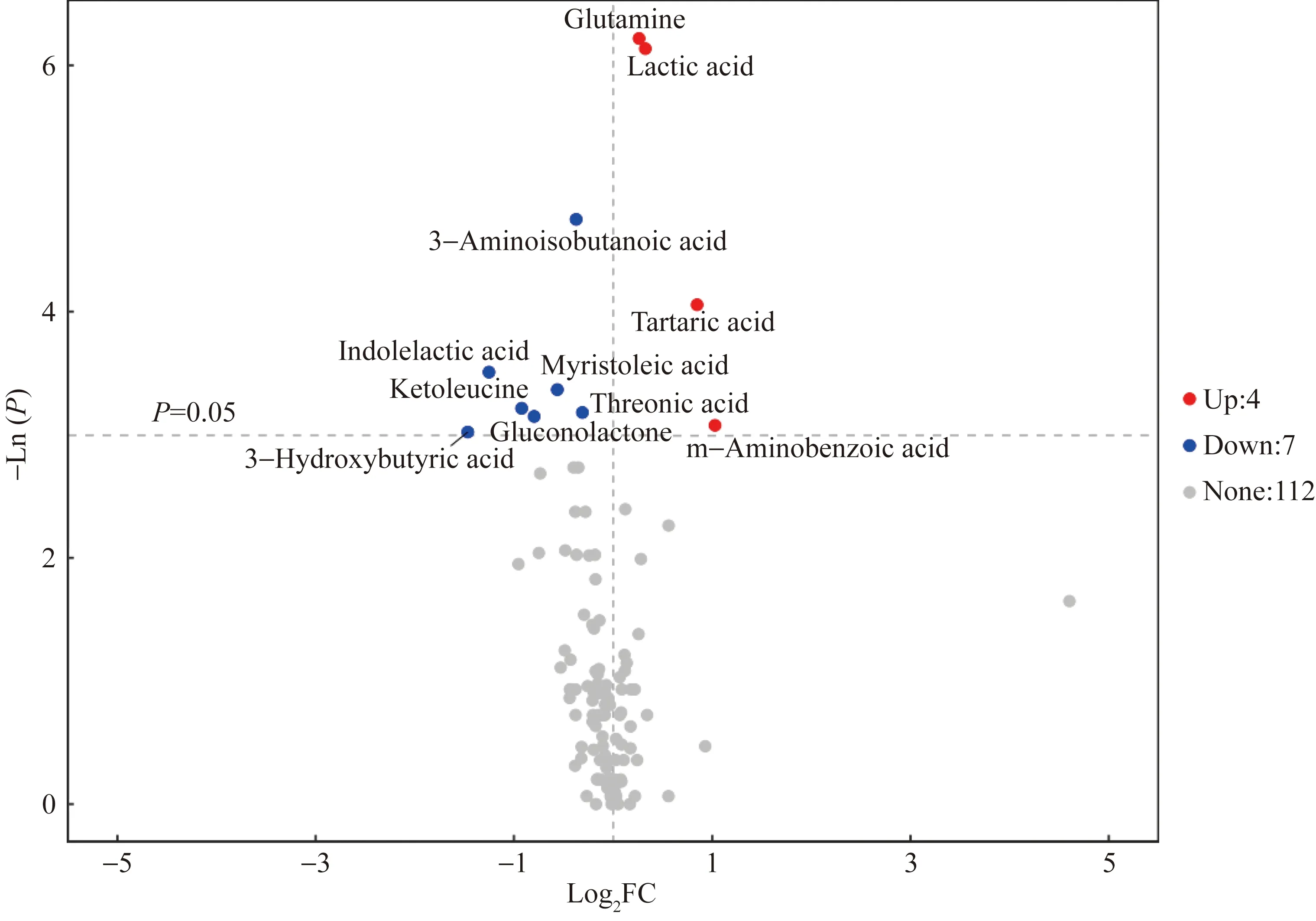
图6 差异代谢物火山图Fig.6 Volcano plot of differential metabolites
利用Metaboanalyst代谢分析平台中东京基因与基因组数据库(Kyoto Encyclopedia of Genes and Genomes,KEGG) 对差异代谢物进行通路富集分析,最终得到14条潜在影响的代谢通路,分别为嘧啶代谢、酮体的合成与降解、D-谷氨酰胺和 D-谷氨酸代谢、氮代谢、缬氨酸、亮氨酸和异亮氨酸的生物合成、磷酸戊糖途径、丁酸代谢、丙酮酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、糖酵解或糖异生、缬氨酸、亮氨酸和异亮氨酸降解、精氨酸和脯氨酸代谢、嘌呤代谢和氨酰-tRNA生物合成(图7)。
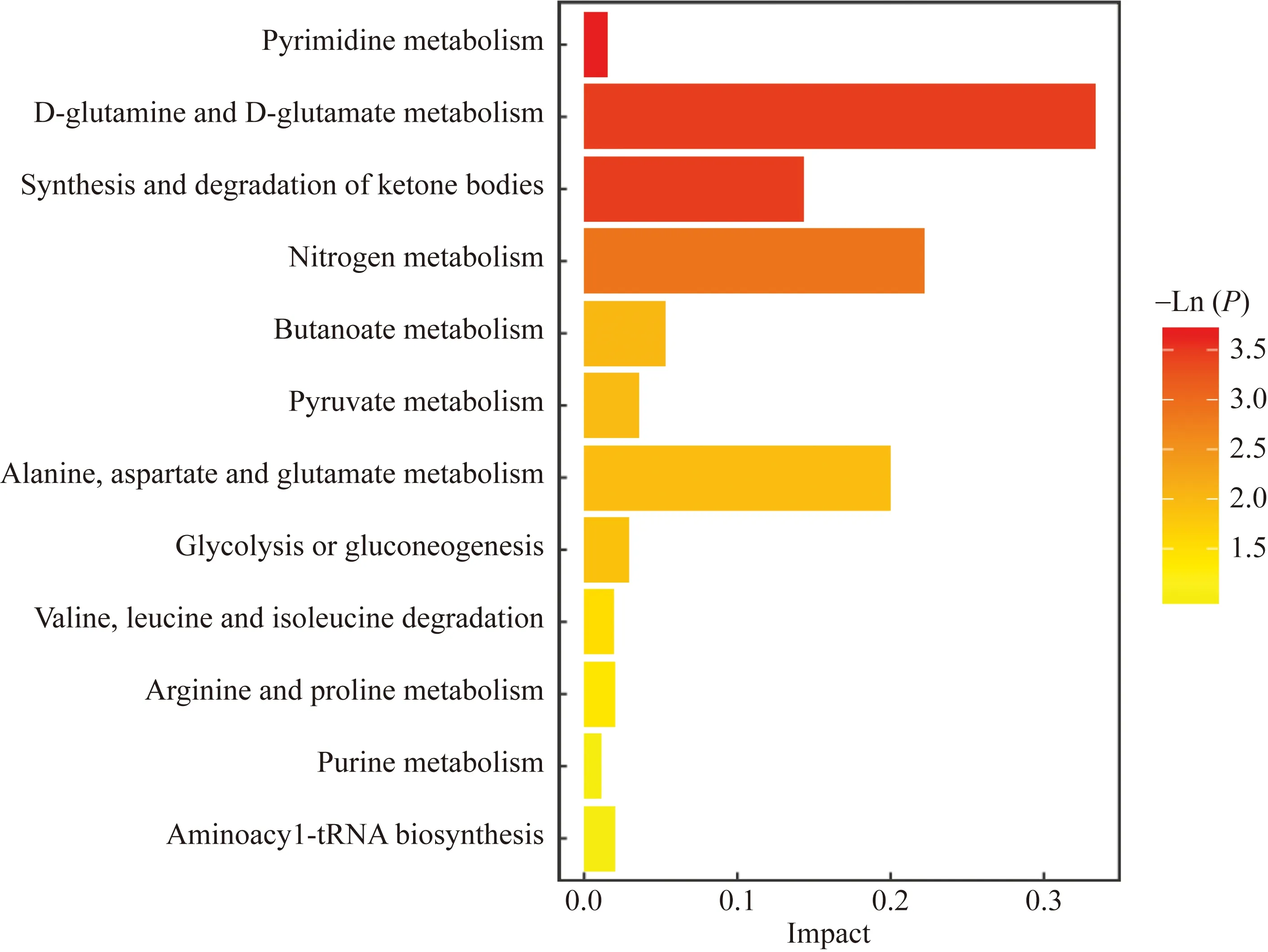
图7 差异代谢物通路富集图Fig.7 Pathway enrichment map of differential metabolites
3 讨论
认知功能减退是糖尿病的重要并发症,一项涉及33项研究的Meta分析显示,T1DM 主要影响患者的总体认知水平、精神心理状态、认知弹性和视觉记忆等认知表现[5]。此外,在T1DM小鼠模型中也发现了空间学习和记忆的损害[6]。
肠道菌群被认为是认知功能的调节剂和脑部疾病新的治疗靶点[7]。肠道菌群和中枢神经系统之间存在双向交流(菌群-肠-脑轴),可参与脑功能调节、神经发育和衰老诱导的认知功能障碍,是多发性硬化(multiple sclerosis, MS)、自闭症、帕金森病、阿尔茨海默病(Alzheimer’s disease,AD)等神经系统疾病的易感因素[8]。肠道菌群在膳食营养素的刺激下可产生短链/支链脂肪酸、维生素及脂质、胆汁酸及甾醇类物质、芳香族化合物、胺类、酚类、内毒素等代谢物[9]。菌群代谢产物在人体健康及疾病中发挥了重要调节作用。目前研究发现短链脂肪酸、胆汁酸、神经递质和其他生物活性物质等菌群代谢物参与调节中枢神经系统,肠道菌群还可提供脂多糖、糖脂、胆碱、乳酸和维生素B等物质参与脑肠轴[10]。此外,肠道菌群也是一个重要的内分泌器官,其产物如短链脂肪酸和氨基酸代谢物,可通过多种途径(如肠激素GLP-1)参与调控宿主能量代谢、血糖和炎性反应,在包括肥胖、糖尿病、非酒精性脂肪性肝和心血管疾病的发生、发展中起到至关重要的作用[11]。研究[12]显示饮食治疗可通过诱导肠道菌群组成和代谢改变来改善糖尿病引起的认知障碍。然而,尚无研究探索能够与T1DM诱导的认知障碍相关的肠道菌群代谢产物在脑内的变化情况。
宏代谢组学方法是研究微生物衍生代谢物的功能,定义代谢概况,识别、量化和表征肠道微生物产生的小分子,并指向代谢产物的生物化学通路的代谢组学检测方法,为研究肠道菌群对疾病的影响提供了进一步的认知。本研究通过检测T1DM模型小鼠在发生学习记忆显著下降后脑组织的肠道菌群代谢物变化,发现了11种显著变化的肠道菌群代谢物,涉及氨基酸代谢、糖代谢、短链脂肪酸代谢、嘌呤代谢和嘧啶代谢等多条代谢通路,为进一步研究肠道菌群及其代谢产物在T1DM诱导的认知功能障碍中的作用提供了依据。
在11种差异代谢物中,谷氨酰胺代谢物浓度在DM组小鼠脑组织中显著增加,而Zheng等[13]发现,接受精神分裂症模型小鼠肠道菌群移植的普通小鼠海马组织中也出现了谷氨酰胺的浓度升高,并伴有谷氨酸浓度低和γ-氨基丁酸(gamma-amino butyric acid,GABA)浓度升高,可能反映了谷氨酸能神经传递的减少、谷氨酸产生的GABA增加或GABA向谷氨酸的分解减少、谷氨酸向谷氨酰胺的转化增加(通过谷氨酰胺合成酶)或谷氨酰胺向谷氨酸的转化减少(通过谷氨酰胺酶),和/或改变上述任何一种的转运或再摄取,而这一机制也与T1DM诱导的认知功能相关,并涉及D-谷氨酰胺和 D-谷氨酸代谢通路。一项研究[14]通过纳入100名AD患者和71名年龄性别匹配的健康对照,对粪便菌群进行对比分析发现,AD 患者粪便肠道菌群特征从丁酸生产者(如粪杆菌)转变为乳酸生产者(如双歧杆菌), 这些改变导致代谢途径从丁酸转变为乳酸,这一转变可能参与了AD的发病机制,与本研究中DM组小鼠脑组织乳酸浓度升高和3-羟基丁酸浓度降低相一致,可进一步探索这一代谢转变的相关特征及功能的具体作用。吲哚乳酸是肠道菌群产生的一种色氨酸代谢物,也是一种有效的抗炎代谢物,研究[15]显示儿童中枢神经系统退行性病变MS患者血清中较低的色氨酸及其肠道菌群代谢物吲哚乳酸浓度与MS发生风险增加相关,这与本研究中DM小鼠脑组织吲哚乳酸水平降低相一致,提示色氨酸、肠道菌群和菌群衍生的色氨酸代谢物之间复杂的相互作用影响神经炎性反应的可能性。此外,在DM小鼠脑组织中还发现了肉豆蔻酸的水平降低,而Yan等[16]构建的帕金森病猴模型肠道中也发现肉豆蔻酸水平显著降低,肉豆蔻酸是小鼠二酰基甘油激酶 (diacylglycerol kinase,DGK) δ表达的增强剂。DGK是一种脂质代谢酶,可将二酰基甘油磷酸化以产生磷脂酸。肉豆蔻酸生成减少导致DGKδ 缺乏,随后可通过增强 DGKδ-KO小鼠的轴突/神经突生长诱导强迫症样行为,这也可能是T1DM诱导认知障碍的潜在机制。
综上所述,本研究中发现的多个T1DM小鼠模型脑组织中肠道菌群差异代谢物浓度改变及潜在代谢通路失调与认知功能障碍和多种中枢神经系统疾病密切相关。然而,本研究中尚未检测两组小鼠的肠道菌群变化,未将肠道菌群组成和丰度与代谢物浓度相关联,仍需确定所检测代谢物的肠道菌群特异性,因此本文的结论是初步的,下一步将进行肠道菌群的测序及关联分析来进一步明确肠道菌群-代谢物-脑轴的调控机制。
利益冲突所有作者声明无利益冲突。
作者贡献声明安宇:实验设计、论文撰写和修改、数据收集;边南南、丁小雨、常晓娜:参与实验设计和数据收集和分析;刘佳:研究和论文指导;王广:全面统筹实验设计实施质量控制、研究和论文指导。
