眼表铁过载小鼠干眼模型的构建和机制研究
2022-07-13郑景怡夏金丹谢安琪费志刚肖启国
孟 霞,王 智,郑景怡,夏金丹,谢安琪,费志刚,肖启国
0 引言
泪液乳铁蛋白(lactoferrin,Lf)含量下降是干眼的重要特征[1],但其引起干眼损伤的确切机制尚不明确。我们的前期研究发现干眼患者泪液乳铁蛋白含量与眼表铁过载及炎症反应呈负相关。输血依赖型贫血患者因反复输血可以导致眼表铁沉积增加,引起眼表损伤及泪膜功能障碍[2]。这些提示眼表铁过载可能通过促进眼表炎症反应导致干眼发生及发展。为证实这一假说,本研究通过腹腔注射铁剂建立眼表铁过载小鼠模型,观察小鼠干眼指标及炎症因子的变化。
1 材料和方法
1.1材料
1.1.1实验动物选取40只SPF级健康雄性C57BL/6小鼠(取右眼为实验眼),周龄6~8周,体质量18~22g,购于湖南SLAC实验动物中心,饲养于南华大学实验动物学部,实验前常规裂隙灯检查以排除眼表相关疾病。在整个实验过程中,小鼠安置于本校动物实验中心标准的环境中统一饲养:温度24℃~26℃,相对湿度50%~70%,灯光昼夜交替循环(每日7AM~7PM开启),定期添加标准鼠粮(不含铁)和水。动物操作及处理均符合南华大学医学研究中心/实验动物学部要求,经实验动物伦理委员会审批。
1.1.2主要试剂右旋糖酐铁(上海麦克林生化科技有限公司),荧光素钠(美国Alcon公司),酚红棉线(天津晶明新技术开发有限公司),组织铁试剂盒(北京索莱宝科技有限公司),ELISA试剂盒(IL-1β、TNF-α、MMP-9)(武汉华美生物工程有限公司),HE染色、普鲁士蓝染色试剂盒及各种常规化学试剂(长沙维世尔生物科技有限公司)。
1.2方法
1.2.1分组及铁过载模型的建立用随机数字表法将小鼠分为4组:对照组10只,每次腹腔注射生理盐水0.2mL;低剂量组、中剂量组、高剂量铁剂组各10只为模型组,每次分别腹腔注射浓度为12.5、25、50mg/mL的右旋糖酐铁溶液0.2mL[3]。每3d注射1次,共注射28d。
1.2.2干眼指标及炎症程度评估分别于注药的第7、14、28d,在裂隙灯下观察小鼠右眼眼前节情况并进行评估,所有检查均在同一地点、湿度、温度及照明情况下由同一名检查者在固定时间(PM16∶00~18∶00)完成。眼表炎症指数采用目前通用的评分标准(分值0/9~9/9)[4]。角膜荧光素染色检查及评分标准参照Pauly等[5]的标准(总分0~16分)。泪膜破裂时间(break up time, BUT)检查:将1滴1%荧光素钠滴入小鼠结膜囊内,人为瞬目3次后在裂隙灯钴蓝光下观察角膜染色区出现第1个黑斑的时间,重复3次取平均值[6]。泪液分泌量(Schirmer Ⅰ test, SⅠt)检测:拉开小鼠下睑,将酚红棉线置于下睑中外1/3结膜囊内,1min后取出棉线,测量被浸湿变红的长度[7]。
1.2.3组织病理学检查注药28d后处死小鼠,取小鼠右眼角膜、结膜及泪腺组织,每组取一半组织用4%多聚甲醛固定、包埋、切片,其余组织置于-80℃冰箱冰冻保存用于后续检测。按常规染色步骤用苏木素及伊红染液进行HE染色,封片后显微镜下观察各组织病理形态学改变;用Perls及核固红试剂进行普鲁士蓝染色,封片后显微镜下观察各组织的铁沉积情况(含铁血黄素或三价铁表现为蓝色)。
1.2.4组织铁检测冰冻组织解冻后加生理盐水,冰水浴匀浆后离心取上清;设空白管、标准管、测定管并添加相应试剂,混匀,沸水浴5min后冷却;离心取上清,测各管OD值,计算各组织中铁含量。
1.2.5ELISA检测冰冻组织解冻后制成匀浆,离心取上清;倍比稀释标准品;设待测样本孔、标准品孔,加样混匀;封孔温育;加生物素标记抗体工作液;封孔温育;加辣根过氧化物酶标记亲和素工作液;封孔温育;加底物溶液,避光显色;加终止液摇匀,用酶标仪测量吸光值并记录,结合标准曲线,计算各组织中IL-1β、TNF-α、MMP-9的含量。
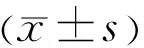
2 结果
2.1干眼指标及眼表炎症程度评估在整个实验期内,四组小鼠精神状态及食欲良好,均未出现死亡情况。建模前四组小鼠角膜透明,结膜未见明显充血。注药后第7、14、28d,对照组小鼠眼表炎症指数评分(F=0.136,P=0.873)、角膜荧光素染色评分(F=0.507,P=0.608)、BUT(F=0.905,P=0.416)、SⅠt(F=0.114,P=0.867),差异均无统计学意义。
四组小鼠眼表炎症指数比较差异有统计学意义(F时间=50.787,P时间<0.001;F组间=245.908,P组间<0.001;F时间×组间=5.160,P时间×组间<0.001);角膜荧光素钠评分比较差异有统计学意义(F时间=267.627,P时间<0.001;F组间=431.875,P组间<0.001;F时间×组间=37.896,P时间×组间<0.001);BUT比较差异有统计学意义(F时间=845.253,P时间<0.001;F组间=3844.659,P组间<0.001,F时间×组间=95.096,P时间×组间<0.001);SⅠt比较差异有统计学意义(F时间=588.618,P时间<0.001;F组间=1396.205,P组间<0.001,F时间×组间=74.375,P时间×组间<0.001)。四组小鼠干眼及眼表炎症程度评估,存在时间及组间差异,进一步进行各组时间及组间两两比较,发现随右旋糖酐铁注药时间及药物浓度增加,小鼠眼表炎症指数增加,角膜荧光素染色评分增加,BUT缩短,SⅠt减少,表明随注药时间及浓度增加,小鼠干眼及眼表炎症程度逐渐加重,见表1~4。

表1 四组小鼠眼表炎症指数比较 分)

表2 四组小鼠角膜荧光素染色评分比较 分)

表3 四组小鼠BUT检测结果
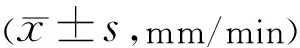
表4 四组小鼠SⅠt检测结果
2.2组织病理学检查及组织铁含量检测
2.2.1HE染色结果对照组角膜表面较光滑,上皮细胞排列整齐,细胞形态较规整;结膜组织上皮细胞为一薄层细胞,表面较光滑,排列整齐,细胞形态正常;泪腺各小叶及腺泡间散在的细胞排列紧密,腺泡大小较均一,结构完整,各组织间未见明显铁沉积(图1A1、A2、A3)。低、中、高剂量组角膜浅层上皮表面欠光滑,上皮细胞排列较紊乱,可见不同程度的上皮缺损(图1B1、C1、D1);模型组结膜上皮不规整,细胞排列紊乱,低剂量组可见少量点状铁沉积(图1B2),中剂量组可见少量团块状铁沉积(图1C2),高剂量组可见较多团块状铁沉积(图1D2);低剂量组泪腺细胞排列稍不规整,腺泡大小欠均一,可见少量点状铁沉积(图1B3),中剂量组泪腺细胞排列紊乱,可见空泡样变,腺泡大小不均一,可见较多点状铁沉积(图1C3),高剂量组泪腺细胞排列紊乱,结构不清晰,可见大量空泡样变,腺泡大小不均一,可见少量团块状铁沉积(图1D3)。

图1 各组小鼠角膜、结膜、泪腺组织HE染色 A:对照组;B:低剂量组;C:中剂量组;D:高剂量组。
2.2.2普鲁士蓝染色结果对照组角膜、结膜及泪腺组织可见极少量蓝色颗粒(图2A1、A2、A3),表明正常眼表组织存在少量的铁沉积。模型组角膜组织可见少量蓝色铁颗粒(图2B1、C1、D1);低剂量组结膜及泪腺组织可见少量散在被染成蓝色的铁颗粒(图2B2、B3),中剂量组结膜及泪腺组织可见被染成蓝色的铁颗粒或团块,呈梭形或不规则形(图2C2、C3),高剂量组结膜组织部分视野布满被染成蓝色的铁团块(图2D2),泪腺组织间可见较多蓝色铁团块(图2D3)。
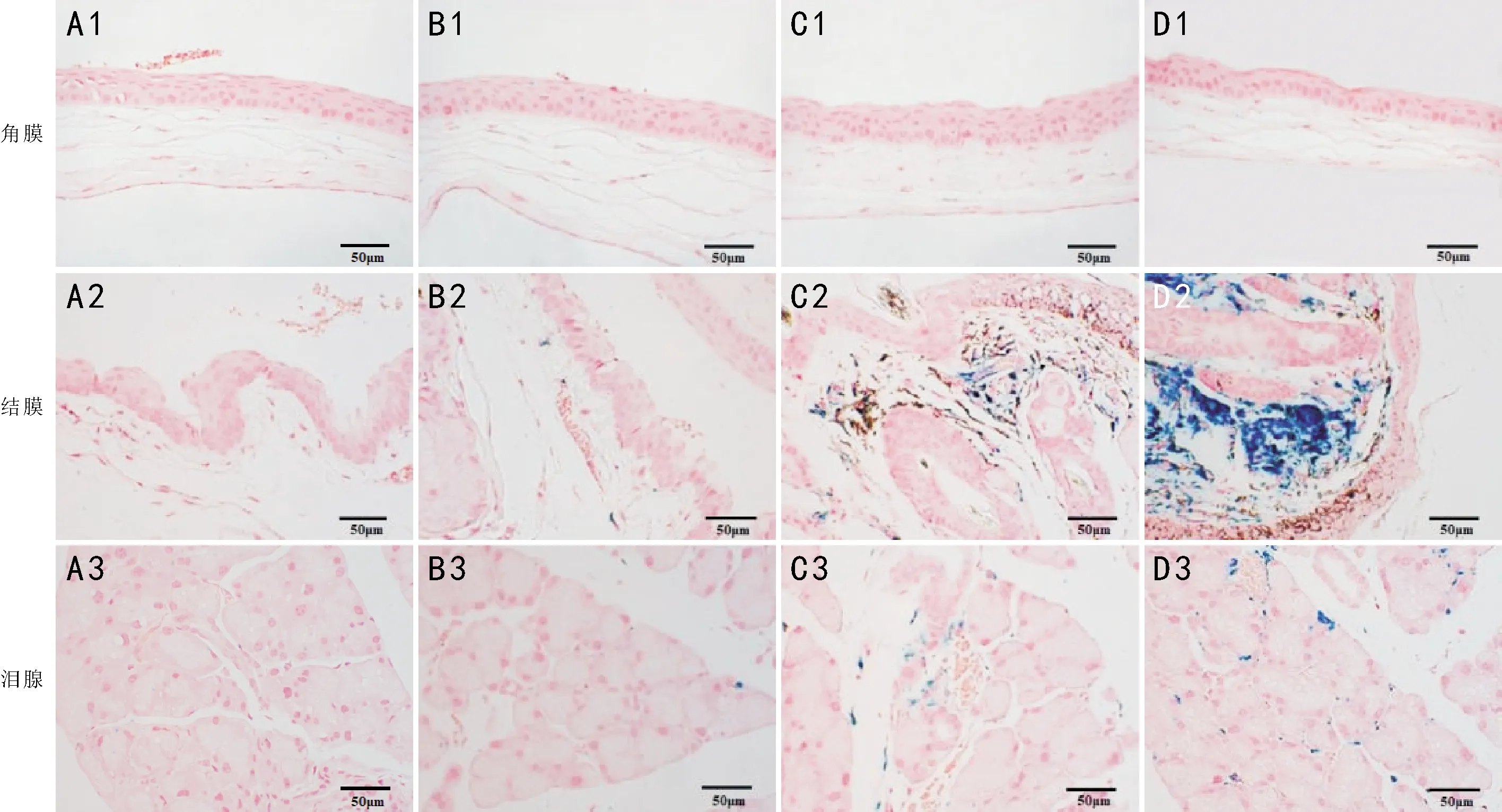
图2 各组小鼠角膜、结膜、泪腺组织普鲁士蓝染色 A:对照组;B:低剂量组;C:中剂量组;D:高剂量组。
2.2.3组织铁含量检测结果对照组小鼠角膜、结膜及泪腺组织均含有少量铁,模型组小鼠各组织铁含量较对照组明显增高,出现铁过载,且铁过载程度随右旋糖酐铁浓度增加呈逐渐加重趋势,与对照组相比差异均有统计学意义(F角膜=87.489,P角膜<0.001;F结膜=69.044,P结膜<0.001;F泪腺=52.054,P泪腺<0.001),见表5。其中泪腺组织中铁含量较角膜及结膜组织中略高,一直呈领先趋势,结膜组织中铁含量在低剂量组较角膜中高,在中剂量组两组数据接近,在高剂量组中被角膜组织反超。总之,正常眼表组织中有一定含量的铁,通过腹腔注射右旋糖酐铁,小鼠眼表组织铁含量明显逐渐增加,与右旋糖酐铁浓度呈正相关,表明眼表铁过载小鼠模型建立成功。
(2)使用建筑和装修去完成一体化的设计,以及施工,理其在想状态下可以说是装修能够伴随着主体施工去同步完成的;
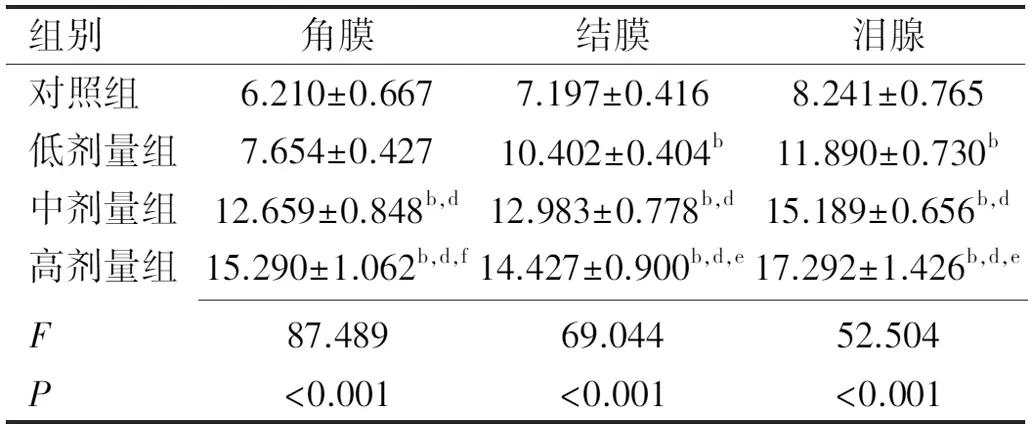
表5 各组小鼠角膜、结膜、泪腺组织铁含量 (μmol/gprot)
2.3炎症因子IL-1β和TNF-α及MMP-9的含量ELISA检测结果显示,与对照组相比,模型组角膜、结膜及泪腺组织中炎症因子IL-1β含量均明显升高,差异均有统计学意义(F角膜=48.405,P角膜<0.001;F结膜=29.466,P结膜<0.001;F泪腺=112.724,P泪腺<0.001),见表6;与对照组相比,模型组各组织中炎症因子TNF-α含量均明显升高,差异均有统计学意义(F角膜=57.548,P角膜<0.001;F结膜=35.345,P结膜<0.001;F泪腺=97.727,P泪腺<0.001)见表7;与对照组相比,模型组各组织中炎症因子MMP-9含量均明显升高,差异均有统计学意义(F角膜=74.754,P角膜<0.001;F结膜=58.096,P结膜<0.001;F泪腺=293.010,P泪腺<0.001),见表8。IL-1β、TNF-α及MMP-9变化趋势与干眼指标及炎症程度的变化趋势一致,与右旋糖酐铁浓度呈正相关,表明铁过载状态下眼表炎症反应加重。
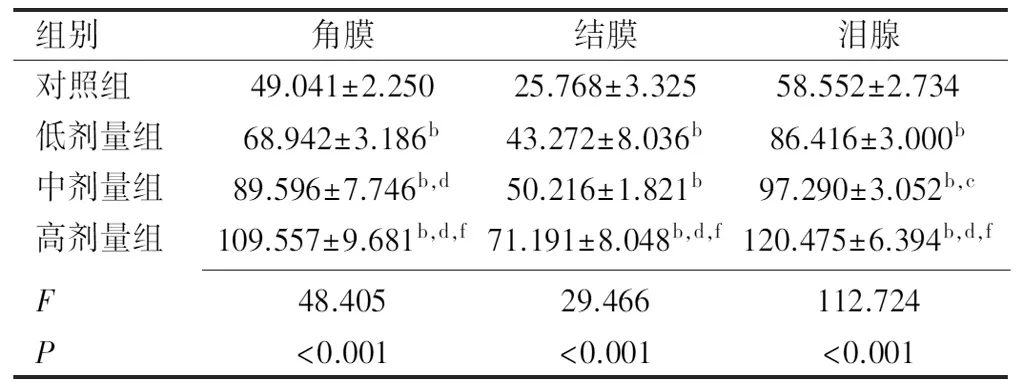
表6 各组小鼠角膜、结膜及泪腺组织中IL-1β的含量 (pg/mL)
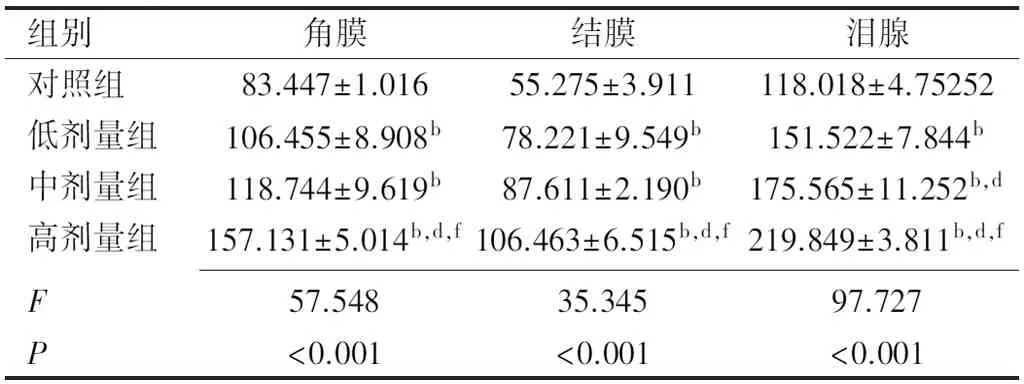
表7 各组小鼠角膜、结膜及泪腺组织中TNF-α的含量 (pg/mL)

表8 各组小鼠角膜、结膜及泪腺组织中MMP-9的含量 (pg/mL)
3 讨论
铁作为人体必需的微量元素之一,参与许多代谢过程并起核心作用[8]。但人体缺乏明确的铁排泄机制,随着年龄的增长,铁会在组织内逐渐积累,机体铁含量越来越高。当机体内的游离铁超负荷(铁过载)时,过多的铁离子通过芬顿反应[9]诱发自由基反应,破坏细胞功能造成机体损伤;铁过载形成铁沉积后,会造成溶酶体膜破裂,细胞出现“自残”现象[10],因此铁代谢异常会引起多种病变的发生。
既往研究表明,铁过载会加重甚至导致年龄相关性黄斑变性、糖尿病视网膜病变等眼底疾病的发生[11-12],而较少有铁过载与眼表疾病关系研究的相关报道。一项横断面对照研究表明[13],多次输血治疗的地中海贫血患者中有68.5%出现眼部异常表现,其中干眼占33.3%,且眼部异常与输血次数的呈正相关且有统计学意义。持续的输血治疗可以缓解贫血,但会导致体内铁的大量沉积,铁沉积的增加对眼表及泪腺组织产生毒性效应,损伤眼表组织,破坏泪膜稳定性,损伤分泌功能,导致泪液分泌减少。
本研究通过定期定量给小鼠腹腔注射右旋糖酐铁[3,14],建立铁过载小鼠模型。注药后模型组小鼠出现角膜上皮损伤、泪膜稳定性变差、SⅠt减少等一系列干眼症状,角膜、结膜及泪腺组织均受到不同程度的损伤。普鲁士蓝染色发现,模型组小鼠眼表铁沉积较对照组小鼠明显增加,与组织铁含量检测结果一致。提示腹腔注射右旋糖酐铁后可造成眼表铁过载,导致干眼的形成,且随注药的浓度及时间增加,干眼程度逐渐加重。
Handa等[15]研究表明铁过载可促进IL-1β、TNF-α等炎症因子的表达,加重炎症反应,而炎症是干眼发病的核心机制。为探寻眼表铁过载引起干眼的损伤机制,我们对炎症指标进行测定,发现模型组小鼠眼表炎症指数增加,炎症程度加重,眼表组织炎症因子表达与铁过载程度呈正相关,这提示铁过载引起的干眼损伤机制可能是铁沉积增加后引起眼表炎症反应,但其确切的信号通路尚有待于进一步研究。
泪液乳铁蛋白是泪液蛋白的重要成分之一,研究表明,干眼患者泪液乳铁蛋白含量明显下降,与泪液分泌试验和BUT呈正相关。泪液乳铁蛋白属于运铁蛋白,是一种铁螯合剂,可通过清除眼表游离铁,抑制炎症因子分泌,并抑制NF-κB信号通路,以降低炎症反应,对维持眼表组织的完整性有重要意义[16]。因此,我们推测,眼表铁过载可能通过NF-κB信号通路加重干眼眼表炎症反应。
综上所述,我们的研究表明小鼠腹腔注射右旋糖酐铁,可以引起眼表铁过载,加重小鼠眼表炎症,导致小鼠干眼发生。此研究不仅为贫血患者长期进行输血治疗后出现干眼症状提供了合理的解释,为泪液乳铁蛋白含量下降引起干眼的损伤机制及干眼的治疗提供了新思路,而且为进一步研究铁过载对眼表组织造成损害的机制提供了稳定的模型。本研究表明眼表铁过载可加重干眼眼表炎症反应,但确切的作用机制及信号通路需进一步研究。
