腹腔镜下胃肠间质瘤切除术对胃不利部位胃肠间质瘤患者免疫功能的影响
2022-07-13晁祥嵩王强陈秉魁
晁祥嵩 王强 陈秉魁
【摘要】 目的:探討腹腔镜下胃肠间质瘤切除术对胃不利部位胃肠间质瘤(GIST)患者的治疗效果及免疫功能的影响。方法:选择2019年8月-2021年8月佳木斯市中心医院收治的116例胃不利部位GIST患者为研究对象,按患者的住院号将其随机分为观察组和对照组,各58例。对照组采用开腹手术治疗,观察组采用腹腔镜下胃肠间质瘤切除术治疗。比较两组患者的手术相关指标、并发症发生情况、肿瘤标志物水平、免疫功能指标、生活质量评分。结果:观察组手术时间、肠道功能恢复时间、开始下床活动时间、住院时间均短于对照组,术中失血量少于对照组(P<0.05)。观察组术后并发症发生率为6.90%(4/58),低于对照组的20.69%(12/58),差异有统计学意义(P<0.05)。术后,两组波形蛋白(VIM)、高尔基体跨膜糖蛋白73(GP-73)、趋化因子1(CXCL1)均低于术前,且观察组上述指标均低于对照组(P<0.05)。术后,两组CD3+、CD4+、CD4+/CD8+均高于术前,CD8+均低于术前,且观察组CD3+、CD4+、CD4+/CD8+均高于对照组,CD8+低于对照组(P<0.05)。术后,两组患者的各项EORTC QLQ-C30生存质量评分均高于术前,且观察组均高于对照组(P<0.05)。结论:腹腔镜下胃肠间质瘤切除术对胃不利部位胃肠间质瘤患者手术效果良好,能够降低手术创伤性,提高手术安全性,促进术后康复,且能改善患者的免疫功能和术后生存质量,可临床推荐。
【关键词】 胃不利部位胃肠间质瘤 腹腔镜手术 并发症 免疫功能 生存质量
Effect of Laparoscopic Resection of Gastrointestinal Stromal Tumors on Immune Function in Patients with Gastrointestinal Stromal Tumors in Unfavorable Parts of the Stomach/CHAO Xiangsong, WANG Qiang, CHEN Bingkui. //Medical Innovation of China, 2022, 19(16): 0-024
[Abstract] Objective: To study the therapeutic effect and immune function of laparoscopic resection of gastrointestinal stromal tumors in patients with gastrointestinal stromal tumors (GIST) at adverse sites of the stomach. Method: A total of 116 GIST patients admitted to Jiamusi Central Hospital from August 2019 to August 2021 were selected as the research objects, and they were randomly divided into observation group and control group according to their hospitalization number, 58 cases in each group. The control group was treated with open surgery, the observation group was treated with laparoscopic gastrointestinal stromal tumor resection. Operation related indicators, complications, tumor marker levels, immune function indicators and quality of life scores were compared between the two groups. Result: The operation time, intestinal function recovery time, start time to get out of bed and hospital stay in the observation group were shorter than those in the control group, the intraoperative blood loss was less than that in the control group (P<0.05). The incidence of postoperative complications in the observation group was 6.90% (4/58), lower than 20.69% (12/58) in the control group, the difference was statistically significant (P<0.05). After operation, vimentin (VIM), golgi transmembrane glycoprotein 73 (GP-73) and chemokine 1 (CXCL1) in both groups were lower than those before operation, and the above indexes in observation group were lower than those in control group (P<0.05). After operation, CD3+, CD4+, CD4+/CD8+ of two groups were higher than those before operation, while CD8+ was lower than before operation, and CD3+, CD4+, CD4+/CD8+ in the observation group were higher than those in control group, while CD8+ was lower than that in control group (P<0.05). After operation, all EORTC QLQ-C30 quality of life scores in two groups were higher than those before operation, and observation group were higher than in those in control group (P<0.05). Conclusion: Laparoscopic gastrointestinal stromal tumor resection has a good surgical effect on patients with gastrointestinal stromal tumor in the unfavorable part of the stomach, it can reduce the surgical trauma, improve the safety of surgery, promote postoperative rehabilitation, and improve the immune function and postoperative quality of life of patients, which can be clinically recommended.
[Key words] Gastrointestinal stromal tumor in unfavorable part of the stomach Laparoscopic surgery Complications Immune function Quality of life
First-author’s address: Jiamusi Central Hospital, Heilongjiang Province, Jiamusi 154002, China
doi:10.3969/j.issn.1674-4985.2022.16.005
胃肠间质瘤(gastrointestinal stromal tumors,GIST)是胃肠外科常见的一种恶性肿瘤疾病,这类肿瘤疾病主要起源于患者的胃肠道间叶组织,在临床上有较高的发病率,也具有潜在恶性[1-2]。GIST常见的发病位置主要有胃、小肠、结直肠、食道等位置,其发病后主要表现出腹痛、包块、消化道出血、胃肠道梗阻等症状,严重影响患者的生命健康和生活质量[3]。因此,对于GIST患者需要即刻给予手术治疗,降低患者恶性肿瘤恶化和转移的风险,实现完全治愈的效果[4]。随着微创手术及腔镜技术的发展,腹腔镜手术在GIST患者的手术治疗中的应用逐渐增多,具有术中创伤小、术后恢复快的优点,备受临床医师的高度认可,在此类患者中有良好的应用效果[5-6]。而胃不利部位的GIST主要集中在患者的胃小弯内侧、近贲门处、胃底后壁等部位,这些解剖位置复杂的肿瘤病灶在手术过程中无疑加大了手术操作的难度[7]。目前,对于胃不利部位GIST患者能否采用腹腔镜下切除术治疗尚未见深入的临床实践报道。而佳木斯市中心医院结合近几年临床实践经验及病例条件,对于胃不利部位GIST患者进行了腹腔镜下胃肠间质瘤切除术的研究,现报道如下。
1 资料与方法
1.1 一般资料 选择2019年8月-2021年8月本院收治的116例胃不利部位GIST患者为研究对象。(1)纳入标准:①患者经诊断确诊为胃不利部位GIST,符合文献[8]中诊断标准;②年龄40~75岁;③均采取手术根治术治疗,具有相应的手术治疗指征;(2)排除标准:①手术禁忌证患者;②已经出现转移的患者;③术中或术后出现严重并发症转入重症监护的患者;④观察指标数据统计不完整的患者;⑤因各种原因自愿退出本项研究的患者。按患者的住院号将其随机分为观察组和对照组,各58例。患者对手术治疗方案知晓并自愿参与本项研究,研究方案的实施通过医院伦理委员会审查批准。
1.2 方法
1.2.1 对照组 采用开腹手术治疗,术前完善各项检查后开始手术,采取静脉全麻复合气管插管麻醉,氧气流量为1.5 L/min,潮气量为8~10 mL/kg。取平卧位常规消毒铺巾,麻醉起效后在患者的腹部正中位置做一长度为10~15 cm手术切口,逐层分离患者的皮下组织到达腹腔,直视下探查患者的腹腔并明确患者肿瘤病灶的位置、大小及边缘情况,对患者的肿瘤病灶进行完整性切除,切缘距离瘤体边缘不少于2 cm。病灶切除后立刻送检术中病理,确保切缘的阴性后0.9%氯化钠注射液冲洗腹腔,放置引流导管后逐层缝合切口,术后进行常规的抗感染治疗。
1.2.2 观察组 采用腹腔镜下胃肠间质瘤切除术治疗,患者术前完善各项检查后开始手术,采取静脉全麻复合气管插管麻醉,氧气流量为1.5 L/min,潮气量为8~10 mL/kg。在患者的脐部下缘约2 cm处做一长度为1 cm切口作为观察孔,并常规建立CO2气腹,气腹压力15 mmHg,然后置入直径为10 mm的套管针和腹腔镜进行腹腔探查。在患者的脐部水平位置左侧做一长度为5 cm的弧形切口,作为主操作孔,并在患者的脐部与剑突连线的中点位置做一长度为3 cm的切口作为副操作孔,在主副操作孔分别置入相应的手术器械。在腹腔镜引导下探查患者的腹腔,并明确患者的肿瘤病灶的位置、大小及边缘情况。但患者的瘤体位于胃小弯侧时,将肿瘤病灶与肝胃韧带进行分离后再行局部切除。当肿瘤位置位于患者胃后壁时,先利用超声刀将网膜无血管区切开,充分暴露肿瘤病灶后进行楔形切除。对于近贲门部的肿瘤病灶,充分游离胃底脾胃韧带后进行完整切除。切除完成后立即送检术中病理,确保切缘的阴性后0.9%氯化钠注射液冲洗腹腔,然后依次退镜并置入引流导管缝合切口,术后进行常规的抗感染治疗。
1.3 观察指标及判定标准
1.3.1 手术相关指标 统计比较两组患者的手术时间、术中失血量、术后肠道功能恢复时间、术后开始下床活动时间、住院时间。
1.3.2 并发症情况 记录统计两组患者的术后并发症发生情况。
1.3.3 肿瘤标志物 采集患者手术前及术后1 d的静脉血5 mL,以Biocen 16R型实验室低温高速离心机(西班牙安赛斯公司)进行离心分离,离心参数:温度25 ℃、转速3 000 r/min、离心半径8 cm、时间15 min。检测分离后的血清样本,波形蛋白(vimentin,VIM)、高尔基体跨膜糖蛋白-73(golgi transmembrane glycoprotein-73,GP-73)、趋化因子1
(chemokine 1,CXCL1)水平采用酶联免疫吸附法检测,检测仪器为Architect i1000型酶联免疫分析仪(美国Abbott公司),试剂盒由上海阿尔德里奇生物科技公司提供。
1.3.4 免疫功能指标 选择1.3.3的血清标本,采用X-20型流式细胞仪(美国BD公司)检测两组患者手术前及术后1 d免疫功能指标(CD3+、CD4+、CD8+),并计算CD4+/CD8+。
1.3.5 EORTC QLQ-C30生存质量评分 采用EORTC QLQ-C30生存质量评分量表评估两组患者手术前及术后1个月的生存质量,研究选取躯体、角色、情绪、認知和社会功能5个功能领域进行评估,每个领域均采用百分制计分,分值越高患者的生存质量越高[9]。
1.4 统计学处理 采用SPSS 25.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
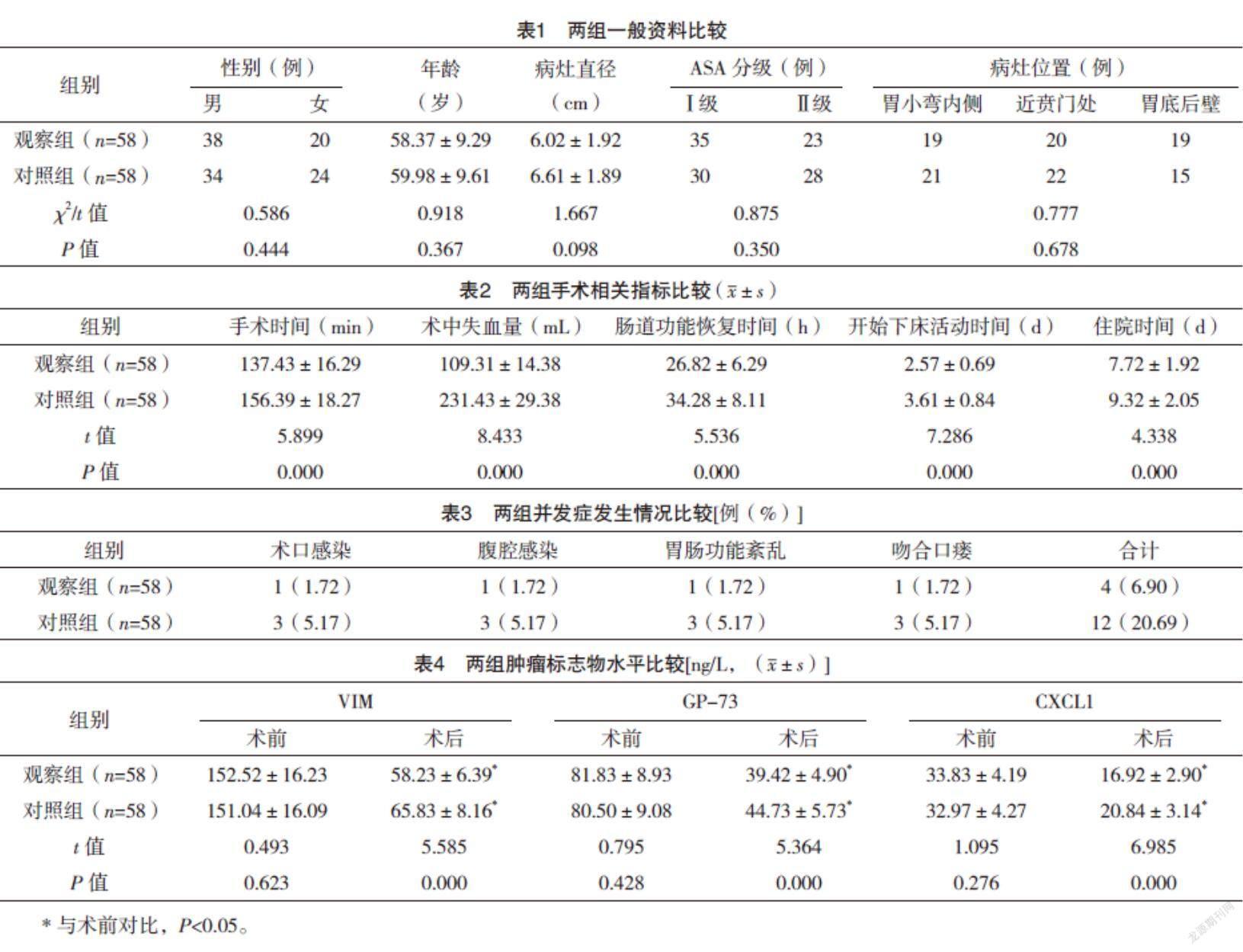
2.1 两组一般资料比较 两组患者的性别、年龄、病灶直径、ASA分级、病灶位置比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
2.2 两组手术相关指标比较 观察组手术时间、肠道功能恢复时间、开始下床活动时间、住院时间均短于对照组,术中失血量少于对照组(P<0.05),见表2。
2.3 两组并发症发生情况比较 观察组术后并发症发生率为6.90%(4/58),低于对照组的20.69%(12/58),差异有统计学意义(字2=4.640,P=0.031),见表3。
2.4 两组肿瘤标志物水平比较 术前,两组VIM、GP-73、CXCL1比较,差异均无统计学意义(P>0.05);术后,两组VIM、GP-73、CXCL1均低于术前,且观察组上述指标均低于对照组(P<0.05)。见表4。
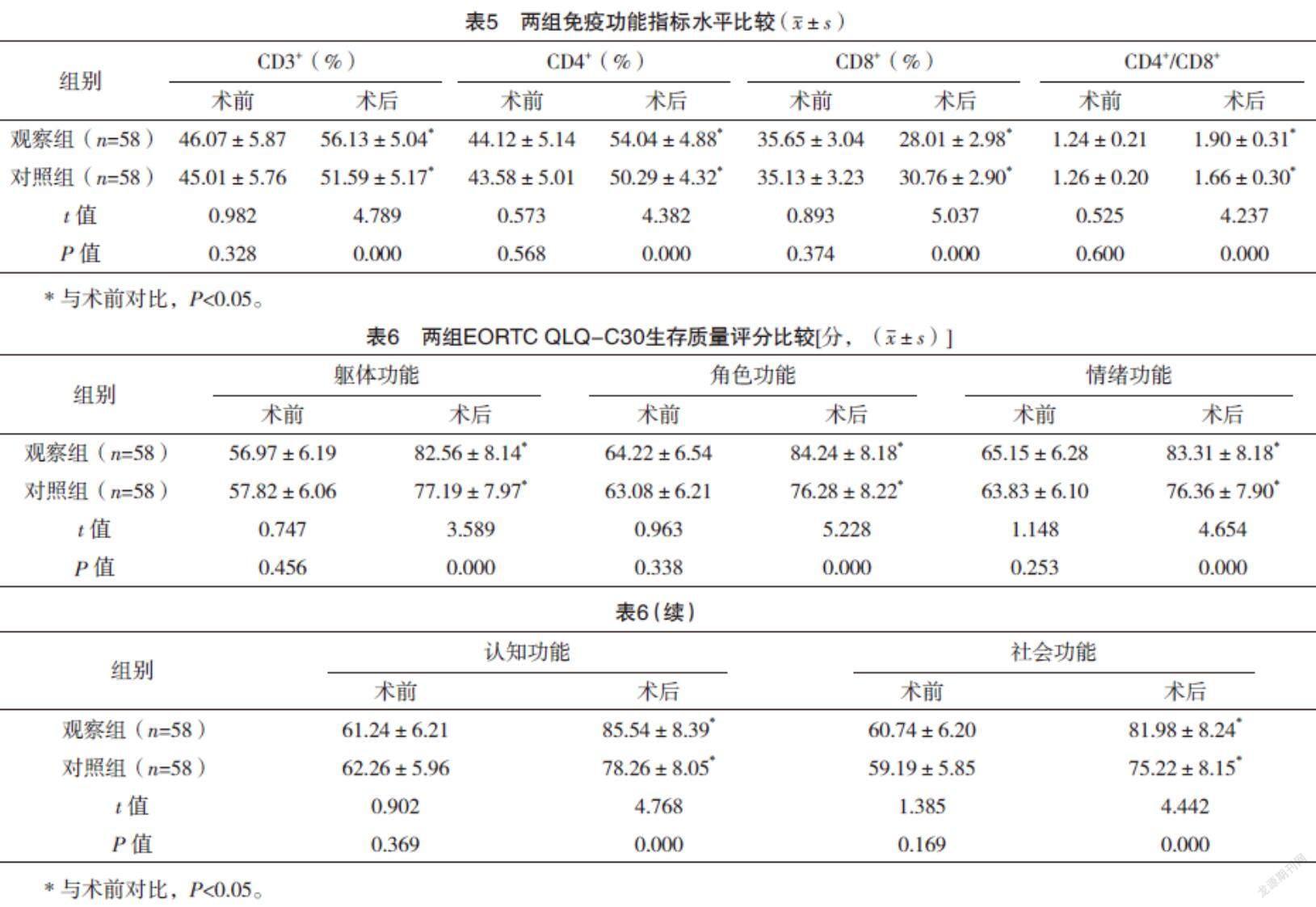
2.5 两组免疫功能指标水平比较 术前,两组CD3+、CD4+、CD8+、CD4+/CD8+比较,差异均无统计学意义(P>0.05);术后,两组CD3+、CD4+、CD4+/CD8+均高于术前,CD8+均低于术前,且观察组CD3+、CD4+、CD4+/CD8+均高于对照组,CD8+低于对照组(P<0.05)。见表5。
2.6 两组EORTC QLQ-C30生存质量评分比较 术前,两组各项EORTC QLQ-C30生存质量评分比较,差异均无统计学意义(P>0.05);术后,两组各项EORTC QLQ-C30生存质量评分均高于术前,且观察组均高于对照组,差异均有统计学意义(P<0.05)。见表6。
3 讨论
CIST是患者消化道间叶组织恶性病变引起的一种潜在性的恶性肿瘤,这类肿瘤在发病及生长过程中具有边界清晰、非浸润性生长以及较少出现淋巴转移等特点,这给此类患者手术切除治疗提供了较好的便利,在确诊后可实现对GIST肿瘤病灶的完整性切除。开放式手术是GIST患者的传统手术切除治疗方法,虽然能够直观地对肿瘤病灶位置进行探查并游离后实现完整切除,但由于开腹手术的创伤性大、术中应激反应较多,限制了其在临床上的广泛应用[10]。腹腔镜下胃肠间质瘤切除术在GIST患者中的应用效果得到了临床的高度认可,与传统开放式手术相比具有一定的优势,主要体现在手术操作的创伤性减小,手术的安全性更有保障[11]。但对于出现在胃小弯内侧、近贲门处、胃底后壁等胃不利部位的GIST,由于解剖学位置复杂,增加了手术操作的难度,存在着手术切除不完全而影响患者预后效果的风险[12]。对于此类患者能否继续应用腹腔镜手术进行切除,是目前临床研究关注的重点方向。
本研究中以胃不利部位GIST患者为手术对象,分别采用腹腔镜手术和开放式手术治疗,结果显示,观察组患者手术时间、术后肠道功能恢复时间、术后开始下床活动时间、住院时间均短于对照组,术中失血量、术后并发症发生率均低于对照组,表明腹腔镜下胃肠间质瘤切除术创伤性更小,对患者的损伤较小,患者术后能够更快的恢复。这是因为本研究中腹腔镜手术采用三孔法,仅需通过穿刺将腹腔镜和操作器械置入腹腔内,相比于开腹手术不需要进行大的手术切口,因而术中失血量大为降低[13-14]。另外,手术过程在腹腔镜的引导下,能够更为清晰的观察手术部位的情况,手术操作的精准度得到提高[13],手术时间得以缩短,手术创伤性的降低使得患者术后能够更为快速的恢复,因而患者下床活动时间、住院时间均有缩短。再者,腹腔镜下胃肠间质瘤切除术可显著提高手术操作的精准度,减少操作过程中对旁系组织的损伤,因而患者术后的并发症发生率也有进一步的降低[15-16]。VIM、GP-73、CXCL1均为GIST患者发病过程中常见的肿瘤标志物,VIM为波形蛋白,是中间丝的其中一种蛋白质,在细胞的分裂过程中有促进作用,既往报道显示VIM在肿瘤疾病中有促进癌细胞分裂增殖的作用,在各类癌症疾病中呈现高表达[17]。GP-73是一种新型的胃部肿瘤早期诊断和病情评估的重要肿瘤标志物,具有较高的灵敏度和特异性[18]。CXCL1是趋化转录因子家族成员,具有高度保守的锌指结构,能够识别趋化因子序列并与之结合,在机体的组织发育过程中有着重要作用,近些年的报道显示CXCL1可作为促癌因子参与胃癌的发生发展过程[19-20]。本研究中观察组术后的VIM、GP-73、CXCL1水平均低于对照组,从分子病理的角度证实了腹腔镜下胃肠间质瘤切除术对于胃不利部位GIST患者的良好治疗效果。免疫功能是机体抵御肿瘤疾病的一道重要屏障,T淋巴细胞亚群是机体细胞免疫的重要组成部分,在GIST患者中通常呈现免疫功能紊乱状态,本研究中观察组术后的CD3+、CD4+、CD4+/CD8+均高于对照组,CD8+低于对照组,表明腹腔镜手术治疗对于胃不利部位GIST患者能够保护机体的免疫功能。在生活质量评分比较中,观察组生活质量各项评分均优于对照组,体现了腹腔镜手术对于胃不利部位GIST患者有良好的预后效果。
综上所述,腹腔镜下胃肠间质瘤切除术对胃不利部位胃肠间质瘤患者手术效果良好,能够降低手术创伤性,提高手术安全性,促进术后康复,且能改善患者的免疫功能和术后生存质量,可临床推荐。
参考文献
[1]支小飞,陈思俊,华如衡,等.CCDC34在胃肠道间质瘤中的表达及其与血管生成的关系[J].中国普通外科杂志,2020,29(4):449-457.
[2]杨成,费建东.胃肠道间质瘤患者的免疫表型,病理特征與预后的相关性研究[J].现代消化及介入诊疗,2019,32(2):127-128.
[3] BANDYOPADHYAY D,BONATTI H.Acute Right Lower Abdomen in a Patient with a History of Gastrointestinal Stromal Tumor[J].Case Reports in Surgery,2019,20(19):1-4.
[4]叶陈敏,易永东,沈雷斌,等.中性粒细胞与淋巴细胞比值联合纤维蛋白原检测对胃肠道间质瘤预后的判断价值[J].中华普通外科杂志,2019,34(4):124-128.
[5] TATARA T,KANAJI S,SUZUKI S,et al.Evaluation of the result of single-incision laparoscopic surgery for gastrointestinal stromal tumors in the stomach[J].Surgical Case Reports,2019,38(5):288-294.
[6] LI P,LI W,MA B.Is endoscopic resection more effective than laparoscopic resection in gastric gastrointestinal stromal tumours?[J].European Journal of Surgical Oncology,2020,46(8):391-396.
[7]王旋,卢婧,郭婉,等.5例双镜联合胃间质瘤黏膜下剥除术的手术配合[J].腹腔镜外科杂志,2019,24(12):112-114.
[8]中国医师协会外科医师分会胃肠道间质瘤诊疗专业委员会,中华医学会外科学分会胃肠外科学组.胃肠间质瘤规范化外科治疗中国专家共识(2018版)[J].中国实用外科杂志,2018,38(9):965-973.
[9]帕爾哈提江·阿布力米提,多力坤·牙生,克力木·阿不都热依木,等.胃肠道间质瘤的免疫疗法现状与进展[J/OL].中华胃食管反流病电子杂志,2020,7(1):374-377.
[10] SONG M,RUTH Y,AHMED S,et al.Microscopically Positive Resection Margins in Laparoscopic Gastric GIST Resection May Not Confer a Poorer Prognosis[J].Surgical Laparoscopy, Endoscopy and Percutaneous Techniques,2019,29(5):393-398.
[11]娄丽萍,倪娟,杨成,等.胃肠道间质瘤c-Kit/PDGFRA基因Sanger法测序套峰产生的原因及解决方案[J].临床与实验病理学杂志,2019,35(10):3253-3258.
[12] LI D M,REN L L,JIANG Y P.Long-term Outcomes of Endoscopic Resection for Gastric Subepithelial Tumors[J].Surgical Laparoscopy, Endoscopy and Percutaneous Techniques,2020,30(2):101-108.
[13]陶凯雄,万文泽,陈俊华,等.腹腔镜和开腹手术治疗胃解剖困难部位胃肠间质瘤效果比较的倾向性评分匹配研究[J].中华外科杂志,2019,57(8):226-230.
[14]程国凌,王松松.腹腔镜下胃肠间质瘤切除术治疗胃不利部位胃肠间质瘤的效果及其对免疫功能的影响[J].实用临床医药杂志,2020,24(21):5-8.
[15]李亚平,朱明杰,蒋鸿元.腹腔镜手术治疗胃肠道间质瘤的效果及预后分析[J].解放军医药杂志,2020,32(8):357-361.
[16]陈镜宇.内镜辅助腹腔镜手术对胃肠道间质瘤患者血清PA,TRF及ALB水平的影响[J/OL].现代医学与健康研究电子杂志,2020,4(10):123-126.
[17] ORESTIS L,YUSEF M,MATTHIAS M,et al.Coincidental Detection of Gastrointestinal Stromal Tumors During Laparoscopic Bariatric Procedures-Data and Treatment Strategy of a German Reference Center[J].Obesity Surgery,2020,29(6):1858-1866.
[18]赵晶晶,邹晓平.胃肠道间质瘤预后相关分子标记物的研究进展[J].中国临床研究,2019,32(5):213-215.
[19] KAZUO T,TOSHIO S,AYAKO F,et al.Laparoscopic resection of a gastrointestinal stromal tumor larger than 5 cm: Report of a Case[J].Acta Medica Nagasakiensia,2019,62(2):63-68.
[20]李素琴,李夏,朱晓芸,等.四种术式治疗胃肠道间质瘤的临床对比研究[J].胃肠病学和肝病学杂志,2019,28(4):215-218.
(收稿日期:2021-12-27) (本文编辑:姬思雨)
