虎杖苷调控PINK1-Parkin介导的线粒体自噬改善变应性鼻炎
2022-07-11刘思奇金海南张雅琳宋艺兰延光海王重阳金永德
刘思奇,金海南,张雅琳,宋艺兰,延光海,王重阳,金永德
(1. 吉林省过敏性常见疾病免疫与靶向研究重点实验室,延边大学,吉林 延吉 133002; 2. 延边大学医学院解剖学教研室,吉林 延吉 133002;3. 延边大学附属医院耳鼻咽喉头颈外科,吉林 延吉 133002)
变应性鼻炎(Allergic rhinitis, AR)与鼻黏膜炎症反应有关,是一种常见的异质性疾病[1]。全球约有4亿AR患者,尤其是在工业化国家,其发病率很高,并且呈上升趋势。该疾病不仅影响患者的生活质量,而且治疗AR具有巨大的社会成本[2]。目前,皮质类固醇药物仍是治疗AR的首选基础疗法,但其副作用是无法忽视的。因此,迫切需要开发一种治疗AR安全有效的方法。
线粒体自噬是一特殊的选择性自噬模式,在应激条件下,会对受损的线粒体选择性地清除和吞噬[3]。研究表明[4],线粒体损伤促进线粒体外膜上PINK1的累积,PINK1将细胞质中的泛素连接酶Parkin招募到去极化的线粒体,通过泛素化线粒体蛋白和吞噬受损的线粒体刺激线粒体自噬,这一过程是维持线粒体内稳态和正常细胞生理功能的关键保护机制。线粒体功能障碍已被证实与过敏性疾病有关,包括变应性皮炎和哮喘等[5-6],线粒体自噬可以抑制线粒体诱导的炎症,因此线粒体自噬可能在线粒体功能障碍和线粒体生物能量学紊乱中发挥重要作用[5]。目前,线粒体自噬在AR中的报道尚不充分,需要进一步探索。
虎杖苷(Polydatin, PD)(3, 40, 5-三羟基二苯乙烯-3-b-D-葡萄糖苷)是一种白藜芦醇糖苷,是从虎杖根茎中提取的天然中药成分[7],具有抗炎、抗氧化、抗动脉粥样硬化以及预防缺血/再灌注损伤等作用[8-9]。Li等[10]研究证实了PD通过激活Parkin介导的线粒体自噬减轻急性呼吸窘迫综合征。Zeng等[11]提出PD通过Nrf2介导的抗氧化作用可以缓解哮喘。据报道,PD通过靶向 Nrf2/HO-1通路抑制过敏性炎症反应,因此,PD可能是治疗过敏性炎症性疾病的一种潜在有效药物[12]。本研究旨在阐明PD是否通过PINK1-Parkin信号通路调控线粒体自噬缓解AR,为临床提供新的靶向治疗药物。
1 材料与方法
1.1 动物模型与分组整个实验过程中的操作程序均按照《实验动物管理条例》进行,并获得延边大学医学院伦理委员会批准(批准号:YB. NO20200614b0321214),实验动物使用许可证号SYXK(吉)2020-0009。选取32只无特定病原体(SPF)级雌性BALB/c小鼠,6~8周龄。随机分为4组(n=8),对照组, OVA组,PD低剂量(30 mg·kg-1)和高剂量(45 mg·kg-1)治疗组。对照组小鼠于d 1、8、15腹腔注射0.3 mL PBS。其余3组按相同的时间表腹腔注射25 μL OVA(1 g·L-1)和50 μL氢氧化铝的混合溶液 0.3 mL致敏。从d 22开始, OVA组、PD低、高剂量组连续滴鼻激发7 d,激发液为20 μL OVA(5 g·L-1), 对照组用等量PBS代替。此外,在d 22~29,PD组在每次激发前2 h处理小鼠。
1.2 小鼠鼻炎症状评估最后一次OVA刺激后,在15 min内,于安静环境中仔细记录小鼠打喷嚏和鼻摩擦运动的总次数,并与对照组进行比较。
1.3 组织学分析鼻组织放于10%甲醛溶液在室温下固定24 h,然后在EDTA脱钙液中脱钙 8~12天,石蜡包埋。连续切片(4 μm厚度),脱蜡后,用苏木精和伊红染色。随机选择切片,在显微镜下拍摄,观察鼻黏膜上皮的形态和鼻黏膜中嗜酸性粒细胞的浸润情况。
1.4 细胞培养和处理人鼻黏膜上皮细胞(HNEpC)购买于吉妮欧生物科技公司(广州),在添加10% FBS(Gibco)的MEM培养基(Life)中,37 ℃、5% CO2的增湿空气条件下培养。用100 μmol·L-1和200 μmol·L-1的PD分别处理治疗组细胞1h后,给予10 μg·L-1的IL-13蛋白(Technologies)刺激细胞24 h。
为了抑制线粒体自噬,先用10 μmol·L-1线粒体自噬特异性抑制剂Mdivi-1[13]预处理细胞2 h,然后用200 μmol·L-1的PD处理治疗组细胞1 h,最后给予10 μg·L-1的IL-13蛋白刺激细胞24 h。
1.5 线粒体分离使用线粒体分离试剂盒(Beyotime)对组织和细胞进行线粒体分离。在冰上均浆,然后4 ℃,12 000×g离心10 min,分离线粒体(Mito)蛋白质,然后在-80 ℃下储存以供Western Blot分析。
1.6 Western blot收集组织蛋白或细胞,在4 ℃下以12 000×g离心10 min。定量蛋白质浓度后进行电泳。待电泳分离,转移至PVDF膜上。加入一抗(PINK1、Parkin、TOM20、Bax、Bcl-2、caspase-3、cleaved-caspase-3、Cytochrome C),4 ℃缓慢摇床过夜。洗膜,用相应的二抗室温下孵育1 h。最后,在暗室中使用增强化学发光(ECL)可视化条带,观察蛋白表达。
1.7 免疫荧光分析处理后的细胞用4 ℃的甲醇固定20 min,在室温下用5% BSA封闭1 h,然后 0.2% Triton渗透20 min。与一抗PINK1、cleaved caspase-3在4 ℃下过夜,然后用相应的二抗孵育,37 ℃,2 h。由Cytaion 5拍摄荧光图像。使用Image J软件,选择相应的荧光通道和测量阈值,每张图像确定细胞位置,记录数据并计算。
2 结果
2.1 PD减轻小鼠的鼻部过敏症状,抑制小鼠鼻黏膜上皮炎症浸润为了探讨PD在AR中的作用,我们通过腹腔注射和滴鼻建立了AR小鼠模型,最后一次OVA鼻内刺激后,在15 min内记录小鼠打喷嚏和挠鼻的频率。结果显示,OVA诱导的AR 小鼠过敏症状显著增加(P<0.05),PD治疗后模型组小鼠打喷嚏和挠鼻的次数明显减少(P<0.05;Fig 1A)。鼻组织HE染色的结果显示在OVA诱导的AR模型中鼻黏膜上皮显著增厚,黏膜下的嗜酸性粒细胞聚集增加,而PD抑制了这些改变,见Fig 1B。

Fig 1 Nasal symptoms and histological changes in murine model of A: the frequency of sneezing and nasal rubbing in each group of murine(n=8); B: HE staining of nasal mucosa sections. Scale bar=500 μm. High magnification of the boxed areas was shown below. Scale bar=200 μm. The arrows indicated eosinophils(n= 4). **P<0.01 vs control group;##P<0.01 vs OVA-induced group.
2.2 PD激活OVA诱导的AR小鼠的线粒体自噬并抑制线粒体凋亡我们通过Western blot检测了PINK1、Parkin、TOM20和线粒体凋亡相关蛋白的水平。结果显示,相比对照组,予以OVA刺激后,PINK1、Parkin、Bax、caspase-3、cleaved-caspcase-3、Cytochrome C在AR小鼠鼻黏膜组织中高度表达(P<0.05), TOM20和Bcl-2的水平降低(P<0.05),PD治疗后上调了PINK1、Parkin、Bcl-2的水平(P<0.05),而TOM20和促凋亡蛋白Bax、caspase-3、cleaved-caspase-3、Cytochrome C的表达减少(P<0.05;Fig 2A、B)。

Fig 2 Expression of PINK1, Parkin, TOM20, Bax, Bcl-2, caspase-3, cleaved-caspase-3 and Cytochrome C in each n=4)A, B : Western blot analysis was used to detected the expression of PINK1, Parkin、TOM20、Bax、Bcl-2、caspase-3、cleaved-caspase-3 and Cytochrome C in murine. **P<0.01 vs control group;#P<0.05, ##P<0.01 vs OVA-induced group.
2.3 IL-13刺激的HNEpCs中PINK1、Parkin、TOM20和凋亡相关蛋白的表达对于线粒体自噬相关蛋白的免疫印迹分析,我们可以看出,与对照组相比,予以IL-13处理后,PINK1、Parkin和促凋亡蛋白表达增加(P<0.05),PD进一步增加了PINK1、Parkin的表达(P<0.05),而抑制了促凋亡蛋白的水平(P<0.05)。并且200 μmol·L-1比100 μmol·L-1的PD治疗效果更明显。IL-13 刺激后,线粒体膜蛋白TOM20和Bcl-2水平降低(P<0.05),PD加速了TOM20的降解(P<0.05),上调了Bcl-2的水平(P<0.05;Fig 3A、B)。免疫荧光结果如预期一样,IL-13上调了PINK1和cleaved-caspase-3的水平(P<0.05),PD组PINK1的表达进一步升高(P<0.05),而cleaved-caspase-3的表达下降(P<0.05;Fig 3C、D)。
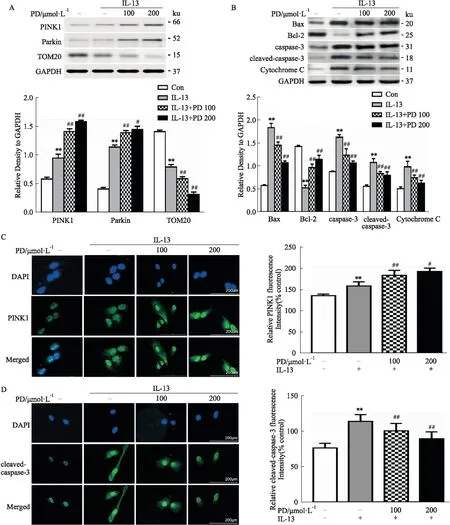
Fig 3 Expression of PINK1, Parkin, TOM20 and apoptosis-related proteins in IL-13-stimulated n=3)After treated with different concentration of polydatin (100 μmol·L-1 and 200 μmol·L-1) for 1h, HNEpCs were stimulated with 10 μg·L-1 IL-13 for 24 h. A,B: Protein expressions of PINK1, Parkin, TOM20, Bax, Bcl-2, caspase-3, cleaved-caspase-3 and Cytochrome C in HNEpCs treated with IL-13 were determined by Western blot; C,D: Immunofluorescence assay was performed for PINK1 and cleaved-caspase-3. **P<0.01 vs untreated group; #P<0.05,##P<0.01 vs IL-13-stimulated group.
2.4 Mdivi-1预处理后HNEpCs中PINK1、Parkin、TOM20和凋亡相关蛋白的表达Western blot结果显示,与模型组相比,Mdivi-1处理后,PINK1、Parkin、Bcl水平降低(P<0.05),TOM20 的表达升高(P<0.05),有趣的是,Mdivi-1抑制线粒体自噬后,PD对上述蛋白的表达没有显著影响(P>0.05;Fig 4A、B)。在免疫荧光中,我们发现,Mdivi-1处理后,抑制了PINK1的表达(P<0.05),此时PD的治疗作用不明显(P>0.05;Fig 4C),而cleaved-caspase-3在予以Mdivi-1处理后,表达量明显提高(P<0.05),PD治疗后没有显著影响(P>0.05;Fig 4D)。

Fig4 Expression of PINK1, Parkin, TOM20 and apoptosis-related proteins in IL-13-stimulatedHNEpCs after Mdivi-1 After pretreated with Mdivi-1 (10 μmol·L-1) for 2 h, HNEpCs were treated with polydatin (200 μmol·L-1) for 1 h, and then stimulated with 10 μg·L-1 IL-13 for 24 h. A, B : Expressions of PINK1, Parkin, TOM20 and apoptosis-related proteins in HNEpCs treated with IL-13 were measured by Western blot; C,D: Immunofluorescence assay was performed for PINK1 and cleaved caspase-3. **P<0.01 vs untreated group; ##P<0.01 vs IL-13-stimulated group.
3 讨论
AR是临床常被患者忽视且很难有效控制的过敏性疾病,是哮喘、中耳炎、睡眠呼吸暂停等许多并发症的基础,严重影响患者生活质量和社会生产力[2]。随着健康意识的提高,人们越来越倾向于通过科学的饮食来防治疾病。因此,PD作为具有抗炎、抗过敏[8]等一系列药物功能的天然植物成分已经应用于许多疾病的治疗。根据我们的数据,OVA诱导的AR小鼠挠鼻和打喷嚏的次数较对照组明显增多,PD缓解了AR小鼠鼻部临床过敏症状,从HE染色结果中可以观察到,PD减轻了鼻黏膜上皮增厚和嗜酸性粒细胞浸润。
线粒体激酶PINK1和E3-泛素(Ub)连接酶Parkin是参与线粒体自噬两种最核心的蛋白,在健康的机体中,PINK1会被迅速降解,因此含量很低[14]。应激条件下,线粒体外膜(TOM)复合物转位酶PINK1输入阻滞,导致其泛素激酶活性通过自身磷酸化激活,并启动Parkin依赖的线粒体清除。PINK1磷酸化的Ub结合Parkin的RING1结构域,诱导了对Parkin的磷酸化,激活Parkin后,将其从细胞质中易位[4]。Cao等[15]表明,姜黄素通过AMPK-TFEB信号通路激活Parkin依赖的线粒体自噬以改善肠道屏障线粒体损伤。Li等[16]研究认为激活PINK1/Parkin介导的线粒体自噬可以减轻细胞线粒体凋亡,从而加速肺血管重塑。Lin[17]和同事证实,Pink1-Parkin通路诱导的线粒体自噬可以抑制线粒体ROS和NLRP3炎症小体来缓解造影剂引起的急性肾损伤。在本研究中,我们发现了在AR小鼠鼻黏膜组织和HNEpC细胞中,模型组PINK1和Parkin高度表达,PD治疗后进一步上调了PINK1/Parkin的水平,激活了线粒体自噬。然后,我们用Mdivi-1处理HNEpCs,Mdivi-1是一种被广泛接受的线粒体自噬的特异性抑制剂,通过阻断动力1样蛋白(DNM1L,线粒体裂变和随后的线粒体自噬消除的关键调控因子)抑制线粒体自噬[13]。结果发现PINK1/Parkin表达显著降低,线粒体自噬减少,而PD治疗对这些变化没有显著影响。基于以上结果,提示抑制线粒体自噬可以减弱PD对PINK1/Parkin通路的激活,进一步确定PD改善AR是通过PINK1-Parkin这一途径实现的。
此外,线粒体自噬与凋亡的相互调节对维持线粒体网络的稳态也发挥着关键作用,线粒体是调控凋亡的中心环节,同时Bcl-2家族也密切参与线粒体自噬功能[18]。在凋亡早期,促凋亡蛋白增加,Bax转移到线粒体内层,通过连续级联诱导Cytochrome C和caspases-3,最终导致细胞死亡[19]。因此,细胞的抗凋亡防御策略,可以减轻线粒体凋亡对机体的有害影响。该研究中,在OVA诱导的AR小鼠和IL-13刺激的HNEpC中,PD均可抑制促凋亡蛋白,包括Bax、caspase-3、cleaved-caspase-3和Cytochrome C,使抗凋亡蛋白Bcl-2的表达增加,从而我们得出PD作为抑制剂发挥其生物学作用减少凋亡从而缓解AR。PD的抗凋亡作用也已在其他疾病中得到证实[20-21]。Tong等[21]提出PD抑制氧化应激和炎症反应,以减少海马细胞凋亡。我们通过线粒体自噬的特异性抑制剂Mdivi-1观察了线粒体自噬对线粒体凋亡的影响,结果中可以看出,Mdivi-1可以促进IL-13诱导的促凋亡蛋白的积累,抑制Bcl-2的水平,PD没有逆转以上蛋白的表达。这些结果说明IL-13促凋亡是通过线粒体自噬-线粒体凋亡途径介导的。
总之,PD可能通过调节PINK1-Parkin介导的线粒体自噬缓解AR。值得注意的是,线粒体自噬是一个十分复杂的过程。目前,线粒体自噬作用尚不能完全阐述,需要进一步探索。本项研究提高了我们对PD在AR中的作用和认识,为AR提供了新的治疗策略。
