野生型p27 和核定位信号缺失型p27真核表达载体的构建及表达
2022-07-11焦鑫艳杨泽健高小倩刘培军
焦鑫艳 ,张 英 ,盛 秋 ,张 妙 ,杨泽健 ,高小倩 ,赵 谦 ,王 博 ,刘培军
(1. 西安交通大学第一附属医院转化医学中心,陕西西安 710061;2. 陕西省肿瘤精准医学重点实验室,陕西西安 710061;3. 西安交通大学第一附属医院消化内科,陕西西安 710061;4. 西北工业大学医院,陕西西安 710072;5. 西安交通大学第一附属医院耳鼻喉头颈外科,陕西西安 710061)
细胞内的核输入和核输出是一个多种蛋白质和复合物在核膜上高度协调工作的生物学过程,维持着细胞生长和死亡的平衡,对保证细胞正常的功能和新陈代谢十分必要。核输入和核输出的紊乱则引起如p27、p21、FOXO、p53 和 Rb 等肿瘤抑制因子的定位异常,导致肿瘤的发生发展[1]。其中,p27 的编码基因为CDKN1B,其在细胞中广泛表达,并高度保守,很少发生突变或者缺失。p27 蛋白作为周期蛋白依赖性激酶抑制剂家族的重要成员,可通过其保守的N 端结构域结合并抑制细胞质中的周期蛋白和CDK 复合体的激酶活性,负调控细胞G1期向S 期转变,抑制细胞周期进程,在细胞增殖中具有重要作用[2]。文献报道,细胞内总p27 表达变化影响细胞增殖,而p27 的细胞核和细胞质定位是影响细胞增殖的关键因素[3],胞核p27 蛋白的聚集表现出抗增殖活性[4]。在正常细胞中,p27 大部分位于细胞核;但在许多肿瘤细胞中,p27 定位紊乱,大部分定位于细胞质。这可能是由于p27 在细胞核和细胞质中具有不同作用,而在肿瘤的发生过程中,一般伴随着p27 的核浆移位。因此,进一步了解p27 核浆定位的变化对深入研究肿瘤的恶性发展很有必要。
本研究拟从人MCF7 细胞的总RNA 中特异性扩增出野生型p27 蛋白(wild-type p27,p27WT)的CDs区序列,再通过重叠PCR 的方法扩增出核定位信号缺失型 p27 蛋白(lacking nuclear localization signal p27,p27△NLS)序列,将其分别连接至真核表达载体pCMV-Blank。经Sanger 测序鉴定后,电穿孔法转染 HEK293T 细胞,验证 p27WT 和 p27△NLS 在细胞质和细胞核中的过表达水平,为今后探讨p27核浆定位机制以及肿瘤恶性生物学行为研究提供细胞基础。
1 材料与方法
1.1 主要试剂
DMEM 培养基(美国 Corning 公司),胎牛血清(美国 Gibco 公司),RNA FAST200 试剂盒(上海Fastagen 公司),限制性内切酶EcoR Ⅰ和BamH Ⅰ(英国 NEB 公司),反转录 cDNA 试剂盒、T4 DNA 连接酶(美国 Thermo 公司),PrimeSTAR 高保真 PCR酶(日本TaKaRa 公司),DNA 凝胶回收试剂盒、质粒小量提取试剂盒和无内毒素质粒提取试剂盒(北京天根生化科技有限公司),PVDF 膜、免疫印迹发光液(美国Millipore 公司),兔抗人p27 抗体(美国Santa Cruz 公司),GAPDH 抗体、兔抗人Lamin B1 抗体(武汉三鹰生物技术有限公司),山羊抗兔二抗(北京博奥森生物技术有限公司),细胞核浆蛋白分离试剂盒(陕西先锋生物科技有限公司)。相关PCR 引物由西安擎科生物公司合成。
1.2 质粒、菌株和细胞系
真核表达载体pCMV-Blank(上海碧云天生物技术有限公司);宿主菌E.coliDH5α(北京天根生化科技有限公司);人胚肾细胞HEK293T 为本实验室保存细胞,使用含50 mL/L 胎牛血清的高糖DMEM 培养基,并置于37 ℃、50 mL/L CO2条件下进行培养。
1.3 获取p27WT 和p27△NLS 编码区片段
根据 GenBank 中 人CDKN1B(NM_004064.5)基因的CDs 序列,以及在UniProt 数据库(https://www.uniprot.org/uniprot/)查询p27 蛋白的核定位信号序列区域。随后,应用软件Oligo 7 设计针对p27全长编码区的特异性PCR 引物,并在上游引物加入酶切位点BamHⅠ和保护碱基,p27WT-F:5′-CGCGGATCCATGTCAAACGTGCGAGTGTCT-3′,在下游引物加入酶切位点EcoR Ⅰ和保护碱基,p27WT-R:5′-CGGAATTCTTACGTTTGACGTCTTCTGAGGCC-3′;同时针对核定位信号缺失设 计 重 叠 PCR 引 物 ,上 游 引 物 p27 △ NLS-F:5′-GAGCAATGCGCAGGAATAAGGACAGAAGAAAATGTTTCAGACGGT-3′,下 游 引 物 p27 △NLS-R: 5′-ACCGTCTGAAACATTTTCTTCTGTCCTTATTCCTGCGCATTGCTC-3′。 收 集MCF7 细胞,依照RNA FAST200 试剂盒说明书,提取细胞总RNA;随后依照反转录cDNA 试剂盒说明书,反转录成cDNA。以该cDNA 为模板,p27WT-F和 p27WT-R 为引物,经 PCR 获取 p27WT 全长编码区的序列,并对PCR 产物进行切胶纯化回收。
再以该胶回收纯化产物为模板,以p27WT-F 和p27△NLS-R 为引物,经 PCR 获取 p27-FR1 序列;以p27△NLS-F 和 p27WT-R 为引物,经 PCR 获取 p27-F1R 序列,分别进行切胶纯化回收。
最后以p27WT-F 和p27WT-R 为引物,以p27-FR1 和 p27-F1R 序列为模板,进行重叠 PCR 扩增,获取p27△NLS 片段的序列,并进行切胶纯化回收。PCR 反 应 体 系 :cDNA 模 板 1 μL,10 μmol/L 上 游和下游引物各 1 μL,5×PCR Buffer 10 μL,dNTP 4 μL,高 保 真 PCR 酶 1 μL,补 足 ddH2O 至 50 μL。PCR 反 应 条 件 :98 ℃ 5 min;98 ℃ 15 s,60 ℃ 20 s,72 ℃ 40 s,39 个循环。该 PCR 产物通过 12 g/L 琼脂糖凝胶电泳进行检测。
1.4 构建p27WT 和p27△NLS 真核表达载体
将 p27WT 和 p27△NLS 的 PCR 产物分别进行切胶回收纯化,随后与真核表达载体pCMV-Blank分别进行BamHⅠ和EcoRⅠ的37 ℃双酶切反应2 h。将双酶切产物分别进行琼脂糖凝胶电泳和切胶回收纯化,并检测浓度。
依照基因片段与载体摩尔比3∶1 的比例,使用T4 DNA 连接酶分别将 p27WT 和 p27△NLS 与真核表达载体pCMV-Blank 于16 ℃进行连接过夜。再将其分别转化E.coliDH5α 感受态细胞,均匀涂在含有卡那霉素的LB 平板上,37 ℃过夜培养。次日挑取数个单克隆菌落,接种在含有卡那霉素的LB 培养基中,置于37 ℃摇床,220 r/min 振荡培养。培养至浑浊后,取 1 μL 菌液,用无菌水稀释 100 倍,100 ℃煮沸10 min 后,取 1 μL 作为模板,进行菌液 PCR,鉴定p27WT 和p27△NLS 片段是否成功插入真核表达载体中。将菌液PCR 鉴定阳性的单克隆菌液提取质粒后,进行双酶切鉴定。最后将双酶切鉴定阳性的克隆质粒送西安擎科生物公司进行Sanger 测序鉴定。将序列比对正确的阳性克隆载体分别命名为pCMV-p27WT 和 pCMV-p27△NLS。
1.5 电穿孔法转染pCMV-p27WT 和pCMV-p27△NLS 质粒
依照无内毒素的质粒中量提取试剂盒说明书,提取无内毒素的质粒pCMV-Blank、pCMV-p27WT 和pCMV-p27 △NLS。 收集处于对数生长期的HEK293T 细胞,依照转染说明书,将适量质粒和细胞混匀后,加入电极杯。设置程序:脉冲电压120 V,脉冲时间10 ms,脉冲时间间隔10 ms。分别将pCMVBlank、pCMV-p27WT 和 pCMV-p27△NLS 质粒转染 HEK293T 细胞,并置于 37 ℃、50 mL/L CO2条件下进行培养,24 h 后更换新鲜的培养基。
1.6 检 测 pCMV-p27WT 和 pCMV-p27△ NLS 质粒在细胞中的表达
经电穿孔法将无内毒素质粒pCMV-Bank、pCMV-p27WT 和 pCMV-p27△NLS 分 别 转 染 HEK293T 细胞 。 48 h 后 ,经 PBS 清 洗 ,无 EDTA 的 胰 酶 消 化 ,PBS 清洗并收集细胞。依照细胞核质蛋白分离试剂盒说明书,分别提取细胞质和细胞核蛋白。经Bradford法进行蛋白定量,按照每孔100 μg 的上样量进行100 g/L 聚丙烯酰胺凝胶电泳,经转膜,50 g/L 脱脂奶 粉 封 闭 ,一 抗(p27,1∶500;LaminB1,1∶1 000;GAPDH,1∶10 000)孵育,TBST 洗膜,二抗(山羊抗兔,1∶5 000)孵育,TBST 洗膜等步骤后,进行化学发光,并使用成像系统进行拍照。
2 结 果
2.1 p27WT 和p27△NLS 蛋白结构域的分析
通过UniProt 数据库的在线分析,可知人野生型p27 蛋白包括 N 端的 Cyclin 结合结构域(28-51aa)和CDK 结合结构域(51-91aa),以及 C 端的 NLS 结构域(153-169aa)等,均较为保守(图1)。Cyclin 结合结构域与Cyclin 亚基结合,CDK 结合结构域与CDK 亚基如CDK2 结合,均为调控细胞周期抑制的结构域;NLS 结构域则负责引导p27 蛋白入核。所构建包含p27WT 全长片段和p27△NLS 片段的真核表达载体,后者不包含NLS 结构域部分,可阻断p27 蛋白入核,使p27 蛋白几乎全部表达在细胞质中。
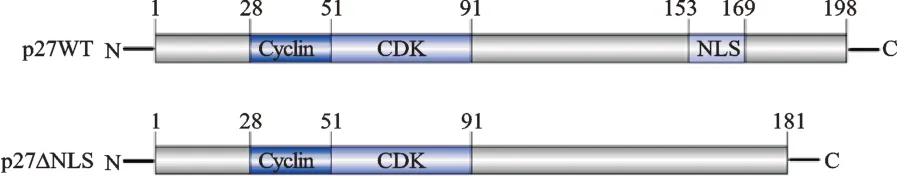
图1 人p27WT 全长编码区和p27△NLS 编码区的结构域示意图Fig.1 Schematic diagram of human p27WT and p27△NLS domains
2.2 人p27WT 和p27△NLS 编码区序列的克隆
琼脂糖凝胶电泳结果显示,p27WT 全长编码区的PCR 产物为600 bp 左右基因条带(图2A),与预期的p27 全长编码区序列594 bp 大小相一致;随后以该PCR 纯化产物为模板,获取 489 bp 的 p27-FR1 序列(图2B)和119 bp 的p27-F1R 序列(图2C);最后进行重叠PCR扩增,获取543 bp的p27△NLS序列(图2D),与预期大小一致。
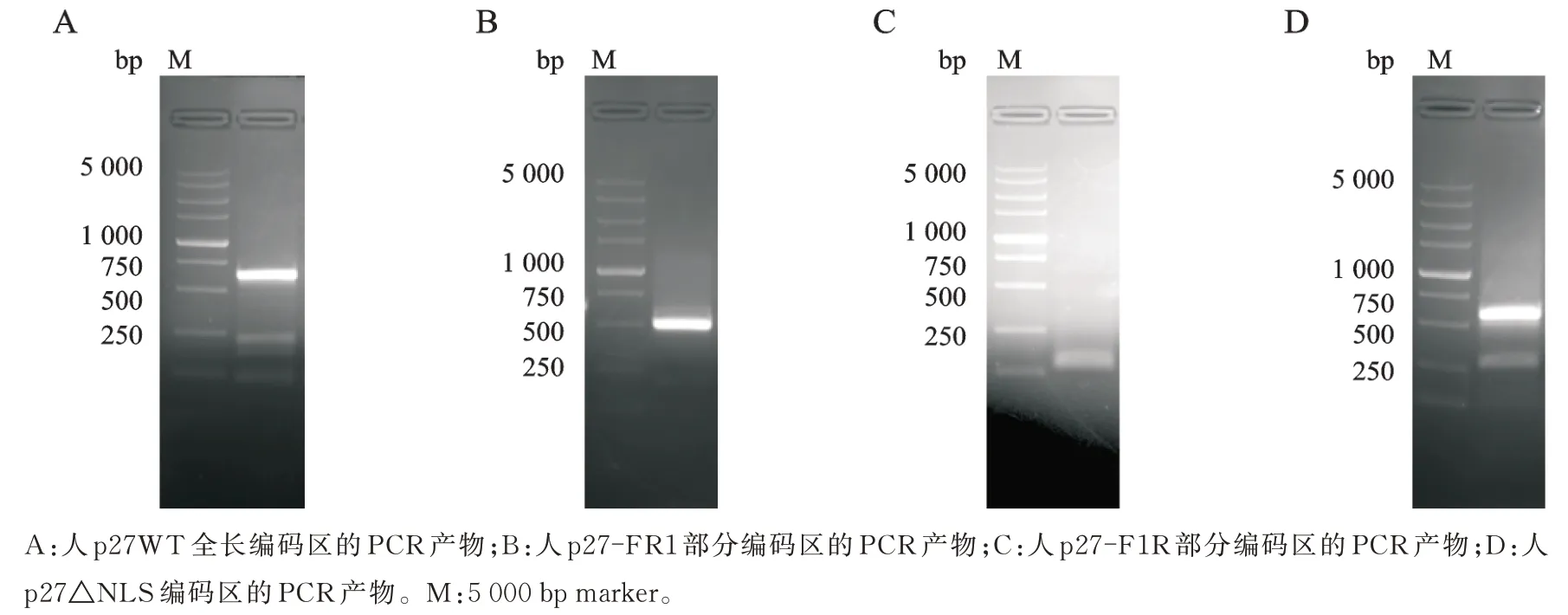
图2 人p27WT 全长编码区和p27△NLS 编码区的PCR 产物电泳图Fig.2 Electrophoretic diagram of PCR fragment of human p27WT and p27△NLS
2.3 真核表达载体pCMV-p27WT 和pCMV-p27△NLS 的鉴定
菌液PCR 产物电泳结果显示,p27WT 的7 号和p27△NLS 的3 号为阳性克隆,PCR 产物电泳分别为594 bp 和543 bp,与理论大小相同(图3A)。载体双酶切鉴定的电泳结果显示,分别获得4 300 bp 和594 bp、4 300 bp 和 543 bp 的 基 因 条 带 ,其 中 4 300 bp 为 线 性载体pCMV-Bank 的产物大小,另一个分别为插入的p27WT 和 p27△NLS 序列产物大小(图 3B)。测序后,在NCBI 中序列比对结果显示,载体pCMV-p27WT 中插入的人p27 全长编码区序列完全正确;载体pCMV-p27△NLS 中插入的人p27 编码区序列缺失核定位信号序列,故以上两种质粒均构建成功。
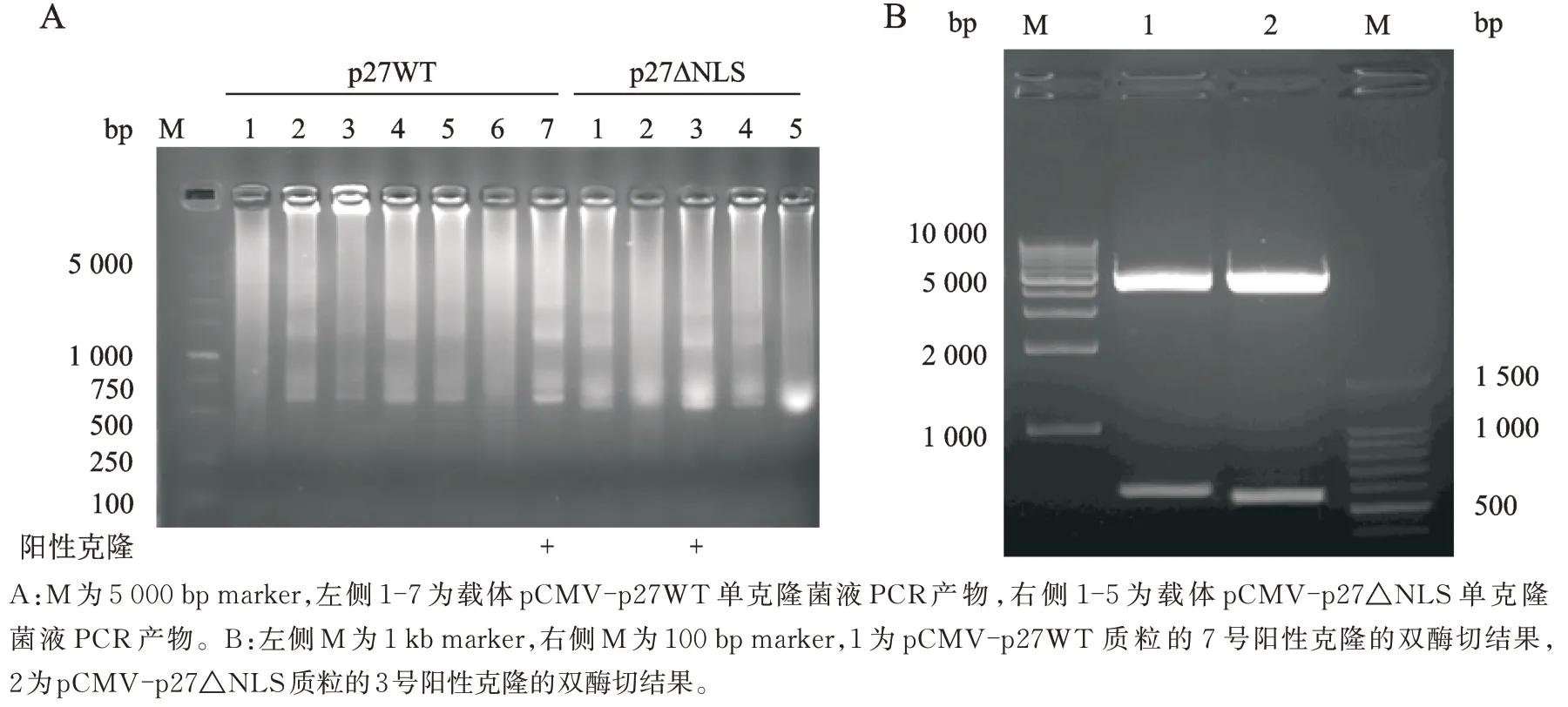
图3 重组质粒pCMV-p27WT 和pCMV-p27△NLS 的菌液PCR 产物电泳结果和双酶切鉴定结果Fig. 3 Identification of recombinant plasmids pCMV-p27WT and pCMV-p27△NLS with bacterial PCR and double restriction enzyme digestion
2.4 p27WT 和 p27△NLS 的细胞表达情况
Western blotting 检测结果显示,pCMV-p27WT转染组中p27 蛋白在细胞核中显著表达,而pCMV-p27△NLS 转染组的p27 蛋白在细胞核中仅有微弱表达(图4)。这提示构建的真核表达载体pCMV-p27WT和pCMV-p27△NLS可以在细胞中成功表达目的基因p27WT及缺失核定位信号的p27△NLS。
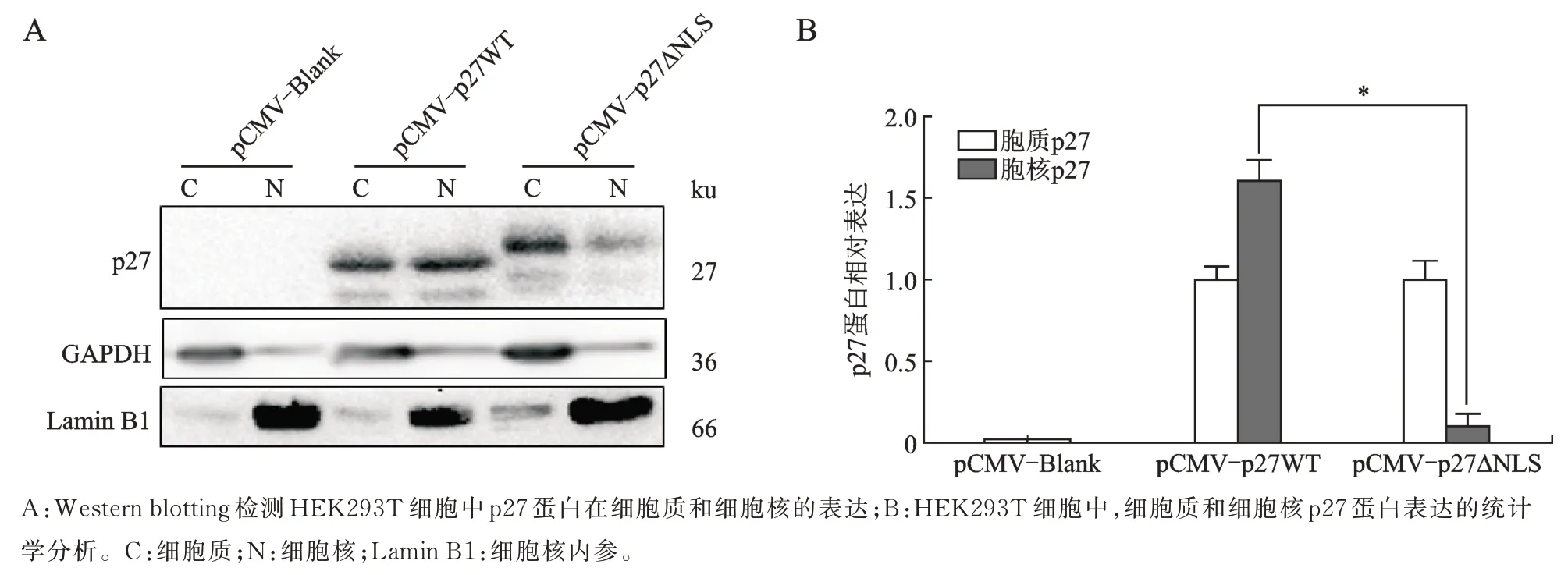
图4 HEK293T 细胞转染重组质粒后细胞质和细胞核p27 蛋白的表达情况Fig.4 Detection of cytoplasmic and nuclear p27 protein expression after transfection with recombinant plasmids in HEK293T cells
3 讨 论
在哺乳动物中,p27 作为细胞周期负调节因子,参与增殖、分化、凋亡等决定细胞命运和组织生长的生物学过程。大量研究证实,许多肿瘤标志物基因可通过p27 蛋白调控肿瘤的发生发展[1,5-6]。在乳腺癌、大肠癌、卵巢癌和前列腺癌等肿瘤中,p27 蛋白表达较低,并且与患者较差的预后相关[2]。在肿瘤进程中,p27 主要通过磷酸化调控自身表达和胞质定位。细胞核p27 蛋白表达降低可显著促进细胞周期进程和细胞增殖[4,7-8]。临床研究提示,p27 蛋白的细胞核表达是鼻咽癌患者有较好预后的有利因素[9]。核p27表达在肾细胞癌中经常丢失,可作为不良预后的指示因子,有助于高危肾透明细胞癌患者的诊断[10]。因此,p27 蛋白的抑癌活性,很大部分依赖于细胞核的亚定位水平。
在很多类型的肿瘤中,不仅有细胞核p27 蛋白表达的降低或者丢失,同时也伴随着细胞质的移位。核输出蛋白染色体区域维持蛋白CRM1 的下调通过改变p27 蛋白的亚细胞定位,促进p27 蛋白入核,减少细胞质p27 蛋白表达,并且抑制p27 蛋白降解,减缓内皮性卵巢癌发病进程[11]。临床治疗方面,p27 蛋白的细胞核/细胞质比率对早期乳腺癌患者辅助综合化疗的效果具有重要的参考意义[12],细胞质低p27 表达和细胞核高p27 表达共同预示着高级别的星形胶质瘤患者中较好的预后情况[13]。可见,细胞核和细胞质的p27 蛋白通过协同作用,共同影响着肿瘤的发展和预后。
然而,在部分肿瘤中,细胞核p27 在细胞中发挥抑癌作用,而细胞质p27 在细胞中发挥促癌作用,p27的细胞质定位能够使该蛋白的抑癌功能失活。细胞质p27 蛋白的减少显著抑制肿瘤细胞运动、细胞存活和致癌进程[14-15]。细胞质p27 蛋白与肿瘤患者较差的预后紧密相关[16-18]。而且,细胞质p27 的表达能通过抑制细胞凋亡增强HER2 阳性乳腺癌细胞的拉帕替尼抗性[19]。总之,与p27 蛋白本身的抑癌作用相反,细胞质p27 蛋白可能在细胞的存活、运动、侵袭和细胞间黏附等方面发挥着促癌作用。
综上所述,本研究构建了重组质粒pCMV-p27WT 和 pCMV-p27 △ NLS,并 在 HEK293T 细 胞中成功表达。未来可通过改变工具细胞、正常细胞或是肿瘤细胞中p27 蛋白在细胞质和细胞核的表达分布,探讨不同病理条件下p27 蛋白功能,为肿瘤恶性机制的深入研究提供了重要的实验基础。
