基于 TCGA 与 GTEx 数据库分析 AEBP1 基因在不同分型胶质瘤中的表达及对预后的影响
2022-07-11王茂德姜海涛李传坤
王 伟,王茂德,姜海涛,李传坤,答 嵘
(1. 西安交通大学第一附属医院神经外科,陕西西安 710061;2. 西安交通大学第一附属医院检验科,陕西西安 710061)
胶质瘤是人类中枢神经系统最常见的原发恶性肿瘤,缺乏明确的早期标志物而预后不良[1]。胶质母细胞瘤(glioblastoma, GBM)是侵袭性最强的颅内恶性肿瘤,即使经过积极的手术切除、局部放疗和全身化疗的综合治疗,其生存期仍在10~12 个月[2]。脂肪细胞增强子结合蛋白1(adipocyte enhancer binding protein 1,AEBP1)编码羧酸肽酶A 蛋白家族的一个成员,最初被认为是负调控脂肪生成的转录抑制因子[3]。
由于AEBP1 和NF-κB 通路之间存在调控关系,而NF-κB 的组成性激活广泛参与致癌作用,提示AEBP1 过表达与肿瘤的发生和进展有关[4]。茹晓宇等研究发现,AEBP1 mRNA 高表达是GBM 患者预后的独立因素,AEBP1 是GBM 患者治疗的潜在靶点[5]。AEBP1 表达在原发性GBM 中上调,而并非进展期的继发性GBM[6]。通过对公共数据库进行分析并通过定量PCR 与免疫印迹方法对胶质瘤肿瘤组织中AEBP1 的表达进行检测,发现AEBP1 在低级别胶质瘤(low-grade glioma, LGG)与GBM 中的表达均上调,AEBP1 敲低会抑制胶质瘤细胞增殖、侵袭及NF-κB 信号通路,并引起细胞早期凋亡[7]。AEBP1下调导致胶质瘤细胞死亡与PTEN 状态有关[2]。与正常星形细胞相比,患者胶质瘤原代分离的肿瘤干细胞对ACT001 具有良好反应,其机制是阻断TGF-β激活的AEBP1/AKT 信号通路[8]。也有研究发现AEBP1 主要通过mTOR 通路促进胶质瘤的产生[9]。一个RNA 转录本通过选择性剪切能够产生不同的mRNA 剪接异构体,产生功能和结构不同或者拮抗的蛋白[10]。选择性剪接会导致蛋白质功能结构域的全面丧失,尤其是功能被癌症基因突变牵连的那些结构域,从而使健康细胞癌变[11]。目前关于AEBP1 在胶质瘤中的研究非常有限,而且不同分型的胶质瘤中AEBP1表达以及剪接异构体的分布未见报道。GEPIA(Gene Expression Profiling Interactive Analysis ,http://gepia.cancer-pku.cn)[12]即基因表达谱数据动态分析,是北京大学开发的采用标准化管线进行RNA序列分析的可视化网站,其数据包括TCGA 与GTEx 数据库中9 736 个肿瘤样本与8 587 个正常组织的信息。本研究拟通过GEPIA 获取肿瘤组织与正常组织的RNA 数据信息,分析AEBP1 在不同分型的胶质瘤组织和相应正常组织中的表达情况以及对预后的影响。
1 材料与方法
1.1 AEBP1 在胶质瘤与正常组织中的表达分析
本研究基于TCGA 数据库与GTEx 数据库,使用GEPIA2 可视化网络分析工具[13](http://gepia2.cancer-pku.cn/)进行分析。在表达分析(Expression Analysis)中,选择 GBM 与 LGG 数据,输入AEBP1 基因名称,P-value Cutoff 值为 0.05,使用 Log Scale[log2(TPM+1)],Jitter Size 为 0.4,与 TCGA normal 和GTEx 数据作为正常对照进行比较。肿瘤组织显示为红色,正常组织显示为灰色,绘制箱线图。对TCGA 数据库中GBM 的4 种分型,包括经典型、间充质型、神经元型、原神经元型,与LGG 的3 种分型,包括星型细胞瘤、少突星型细胞瘤、少突胶质细胞瘤,与TCGA 和GTEx 数据库中人体正常组织样本采用单因素方差分析(one-way ANOVA)法比较AEBP1 基因表达水平。
1.2 AEBP1 剪接异构体在GBM 与LGG 中的表达分析
利用Isoform Usage 模块,输入AEBP1 基因名称,坐标轴默认X 轴为肿瘤类型,Y 轴为剪接异构体,选择GBM 与LGG 数据,进行小提琴图的绘制,分析AEBP1 基因同源蛋白异构体的表达分布情况。
1.3 AEBP1 对胶质瘤预后的影响
利用生存分析模块,输入AEBP1 基因名称,方法分别选择总生存期(overall survival, OS)或无进展生存期(disease-free survival, DFS),Group Cutoff 选择中位数,将不同分型胶质瘤组内分为AEBP1 低表达组与高表达组。选择GBM 与LGG 数据,低表达组显示为蓝色,高表达组显示为红色,坐标轴单位选择月,绘制Kaplan-Meier 生存曲线与Logrank 检验。对TCGA 数据库中GBM 的4 种分型,包括经典型、间充质型、神经元型,原神经元型,与LGG 的3 种分型,包括星型细胞瘤、少突星型细胞瘤、少突胶质细胞瘤分别绘制Kaplan-Meier 生存曲线,并采用Logrank检验分析AEBP1 基因低表达组与高表达组的预后。
1.4 统计学分析
AEBP1 在胶质瘤与正常组织以及不同分子型别胶质瘤中的差异表达分析使用单因素方差分析(One-way ANOVA)。AEBP1 对胶质瘤预后影响的分析中生存期差异比较采用Logrank 检验。P<0.05认为差异有统计学意义。
2 结 果
2.1 AEBP1 在 GBM 与 LGG 中表达均高于正常对照,但胶质瘤分型影响AEBP1 表达
AEBP1 基因在GBM 与LGG 肿瘤组织中表达均高于正常对照组织,箱线图显示GBM 肿瘤组织中AEBP1 的表达与正常对照组织中差异具有统计学意义(P<0.05),但是 LGG 肿瘤组织中AEBP1 的表达与正常对照组织中差异无统计学意义(图1A)。对GBM 不同分型的研究结果显示,在经典型(classical)、间充质型(mesenchymal)、神经元型(neural)与原神经元型(proneural)4 种型别肿瘤组织中AEBP1 的表达与正常对照组织中差异均具有统计学意义(P<0.05,图1B)。对LGG 不同亚型的研究结果表明在星型细胞瘤(astrocytoma)与少突星型细胞瘤(oligoastrocytoma)中肿瘤组织中AEBP1 的表达与正常对照组织中差异均具有统计学意义(P<0.05),但是少突胶质细胞瘤(oligodendroglioma)肿瘤组织中AEBP1 的表达与正常对照组织中差异无统计学意义(图1C)。
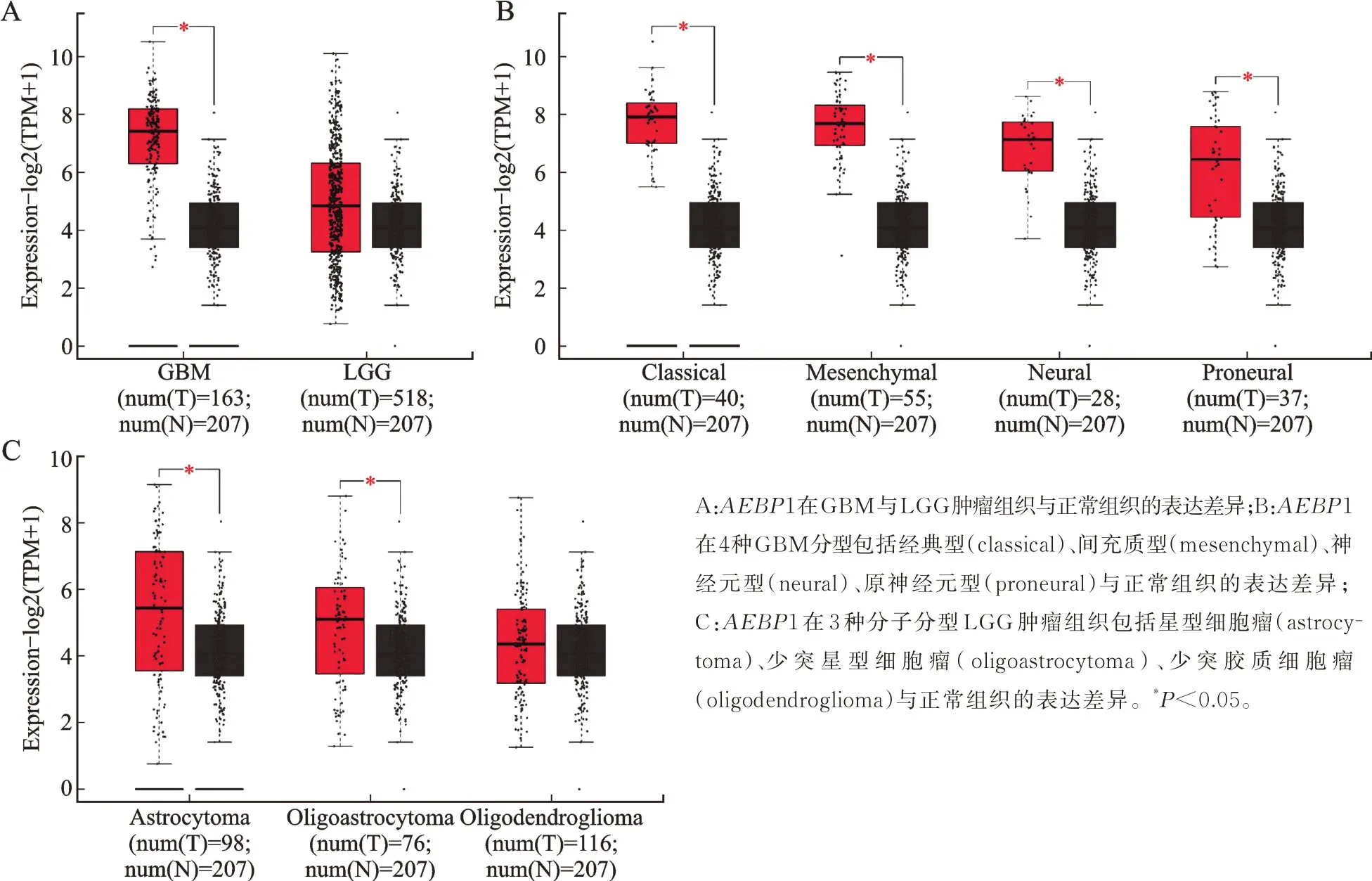
图1 AEBP1 在GBM 与LGG 肿瘤组织与正常组织之间的表达差异Fig.1 Difference of AEBP1 expression in GBM and LGG tumor tissues and normal tissues
2.2 AEBP1 剪接异构体在 GBM 与 LGG 肿瘤组织中的表达差异
在 GBM 与 LGG 肿 瘤 组 织 中 ,AEBP1 具 有 9 种剪接异构体。小提琴图显示GBM 肿瘤组织中9 种AEBP1 剪接异构体表达都高于LGG 肿瘤组织。AEBP1-001、AEBP1-002、AEBP1-003 与AEBP1-008 的分布趋势在GBM 与LGG 肿瘤组织中相反(图2)。
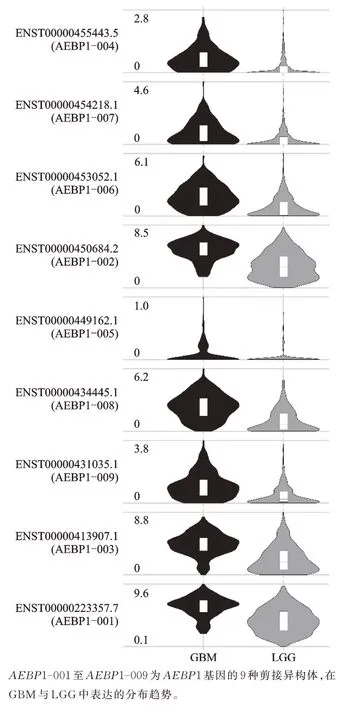
图2 AEBP1 剪接异构体在GBM 与LGG 肿瘤组织中的表达差异Fig. 2 Difference of AEBP1 isoform expression in GBM and LGG tumor tissues
2.3 AEBP1 对胶质瘤预后的影响
GBM 患者中AEBP1 低表达组的OS 优于高表达组(P<0.05,图3A)。但是 4 种 GBM 分型中,仅有原神经元型GBM 患者AEBP1 低表达组的OS 优于高表达组(P<0.05,图3B)。经典型(附图S1)、间充质型(附图S2)与神经元型(附图S3)的GBM 患者AEBP1 低表达组的OS 均与高表达组无差异。GBM患者中AEBP1 低表达组的DFS 与高表达组无差异(附图S4),在经典型(附图S5)、间充质型(附图S6)、神经元型(附图S7)与原神经元型(附图S8)4 种GBM 分型患者中AEBP1 低表达组的DFS 与高表达组亦无显著差异。LGG 患者中AEBP1 低表达组的OS 优于高表达组(P<0.05,图 3C)。但是 3 种分型LGG 中,仅有星型胶质细胞瘤患者中AEBP1 低表达组的OS 优于高表达组(P<0.05,图3D)。但是少突星型细胞瘤(附图S9)与少突胶质细胞瘤(附图S10)AEBP1低表达组的OS均与高表达组无差异。LGG患者中AEBP1低表达组的DFS优于高表达组(P<0.05,图3E)。但是仅有星型胶质细胞瘤患者中AEBP1 低表达组的DFS 优于高表达组(P<0.05,图3F),而少突星型细胞瘤(附图S11)与少突胶质细胞瘤(附图S12)的患者中AEBP1 低表达组的DFS 与高表达组亦无显著差异。
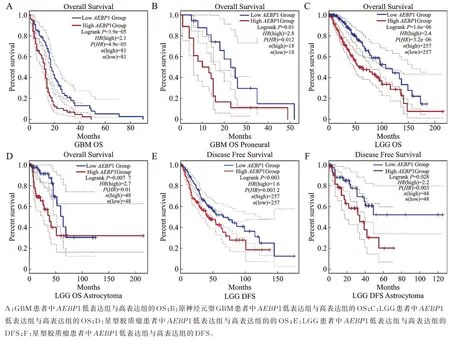
图3 AEBP1 对胶质瘤预后的影响Fig.3 The effect of AEBP1 on the prognosis of glioma patients
3 讨 论
脑胶质瘤是由于胶质细胞癌变所导致的最常见的原发性颅脑恶性肿瘤,GBM 是最常见的侵袭性脑内恶性肿瘤,尽管目前有多种治疗方法,但总体预后不佳,生存期仅仅10~12 个月[2]。二代测序技术在胶质瘤分子诊断中的应用,发现GBM 存在明显异常的代谢重组[14],以及显著的细胞和分子异质性[15],这些可能导致各种新型治疗以失败告终。
AEBP1 是一种转录抑制因子,参与调节多种重要的生物过程,包括脂肪形成、乳腺发育、炎症、巨噬细胞胆固醇稳态和动脉粥样硬化的发生。近年来,由于NF-κB 信号在炎症和癌症等关键细胞过程中的作用,AEBP1 与NF-κB 通路之间的调控关系引起了许多研究者的关注。由于NF-κB 的组成性激活广泛涉及多种组织癌变,提示AEBP1 的过表达与肿瘤的发生和进展密切相关。AEBP1 在多种恶性肿瘤(如乳腺癌、GBM、膀胱癌、胃癌、结直肠癌、卵巢癌和皮肤癌)中过表达,并能够通过其他关键通路[如PI3KAkt、sonic hedgehog (Shh)、p53、PARP-1 和 PTEN]调控细胞增殖和凋亡。AEBP1 可能成为评估癌症预后的潜在生物标志物,并可能会成为预防和/或治疗多种类型癌症的新治疗靶点[4]。AEBP1 通过调节PI3KCB的表达作为GBM 中潜在的致癌蛋白,在多种癌症中越来越被认为是一个重要的分子[2]。但是AEBP1 在胶质瘤的发生发展中的作用及其表达水平对患者预后的影响研究较少,而且AEBP1 在不同分型胶质瘤中的不同表现以及剪接异构体的表达均未见报道。
本研究为系统掌握AEBP1 基因在人脑胶质瘤中的表达情况,利用GEPIA 分析工具挖掘TCGA 数据库与GTEx 数据库中AEBP1 基因在GBM 与LGG中的表达情况。研究者通过微阵列分析确定GBM的特异性诊断和预后标志物,发现AEBP1 在原发性GBM 中表达上调超过4倍[6]。本研究发现AEBP1基因在GBM 肿瘤组织中表达高于正常对照组织,而且GBM 的4 种分型包括经典型、间充质型、神经元型与原神经元型的肿瘤组织中AEBP1 的表达亦均高于正常对照组织。虽然LGG 肿瘤组织中并未发现AEBP1 的表达与正常对照组织间存在统计学差异,但是除了少突胶质细胞瘤,其他两种LGG 包括星型细胞瘤与少突星型细胞瘤肿瘤组织中AEBP1 的表达均高于正常对照组织。AEBP1 具有9 种剪接异构体在GBM 与LGG 中均有表达,但是分布趋势有所差异,其中AEBP1-001、AEBP1-002、AEBP1-003 与AEBP1-008 的分布趋势在GBM 与LGG 肿瘤组织中相反。AEBP1 在人类胶质瘤中高度表达,抑制AEBP1 能够抑制胶质瘤细胞增殖与侵袭,并诱导细胞凋亡,同时下调 NF-κB 的表达[7,16];而上调AEBP1表达能够通过激活NF-κB 通路促进GBM 细胞的增殖,增强迁移与侵袭能力,促进肿瘤生长[17]。提示AEBP1 基因在胶质瘤的发生中具有重要意义。在其他肿瘤中AEBP1 同样发挥重要作用,AEBP1 能够通过激活胃癌NF-κB 通路促进上皮间质转化,敲除AEBP1 能够显著抑制胃癌细胞的增殖、迁移、侵袭、转移[18]。在结肠腺癌的研究中发现AEBP1 是上皮间质转化的重要调控基因[19]。儿童急性淋巴细胞白血病的研究发现,下调异常高表达的AEBP1 能够通过p53 依赖性信号通路抑制肿瘤生长[20]。此外,AEBP1在靶向治疗获得性耐药中发挥重要作用,在RAF 抑制剂PLX4032 获得性耐药的BRAFV600E突变黑色素瘤中AEBP1 表达显著升高[21]。
生存分析结果显示,GBM 患者中AEBP1 低表达组的OS 优于高表达组,但在4 种分型中仅有原神经元型GBM 患者中AEBP1 低表达组的OS 优于高表达组。LGG 患者中AEBP1 低表达组的OS 与DFS 均优于高表达组,但是3 种分型中仅有星型胶质细胞瘤患者中AEBP1 低表达组的OS 与DFS 均优于高表达组。本研究结果提示,AEBP1 表达水平对GBM 尤其是原神经元型GBM 的OS 影响较大,但是对LGG 尤其是星型胶质细胞瘤的OS 与DFS 均影响较大。在胃癌的研究中同样发现,AEBP1 高表达的早期与晚期胃癌患者的OS 均较非高表达患者短,患者的预后差[18]。同样,AEBP1 高表达的结肠腺癌患者的 OS 短于AEBP1 低表达患者[19]。
本研究结果显示,AEBP1 基因在4 种分型的GBM 及2 种分型的LGG(星型细胞瘤与少突星型细胞瘤)较正常组织中高表达。同时发现AEBP1 影响胶质瘤的预后,AEBP1 对LGG 特别是星型胶质细胞瘤预后影响最大,不仅影响OS,同时影响DFS;而在GBM 中,AEBP1 仅影响原神经元型 GBM 的 OS。本研究结果提示AEBP1 在GBM 与LGG 的发病与发展中具有重要临床价值,可作为评估原神经元型GBM 与星型胶质细胞瘤患者预后的标志物,并可能成为靶向治疗的候选基因。
