胃癌组织中组织蛋白酶D的表达及与侵袭基因和预后的关系
2022-07-10彭昌能郴州市第四人民医院湖南郴州423000
彭昌能 (郴州市第四人民医院,湖南 郴州 423000)
胃癌是起源于胃黏膜上皮的恶性组织增生肿瘤,具有明显的组织浸润和侵袭特性,表现为细胞黏附能力下降、穿破基底膜进入血液循环、逃避免疫监视及在远隔部位生长等[1-2]。目前已发现的胃癌侵袭转移基因中基质金属蛋白酶(MMP)属于重要的一类,可高效促进肿瘤的侵袭转移能力[3-4]。而胃癌组织在浸润迁移过程中,转移蛋白酶水平会出现相应变化,其中包括组织蛋白酶。组织蛋白酶是半胱氨酸蛋白酶家族的主要成员,人体中包含11 种,与肿瘤疾病、骨质疏松、关节炎等多种重大疾病的进展和恶化密切相关。组织蛋白酶D(CTSD)属于蛋白水解酶,其水解基质特性可加速破坏基底膜、促进基质溶解,在肿瘤组织的浸润、转移过程中发挥重要作用[5]。但CTSD在胃癌组织中的表达意义,以及其胃癌患者预后之间是否存在联系仍属于目前的研究薄弱方向。基于此,本研究纳入92胃癌患者进行分析,探讨CTSD与胃癌组织侵袭转移和预后的关系,旨在为控制胃癌组织浸润转移、提高胃癌预后质量提供新思路。
1 资料与方法
1.1研究对象:选取我院2018年2月~2021年2月收治的92例胃癌患者肿瘤组织标本作为观察组,以上述标本内的非肿瘤胃黏膜组织作为对照组。其中男52例,女40例;年龄50~72岁,平均年龄(61.65±6.25)岁;组织标本包括41例胃窦腺癌,27例胃体,24例胃角。所有患者胃癌组织均来自原发病灶,患者未合并有其他肿瘤疾病,且均未接受放化疗。本次研究经过本院医学伦理委员会同意。
1.2方法:本研究试剂及仪器包括olympus显微镜,CTSD试剂盒(北京中山生物技术有限公司),S-P试剂盒(美国Maxim公司)。所取胃癌组织标本均经甲醛溶液固定、脱水,采用S-P 法处理取片:5 μm连续切片,脱石蜡,采用酒精水化一次阻断组织氧化,经微波抗原修复后以羊血清封存。研究时,先取出加入一抗(CTSD单克隆抗体),置入-4 ℃冰箱留置一夜;取出后再滴入二抗和三抗,DAB显色处理,再采用酒精梯度脱水、取片[6-7]。本研究在染色流程中设置对照组,以PBS液替代一抗作为阴性对照。
1.3CTSD结果判定:实验所得结果由同一位专业医师评估,以显微镜观察每张切片3~5个热点区视野内的阳性细胞比例、着色强度。阳性细胞比例>75%计为4分,51%~75%计为3分,26%~50%计为2分,1%~25%计为1分,阴性计为0分。着色强度根据视野内棕色颗粒强度判断,棕褐色计为3分,棕黄色计为2分,淡黄色计为1分,无明显显色计为0分。阳性细胞比例分数与显色强度分数相乘,总分12 分,>6分为阳性,反之则为阴性[8]。
1.4统计学方法:本实验数据采用SPSS22.0软件分析,计数数据组间行χ2检验;计量数据组间比较采用t检验;采用Kaplan-Meier分析胃癌患者生存率,组间比较行log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1两组标本组织中的CTSD、侵袭基因表达情况比较:观察组中CTSD、MMP-3阳性表达率显著高于对照组,二者组间比较差异有统计学意义(P<0.05)。 见表1。

表1 两组标本组织中的CTSD及MMP-3表达情况比较[n(%),n=92]
2.2CTSD与MMP-3的关系:在MMP-3阳性表达中,CTSD阳性表达率为85.11%(40/47),在MMP-3阴性表达中,CTSD阳性表达率为62.22%(28/45),二者比较差异有统计学意义(P<0.05)。见表2。
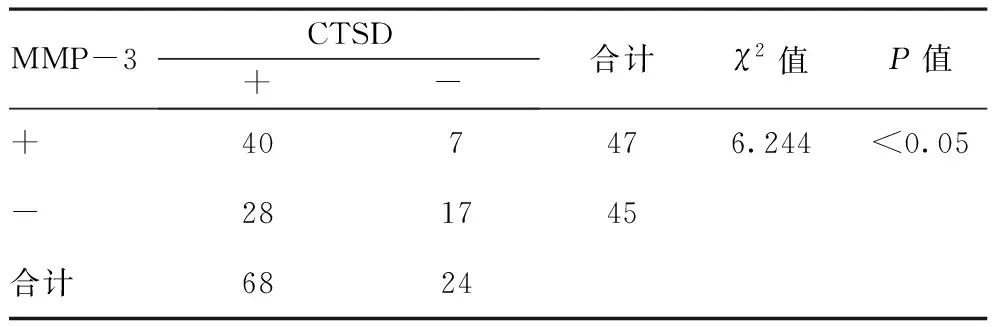
表2 CTSD与MMP-3的关系(n=92)
2.3CTSD与胃癌浸润转移的关系:观察组中不同胃癌组织学类型、病理分化程度中的CTSD阳性和阴性表达差异无统计学意义(P>0.05);在不同浸润程度、有无淋巴结转移中CTSD阳性和阴性表达率差异有统计学意义(P<0.05)。见表3。
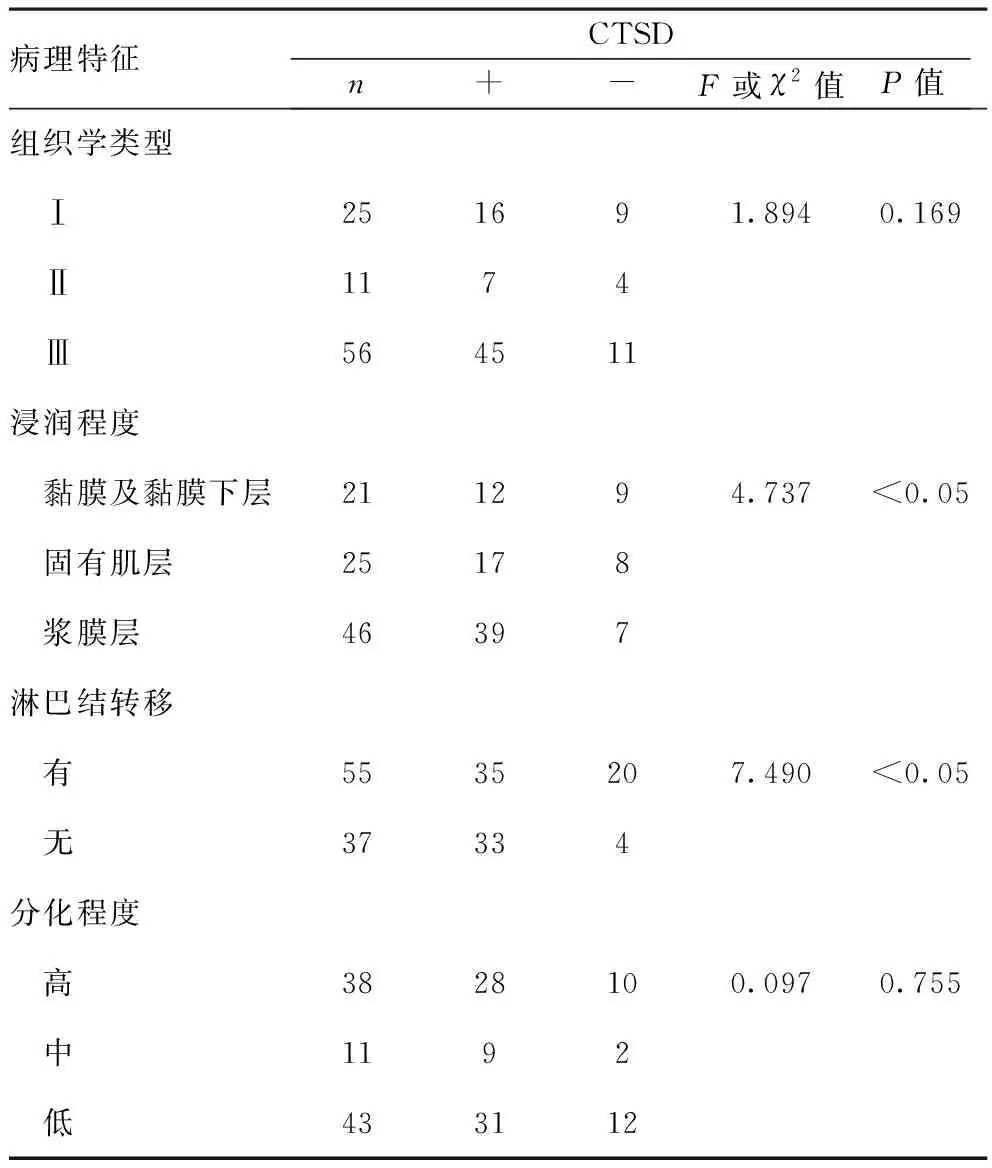
表3 各病理因素间的CTSD表达情况(n,n=92)
2.4CTSD表达与预后的关系:本研究随访10~40个月,平均随访(24.55±10.02)个月。术后胃癌CTSD阳性表达生存24例(35.29%),阴性表达生存15例(62.50%)。经Kaplan-Meier分析,CTSD阳性表达者平均无进展时间为(27.86±1.40)个月,CTSD阴性表达者平均无进展时间为(35.17±3.11)个月,二者比较差异有统计学意义(t=20.558,P<0.05)。见图1。
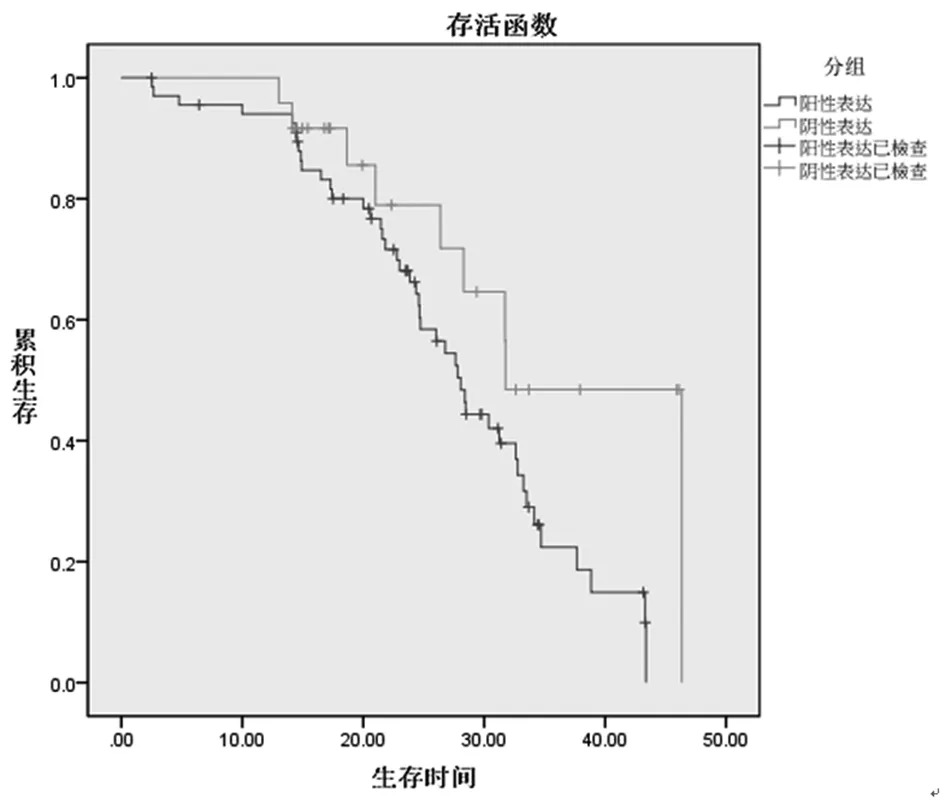
图1 CTSD表达与预后的关系
3 讨论
胃癌不断恶化发展的主要机制在于胃黏膜上皮的恶性组织浸润侵袭及转移,其中包含多个复杂的恶性肿瘤生物学特征,向鞍区周围组织浸润生长,破坏正常结构[9-10]。原发病灶内的癌细胞不断发展导致细胞粘附能力下降,癌细胞脱离病灶游离侵袭病灶周围组织,穿破基底膜在血液循环系统内扩散,避开免疫系统监视机制形成新生血管,在远隔部位形成新的病灶继续生长[11]。因此,胃癌恶性肿瘤疾病恶化迅速,需探究相关指标在胃癌早期于组织侵袭转移、预后的关系,以此控制胃癌组织浸润转移,提高胃癌预后质量。
组织蛋白酶存在于动物组织细胞内,主要存在于溶酶体部分,可以根据所作用的代表性底物发挥肽链内切酶功能,降解不同胶原细胞外基质[12]。CTSD具有独特的合成和转运方式,表面由粗面内质网合成,通过多种蛋白质水解途径最终抵达细胞内的小泡结构(溶酶体、核内体、吞噬体),从而发挥蛋白质水解、细胞增殖、细胞凋亡等生理和病理功能[13-14]。本研究结果表明,胃癌组织恶化发展过程中合并大量CTSD,高效促进癌细胞的侵袭转移进程。
刘爱东等[15]在相关研究中发现,胃癌组织中侵袭基因MMP-11和CTSD阳性表达呈显著正相关,二者存在联动作用,共同促进癌细胞的侵袭转移。MMPs蛋白家族需要Ca2+、Zn2+等辅助激活,主要由疏水信号肽序列、保持酶原稳定性的前肽区、金属离子结合点的催化活性区、富含脯氨酸的铰链区以及酶底物特异性的羧基末端区5个功能区组成[16-17]。不同MMPs成员在不同功能区各有特点,但酶催化活性区和前肽区均具有高度保守性,可降解多种细胞外基质成份(ECM)中的各种蛋白成分,由此影响肿瘤细胞侵袭组织学屏障。MMPs家族已分离鉴别出26个成员,其中MMP-3又称为基质溶解酶1(stromelysin 1),在恶性肿瘤细胞表达浓度远远高于其他MMP成员[18]。本研究结果与上述结论一致。究其原因,胃癌组织细胞侵袭转移过程中CTSD大量合成,发挥肽链内切酶功能活化胶原酶,激活侵袭基因MMPs,经MMP激活后降解细胞外基质,打开恶性肿瘤细胞转移通路,进一步加快肿瘤的浸润和侵袭[19-20]。
此外,MMP-3主要作用于非变性胶原蛋白(PG)、层粘连蛋白(LN)、纤连蛋白(FN)、Ⅲ型和Ⅳ型胶原及明胶,且能够激活阳性率较低的MMP-1和其他家族成员,而MMP-1在各种刺激下可呈高表达状态,与恶性肿瘤与预后质量存在密切联系[21],这说明CTSD阳性可能也与胃癌患者预后质量有关。本研究结果说明CTSD阳性表达不仅会影响侵袭基因的表达状态,还会加快胃癌肿瘤疾病的恶化进程,缩短患者生存时间[22]。
综上所述,胃癌组织中CTSD呈高度表达状态,且与胃癌侵袭基因存在密切联系,可用以初步判断患者的预后质量。
