盐胁迫对小麦苗期荧光特性的影响及综合评价
2022-07-09徐学欣朱紫鑫张玉璐高国龙盖红梅赵长星
孙 芹,徐学欣,邓 肖,朱紫鑫,张玉璐,高国龙,盖红梅,赵长星
(1青岛农业大学农学院/山东省旱作农业技术重点实验室,山东青岛 266109;2青岛市农业科学研究院作物研究所,山东青岛 266100)
0 引言
土壤盐渍化是影响全球农田的最严重环境压力之一,给世界各地作物生产带来了重大挑战[1]。除自然过程造成的原生盐碱化外,近年来,由于长期大量施肥、盐水灌溉和不当灌溉方法等人为活动,农田次生盐碱化面积迅速增加[2-3]。小麦是国内盐碱地主要栽培作物之一,年产量约为1.3 亿t。选择和培育能够在盐碱条件下生长并产生经济产量的小麦品种是解决人口、粮食、资源和环境等问题的重要措施[4-5]。
盐胁迫是影响细胞和植物个体水平生理生化和生长发育过程的非生物因素之一[6]。在盐胁迫下,植物的酶和非酶抗氧化系统、光合作用系统以及生长发育受到抑制,但脂质过氧化产物增加[7-8]。在生理属性中植物的光合作用是相当重要的,盐胁迫通过影响植物对土壤中离子的吸收和运转,导致光合作用相关指标发生变化[9]。前人研究表明,植物在盐胁迫下,光合速率、蒸腾速率、气孔导度均显著下降[10]。在大多数作物中,植物的光合特性与植物生长和最终产量呈正相关[11]。盐胁迫在对气孔特征产生不利影响的同时,也对光系统II(PSII)造成严重的损害。PSII 的反应中心是吸收、传递并转化光能的关键场所,PSII的功能可以通过测量叶绿素荧光的不同属性来评估[12]。叶绿素荧光参数能够反映光合系统“内在性”特点,是光合作用的有效探针[13-15]。盐胁迫下的植物状态变化可以通过生物化学信息传达,但破坏性生物化学分析不允许实时监测,而叶绿素荧光分析能有效地评估生理变化,是快速、实时地筛选麦类作物耐盐性的方法[16]。
不同品种的耐盐机制不同,仅从单一指标来评价小麦耐盐性具有片面性。目前在筛选耐盐小麦材料时进行综合耐盐性评价的较少。笔者以4 份小麦为材料,分析盐胁迫下小麦幼苗生长发育、光合特性、荧光参数以及MDA和脯氨酸含量的变化特点,研究比较4份小麦苗期的耐盐性,并通过主成分分析及隶属函数法对小麦的生长及生理生化指标进行综合评价,发掘高抗性的小麦资源,以期为小麦耐盐育种和培育提供科学理论依据和基础材料。
1 材料与方法
1.1 试验材料
试验于2019年9月—2020年3月在青岛农业大学温室进行。试验采用4 个小麦品种包括‘冀麦32’(河北省中捷农场农科所)、‘泰农18’(鲁农审2008056号)、‘德抗961’(鲁农审2001036)、‘师栾02-1’(国审麦2007016)。
1.2 试验方法
1.2.1 试验设计 将籽粒饱满、大小一致的小麦种子用3%H2O2消毒15 min,再用蒸馏水反复冲洗3次。放置于铺有滤纸的发芽盒中,在光照培养箱中培养6天后,选取长势一致的幼苗,移植于带有圆孔的泡沫板上,放置于塑料方盒中用霍格兰氏(Hoagland)全营养液培养,培养条件为温室,相对湿度65%、光照周期13 h/11 h(白天/夜晚),昼夜温度为25℃/12℃,光合通量密度(PPFD)为20000 lx。待小麦生长至三叶一心进行盐胁迫处理,NaCl 胁迫浓度为0、100、200 mmol/L,每个处理6次重复,试验期间每3天换一次营养液,胁迫7天后进行指标测定。
1.2.2 生长指标 于幼苗盐胁迫处理后第7 天,每重复用直尺测量10株小麦株高。于幼苗盐胁迫处理后第7天,用滤纸吸干根部表面水分,用分析天平称取小麦根部及叶茎部分鲜重并记录,每个处理进行3 次重复。根系形态指标测定,采用台式扫描仪(Epson Experssion 10000XL)将幼苗根系图像分别扫描并存入电脑,利用Win-RHIZO 根系分析系统(Regent Instruments Inc,Canada)对图像进行分析,获得总根长、总根表面积、平均根系直径、总根体积。
1.2.3 光合特性 于幼苗盐胁迫处理后第7 天,采用便携式光合系统(Li-6800,USA)在上午9:00—11:00进行净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等光合特性的测定。选取小麦的最新展开叶进行测定,每个处理重复3次,每重复随机选取3片长势一致的叶片。
1.2.4 叶绿素荧光参数 使用调制荧光成像系统Mini-IMAGING-PAM(WALZ,德国)测定小麦幼苗的叶绿素荧光参数。叶片暗适应30 min 后,测定小麦叶片PSII最大光化学效率(Fv/Fm)、PSII实际光化学量子效率(ΦPSII)、光化学猝灭系数(qP)、非光化学猝灭系数(NPQ)。选取小麦的最新展开叶进行测定,每个处理重复3次,每重复随机选取3片长势一致的叶片。
1.2.5 MDA含量和脯氨酸含量MDA含量测定采用北京索莱宝科技有限公司的试剂盒,使用INFINITE 200 PRO(瑞士Tecan产)酶标仪。称取0.1 g小麦鲜样加入1 mL 提取液进行冰浴匀浆,8000 r/min 4℃离心10 min,取0.2 mL上清液于2 mL离心管中,加入试剂,放置100℃水浴中保温60 min,冷却后10000 r/min 常温离心10 min,取上清至1 mL 玻璃比色皿中,于450、532、600 nm下测定吸光度值。
脯氨酸含量测定采用北京索莱宝科技有限公司的试剂盒,使用INFINITE 200 PRO(瑞士Tecan 产)酶标仪。称取0.1 g小麦鲜样加入1 mL提取液进行冰浴匀浆,沸水浴震荡提取10 min 后,10000 r/min 常温离心10 min,取0.2 mL上清液于2 mL离心管中,加入试剂,放置沸水浴中保温30 min,每10 min震荡1次,冷却后加入1 mL甲苯,震荡30 s,静置片刻,取0.8~1 mL上清于1 mL玻璃比色皿中,于520 nm下测定吸光度值。
1.3 耐盐性综合评价
根据文献[17-18],计算综合指标的隶属函数值、权重值和耐盐综合评价D值,计算如式(1)~(4)。


式中,α为单项指标耐盐系数。U(Xij)为第i个材料第j个综合指标的隶属函数值,Xij表示第i个材料第j个综合指标值,Xjmin表示该综合指标最小值,Xjmax表示该综合指标最大值。wj表示第j个综合指标在所有综合指标中的重要程度,即权重。Pj表示第j个综合指标贡献率,综合指标和贡献率由主成分分析法获得。D为各材料在盐胁迫条件下用综合指标评价的耐盐度量值,D是纯数值,其范围为[0,1],使材料之间的耐盐性具有可比性,D值越大耐盐性越强[19]。
1.4 数据分析
数据整理利用Excel 2007进行,用SPSS 22.0软件对数据进行方差分析、相关性分析以及主成分分析,用Origin Pro9作图。
2 结果与分析
2.1 不同浓度NaCl处理对小麦幼苗生长特性的影响
如表1 所示,随NaCl 浓度增加,各品种小麦的叶鲜重、根鲜重、总根长、总根表面积和总根体积呈下降趋势;‘师栾02-1’、‘冀麦32’和‘泰农18’的根直径呈上升趋势。在100、200 mmol/L NaCl处理下,‘冀麦32’的叶鲜重显著高于‘师栾02-1’和‘泰农18’,‘泰农18’的总根长和总根表面积显著高于‘冀麦32’和‘德抗961’;‘冀麦32’的根平均直径显著高于‘泰农18’和‘师栾02-1’;‘泰农18’的总根体积显著高于‘冀麦32’。在100、200 mmol/L NaCl 处理下,‘冀麦32’的叶鲜重、根鲜重、总根长较对照下降最小,‘德抗961’的根表面积较对照下降最小。100 mmol/L NaCl 处理下‘冀麦32’的总根体积较对照下降最小。200 mmol/L NaCl 处理下‘德抗961’的总根体积较对照下降最小。

表1 不同浓度NaCl处理下小麦生长特性
2.2 不同浓度NaCl处理对小麦幼苗光合特性的影响
如图1所示,随NaCl浓度增加,各品种小麦的Pn、Tr、Gs呈下降趋势,Ci呈上升趋势。在100、200 mmol/L NaCl 处理下,‘冀麦32’的Pn显著高于‘师栾02-1’。100 mmol/L NaCl处理下,‘泰农18’的Gs显著高于‘冀麦32’和‘师栾02-1’。在100、200 mmol/L NaCl 处理下,‘师栾02-1’和‘泰农18’的Ci显著高于‘冀麦32’。200 mmol/L NaCl 处理下,‘冀麦32’的Pn、Tr、Gs较对照下降幅度最小,分别是35.5%、36%、32.3%;‘师栾02-1’的Pn、Tr、Gs较对照下降幅度最大,分别是48%、44.3%、45.7%;在100、200 mmol/L NaCl处理下,‘冀麦32’的Ci较对照上升幅度最小,‘师栾02-1’较对照上升幅度最大。
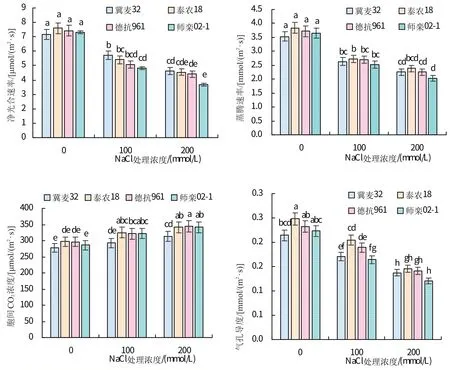
图1 不同浓度NaCl处理下小麦光合特性
2.3 不同浓度NaCl处理对小麦幼苗荧光参数的影响
如图2 所示,随着NaCl 浓度的增加,各品种小麦的Fv/Fm呈先下降后上升趋势,ΦPSII和qP呈下降趋势,而NPQ呈上升趋势。100 mmol/L NaCl 处理下,‘师栾02-1’的Fv/Fm显著低于其他3 个品种。100、200 mmol/L NaCl处理下,‘冀麦32’的ΦPSII显著高于‘师栾02-1’,‘冀麦32’的NPQ显著高于‘师栾02-1’,各品种小麦间的qP差异不显著。NaCl 处理下,与对照相比,‘冀麦32’的ΦPSII和qP下降幅度最小,‘师栾02-1’下降幅度最大,‘冀麦32’的NPQ上升幅度最大,‘师栾02-1’上升幅度最小。200 mmol/L NaCl处理下,叶片的ΦPSII和qP与对照相比,‘冀麦32’下降13.5%和10.2%,‘师栾02-1’下降25.9%和16.9%;叶片的NPQ与对照相比,‘冀麦32’上升34.7%,‘师栾02-1’下降20.2%。
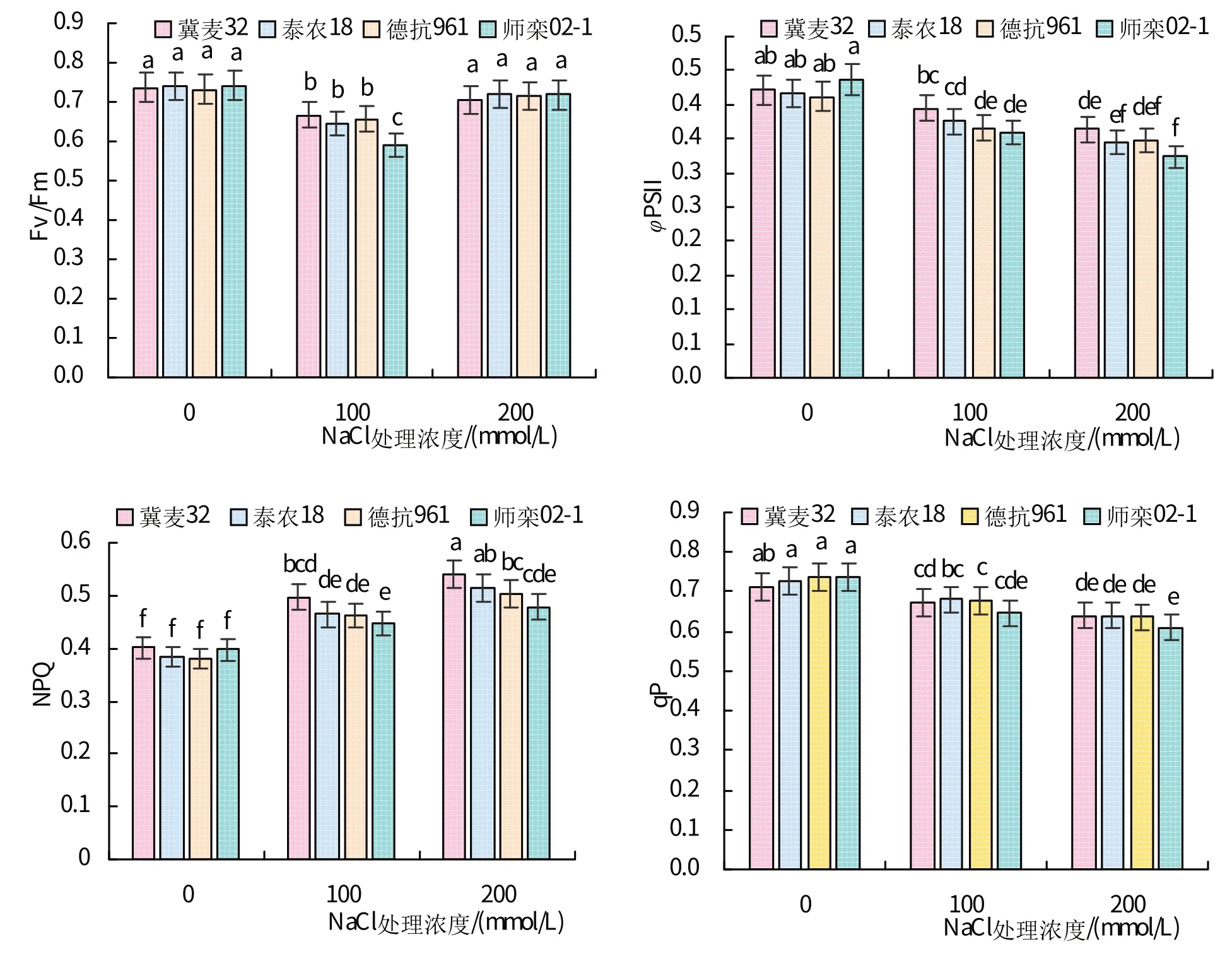
图2 不同浓度NaCl处理下小麦叶绿素荧光参数
2.4 不同浓度NaCl处理对小麦幼苗MDA和脯氨酸含量的影响
如图3 所示,随着NaCl 浓度的增加,各品种小麦的MDA 和脯氨酸含量呈上升趋势。在100、200 mmol/L NaCl 处理下,‘师栾02-1’的MDA 含量显著高于‘冀麦32’和‘泰农18’,‘冀麦32’的脯氨酸含量显著高于其余3个品种。200 mmol/L NaCl处理下,与对照相比,‘冀麦32’、‘泰农18’、‘德抗961’和‘师栾02-1’的MDA 含量分别上升136.8%、175.2%、155.7%和233.0%,脯氨酸含量分别上升了169.1%、144.0%、158.8%和104.2%。
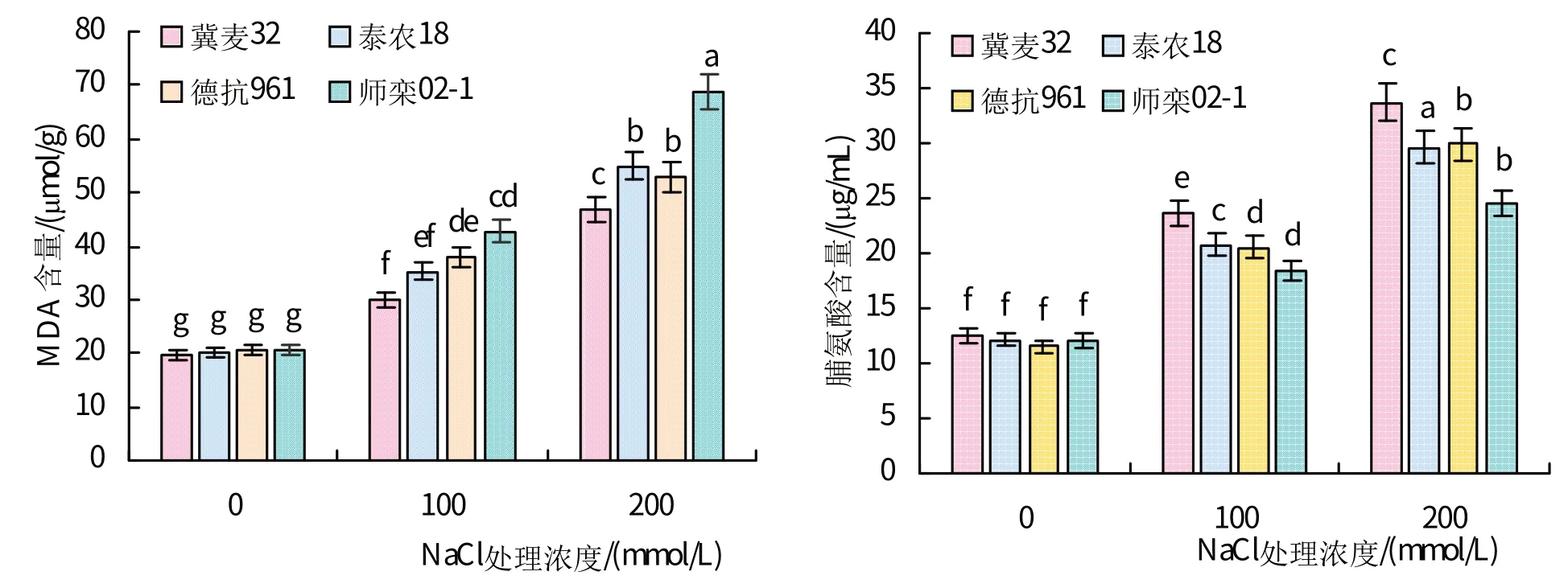
图3 不同浓度NaCl处理下小麦MDA和脯氨酸含量
2.5 小麦苗期各单项指标的抗盐系数及相关性分析
根据式(1)计算出各单项指标耐盐系数,由表2 可知,各品种叶鲜重、根鲜重、总根长、总根表面积、总根体积、Pn、Tr、Gs、Fv/Fm、ΦPSII和qP与对照相比有所下降,根平均直径、Ci、MDA、NPQ和脯氨酸含量有所上升。由于不同品种的各指标变化幅度不同,用单一的指标评价小麦的耐盐性结果都不相同。通过表3相关性分析可知,各指标之间存在一定的相关性,因此需要对小麦苗期相关指标进行主成分降维分析。
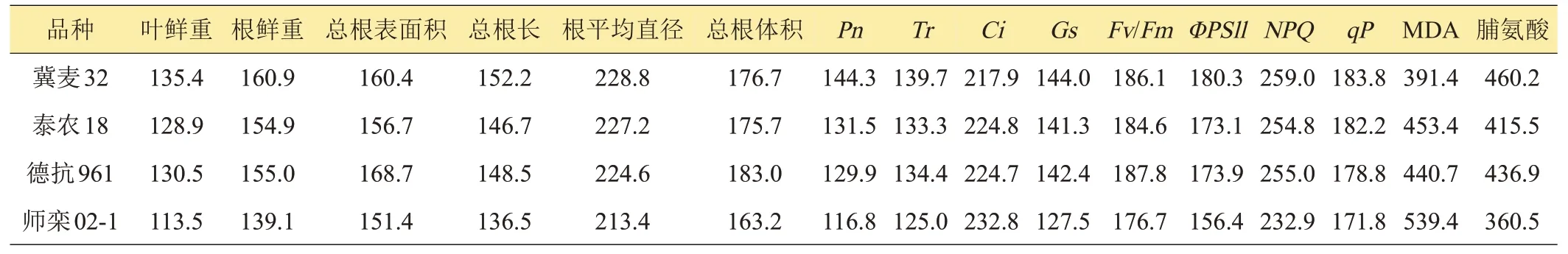
表2 小麦苗期各单项指标的抗盐系数α值 %

表3 盐胁迫下小麦相关性分析
2.6 小麦苗期的主成分分析
对盐胁迫下4份小麦材料的16个指标做主成分分析(表4)。以累计贡献率达85%且特征值大于1 为原则选择主成分,选择5 个独立的主成分作为小麦材料耐盐性鉴定的综合指标。单指标的得分系数绝对值越大,在主成分中的作用就越大[19]。起主要作用的是主成分1 中NPQ、MDA 和叶鲜重,主成分2 中叶鲜重和Pn,主成分3中Ci、Gs和脯氨酸,主成分4中根表面积、根长和总根体积,主成分5中根鲜重、ΦPSll和Tr。

表4 主成分得分系数及贡献率
2.7 4份小麦材料的综合评价
根据式(2)得到4份小麦盐浓度下3个主成分的隶属函数值。结合3个主成分的贡献率,根据式(3)计算出5 个主成分的权重,分别为0.493、0.178、0.144、0.097、0.088。利用式(4)计算出4份小麦材料在盐胁迫下的综合评价值(D)。根据D值对供试材料苗期耐盐性进行排序(表5),4份小麦材料在盐胁迫下耐盐性由强到弱为‘冀麦32’、‘德抗961’、‘泰农18’、‘师栾02-1’。

表5 小麦苗期的综合指标值、权重、隶属函数值、D值及综合评价
3 讨论
植物的生长发育状况是反映植物受到胁迫后最直观可靠的指标。盐胁迫抑制植物的生长,长期遭受盐害胁迫会导致植物死亡[20-21]。本试验中,100、200 mmol/L NaCl 胁迫均抑制了4 个小麦幼苗根茎的生长,显著降低了叶鲜重和根鲜重,且不同品种间下降幅度不同。在2 个盐浓度下,‘师栾02-1’根鲜重和叶鲜重比其余3 个品种降低最多,说明‘师栾02-1’对盐胁迫响应最差。Tian等[22-23]研究表明,盐分胁迫抑制了花生根系生长,降低了总根体积、总根长和根表面积,然而根平均直径几乎不受盐分胁迫的影响。本研究发现,随着盐浓度增加各品种的总根长、总根体积和总根表面积均下降,根平均直径却有所增加,原因是中高盐胁迫抑制了总根长和总根表面积生长,根系依靠根直径的增加吸收养分水分,这与黄玲等[24]研究的结果一致。
植物叶片的光合能力是决定作物产量的关键因素,高盐胁迫下光合作用受到破坏并导致其他生理代谢发生变化[25]。一般认为,盐胁迫下植物光合速率下降是由于气孔调节和非气孔调节引起的[26]。本研究中,随着盐浓度增加各品种的Tr和Gs均下降,而Ci上升,说明在中高盐浓度下小麦叶片Pn的下降主要是由非气孔因素引起的。‘师栾02-1’在200 mmol/L NaCl胁迫下Pn和Tr较低,Ci较高,这可能是其耐盐性弱的重要原因。‘冀麦32’能在盐胁迫下保持较高的Pn,且Pn、Tr和Gs下降幅度相对于其他品种较小,说明‘冀麦32’在盐胁迫下光合机构损伤较小,耐盐性较强。这与张浩等[27]的研究结果一致。
叶绿素荧光参数能够直接反映光合作用的实际及最大光合效率、反应中心开放程度和植物热耗散等情况[28-29]。Fv/Fm是快速叶绿素荧光的参数之一,植物中的Fv/Fm有效地响应NaCl、PEG、光和重金属胁迫[30]。本研究中4 个品种的Fv/Fm在100 mmol/L NaCl 胁迫下显著下降,表明中度盐胁迫致使PSII潜在活性中心受损,PSII 的光化学转化效率降低,植株受到光抑制[31]。在200 mmol/L NaCl胁迫下Fv/Fm降低不明显,原因是高盐破坏了光化学反应中的PSII 能力,与Abdeshahian[12]研究的结果一致。本研究中,随着盐浓度的增加各小麦品种的ΦPSII和qP降低,NPQ升高,表明盐胁迫导致小麦光化学中的PSII 吸收的光子程度降低,光子能量转换为化学能的能力下降,最终导致植物净光合速率下降[32],而过多的能量会通过增加NPQ途径(如叶黄素循环)消散,以缓解盐胁迫对光合作用的影响[11]。
MDA是膜脂过氧化的产物,其含量是反映细胞膜脂过氧化作用和质膜破坏程度的重要指标,MDA含量越高,质膜伤害程度越大[33]。前人研究表明,盐胁迫下脯氨酸通过减少有毒离子的吸收来缓解细胞的渗透胁迫,在盐胁迫条件下积累较高水平脯氨酸的小麦基因型被归类为耐盐小麦[34-35]。本研究中不同浓度盐胁迫下各小麦品种的MDA和脯氨酸含量均不同程度高于对照,‘冀麦32’和‘德抗961’的MDA 升高幅度较小,说明‘冀麦32’和‘德抗961’相对于其他2个品种膜损伤程度较轻,受到盐胁迫伤害小,‘冀麦32’的脯氨酸含量最高,说明相对于其他品种‘冀麦32’合成更多的脯氨酸以维持渗透势平衡,从而减轻钠离子毒性对小麦造成的伤害。
前人鉴定植物耐盐性时通常使用单一类别的指标进行鉴别,但是植物耐盐机制是复杂多样性的,单一指标无法准确评价植物的耐盐性[36-37]。因此,用多个类别指标来综合评价小麦耐盐性才更真实客观。本研究对盐胁迫下小麦苗期的生长指标、光合指标、荧光参数以及MDA 和脯氨酸含量通过主成分分析进行降维,结合主成分分析与隶属函数法计算4份小麦材料的综合评价D 值,4 份小麦材料盐胁迫下耐盐性由强到弱依次为‘冀麦32’、‘德抗961’、‘泰农18’、‘师栾02-1’,该耐盐强弱顺序与4份小麦材料生长指标的表现基本一致,该评价方法具有可行性。另外,本研究中选择了4个小麦品种进行鉴定,品种较少,今后应该选用更多的品种进行耐盐性鉴定,同时加入产量指标,筛选出供小麦耐盐育种的种质资源或直接用于小麦生产的高耐盐性品种。
4 结论
不同小麦材料对盐胁迫的生长和生理响应不同,盐胁迫下‘冀麦32’和‘德抗961’表现出更高的诱导PSII和调节NPQ的能力,以防止脂质过氧化和光合速率下降。因此,这些稳定的生理功能导致幼苗生长更好,具有更强的耐盐性。
