解淀粉芽胞杆菌JK10防治蓝莓根癌病的机理研究
2022-07-09张晋豪何依璐梁旭清崔兴国荣浪飞周星海魏方俊何祖雷姬广海魏兰芳
姚 博,张晋豪,何依璐,梁旭清,崔兴国,荣浪飞,周星海,魏方俊,何祖雷,姬广海*,魏兰芳∗
(1.云南农业大学省部共建云南生物资源保护与利用国家重点实验室,昆明 650201;2.云南农业大学农科基础实验教学中心,昆明 650201;3.曲靖佳沃现代农业有限公司,曲靖 655000)
蓝莓作为一种高经济价值,营养丰富且具有保健功能的小浆果,其发展前景广阔[1]。蓝莓根癌病(Blueberry crown gall disease)是由根癌土壤杆菌Agrobacteriumtumefaciens引起的一种蓝莓根部病害[2]。随着我国蓝莓产业的快速发展,目已成为蓝莓生产中的主要病害,极大地限制着蓝莓产业的发展[3]。由于蓝莓根癌病主要发生于根部,从侵染到地上部分表现出症状需要漫长过程,一旦发病树势会逐年变弱,造成减产和果品下降,直接带来严重经济损失。目前关于蓝莓根癌病的防治报道较少,主要集中在化学防治,常用药剂有噻霉酮[2]、硫酸铜[4]等,但是长期使用化学药剂会导致环境污染和影响蓝莓品质,因此寻找蓝莓根癌病安全有效的防治方法具有重要意义。
目前认为生物防治是控制根癌病最有效的方法之一[5]。世界范围内最早用于防治根癌病的菌株为放射形土壤杆菌AgrobacteriumradiobacterK84,其作用机理为抢占果树伤口定殖和产生农杆菌素,阻止病原菌侵入和生长[6]。放射形土壤杆菌A.radiobacterK84及其遗传改造菌株K1026,被研制成商品制剂Nogall[7],并成功用于核果类果树根癌病的防治,为最早的根癌病生物防治商品。解淀粉芽胞杆菌B.amyloliquefaciens32a、甲基营养型芽胞杆菌Bacillusmethylotrophicus39b都产生拮抗根癌土壤杆菌的脂肽类物质,活体条件下抑制根癌土壤杆菌引起的番茄冠瘿瘤[8,9]。贝莱斯芽胞杆菌BacillusvelezensisCLA178菌株产生的macrolactin类化合物对根癌土壤杆菌C58菌株有抑制活性[10]。近年来,国内陆续也有根癌病生物防治的报道:高之蕾等[11]分离的粪产碱菌Alcaligenesfaecalis51-A和51-B对根癌土壤杆菌引起的番茄冠瘿瘤有强烈抑制作用,但机理不明;张锡唐等[12]分离的瓦雷兹芽胞杆菌BacillusvelezensisJK-XZ8对樱花根癌病具有良好田间防效,其作用机理可能是JK-XZ8产生抑制病原菌的活性物质。李昱佳等[5]报道的泛菌Pantoea deleyi和肠杆菌Enterobactercowanii能够在番茄根细胞间隙定殖,且显著抑制根癌土壤杆菌引起的向日葵冠瘿瘤,作用机理尚不明确。葡萄土壤杆菌AgrobacteriumvitisE26通过产生对葡萄根癌病菌A.vitis有抑制作用的土壤杆菌素E26达到生防的目的[13]。综上所述,目前国内外关于根癌病生物防治机理主要为生防菌产生对病原菌有抑制作用的物质和抢占伤口或侵入位点,但是蓝莓根癌病生物防治的研究还未见报道。
本课题组从200余株蓝莓根内生细菌中筛选得到一株对蓝莓根癌病菌有较强拮抗作用,且对蓝莓根癌病有良好田间防效的解淀粉芽胞杆菌JK10。本研究通过分析菌株JK10产生的活性物质,定殖情况和施入菌株JK10后蓝莓根内生细菌群落的结构变化,揭示解淀粉芽胞杆菌JK10的生防机理,为蓝莓根癌病的生物防治提供理论基础和科学依据。
1 材料与方法
本研究于2020年5月至2021年9月在云南农业大学和曲靖佳沃现代农业有限公司蓝莓基地内完成。
1.1 试验材料
1.1.1 供试菌株 解淀粉芽胞杆菌JK10(16S rDNA GenBank登录号:OL825023),健康蓝莓根组织内生细菌,对蓝莓根癌土壤杆菌有良好的拮抗效果;根癌土壤杆菌 L-11(16S rDNA GenBank登录号:MK910214.1),分离自蓝莓根癌病冠瘿瘤组织[2]。
1.1.2 供试植株 番茄(中蔬4号)从市场购买;蓝莓苗品种为“Jewelry”,1年组培苗,由曲靖佳沃现代农业有限公司惠赠。
1.1.3 质粒 质粒EC135-PGFP4412由中国农业大学植物保护学院惠赠,该穿梭质粒携带有绿色荧光蛋白编码基因GFPmut3a(717 bp)。
1.2 培养基
解淀粉芽胞杆菌发酵培养基参考刘京兰等[14]的配方,主要考虑抑菌活性和活菌量两个指标,使用单因素变量筛选优化,改良后培养基命名为BA培养基(1 L):工业蛋白胨11.25 g、酵母浸粉3.75 g、工业蔗糖5 g、马铃薯淀粉5 g、MgSO4·7H2O 1.5 g、NaCl 1 g,蒸馏水定容至1 L,1 mol/L的NaOH溶液将pH调至7.0,分装后灭菌备用;YEM培养基(1 L):甘露醇10 g、酵母膏3 g、NaCl 0.2 g、MgSO4·7H2O 0.2 g、K2HPO4·3H2O 0.5 g、琼脂20 g、使用1 mol/L的NaOH溶液将pH调至7.0,分装后灭菌备用;不加琼脂为YEB培养基。生长转化培养基、电击转化缓冲液、复苏培养基均参考文献[15]。
1.3 菌株JK10活性物质提取与分析
1.3.1 菌株JK10 发酵液 JK10于LB平板上纯化后挑取单菌落接种于LB液体培养基中,30 ℃、160 r/min过夜培养,次日按照1%的比例接种至BA培养基,装液量为500 mL/瓶,30 ℃、160 r/min培养36 h用于田间试验及活性物质分析试验。
1.3.2 菌株JK10发酵液中活性物质的分离 将1.3.1中摇床培养36 h的菌液于50 mL无菌离心管中10000 r/min离心20 min,得到无菌上清液。收集上清液到干净无菌的三角瓶中,每瓶500 mL备用。
酸沉淀法[16]。使用6 mol/L HCl将上述上清液pH调至2.0后置于4 ℃冰箱过夜,12000 r/min离心10 min收集沉淀。沉淀于超净工作台中吹干,使用适量分析纯甲醇对沉淀充分抽提,合并抽提液后使用滤纸过滤,然后使用旋转蒸发仪除去甲醇溶剂,称重,得到脂肽类粗提物。
硫酸铵沉淀法[17]。上述上清液中加入分析纯硫酸铵,使硫酸铵溶解度为30%,硫酸铵震荡溶解后于4 ℃冰箱放置2 h后离心,收集沉淀后放到超净工作台中吹干,使用分析纯甲醇溶解沉淀并使用滤纸过滤溶液,然后使用旋转蒸发仪旋蒸至干并称重,得到抑菌蛋白类粗提物。
乙酸乙酯萃取法[18]。取上述无菌上清液500 mL于分液漏斗中,加入等体积的乙酸乙酯充分震荡后静置使其分层,收集上层有机相。重复萃取一次后,合并两次萃取得到的乙酸乙酯溶液,并往溶液中加入 20 g无水硫酸钠除去水分,滤纸过滤后使用旋转蒸发仪旋蒸至干,称重备用。
大孔树脂吸附法。参照林宝妹等[19]的方法对大孔树脂进行预处理。称取预处理好的大孔吸附树脂20 g加入到上述上清液中,置于恒温振荡器中30 ℃、160 r/min吸附24 h。无菌水超纯水清洗两遍树脂颗粒后过4层纱布,收集树脂颗粒,树脂颗粒自然风干后置于100 mL三角瓶中,加入50 mL甲醇,30 ℃、160 r/min恒温振荡器中解吸附2 h,而后将甲醇滤出,加入50 mL甲醇重复解吸附2次,将3次得到的甲醇溶液合并后使用旋转蒸发仪旋蒸至干,称重。
1.3.3 粗提物活性检测 以根癌土壤杆菌L-11为靶标菌株,将4种方法得到的粗提物均使用甲醇溶解后稀释到10 mg/mL,过0.22 μm有机相滤膜除菌。将在YEM平板上生长的L-11挑取单菌落至无菌离心管中,使用无菌水稀释成OD600=0.3的菌悬液后吸取100 μL到新的YEM平板上并涂布均匀,将灭菌后的滤纸片均匀放置在离培养皿中心25 mm的位置上,每皿3片(滤纸片直径为6 mm),每个滤纸片滴加10 μL粗提物,以无菌甲醇作为对照。滴加粗提物后平板置于4 ℃冰箱2 h,使粗提物充分分散到平板中[20],然后置于28 ℃恒温培养箱中,36 h后观察记录抑菌圈大小,以此评价四种粗提物的活性,每个处理重复3皿。
1.3.4 菌株 JK10活性物质种类分析 基质辅助激光解吸离子化飞行时间质谱(MALDI-TOF MS)使用Shimadzu AXIMA Performance质谱仪,采用α-氰-4-羟肉桂(α-cyano-4-hydroxycinnamic acid)为基质,三氟乙酸钠为离子源,按照线性、正离子模式测试,使用337 nm氮激光源解吸附和电离,具体方法参照 Ongena等[21]。将提取的粗提物母液(10 mg/mL)用无水甲醇稀释50倍后置于仪器离子源进行测定,质量扫描范围为100~3000 Da。
1.4 菌株JK10绿色荧光蛋白标记及其生物学特性测定
1.4.1 菌株JK10感受态细胞制备 参考康星星[15]的方法,JK10于LB培养基连续划线纯化2次后,挑取单菌落接种于LB液体培养中,摇床160 r/min、30 ℃过夜培养,作为种子液。将种子液按照1%的接种量接入到生长转化培养基中,摇床160 r/min、30 ℃培养至生长对数期OD600=0.6~0.8,使用电击转化缓冲液将离心得到的JK10细胞洗涤4次后加入1 mL电击转化缓冲液重新悬浮,无菌离心管每管100 μL分装后使用液氮速冻,放置于-80 ℃冰箱备用。
1.4.2 质粒EC135-PGFP4412提取 宿主菌EC135在LB抗生素(卡那霉素浓度为25 μg/mL)培养基上划线纯化后,挑取紫外光下发出强烈绿色荧光的单菌落接种LB抗生素(卡那霉素浓度为12.5 μg/mL)液体培养基中,摇床160 r/min、30 ℃培养24 h,使用质粒小提试剂盒提取质粒后置于-20 ℃冰箱保存备用。
1.4.3 电击转化 将100 μL JK10感受态细胞与10 μL(500 ng/μL)EC135-PGFP4412质粒加到1 mm电击杯中混合均,电击转化(电压为1800 V,电阻为200 Ω,电容为25 μF)。电击转化后的细胞立即转移至900 μL复苏培养基中,摇床160 r/min、37 ℃复苏培养4 h,复苏培养后离心除去多余培养基,浓缩至400 μL,吸取100 μL均匀涂布到LB抗生素(卡那霉素浓度为25 μg/mL)培养基,37 ℃恒温培养箱培养。1~2 d后在紫外光下观察,挑取发出绿色荧光的阳性转化子,划线纯化后保存,绿色荧光蛋白标记的菌株命名为JK10-GFP。
1.4.4 标记菌株与原始菌株的生物学比较 标记菌株JK10-GFP与原始菌株JK10生长曲线及稳定性测定参考文献[22,23],培养条件均为培养条件为160 r/min、30 ℃。JK10-GFP培养至指数期,以1%的接种量每隔12 h连续转接至LB液体培养基中,直至第5 d,转接的同时吸取JK10-GFP菌液稀释后涂布到LB培养基和LB抗生素(卡那霉素浓度为25 μg/mL)培养基中,观察总的菌落数量及发出荧光的菌落数;JK10与JK10-GFP分别挑取单菌落接至LB液体培养基中过夜培养,次日将JK10、JK10-GFP使用无菌水调至相同浓度OD600=1,然后按照1%的接种量接种至LB液体培养基中,每隔3 h测定两株菌液OD600值并绘制生长曲线。
1.4.5 抑菌活性及温室防效比较 JK10、JK10-GFP活化后,分别挑取单菌落接种于BA培养基,L-11活化后挑取单菌落接种于YEB培养基,三株菌于28 ℃、150 r/min摇床内培养24 h。使用无菌水将L-11菌液稀释成OD600=0.3的菌悬液,吸取100 μL均匀涂布到YEM平板上。距离平板中心2 cm的位置均匀放置3只牛津杯,无菌水作为对照,处理中分别加入100 μL JK10、100 μL JK10-GFP菌液,重复3皿,36 h后测量两株菌的抑菌圈,以此评价两株菌的抑菌活性。温室盆栽番茄苗,40 d后使用针刺接种法评[24]价JK10与JK10-GFP的对L-11致瘤的影响。将上述培养的JK10、JK10-GFP菌液和无菌水各吸取500 μL至无菌离心管中,再分别加入500 μL L-11菌液,摇晃均匀,用1 mL无菌注射器分别注射到番茄茎基部,每处注射100 μL,每棵番茄苗接种两处(间隔5 cm)。接种30 d后将瘤状组织用锋利小刀切下后称重,以此评价菌株JK10,菌株JK10-GFP对L-11起瘤的抑制作用,无菌水作为对照。
1.5 菌株JK10绿色蛋白标记菌株定殖情况
1.5.1 菌株JK10-GFP温室盆栽定殖试验 参考李昱佳等[5]的方法将纯化后的菌株JK10-GFP、L-11分别接种于BA、YEB培养基中,30 ℃、160 r/min摇床培养36 h。培养结束,菌株JK10-GFP菌量为5×1010cfu/mL,L-11菌量为 2×109cfu/mL。然后将两种菌液灌根接种于蓝莓苗根际土中,使 JK10-GFP初始接种浓度为1×108cfu/g,L-11的初始菌量为1×107cfu/g,以只接种L-11不接种JK10-GFP作为对照。从接种后第1、3、5、7 d取1次蓝莓根际土与蓝莓叶片组织,从第7 d开始每隔7 d取一次。盆栽蓝莓苗所用基质为草炭与珍珠岩,比例为8:2(V:V)。
1.5.2 标记菌株在蓝莓根际土和叶片中的存活情况 将1.5.1中采集的蓝莓根际土、蓝莓叶片组织(剪碎)称取0.1 g置于无菌离心管中,加入900 μL无菌水充分磨碎后于恒温震荡器中震荡30 min,此为10-1浓度,然后再依次稀释105或106倍后吸取100 μL均匀涂布于LB抗生素(卡那霉素浓度为25 μg/mL)平板上,48 h后在紫外光下观察并计数发出绿色荧光的菌落,每次重复3皿。
1.5.3 标记菌株在蓝莓组织内的定殖观察 将施入JK10-GFP菌株1、7、21 d的蓝莓根使用冷冻切片技术切成20 μm的薄片,分别使用莱卡荧光显微镜(德国莱卡公司,型号:DM2000)和激光共聚焦扫描显微镜(德国莱卡公司,型号:Leica SP5 II)观察标记菌株在蓝莓根组织内的定殖情况[25]。
1.6 菌株JK10对蓝莓内生细菌的影响
1.6.1 田间试验设计 本部分试验于曲靖佳沃现代农业有限公司蓝莓基地园区内进行。选取蓝莓根癌病发病程度中等的片区(发病率为38.4%),将1垄连续的90棵蓝莓苗划分为3组即DT、HT、CT,每组中都包含发病植株和健康植株,DT组(30棵)和HT组(30棵)作为对照,CT组灌根JK10菌悬液。2021年1月10日开始,每隔15 d,CT灌根一次JK10发酵液50倍液(菌量为1×109cfu/mL),每棵蓝莓苗灌2 L,连续灌根3次。DT与HT每棵每次灌根2 L清水。2021年7月1日在DT组随机选取3株蓝莓根癌病株采集冠瘿瘤组织,HT组随机取3株健康蓝莓采集健康根组织,CT组随机取3棵蓝莓根癌病株采集冠瘿瘤组织,样品采集后立即放到干冰中。到实验室后用自来水将3组样品的根组织冲洗干净,再浸泡在5%次氯酸钠中消毒5 min,使用无菌手术刀小心将根表面和小侧根刮除干净[26]。将处理好的样品放置于干冰盒中,寄送至北京诺禾致源科技股份有限公司进行内生细菌的高通量测序。
1.6.2 细菌基因组DNA提取、扩增、纯化和测序 采用CTAB或SDS方法[27]对样本的基因组 DNA进行提取,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量样本DNA于离心管中,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物,New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer,和高效高保真酶进行PCR,确保扩增效率和准确性。
1.6.3 Alpha Diversity分析 使用Qiime软件(Version 1.9.1)计算simpson,Chao1,Shannon指数,使用R软件(Version 2.15.3)进行Alpha多样性指数组间差异分析。通过分析3组样本内Alpha多样性以反映样本内的微生物群落的丰富度和多样性,评估其丰富度和多样性的差异[28]。
1.6.4 Beta Diversity分析 用Qiime软件(Version 1.9.1)计算Unifrac距离、构建UPGMA样本聚类树。使用R软件(Version 2.15.3,WGCNA,stats和ggplot2软件包)绘制并分析PCoA图。使用R软件进行Beta多样性指数组间差异分析,分别进行有参数检验和非参数检验。
1.6.5 JK10对蓝莓根内生细菌的影响 利用Uparse软件(Uparse v7.0.1001)对所有样本的全部 Effective Tags进行聚类,默认以97%的一致性将序列聚类成为OTUs,同时会选取OTUs的代表性序列,依据其算法原则,筛选OTUs中出现频数最高的序列作为OTUs的代表序列。对OTUs序列进行物种注释,用Mothur方法[29]与SILVA138的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1),获得分类学信息并分别在各个分类水平:kingdom(界),phylum(门),class(纲),order(目),family(科),genus(属),species(种)统计各样本的群落组成。使用MUSCLE(Version 3.8.31)软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系[30]。
1.7 数据统计与分析
试验数据使用GraphPad Prism 8和Excel 2016软件分析。
2 结果与分析
2.1 菌株JK10活性物质分析
2.1.1 四种方法提取的活性物质的抑菌活性及产率 4种粗提物对L-11均有明显的抑制效果。表1所示,大孔树脂吸附法得到的粗提物抑菌活性最强且产率最高,酸沉淀法得到的粗提物抑菌活性最低,乙酸乙酯萃取法得到的粗提物产率最低。

表1 4种方法粗提物的抑菌活性及产率Table 1 Antibacterial activity and yield of crude extracts of four methods
2.1.2 大孔树脂提取物MALDI-TOF-MS分析 对于产率和活性均最高的大孔树脂吸附法得到的粗提物进行基质辅助激光解吸附飞行时间质谱分析。MALDI-TOF-MS质谱分析结果显示:JK10在m/z值(图1A)为550.3512离子峰对应于大环内酯类抗生素Divergolide D的质量[31];在m/z值为581.0817处有离子峰(簇)出现,这个离子峰对应于Bacillaene[32]的质量。菌株JK10发酵液在m/z值(图1B)1030.4344、1044.4754和1058.5153处有离子峰(簇)出现,这3个离子峰分别对应 C14-C16 bacillomycin D的质量;在m/z值(图1C)为1449.6271、1463.6456处有离子峰(簇)出现,这两个离子峰分别对应fengycinA、fengycinB的质量;MALDI-TOF-MS分析表明,菌株JK10发酵液中含有脂肽类化合物fengycinA、fengycinB、C14-C16 bacillomycin D;可能含有大环内酯类抗生素Divergolide D,聚酮类化合物Bacillaene。
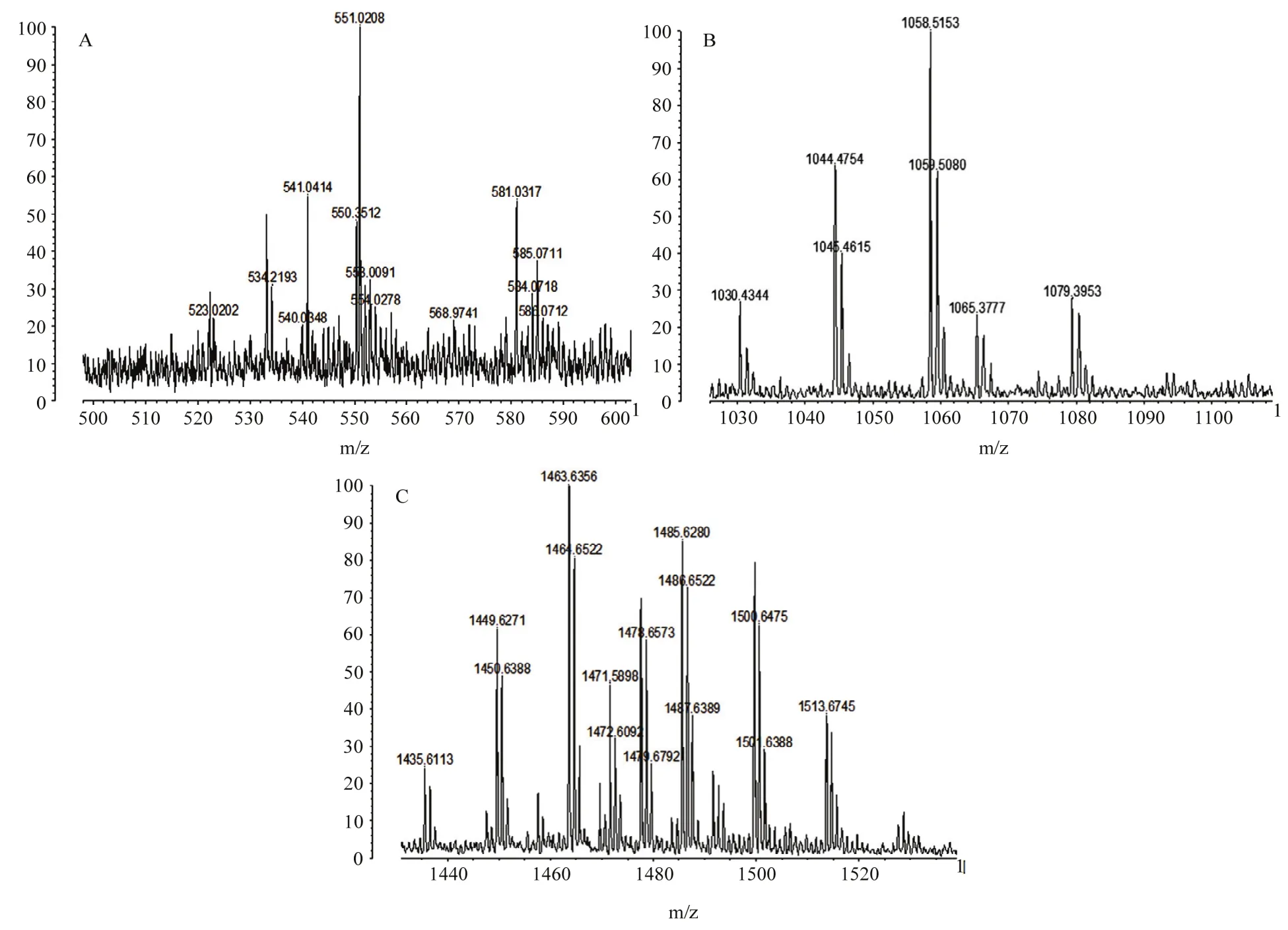
图1 菌株JK10活性物质 MALDI-TOF-MS分析Fig.1 MALDI-TOF-MS analysis of active substance of biocontrol strain JK10
2.2 标记菌株的生物学特性
2.2.1 标记菌株生物学特性 连续转接 10次后,无论是抗性平板还是非抗性平板上生长的所有菌落都仍然保持均匀而且强烈的绿色荧光,说明标记基因在JK10中能够稳定遗传,转接至第5 d荧光稳定性还保持在100%。由图2可知JK10与JK10-GFP菌株的生长曲线,在3~12 h为生长对数期,两株菌生长曲线基本重合,说明外源质粒的存在和GFP的表达未对JK10的生长产生明显不利影响。
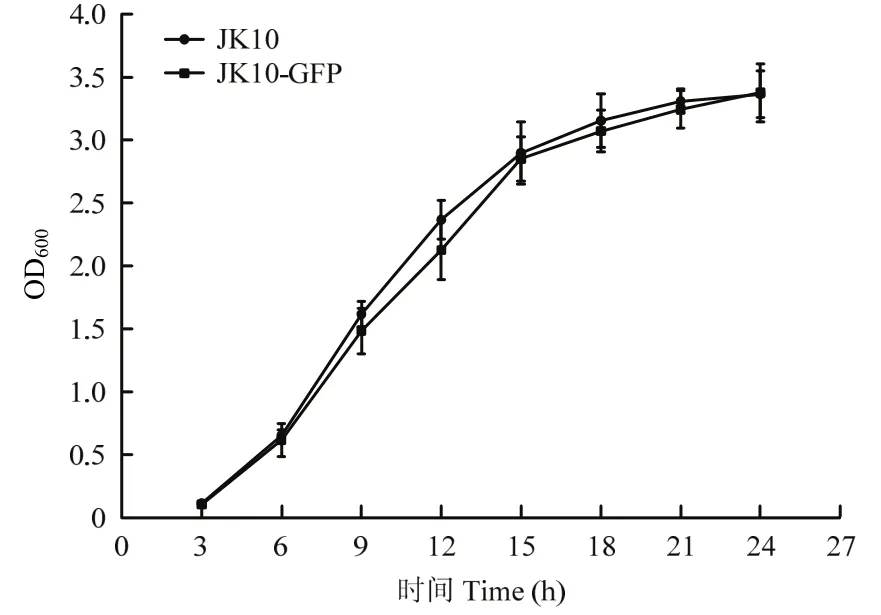
图2 菌株JK10与JK10-GFP生长曲线Fig.2 Growth curve of biocontrol strains JK10 and JK10-GFP
2.2.2 标记菌株抑菌活性检测 图3A所示,室内拮抗试验中JK10,JK10-GFP对L-11均有明显的抑菌圈,抑菌圈直径分别为(24.15±0.31)和(23.63±0.24)mm,两者无显著差异(P>0.05)。模式植株番茄活体针刺接种试验表明,野生型菌株JK10与标记菌株JK10-GFP对L-11的致瘤均有强烈抑制作用,两株菌处理过的番茄茎部都几乎不起瘤,二者瘤重无显著差异(P>0.05),且抑制率均在 90%以上(图3B)。证明外源质粒的存在及GFP的表达未对菌株JK10的生理代谢、生防功能产生明显的不利影响,JK10-GFP可替代JK10用作生防试验。
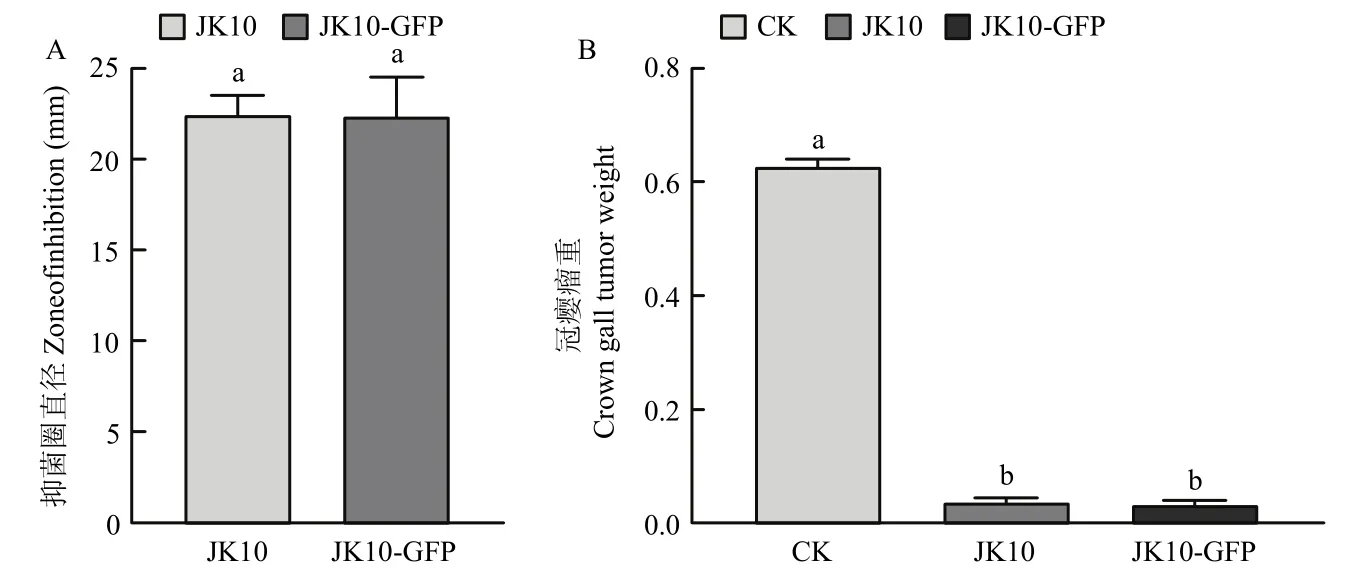
图3 抑菌活性及抑制番茄起瘤效果Fig.3 Antibacterial activity and inhibiting effect on tomato tumor formation of biocontrol strain
2.3 标记菌株的定殖能力
2.3.1 标记菌株在蓝莓根际土和叶片中存活能力检测 平板计数结果显示,标记菌株可以在蓝莓根际土和蓝莓叶片中稳定存活3个月以上(图4)。在整个观测期间(0~91 d),蓝莓根际土壤和蓝莓叶片中均能分离得到带有荧光标记的菌株,而对照组根际土与叶片中均未见发出荧光的菌株。JK10- GFP在蓝莓根际土壤中呈现先快速下降后稳定的趋势,0~7 d蓝莓根际土壤中的标记菌株数量下降了一个数量级,之后下降速度减慢,直至35 d左右菌量稳定在1×106cfu/g;JK10-GFP在蓝莓叶片组织中的含量在0~7 d从无到有并达到了103cfu/g以上,之后上升速率有所减慢,35 d后逐渐稳定在4.0×105cfu/g。
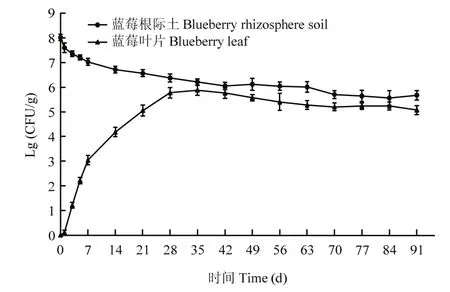
图4 菌株JK10-GFP在蓝莓根际土及蓝莓叶片中的存活量Fig.4 Colonization ability of JK10-GFP in blueberry rhizosphere soil and blueberry leaves
2.3.2 标记菌株在蓝莓根部的定殖观察 图5所示,JK10-GFP灌根1 d后即可在蓝莓根纵切面的边缘观察到强烈的荧光,说明标记菌株灌根处理1 d内,即可在蓝莓根表面富集,之后再通过传导系统进入蓝莓组织内部,而对照均未观察到荧光,表明未经处理的蓝莓根组织无荧光背景。
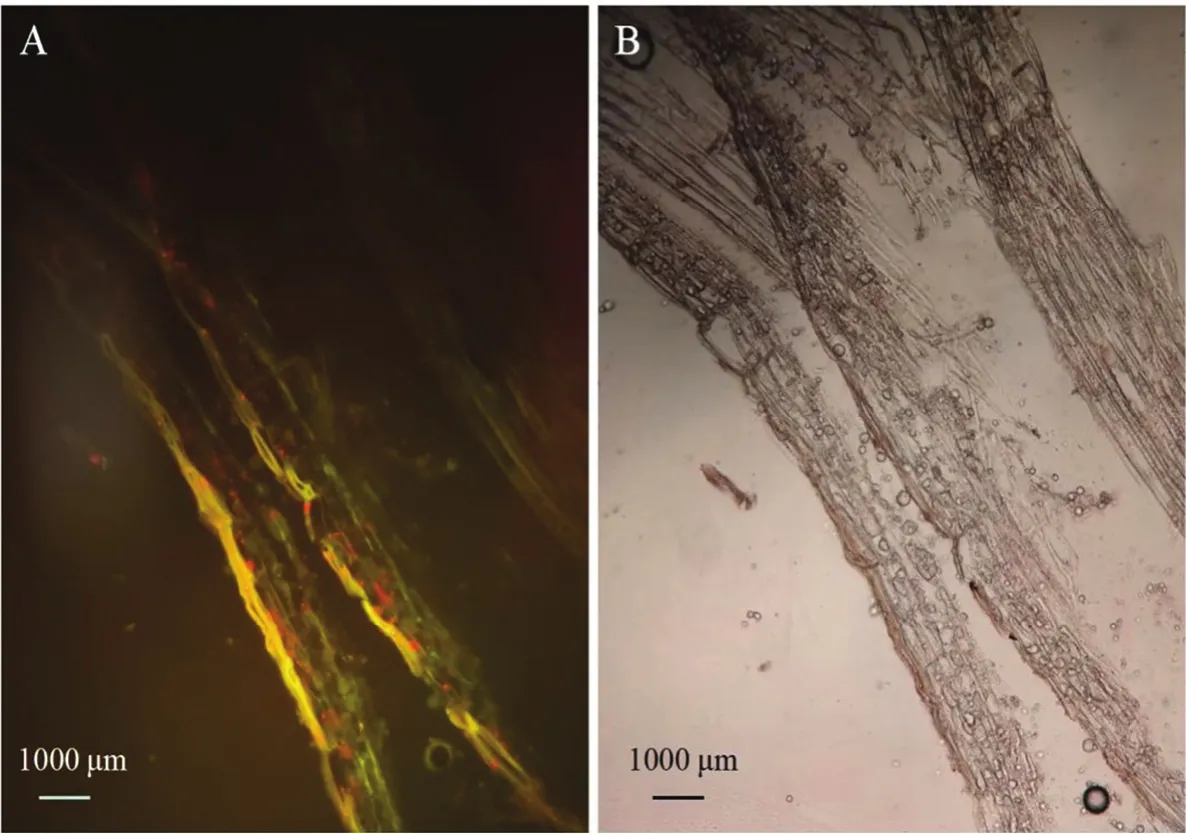
图5 荧光显微镜观察JK10-GFP在蓝莓表面聚集Fig.5 Fluorescence microscope observation for colonization ability of JK10-GFP on the surface of blueberries root
使用激光扫描共聚焦显微镜观察JK10-GFP灌根处理7、21 d的蓝莓根组织纵切面,结果如图6所示。JK10-GFP处理7 d后,标记菌株主要聚集在蓝莓根的表面,且土壤中的标记菌株较多,对观察影响较大;处理21 d后,标记菌株在蓝莓根组织细胞间隙内分布均匀,含量较7 d的蓝莓根组织明显增多。说明灌根处理蓝莓后,标记菌株是从蓝莓根际土中进入到蓝莓根组织中。
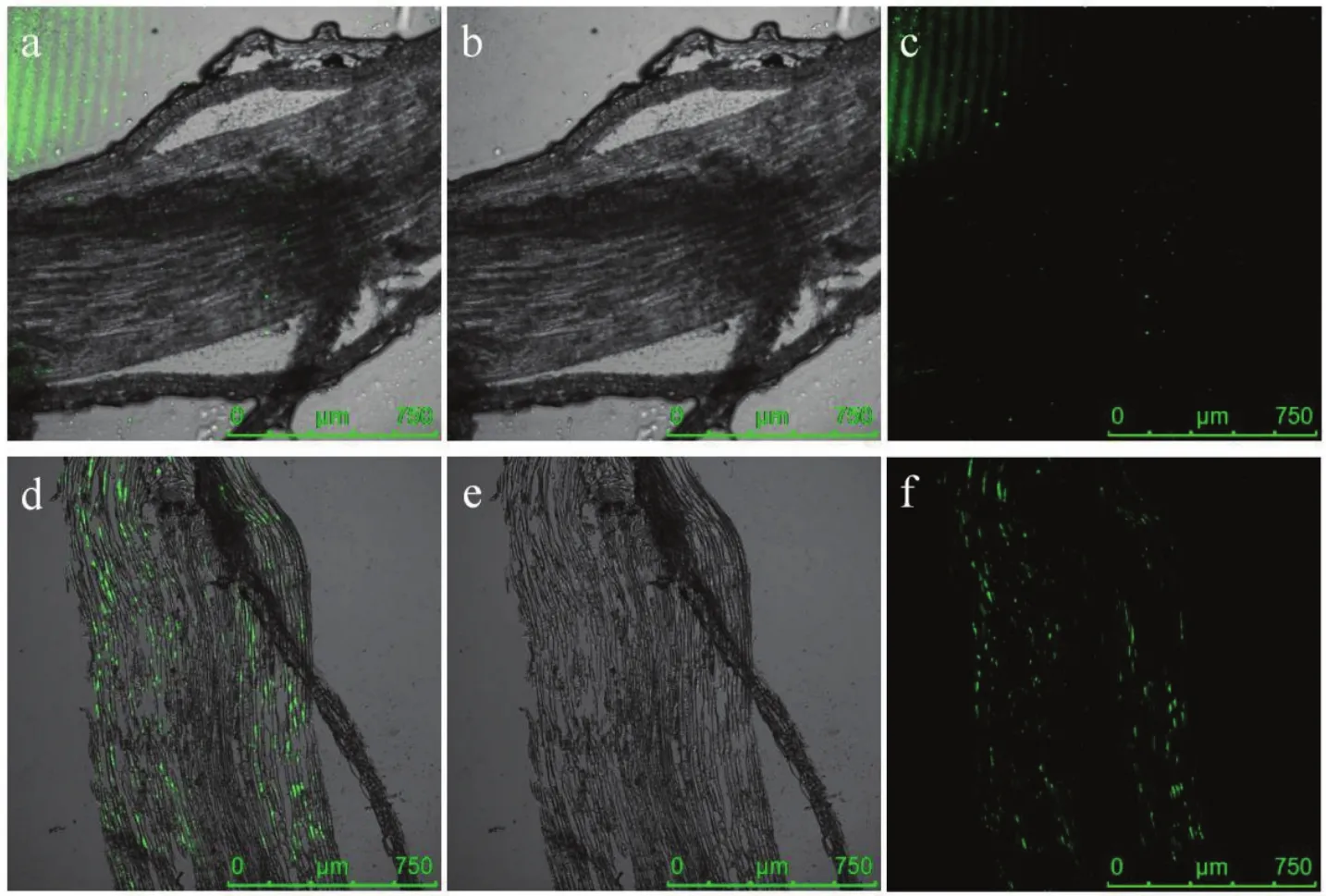
图6 激光扫描共聚焦显微镜观察JK10在蓝莓根组织内的定殖情况Fig.6 Observation of the colonization ability of JK10 in blueberry root tissue by laser scanning confocal microscope
2.4 JK10对蓝莓根组织内生细菌群落的影响
2.4.1 JK10三组样品组内物种丰富度比较 HT、DT、CT内生细菌α多样性指数如图7所示,可以看出经过JK10处理的CT内生细菌的Observed_species、simpson、Chao1 指数、Shannon指数均明显高于未经处理的蓝莓冠瘿瘤组织DT,说明通过JK10灌根处理蓝莓根癌病冠瘿瘤组织内部的微生物群落的丰富度和多样性显著增加。
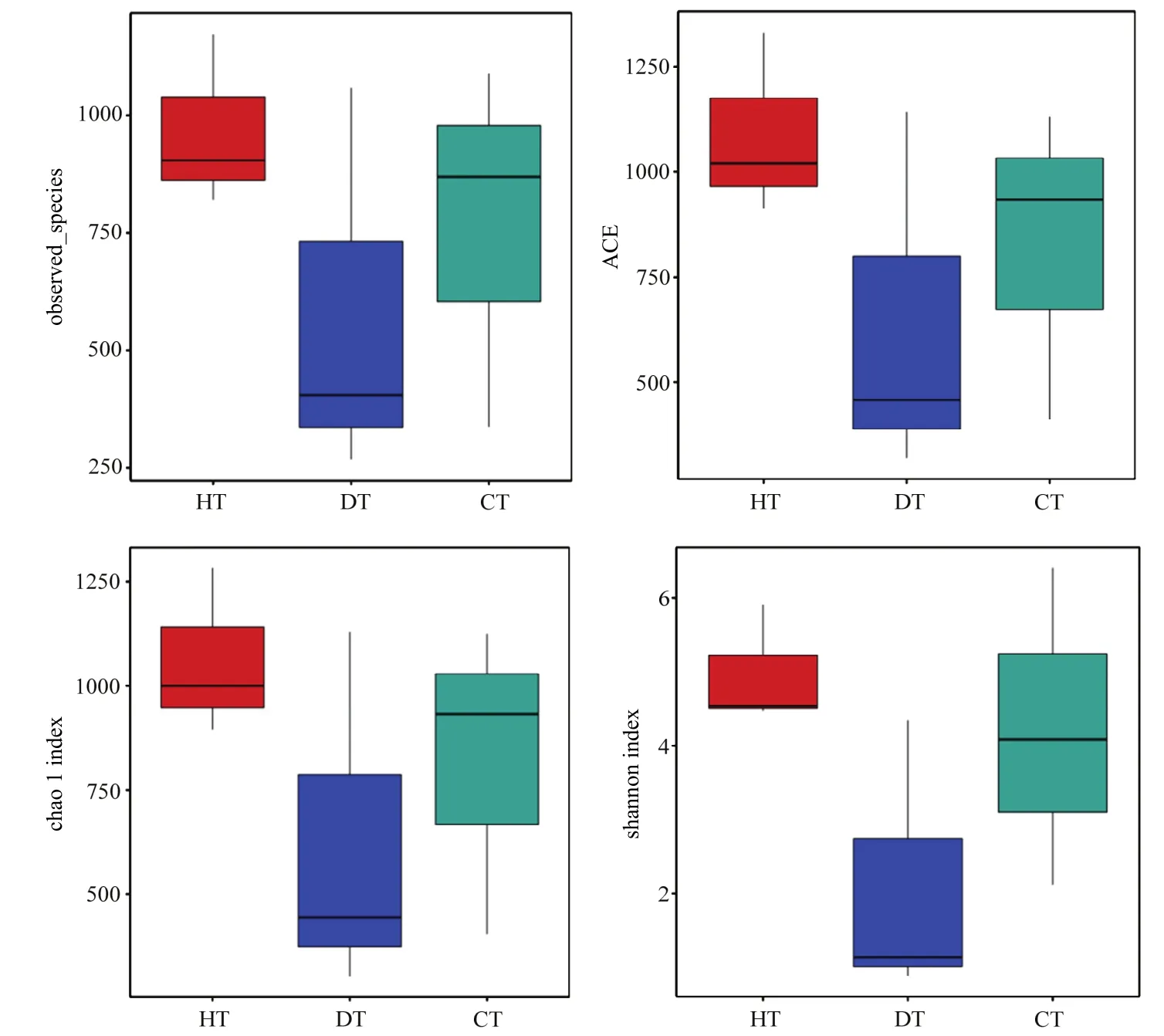
图7 三组样品内生细菌alpha多样性指数Fig.7 Boxplot showing bacterial alpha diversity indexes of three groups
2.4.2 JK10对蓝莓根内生细菌组间的差异影响 基于Weighted Unifrac距离和 Unweighted Unifrac距离的PCoA分析,样本距离越接近表示物种组成结构越相似,群落差异很大的样本则会远远分开。由图8可知,两种分析方法都表明健康蓝莓根组织内生细菌与根癌病蓝莓根组织内生菌差异较大,而经过JK10灌根处理的CT,3个样本散落在不同的象限,且距离HT比距离DT明显更近。
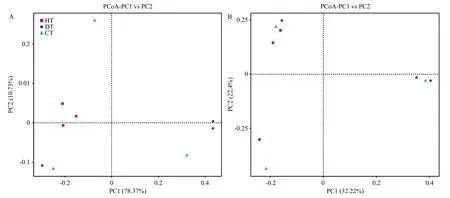
图8 基于Weighted Unifrac距离(A)与 Unweighted Unifrac 距离(B)的PCoA分析Fig.8 PCoA analysis based on Weighted Unifrac distance (A) and Unweighted Unifrac distance (B) for diversity analysis
以 Weighted Unifrac 和 Unweighted Unifrac 距离绘制的Heatmap结果用以表示HT、DT、CT之间的相异系数,其值越小,表示两个样本在物种多样性方面存在的差异越小,由图9可知CT与HT之间的相异系数显著低于CT与DT之间的相异系数。说明经过JK10处理,CT的内生细菌群落相较于没有处理的发病蓝莓根癌病根组织,其物种结构更接近于健康蓝莓根。
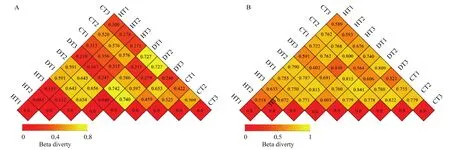
图9 基于Weighted Unifrac距离(A)与 Unweighted Unifrac 距离(B)的矩阵热图Fig.9 Distance heatmap graph based on Weighted Unifrac distance (A) and Unweighted Unifrac distance (B) for bacterial communities analysis
2.4.3 蓝莓根内生细菌门级物种比较 图10所示,在门水平上发现HT内生细菌占主导地位的物种包括:蓝藻门 Cyanobacteria、放线菌门 Actinobacteria、变形菌门 Proteobacteria、酸杆菌门 Acidobacteriota;DT内生细菌门水平占主导地位的物种包括蓝藻门 Cyanobacteria、放线菌门 Actinobacteria、酸杆菌门Acidobacteriota、变形菌门Proteobacteria;CT内生细菌门水平占主导地位的物种包括蓝藻门Cyanobacteria、放线菌门Actinobacteria、拟杆菌门Firmicutes、变形菌门Proteobacteria。
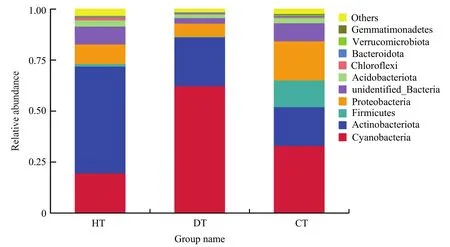
图10 三组样品内生细菌在门水平的分布Fig.10 Relative abundance at phylum level based on the species annotation results for top 10 phyla in all groups
2.4.4 蓝莓根内生细菌属水平物种比较 根据所有样本在属水平的物种注释及丰度信息,选取丰度排名前35的属,根据其在每个样本中的丰度信息,从物种和样本两个层面进行聚类,绘制成热图(图11)。结果发现HT富集较多的内生细菌属有诺卡氏菌属Nocardia、热酸菌属Acidothermus、Conexibacter、分枝杆菌属Mycobacterium、鞘氨醇单胞菌属Sphingomonas;DT中优势根内生菌属有诺卡氏菌Nocardia、鞘氨醇单胞菌属Sphingomonas、热酸菌属Acidothermus、分枝杆菌属Mycobacterium、新鞘氨醇菌属Novosphingobium;CT中优势根内生菌属有诺卡氏菌属Nocardia、芽胞杆菌属Bacillus、异样根瘤菌属Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、新鞘氨醇菌属Novosphingobium、鞘氨醇单胞菌属Sphingomonas。综合3组样品发现诺卡氏菌属、鞘氨醇单胞菌属在3组样品中均为优势物种,且相对丰度较高。CT内生细菌中芽胞杆菌属相对丰度明显升高,可能是因为JK10处理的蓝莓根组织招募了更多的芽胞杆菌属细菌或者是JK10能够在蓝莓根内定殖。
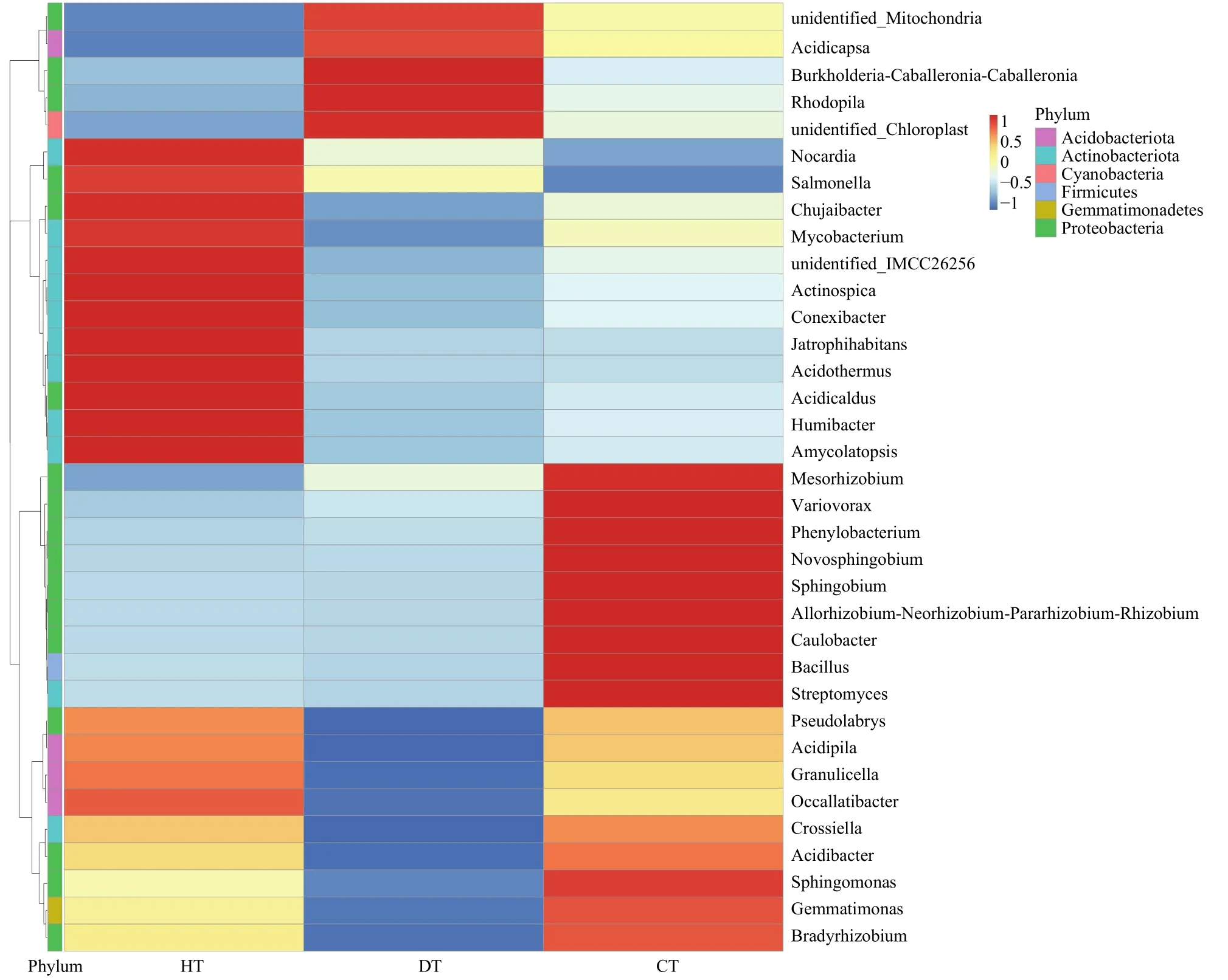
图11 蓝莓根内生细菌物种在属水平聚类图Fig.11 Cluster map heatmap representing the relative abundance of top 35 bacterial genera
3 讨论
解淀粉芽胞杆菌具有广谱抑菌活性,可产生多种拮抗真菌和细菌的活性物质。桑建伟等[33]研究表明解淀粉芽胞杆菌BEB17产生多种脂肽类和聚酮类物质,其粗提物对香蕉枯萎病菌Fusariumoxysporum具有较好的抑制作用。向亚萍等[34]研究发现解淀粉芽胞杆菌B1619分泌的3类脂肽类抗生素中对番茄枯萎病菌Fusariumoxysporum生长有抑制作用的抗生素是bacillomycin L和fengycins。杨桥等[35]从深海泥中分离得到的一株解淀粉芽胞杆菌产生一种新型的大环内酯抗生素macrolactin对大肠埃希菌Escherichiacoli、金黄色葡萄球菌Staphylococcusaureus都有抑制作用。解淀粉芽胞杆菌防治真菌病害的报道较多,防治细菌病害的报道较少,目前被广泛认可的对细菌有拮抗作用的化合物有 surfactin、Bacillibactin、Difficidin 和Bacillaene,拮抗机理主要有改变细菌的表面疏水性,破坏生物膜完整性等[36,37]。本研究证明,解淀粉芽胞杆菌 JK10的发酵液中含有 bacillomycin D、fengycin两类脂肽类化合物可能含有大环内酯类抗生素Divergolide D、聚酮类化合物Bacillaene。具体哪种是抑制根癌土壤杆菌的主要物质还需要对粗提物进一步纯化和鉴定。
对于土传病害来说,生防菌株能否稳定定殖是其发挥生防功能的关键[38]。张楠等[39]使用 GFP标记解淀粉芽胞杆菌 SQR9,并证明其在水培和土培条件下均能稳定定殖在香蕉根表,对香蕉枯枯萎病有良好的防治前景。高竞等[40]使用GFP标记的解淀粉芽胞杆菌GFP-WK1有较强的移动性,无论是通过根系浇灌、叶面喷施还是树干滴注其都能够在山核桃的根、茎、叶中稳定定殖,对山核桃干腐病有良好的应用前景。李昱佳等[5]使用GFP标记的泛菌P.deleyi和肠杆菌E.cowanii对根癌土壤杆菌引起的向日葵冠瘿瘤有明显的抑制效果,并且可以定殖在番茄根部细胞间隙中,有良好防治桃树根癌病前景。本研究直接使用蓝莓作为研究对象,模拟实际生产中的情况,使用草炭和珍珠岩作为蓝莓苗栽培基质,接种生防菌的同时接种蓝莓根癌病病原菌,明确了 JK10不仅可以稳定定殖在蓝莓根际土和蓝莓根部,由于其具有良好的移动性,还能在蓝莓的叶片组织中定殖。由于JK10产生抑制真菌的fengycin、bacillomycin D,这使得其对蓝莓主要叶部病害,如蓝莓叶斑病,蓝莓灰霉病可能也有一定的生防价值。
根癌土壤杆菌与植物内生细菌互作关系已成为研究的热点领域,也是根癌病生物防治的重要切入点。桃树抗/感根癌病品种内生细菌群落差异研究证实,抗病品种的内生细菌群落与可培养细菌丰度高于感病品种,根部的根癌拮抗菌假单胞菌属Pseudomonas、链霉菌属Streptomyces和枝条中的根瘤菌属Rhizobium等细菌在抗病植株中分布频率高,可作为生防菌应用[41];李昱佳等[5]研究表明在接种根癌土壤杆菌后桃枝条内生细菌中,肠杆菌属Enterobacter、泛菌属Pantoea和根瘤菌属Rhizobium数量显著上升。尹丹韩[42]研究表明施入生防菌哈茨木霉菌 T4后木霉对黄瓜根围土壤细菌群落产生显著影响,对一些不可培养细菌的有效抑制作用,对芽胞杆菌、土壤杆菌、芽单胞菌有明显促进作用。陈胜菊等[43]研究表明生防荧光假单胞菌Pseudomonasfluorescens定殖后对土壤中可培养的真菌数量上有抑制作用。本研究证明施入解淀粉芽胞杆菌JK10之后蓝莓根癌病根内生细菌种群结构发生了改变,其中芽胞杆菌属Bacillus、异样根瘤菌Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium、新鞘氨醇菌属Novosphingobium、鞘氨醇单胞菌属Sphingomonas含量均上升,其中芽胞杆菌属Bacillus作为生防细菌的应用是最广泛和成熟的,鞘氨醇单胞菌属Sphingomonas某些菌株具有降解高分子有机污染物的能力[44,45]。通过Beta多样性分析证明JK10灌根处理后的蓝莓根癌病植株冠瘿瘤内生细菌的群落组成,相较于未处理的蓝莓根癌冠瘿瘤组织内生细菌更趋向于健康蓝莓根组织内生细菌,但关于这些增加的细菌的功能还有待研究。
