浮性与沉性生物絮团氨氮处理能力与营养组成的比较研究
2022-07-07谭竟宏陆泳因罗国芝谭洪新刘文畅
谭竟宏,陆泳因,罗国芝,2,3,谭洪新,2,3,刘文畅,2,3
(1上海海洋大学上海水产养殖工程技术研究中心,上海 201306;2 上海海洋大学上海市水产动物良种创制与绿色养殖协同创新中心,上海 201306;3 上海海洋大学水产科学国家级实验教学示范中心,上海 201306)
生物絮团技术是通过向养殖水体中添加碳源或提高饲料中的碳含量促进硝化细菌等微生物生长和对氮的吸收,将水体中浮游植物、细菌、颗粒有机物等絮凝成养殖对象可摄食的生物絮团,从而起到净化水质的作用[1-2]。然而生物絮团的积累会导致养殖池底的总悬浮固体(TSS)含量增加,这会对养殖对象的摄食情况,甚至生长发育等产生负面影响[3-6]。
传统絮团生物量的调控,通常通过添加沉降单元[7]或者絮团脱水技术[8]排除掉密度体积较大的絮团来达到减少系统TSS质量浓度的目的。絮团沉淀过程中,生物絮团会逐渐分为两部分,即浮性絮团与沉性絮团。浮性絮团是因为水体低溶氧水平、营养缺乏或其他刺激絮团生长的条件导致丝状微生物的快速增殖或发生絮团的反絮凝作用形成[9-12]。沉性絮团则是由细菌胞外聚合物(Extracellular Polymeric Substances,EPS)粘连微生物逐渐形成的密度较大的细菌团[13-14]。有研究表明通过沉淀调节絮团TSS质量浓度不会影响系统水质控制能力[15],但同样大小的絮团也会有不同的沉降速度[16]。目前的研究结果并不能证明沉性絮团或者浮性絮团各自的水质控制能力且没考虑沉淀的时间成本。
本研究以5 min为沉淀时间,比较了浮性絮团和沉性絮团的总氨氮处理能力和营养组成,旨在为养殖中生物絮团量的调控提供参考。
1 材料与方法
1.1 设备以及材料
生物絮团用鱼用膨化配合饲料(通威股份公司)培养絮团,所用饲料含28%粗蛋白、12%粗纤维、5%粗脂肪、15%粗灰分、0.6%总磷以及12.5%水分。18个10 L聚乙烯透明桶为容器。用透明硅胶软管(内径5mm,外径7 mm)作为曝气管,采用大马蹄曝气石曝气。马弗炉(SR-JX3-9箱式电炉)用于灼烧絮团。两台罗茨鼓风机(功率750W,森森集团股份有限公司)。元素分析仪ELMENTAR VARIO MAX用于分析生物絮团的碳氮元素。坩埚用于絮团进行灼烧。葡萄糖(C6H12O6)为碳源。碳酸氢钠(NaHCO3)调节碱度。多参数水质测量仪(WTW,Multi 3430,德国)用于水质指标检测。紫外分光光度计(型号UV2000,上海尤尼柯,中国)用于水质检测。
1.2 试验设计
取18个10 L聚乙烯透明水桶,有效体积为7 L,将18个桶编为6组,分别为A组、B组、C组、D组、E组、F组,每组3个平行,组内编号为1、2、3。试验用上海海洋大学养殖技术与工程实验室已经培养好的生物絮团,将生物絮团沉淀5 min,取上清液42 L,平均倒入C组、F组,每组体积为7 L,每桶TSS≈150 mg/L。将原生物絮团重新混匀沉淀5 min后,取沉淀,使用曝气3 d以上的自来水将其稀释,使其TSS≈150 mg/L,平均倒入A组、D组,每组体积为7 L。将原生物絮团重新混匀后,直接取用生物絮团,加入曝气3 d以上的自来水将其稀释,使其TSS≈150 mg/L,再将混匀后的生物絮团平均倒入B组、E组,每组体积为7 L。

表1 各个试验组设置条件Tab.1 Set conditions for each experimental groups
上述各组初始碱度维持在300.00 mg/L左右,两台罗茨鼓风机(功率750 W)为上述18个桶进行曝气,溶氧保持最初取样时一致。对A、B、C、D、E、F组絮团进行总氨氮快速转化试验,即A、B、C三组分别以初始质量浓度为10 mg/L氯化铵作为氮源,以DOC/TN(溶解性有机碳/总氮)=15加入葡萄糖作为碳源;D、E、F三组分别以初始质量浓度为10 mg/L氯化铵作为氮源。当每组的亚硝酸盐氮含量下降至约为0 mg/L时,则试验结束。
2 试验指标与检测方法
2.1 水质指标测定
2.2 絮团指标测定
TSS采用称重法进行测定[18];絮团粗蛋白和碳氮比(C/N)使用元素分析仪ELMENTAR VARIO MAX检测氮元素含量,再换算成蛋白质平均系数6.25[19]。粗灰分测定采用GB/T 6438—2007[20]的方法;粗脂肪采用氯仿-甲醇法[21],脂肪酸测定采用甲酯化法[22],水解氨基酸采用GB/T 5009.124—2003[23]前处理,上机测定(日立,L-8800,氨基酸分析仪)。
2.3 氨氮去除效率和总氨氮去除速率计算公式

R=100%×(C1-C2)/C1
(1)
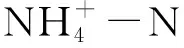

S=(C1-C2)/(T×t)
(2)
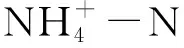
2.4数据分析
试验数据采用Excel软件进行结果统计,用Origin、Adobe Illustrator软件进行相关图表的绘制。试验数值用平均值±标准差(Mean±SD)形式表示,采用SPSS 22.0统计软件对数据进ANOVA单因素方差分析,P<0.05为差异性显著。
3 结果
3.1 生物絮团组分指标
试验结束时,如表2所示加碳源组浮性絮团粗蛋白含量最高为(30.66±0.01)%,不加碳源组沉性絮团粗灰分含量最高为(45.99±1.51)%,加碳源组混合絮团粗脂肪含量最高为(4.46±0.22)%;加碳源组粗蛋白含量高于不加碳源组且粗灰分含量低于不加碳源组,而C/N低于不加碳源组。脂肪酸测定结果如表3所示,两种条件下浮性絮团EPA含量最高。

表2 试验结束时各组生物絮团营养指标含量Tab.2 The contents of bioflocs nutrient composition at the end of experiment
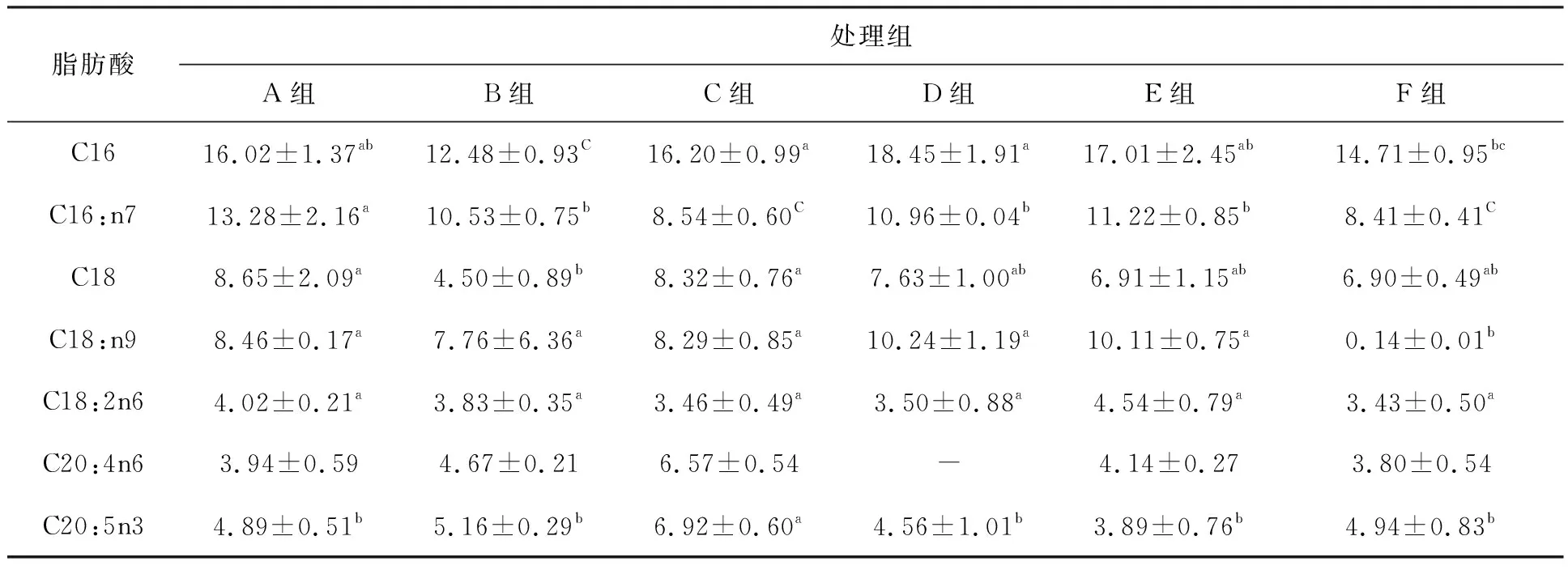
表3 试验结束时各组生物絮团的脂肪酸含量Tab.3 The contents of bioflocs fatty acids at the end of experiment
3.2 生物絮团的水解氨基酸含量
如表4所示,加碳源组A、B、C中,甘氨酸、半胱氨酸、蛋氨酸、组氨酸、天冬氨酸组内差异显著(P<0.05),不加碳源组中天冬氨酸、苏氨酸、丝氨酸、蛋氨酸、脯氨酸组内差异均显著(P<0.05)。加碳源组中,浮性絮团氨基酸含量是除了甘氨酸以外为组内最高;不加碳源组中,浮性絮团氨基酸含量是除了蛋氨酸以外为组内最低。加碳源所有组中氨基酸含量高于不加碳源组。
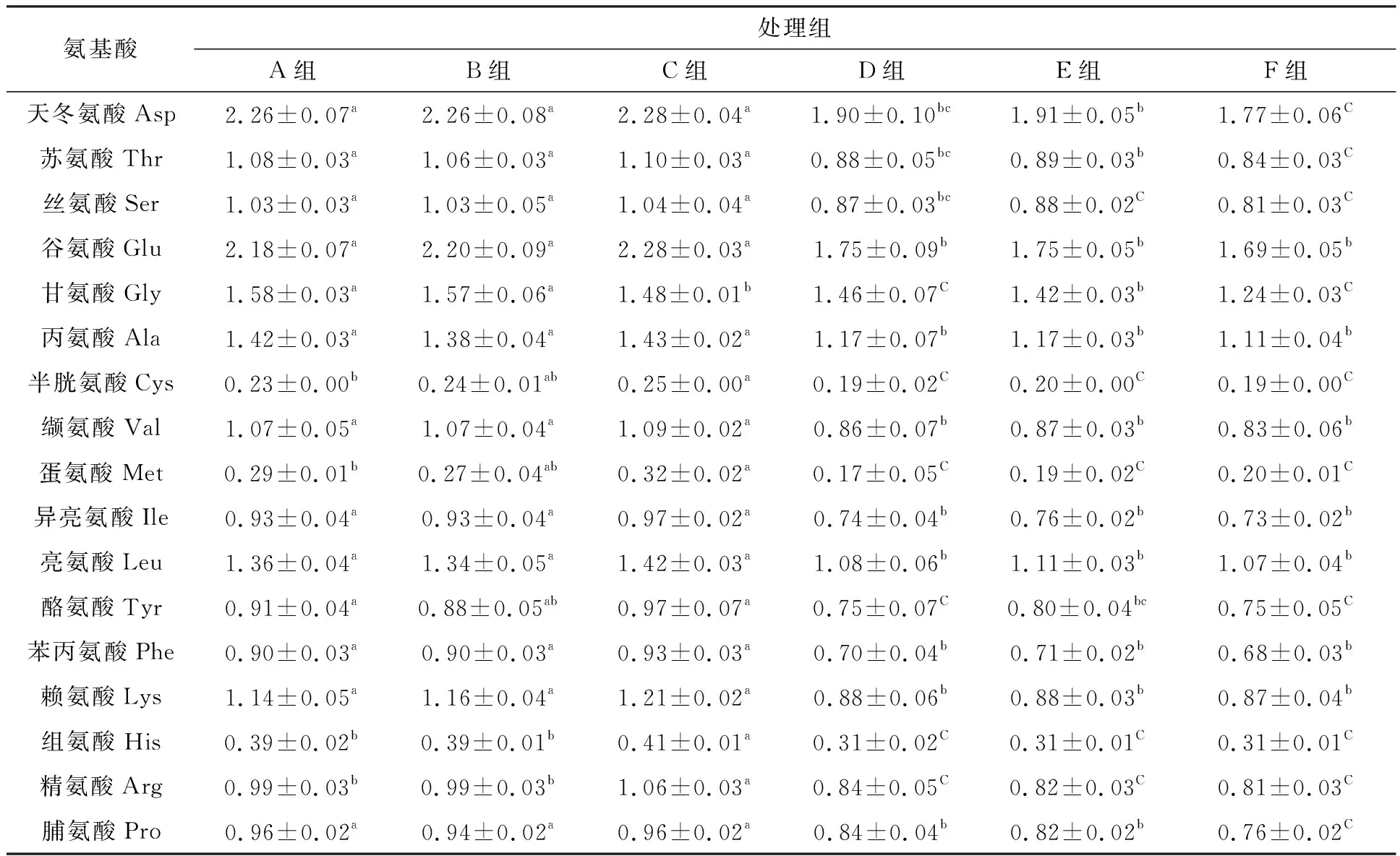
表4 试验结束时17种氨基酸含量Tab.4 The contents of 17 kinds of amino acids at the end of experiment
3.3 试验期间的水质变化
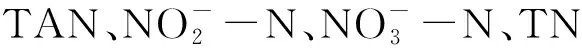
表5 试验运行期间各组主要水质指标的平均值以及标准差Tab.5 The average and standard deviation of each primary water quality index in all treatment groups during the experiment
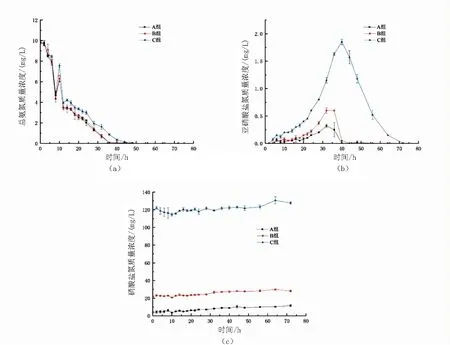
图1 10mg/L总氨氮快速转化试验加碳源组中A组、B组、C组的三态氮变化图Fig.1 Dynamics of total ammonium-N(a),nitrite-N(b)and nitrate-N(c) in A,B and C duringthe adding carbon source experimental period
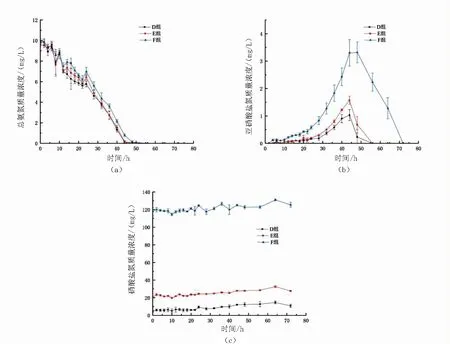
图3 10mg/L总氨氮快速转化试验不加碳源组中D组、E组、F组的三态氮变化图Fig.3 Dynamics of total ammonium-N(a),nitrite-N(b)and nitrate-N(c) in D,E andF during the no adding carbon source experimental period
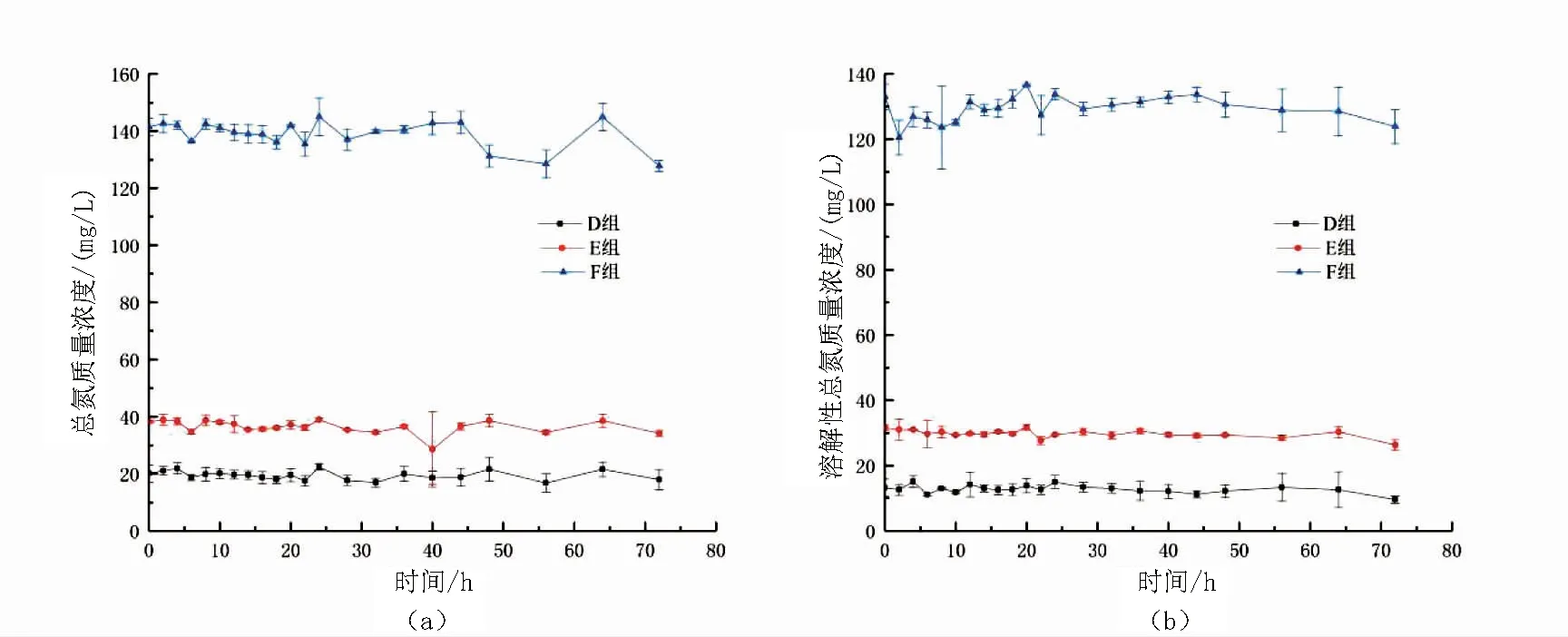
图4 10mg/L总氨氮快速转化试验不加碳源组中D组、E组、F组的总氮与溶解性总氮变化图Fig.4 Dynamics of TN(a) and DTN(b) in D,E and F during the no adding carbon source experimental period
3.4 试验前后TSS含量变化
如图5和图6所示,试验结束时,两种条件下TSS质量浓度都上升且加碳源组增加量高于不加碳源组。加碳源组中,A组和B组前后TSS质量浓度差异显著(P<0.05),C组前后TSS质量浓度差异不显著(P>0.05);不加碳源组D组和F组前后TSS质量浓度差异显著(P<0.05),B组TSS质量浓度前后差异不显著(P>0.05)。
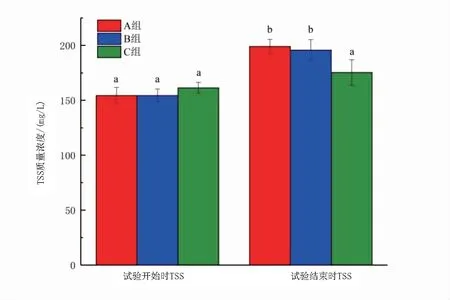
图5 加碳源组试验开始时、结束时各组TSS变化Fig 5 Dynamics of total suspended solids from beginning to end of the adding carbon source experiment
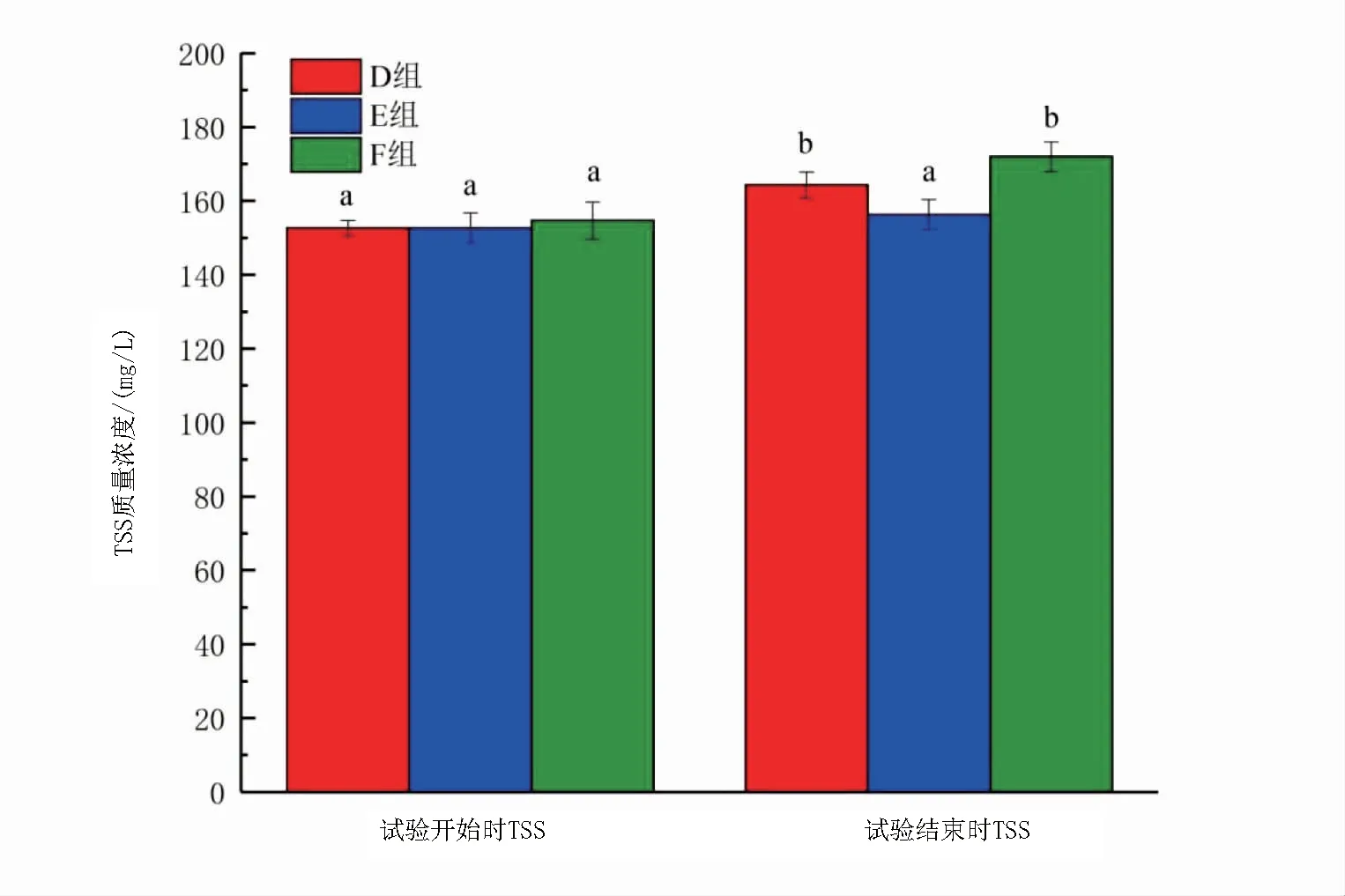
图6 不加碳源组试验开始时、结束时各组TSS的变化Fig 6 Dynamics of total suspended solids from beginning to end of the no adding carbon source experiment
4 讨论
4.1 沉性与浮性生物絮团对生物絮团系统营养成分比较
本试验加碳源组中粗蛋白含量显著高于不加碳源组粗蛋白含量,有研究表明[24-27]添加碳源有利异养微生物的生长以及提高生物絮团系统中的生物多样性,而异养细菌生长速率为自养细菌的10倍,提供了更多的菌体蛋白。所以加碳源组粗蛋白含量高于不加碳源组,与研究结论相符。本研究中加碳源组与不加碳源组中浮性絮团粗蛋白含量最高,可能与生物絮团中的胞外聚合物(Extracellular Polymeric Substances,EPS)的含量有关。有研究表明[28-33]EPS中蛋白质是其主要成分,污泥的絮凝能力随着总EPS含量的增加而降低,与本研究结果相符。试验前后粗灰分占比高达40%左右,吴盛凯等[34]用生物絮团养殖罗非鱼,研究结果表明随着养殖进程的推进,生物絮团的粗灰分占比不断增加,最后占比为30%左右。本研究使用的生物絮团来自上海海洋大学循环水养殖技术与工程实验室,生物絮团硝化系统建立到本试验使用距离有半年,其间一直添加碳源氮源保证其硝化进程的运行,本试验粗灰分含量在40%左右,可能是原絮团培养周期长,导致粗灰分占比的增加。
试验前后粗脂肪的含量变化不大,在4%左右。Kuhn等[35]通过养殖试验表明生物絮凝物之间可能存在不确定的营养不一致。这一结果与Ekasari等[36]的研究结果一致,其研究表明即使粒径较小的絮团,粗脂肪含量也高于粒径较大的絮团。也有一些研究表明生物絮团的微生物群落的结构不同,取样时间的不同,都会引起营养指标的差异[37-40]。B组、C组与E组、F组C16差异显著(P<0.05),A组与D组仅在C16:n7差异显著(P<0.05),除了E组,其余5组多不饱和脂肪酸含量都增加,且加碳源组比不加碳源组含量高,与Elrazak等[41]和Qi等[42]研究不相同,葡萄糖可能是影响细菌生长和EPA生产率的最重要因素,添加葡萄糖会导致EPA含量下降。但也有研究表明脂肪酸含量与生物量以及种群丰度有关[37]。本研究中加碳源组EPA含量高于不加碳源组含量,可能是生物量以及丰度高于不加碳源组。两种条件下,浮性絮团的EPA含量高于组内其余两组,可能是浮性絮团有更高的亚硝酸盐积累,有研究表明pH、温度或外界压力等其他因素会引起细胞膜的变化且细胞膜流动性越强,EPA含量越高[41,43-47]。本研究中更高的亚硝酸盐积累可能导致浮性絮团中细菌的细胞膜流动性增强,所以两种条件下浮性絮团EPA含量为同组内最高。
本试验加碳源组中,氨基酸含量高于不加碳源组,与金毅等[48]、Schneider等[49]研究结果一致,即生物絮团中更高的碳源输入以及更高的生物量,有利于营养物质的增加。加碳源组中浮性絮团氨基酸含量除了甘氨酸以外高于其余两组,与张扬等[50]和Rontani等[51]研究相似,即浮性颗粒可能含有更多的氨基酸等营养物质。不加碳源组中,浮性絮团氨基酸含量除了蛋氨酸以外低于其余两组,可能是因为水体拥有更高的亚硝酸盐氮负荷,在不加碳源的条件下,生物絮团进行硝化作用消耗了更多的自身营养物质,与李莉等[52]研究结果相似。
4.2 沉性絮团与浮性絮团对生物絮团系统氮素转化比较

浮性絮团的增多还有一种可能性是生物絮团发生反絮凝,导致絮团密度体积粒径变小,沉浮性变差,浮性絮团增加[9-12]。叶继良等[57]以转速作为变量,通过水体剪切力切割生物絮团,发现高转速组的絮团紧实密度高,低转速组的絮团松散密度低,但通过氨氮快速转化试验发现二者对氨氮有良好的去除速率且各组之间差异不显著。Souza等[58]发现生物膜的大小以及总悬浮固体的数量不会影响BFT系统中的硝化过程,但会造成硝化活性延迟或降低。所以本试验浮性絮团的产生原因可能不是发生了反絮凝。
5 结论
浮性絮团与沉性絮团粗蛋白差异不显著,加碳源组粗蛋白含量高于不加碳源组;沉性絮团比浮性絮团拥有更高的粗灰分含量,不加碳源组粗灰分含量整体高于加碳源组;加碳源后混合絮团粗脂肪含量更高,不加碳源组中沉性絮团粗脂肪含量更高;加碳源组与不加碳源组中,浮性絮团具有更高的EPA含量;加碳源组中浮性絮团氨基酸含量除甘氨酸以外高于沉性絮团,不加碳源组中,浮性絮团氨基酸含量除了蛋氨酸以外低于沉性絮团;浮性絮团比沉性絮团具有更高的亚硝酸盐峰值,不加碳源组氨氮去除效率高于加碳源组。应进一步探究沉性絮团与浮性絮团在实际生产中对养殖对象产生的影响,为生物絮团量的调控提供更优解的方案。
□
