工厂化养殖红罗非鱼摄食耗氧规律
2022-07-07张瑜霏张宇雷
张瑜霏,张宇雷
(1上海海洋大学水产与生命学院,上海 201306;2 农业农村部渔业装备与工程技术重点实验室,中国水产科学研究院渔业机械仪器研究所,上海 200092)
溶氧是溶解在水中的分子态氧,是鱼类赖以生存的必要条件之一。以陆基工厂化为主的养殖生产方式环境相对封闭[1],鱼类呼吸代谢所消耗的溶氧主要依靠向水中通入空气或纯氧来补充平衡[2-3]。研究表明,鱼类耗氧会受到自身和环境因素的影响而变化,导致鱼池溶氧产生波动[4-6]。乔德亮等[7]通过测量白斑狗鱼(Esoxlucius)耗氧率发现了白斑狗鱼属于“夜伏昼出”的鱼类,日均耗氧显著高于夜均耗氧,耗氧量随体质量的增加而升高,随温度的上升而增加。戴庆年等[8]发现青石斑鱼(Epinephelusawoara)昼夜耗氧差异较大,属于“昼伏夜出”的鱼类,主要在夜间取食。宋协法等[9]发现在20℃、25℃、30℃下斑石鲷(Oplegnathuspunctatus)的耗氧率昼夜差异不明显,耗氧率在投饲后1~3 h达到峰值,随后呈现逐渐下降的趋势。王资生等[10]发现盐度在26.76时,半滑舌鳎(Cynoglossussemilaevis)的耗氧率最低,盐度在20.08时,半滑舌鳎的耗氧率最高,盐度对半滑舌鳎耗氧率有极显著影响。汤洪芬等[11]研究表明,鲇鱼(Silurusasotus)幼鱼采用降低代谢水平的方式来适应饥饿环境,饥饿时间越久代谢率越低。强笑野等[12]研究表明,罗非鱼应激状态下耗氧率较试验前有明显的上升,其差异随体质量的增加而减小。总体而言,鱼类自身的饥饿、摄食、应激以及外界温度、盐度、昼夜交替的变化都会对鱼的耗氧造成显著影响。其中,鱼类摄食后耗氧率的变化相对更为明显和重要, Merino等[13]发现加利福尼亚比目鱼(ParalichthysCalifornicus)的摄食耗氧率随个体的增大而减少,3.2~14.2 g规格的幼鱼在喂食期间耗氧量达到峰值,但这一影响不会超过24 h。 Royer等[14]在研究虹鳟(Oncorhynchusmykiss)精准养殖方法指出虹鳟鱼摄食后耗氧量是平时的2倍以上,针对这一短期的耗氧变化进行预测,可以实现具有成本效益的供氧自动控制。
为了提高工厂化养殖效率,降低养殖成本,减少养殖风险,本研究对红罗非鱼在不同温度和投饲率条件下的摄食耗氧量及其恢复情况进行了研究,旨在进一步了解和掌握鱼类耗氧规律,为水产养殖溶氧精准控制提供理论依据。
1 材料与方法
1.1 材料
本试验在中国水产科学研究院渔业机械仪器研究所如东中试基地进行,试验系统主要由养殖池、竖流沉淀器、泵池、移动床生物滤器、紫外杀菌器、自动投饲机、自动增氧装置、pH调控装置以及温控设备组成,系统工艺如图1所示。养殖池为直径1.5 m的圆池,水体量1.2 m3。自动投饲机(自制)投饲精度±1 g。自动增氧装置(自制)控制精度±0.2 mg/L。pH调控装置(自制)控制精度±0.2。温控设备购于贝尔美智能科技有限公司,控温精度±0.2℃。水温、溶氧和pH传感器均安装在鱼池内。为避免大气交换对试验参数造成影响,采用硅胶垫覆盖鱼池。试验鱼为红罗非鱼,养殖密度为30 kg/m3,规格为50±2 g,总尾数700尾。
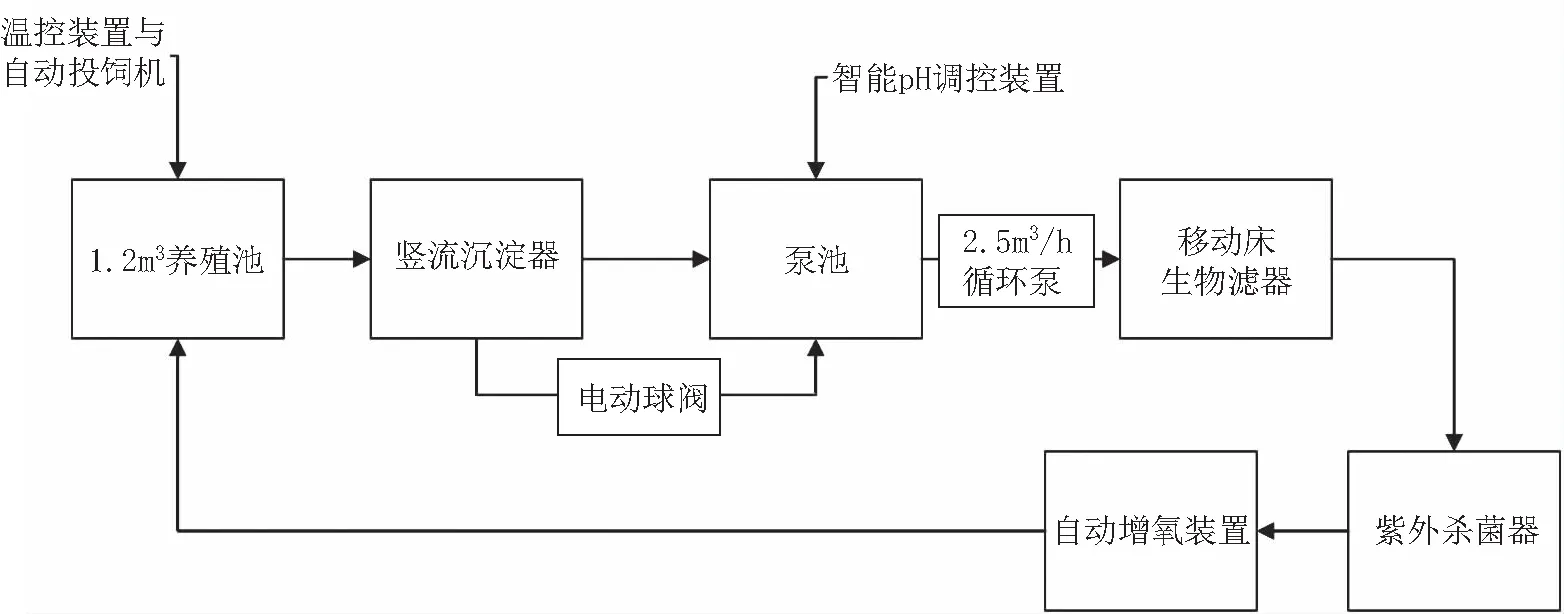
图1 循环水养殖系统Fig.1 Recirculating aquaculture system
1.2 方法
该试验使用1套循环水系统,1个养殖池,试验连续39 d,由于红罗非鱼生长比较缓慢,本研究忽略罗非鱼体质量对耗氧量的影响。为避免养殖对象在试验过程中产生应激,影响数据准确性,本试验采用静水法(临时关闭系统循环),通过记录养殖池内溶氧变化计算得到罗非鱼耗氧量。在关闭系统循环前,控制溶氧质量浓度(7.5±0.2)mg/L、pH(7.2±0.2)。试验中出现死鱼时根据死鱼数量及时补充至初始尾数。
试验设置26℃、29℃、32℃共3个温度处理组和0.4%、0.8%、1.2%、1.6%、2.0%共5个投饲率的处理组和不投饲的对照组。将不同的温度和投饲率两两组合,测量投饲时和投饲后一段时间的耗氧量,试验共设30个处理组,每个处理组设置3个重复,研究不同温度和投饲率组合对鱼类摄食耗氧量和摄食后2 h耗氧恢复情况的影响。
每次试验时间为上午9:00,每天只进行一次试验以确保鱼消化完全。当溶氧从7.5 mg/L降至4.5 mg/L时停止记录,采样频率为1 min,计算摄食耗氧量。继续开启系统循环,将溶氧重新调控至7.5 mg/L,2 h后关闭系统,溶氧从7.5 mg/L降至4.5 mg/L时停止记录,采样频率为1 min,计算摄食后2 h的耗氧量。每组试验完成后将溶氧探头进行校准。试验前,提前3 d将水温调整至试验水温,正常投饲使罗非鱼适应试验水温,待罗非鱼游动、摄食正常后用于试验。
1.3 数据处理
摄食耗氧量:
Mo=(A1-A2) ×V/(M×T)
(1)
式中:Mo—摄食耗氧量(mg/ind.h),A1—试验前溶氧(mg/L),A2—试验后溶氧(mg/L),V—鱼池水体积(L),M—试验鱼尾数(ind),T—试验前后时间差值(h)。
以上所得数据导入Microsoft Excel进行整理和作图,并通过SPSS26.0软件进行描述性统计、双因素方差分析、多重比较(Duncan法),显著性水平为0.05。统计值采用平均值±标准差(Mean±SD)表示。
2 结果与分析
2.1 温度对罗非鱼摄食前耗氧量的影响
分别在26℃、29℃、32℃3个温度组下对红罗非鱼摄食前耗氧量进行测量,测得3组耗氧量的平均值:16.842±0.425、20.218±0.250、22.606±0.799 mg/ind.h。结果表明不同温度组耗氧量差异极显著(P<0.001)。如图2所示,红罗非鱼摄食前耗氧量随水温的升高而增加,32℃组显著高于26℃组和29℃组,温度和摄食前耗氧量具有线性关系,可用线性方程y=0.960 7x-7.970 7(n=3,P<0.001,R2=0.990 3)表示。

图2 不同温度下的摄食前耗氧量Fig.2 Pre-feeding oxygen consumption at different temperatures
鱼类属于变温动物,水温的变化会直接影响鱼类的新陈代谢,在合适温度范围内,温度越高,鱼类的生理代谢水平也越高,耗氧水平也随之增强,当超过一定温度后,组织代谢会进入麻痹甚至停止的状态,耗氧水平也随之降低。杨斯琪等[15]运用封闭流水式试验方法发现,大口黑鲈幼鱼(Micropterussalmoides)的耗氧量随温度的升高而增加,29℃时到达顶峰,33℃开始下降。李利等[16]通过控制不同的温度水平测量吉富罗非鱼(GIFT)的呼吸情况,证明25℃以上时罗非鱼呼吸频率变化起伏较大,耗氧量与温度呈线性关系(R2=0.954 9),这与本研究中的现象一致。26℃、29℃、32℃这3个温度组下,耗氧量随水温升高而增加,属于红罗非可以适应的水温,耗氧水平呈现线性关系。
2.2 温度和投饲率对摄食耗氧量和摄食2 h耗氧量的影响
双因素方差分析温度和投饲率对罗非鱼摄食耗氧量和摄食后2 h耗氧量的影响见表1。温度和投饲率对罗非鱼摄食耗氧量及摄食后2 h耗氧量有交互作用,且温度和投饲率对罗非鱼摄食耗氧量及摄食后2 h耗氧量的影响有极显著性差异(P<0.001)。
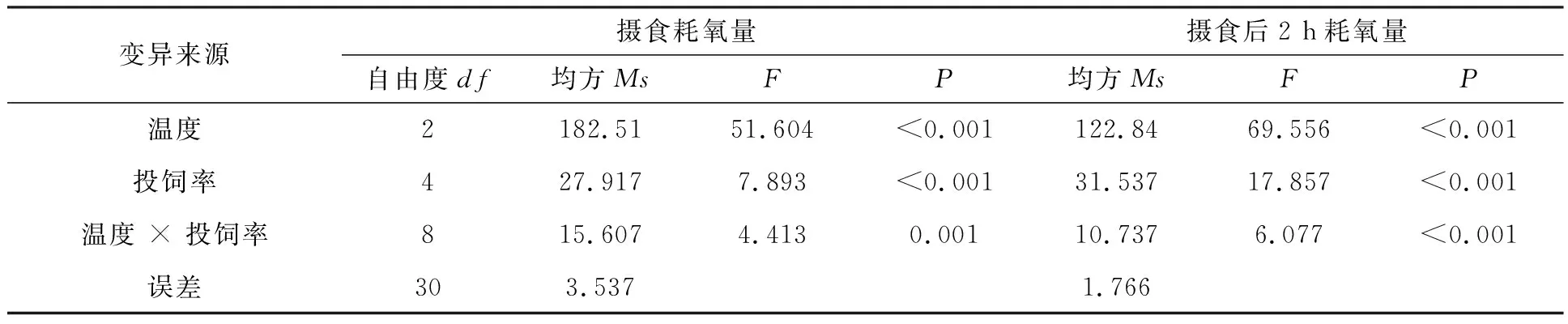
表1 双因素方差分析温度和投饲率对红罗非鱼摄食耗氧量和摄食2h耗氧量的影响Tab.1 Two-factor analysis of variance on the effect of temperature and feeding rate on oxygen consumption of red tilapiaand 2 hours after feeding
温度和投饲率对罗非鱼摄食耗氧量及摄食后2 h耗氧量有交互作用,因为温度是影响鱼类食欲和呼吸的主要影响因素之一,在合适的水温范围内,温度越高鱼体的生理代谢水平就越高,鱼类的摄食耗氧量会随着温度的升高而增加,在摄食后其耗氧量的增幅就越高[17-19]。陈松波[20]测量了不同温度下鲤鱼(Cyprinidae)的日摄食率,发现鲤鱼成鱼在低温状态下,摄食率较小,摄食率不随温度的升高而改变。幼鱼则随着温度的升高呈现逐步上升的趋势,在28℃时达到顶峰,鲤鱼成鱼和幼鱼皆在30℃时摄食率发生骤降。本研究温度设置在26~32℃之间,耗氧量随着温度的升高,耗氧量显著升高,在投饲率增加的情况下,摄食耗氧量也呈现上升的趋势,说明26~32℃在罗非鱼的适温范围内,温度和投饲率的变化都能对摄食耗氧量产生显著影响。温度的升高加快了鱼类的摄食代谢,提升了鱼类的摄食欲望,从而产生鱼类摄食耗氧量随温度的升高而增大的趋势。
图3显示不同温度和投饲率下红罗非鱼摄食耗氧量和摄食2 h耗氧量的测量结果,红罗非鱼摄食后2 h耗氧量显著低于摄食耗氧量,说明在不同温度和投饲率下,红罗非鱼在摄食完成2 h后耗氧量均恢复了一定水平。在26℃条件下,摄食耗氧量随投饲率的增加而上升,到1.6%投饲率时达到顶峰,随后发生下降,2 h后耗氧量呈现同样趋势。在29℃条件下,摄食耗氧量与26℃时趋势相同,2 h耗氧量随投饲量呈现逐步上升趋势未出现下降现象。32℃条件下,耗氧量和投饲率的关系较不稳定,耗氧量呈现先高再降接着逐渐上升的趋势,0.4%投饲率与1.2%和1.6%差异均不显著(P>0.05),2 h后耗氧量也比较异常未呈现随投饲率上升的趋势。4%投饲率处理下,红罗非鱼摄食耗氧量均呈现随温度升高而上升的趋势,各温度组之间差异极显著(P<0.05),2 h后耗氧量呈现同样趋势。随着投饲量的增加,各温度间的差异逐渐减少,在投饲率1.2%处理下,摄食耗氧量受温度的影响不显著(P>0.05),1.6%和2%也未出现耗氧量随温度影响呈完全显著的现象,2 h后耗氧量同样表现不规律。

图3 不同温度和投饲率下红罗非鱼摄食耗氧量 和摄食2h耗氧量Fig.3 Red tilapia postprandial oxygen consumption and2 h postprandial oxygen consumption under differenttemperatures and feeding rates
鱼类的饥饿程度决定其代谢强度,当鱼类饥饿状态时会出现和低温类似的代谢状态,从而减少能量支出,在出现大量食物时鱼类又会处于补偿生长期拼命地摄食[21-23]。在以往耗氧量测量中,学者们试验前通常将试验鱼饥饿3 d,此时鱼类耗氧量将低于正常状态,本试验在正常运行的循环水系统中测量耗氧量,更接近生产时的鱼类耗氧水平。近期有研究报道采用荧光传感器测量溶氧相对比Winker法误差更小[24],考虑到Winker法步骤较为烦琐,试验采用荧光溶氧传感器测量鱼池溶氧。本研究中的试验鱼,一天只进行一次投饲以保证每次投饲试验鱼都能将饲料吃完,鱼类在投饲前皆保持着饥饿状态,当投饲发生时,鱼群抢食激烈,耗氧量较平时上升了1.5~2倍,这一现象在De la Gándara等[25]的报道中也相同体现,黄尾鰤(SeriolaDumerili)在1天2次的投饲频率下,耗氧量上升显著,2 h内较投饲前耗氧量上升近2倍。近期蒲德永等[26]对鲈鲤(Percocyprispingipingi)的在不同温度下的摄食耗氧量进行了研究,其发现在15℃组中,1%与2%的摄食后耗氧量接近,而25℃组中摄食耗氧量随投饲率的增加而表现增大趋势,这与本研究的试验结果基本一致。雷思佳[27]测量了台湾红罗非鱼的耗氧率,其52.41 g体质量组的耗氧量低于本研究中的摄食耗氧量。金一春等[28]测量的“GTC”罗非鱼 287 .40~391 .90 g组耗氧量接近于本研究中红罗非鱼摄食后的耗氧量,红罗非鱼摄食后可以暂时达到大规格鱼的水平。本研究中有部分试验组摄食耗氧量随投饲率的增加而减小,其原因是投饲率超过了罗非鱼最适的摄食温度所能够产生的最大摄食率,鱼在摄食一段时间后发生了少量呕吐现象。唐道君等[29]发现黑鱾(Girellamelanichthys)在32℃时,摄食量显著低于其他温度组,摄食后的耗氧率也呈现不规律的状态。在高密度养殖环境下,溶氧难控制,主要是鱼类摄食后的特殊动力作用造成的,因此研究鱼类摄食耗氧规律对高密度养殖环境下溶氧的稳定具有重大意义。
鱼类在摄食完成后耗氧量先呈现急剧上升的趋势,到达顶峰后逐渐开始下降,直至恢复投饲前的水平。邢道超等[30]的报道中指出云龙石斑鱼(Epinephelusgroupers)幼鱼的特殊动力作用主要是由蛋白质的代谢作用引起的。在蒲德永等[26]的报道中,鲈鲤的耗氧量在摄食后2~8 h达到顶峰在30 h后耗氧量恢复至投饲前水平,其投饲率越高耗氧量恢复的速度越慢,这与本研究中的研究结果一致,本研究中采集的投饲后2 h的耗氧量,投饲率较少的试验组摄食耗氧恢复率已经接近投饲前的耗氧量,而较高的试验组2 h后的耗氧量与投饲前的耗氧量还存在较大的距离。这一现象说明投饲率越高,鱼类消化食物的时间越久,耗氧量恢复至投饲前水平所需要的时间越长。
3 结论
温度变化和投饲是造成循环水系统鱼池溶氧波动的主要诱因,鱼类摄食前耗氧量与温度呈线性关系而投饲后则不具备线性关系,但耗氧量仍保留随温度升高和增加的特性。鱼池溶氧呈现3种状态:鱼类摄食前耗氧状态、鱼类摄食状态、鱼类恢复状态。这意味着高密度养殖环境下,纯氧的输出流量无法只停留在单一的幅度,而是随着鱼类摄食的状态而随之变化。鉴于此,下一步的溶氧智能调控装备的研发重点是解决温度变化以及投饲后带来的溶氧扰动,应用鲁棒性较高的智能控制算法通过温度、溶氧、投饲量等参数的建模和反馈实现主动控制,提前预知温度变化和投饲参数,及时做出控制响应。
□
