纳豆对菌群失调小鼠肠道微生物代谢多样性的影响
2022-07-07郭雪莹武天元吴晨悦张树明
郭雪莹,曹 阳,武天元,陈 柱,王 博,吴晨悦,张树明
(1黑龙江省中医药科学院·黑龙江 哈尔滨 150036;2黑龙江中医药大学药学院·黑龙江 哈尔滨 150040;3荆门市第一人民医院·湖北 荆门 448000)
人体的肠道中寄生着数以亿计的微生物,不同菌群的微生物按照一定比例构成了人体健康的菌群环境,在维护身体健康方面发挥着复杂的、广泛的、多维度的作用,但同时,肠道菌群的结构也受多种因素的影响,比如疾病、饮食结构、服用药物等原因都会使其发生变化。抗生素是感染性疾病的常用药及特效药,其使用范围广、频率高,但在使用中常出现未经医嘱的滥用或过度应用,给身体带来了诸多不良影响,比如菌群失调所造成的免疫力降低或免疫系统过度活跃、肠炎、肥胖、甚至是糖尿病、癌症等疾病[1-3]。因此,抗生素治疗后健康肠道菌群结构的恢复,对促进患者恢复健康、避免诱发其他疾病显得尤为重要。
纳豆是由枯草芽孢杆菌发酵大豆制成,富含丰富的营养物质及活性成分[5-6],具有溶栓、醒酒、抗癌、抗氧化等多种功效[7-8]。目前,枯草芽孢杆菌对肠道菌群的调节作用已有报道[9],但是纳豆作为一种枯草芽孢杆菌与大豆共同发酵的食品,是否具有更好的效果,还有待深入研究。Biolog-ECO板通过微生物对碳源的利用能力来表征微生物群落代谢多样性和功能特征,目前这项技术在土壤微生物群落的研究中应用比较广泛[10]。Biolog微生物自动分析系统中包含糖、醇、酸、酯、胺和大分子聚合物等6大类碳源,并根据微生物对其中每一种碳源的利用强度,判断某些代谢途径中关建酶的活性大小,以此代表某代谢路径及代谢能力[11-14]。所以,本研究中采用biolog-ECO板检测纳豆对抗生素诱导肠道菌群失调模型小鼠的肠道微生态恢复的影响,以明确纳豆在此过程中的促进作用。
1 材料
1.1 实验动物 选取30日龄SPF级健康ICR小鼠40只,雌雄各半,体质量18~20 g,由哈尔滨医科大学实验动物学部提供,许可证号SCXK(黑)2013-001。小鼠饲养在黑龙江省中医药科学院动物室屏障动物实验设施中。
1.2 药物和试剂 纳豆:黑龙江省中医药科学院制剂室提供,以大豆作为发酵基质,采用实验室分离菌种进行纯种发酵而成,匀浆机制成细腻的匀浆液,浓度为325 g/L,-20 ℃冰箱中保存备用。枯草芽孢杆菌活菌胶囊:北京紫竹药业有限公司,批号:1801068,0.25 g/粒(含活菌数不低于2.5×107CFU),取1粒,无菌生理盐水稀释到14.625 g/L,临用时配制。头孢曲松钠粉针剂:上海上药新亚药业有限公司,批号:1703111,无菌生理盐水配成浓度为6.5 g/L,临用时配制。
1.3 主要仪器 Biolog微生物自动分析仪:Biolog公司;生物安全柜:北京东联哈尔仪器制造有限公司。
2 实验方法
2.1 动物分组、造模及给药 40只小鼠适应性饲养3 d后,按体质量随机分为4组,即正常组、模型组、阳性组、纳豆组,每组10只,雌雄各半,分笼饲养。正常组小鼠每只每次灌胃给予等体积(0.2 mL/10 g)无菌水,其余各组灌胃给予头孢曲松钠溶液(260 mg/kg),2次/日,连续5 d。造模成功后,正常组、模型组给予等量无菌水;阳性组给予枯草芽孢杆菌药液,292.5 mg/(kg·d);纳豆组给予纳豆匀浆液6.5 g/(kg·d);所有药物均以成人用量换算为小鼠临床等效剂量。每天灌胃给药1 次,连续给药14 d。实验期间每天观察并记录各组小鼠的饮食、饮水、排便、毛色、精神、活动等一般状况。
2.2 观察指标测定
2.2.1 小鼠粪便的提取 无菌操作台紫外灯照射30 min灭菌,将小鼠颈椎脱臼处死后立即放于超净工作台上,无菌采集各组小鼠空肠到回肠段内容物,样品混合收集于无菌离心管中,立即用液氮迅速降温冷冻,回到实验室后,转移到-80 ℃冰箱中保存备用。
2.2.2 Biolog-ECO分析 Biolog-ECO生态板中含有31种碳源,编号同参考文献[15]。无菌状态下将1 g肠道内容物放入15 mL无菌管中,加入10 mL生理盐水,涡旋振荡15 min制成混悬液,500 r/min离心10 min后收集上清液,即为肠道菌液。取肠道菌液,倍比稀释,制备成浓度为10-3g/mL的混悬液。用8通移液器将稀释后的菌液加入ECO培养板中,每孔150μL。完成后将培养板放入有氧培养箱中进行培养,温度设定为37 ℃,在培养的第4、12、24 h及之后的每24 h用Biolog读数系统读取数据。
2.2.3 数据处理 (1)小鼠肠道微生物的代谢活性用每孔颜色平均变化率(Average well color development,AWCD)来描述,计算公式参照文献[16],AWCD=∑ (Ci-R)/31。式中,Ci为各碳源孔在590 nm下的吸光度值与750 nm下吸光度值的差值,R为ECO板对照孔A1的吸光度值,Biolog-ECO板的碳源数目为31。(2)计算各组样本微生物多样性的Shannon指数(H’)、Shannon均匀度(E)、Simpson指数(1/D)和Mclntosh指数(U),所有数据采用培养72 h时数据。计算方法参照文献[17]。
Shannon指数:H’=-∑(Piln Pi).式中,Pi=(Ci-R)/∑(Ci-R),表示有碳源的孔与对照孔A1的光密度值之差与整板总差的比值。
Shannon均匀度:E=H’/ln S.式中,S表示碳源代谢孔的数目(Ci-R>0,则表示该孔碳源被利用,该孔即为反应孔)。
Simpson指数(1/D):D=∑ni(ni-1)/N(N-1)。式中,ni是第i孔的相对吸光度值(Ci-R),N是相对吸光度值的总和(∑(Ci-R)),同时,为防止出现负值,需将数据扩大1 000倍.
2.3 统计学方法 AWCD、Shannon指数(H’)、Shannon均匀度(E)、Simpson指数(1/D)和Mclntosh指数(U)用Microsoft Excel 2010计算,SPSS软件做聚类分析和主成分分析及t检验。
3 结果
3.1 纳豆对小鼠肠道微生物AWCD的影响 见图1。
由图1可知,4组小鼠肠道微生物AWCD值在培养168 h内随时间的延长而增加。4~72 h,各组AWCD值呈不同速率的增加,纳豆组增加最为缓慢,72 h后各组数值变化趋于稳定。各组之间AWCD值比较可见,培养12 h、24 h时,模型组>正常组>阳性组>纳豆组,培养48 h及以后,模型组>阳性组>正常组>纳豆组。培养初期菌群的生长还处于不稳定的增长状态,当培养到某个时间时,菌群中菌的数量及生长速度达到某种平衡状态,所以在48 h前后,各组间AWCD值排序出现变化。综合考虑,选取72 h时间点数据进行后续分析。
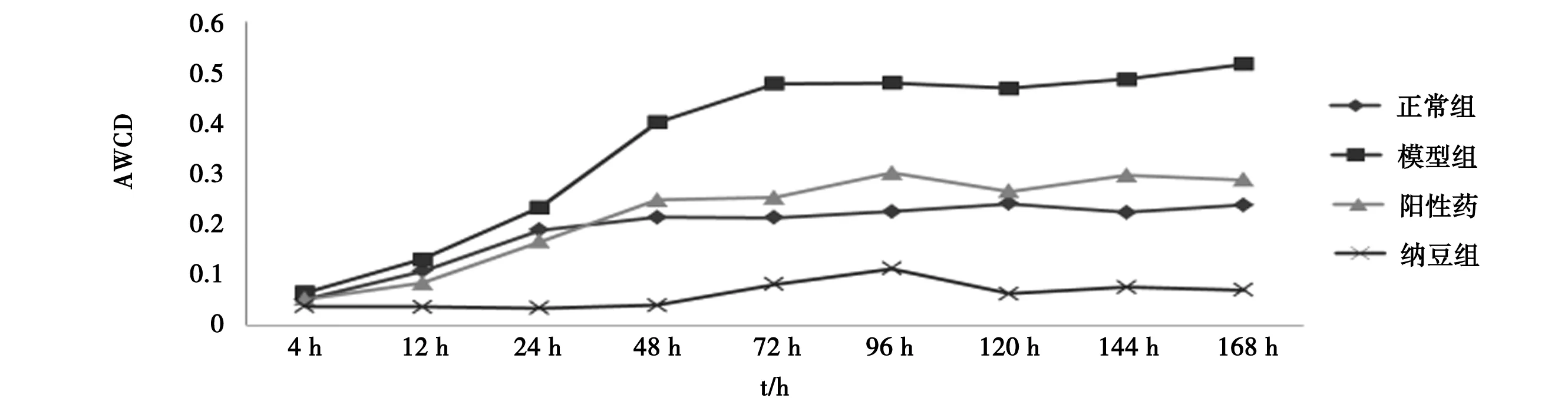
图1 各组小鼠各时段肠道微生物AWCD变化
3.2 纳豆对小鼠肠道微生物多样性的影响 见表1。
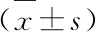
表1 各组小鼠肠道微生物的多样性和均匀度指数比较
3.3 各组小鼠肠道微生物群落代谢变化的聚类分析 见图2。
由图2 可见,当聚类距离≤10时,正常组碳源可以聚类为4类,模型组碳源可以聚类为3类,纳豆组碳源聚类为5类;阳性组碳源可聚为4类且有部分碳源不能聚类为任一类别。正常组中主要为单糖及糖苷类以及聚合糖类为一类,造模后,聚为一类的物质中单糖及糖苷类、聚合糖类成分减少,而氨基酸类、酯类及酸类增多;阳性组与模型组比较,单糖及糖苷类物质有所增多,相应的氨基酸和酯类、酸类物质减少,但与正常组比较仍有较大差异。纳豆组与阳性组比较,酸类物质减少,与正常组比较,组成成分类别更接近。
1.β-甲基-D-葡萄糖苷;2.D-半乳糖酸-γ内酯;3.L-精氨酸;4.丙酮酸甲酯;5.D-木糖;6.D-半乳糖醛酸;7.L-天冬酰胺酸;8.吐温40;9.I-赤藻糖醇;10.2-羟苯甲酸;11.L-苯基丙氨酸;12.吐温80;13.D-甘露醇;14.4-羟基苯甲酸;15.L-丝氨酸;16.α-环式糊精;17.N-乙酰基-D-葡萄胺;18.γ-羟基丁酸;19.L-苏氨酸;20.肝糖;21.D-葡萄胺酸;22.衣康酸;23.甘氨酰-L-谷氨酸;24.D-纤维二糖;25.葡萄糖-1-磷酸盐;26.α-丁酮酸;27.苯乙基胺;28.α,D-乳糖;29.D,L-α-甘油;30.D-苹果酸;31.腐胺
当聚类距离≤5时,正常组中的β-甲基D-葡萄糖苷和D-纤维二糖在模型组中分别与其他物质聚为一类,所利用的氨基酸及胺类具体物质也不同。阳性组与模型组比较,仅3种单糖及糖苷类物质聚为一类,其他物质均未聚于此类。纳豆组与模型组比较,对氨基酸及酸类物质的利用减少,胺类物质的种类不同,并没有对酯类物质的利用,这与正常组的情况更为接近,葡萄糖-1-磷酸盐、α-环式糊精、苯乙基胺三种物质聚为一类,同时有氨基酸类,但是增加了对苹果酸的利用。
3.4 各组小鼠肠道微生物菌落代谢变化的主成分分析 见图3。
ECO板的数据代表微生物对不同碳源的代谢利用情况,从数据可知,不同组小鼠的肠道微生物能够代谢ECO板中的绝大多数种类的碳源。分别对4个组数据进行主成分分析(PCA),在正常组、模型组、阳性组及纳豆组中,成分1(PC1)的方差贡献率分别为58.46%、67.39%、65.86%和72.73%。
对ECO板数据进行提取,4个组分别获得1张呈现2个主成分的载荷图,以此来分析各组的代谢特点。见图3。图3可见,PC1各组比较,模型组与正常组相比,增加了单糖及糖苷类和胺类化合物;阳性组与模型组相比,减少了聚合糖类化合物,酸类物质数量减少;纳豆组与模型组相比,参与代谢的化合物种类相同,而与阳性组相比,增加聚合糖类碳源。综合4组数据,发现糖类和羧酸类在PC1上载荷均较高,提示此两类碳源为肠道微生物基础代谢所需;4个组在7种碳源上有不同程度上的利用。利用较多且具有较高负荷的碳源,正常组为酯类及酸类碳源,模型组为酸类、聚合糖类、酯类及氨基酸类碳源,阳性组为聚合糖类、醇类及氨基酸类碳源,纳豆组为氨基酸类、酯类、胺类及酸类碳源。纳豆组、阳性组和正常组比较发现,纳豆组中载荷在0.9以上的碳源中,脂类碳源有4种,正常组脂类碳源有4种,而阳性组中脂类碳源仅有1种,且载荷排位顺序较后。纳豆组、阳性组和模型组比较发现,纳豆组对酯类的利用较模型组更多,纳豆组和阳性组对聚合糖类、酸类碳源利用更少。
图3显示:4个组别中,PC2在酸类碳源上均具有较高载荷,提示此类碳源对PC2的贡献率较高,是小鼠肠道微生物的基础代谢所需碳源。与正常组相比,模型组缺少了聚合糖类及胺类碳源,增加了醇类和脂类碳源;阳性组缺少聚合糖类、胺类及氨基酸类碳源,增加了脂类碳源;纳豆组缺少了胺类、氨基酸类及单糖及糖苷类碳源,增加了醇类碳源。与模型组比较,阳性组缺少氨基酸类及醇类碳源,纳豆组缺少单糖及氨基酸类碳源,增加了聚合糖类碳源。
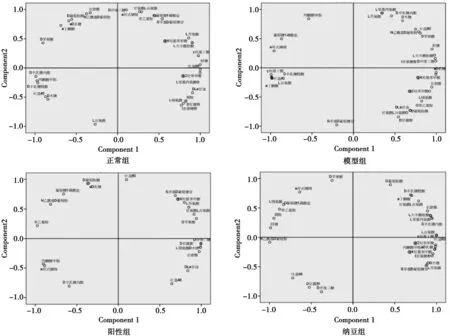
图3 各组小鼠肠道微生物碳源代谢的主成分分析图
聚合物类碳源肝糖在正常组及纳豆组中对PC1的贡献率较大,而模型组中对PC1贡献率都不大,对PC2无贡献率,表明纳豆组肠道微生物代谢更接近正常组,具有调控作用。D-半乳糖酸γ内酯在正常组及纳豆组中对PC1的贡献率较大,模型组及阳性组中对PC2的贡献率较大,可见在某些方面,纳豆对其代谢的调控作用更显著,阳性药的调控与自然恢复差别相似。
4 讨论
纳豆是大豆经过枯草芽孢杆菌发酵制成的食品,具有多种保健功能。本文通过给予肠道菌群失调小鼠纳豆匀浆液研究纳豆对小鼠肠道菌群的调节作用。AWCD是微生物群落代谢的整体活性的直接指标,其值与微生物活性成正比[18],本研究采用Biolog-ECO微生态板进行测定,经数据统计分析,模型组小鼠的肠道微生物AWCD最大,说明模型组的菌群在抗生素的作用下出现失调,肠内容物中好氧微生物代谢活力最强,这可能是由于模型组肠道菌群在自然恢复期间,菌群数量出现的反跳现象[19-20]。不同时间点AWCD值比较,培养48 h后,4 组的关系稳定在模型组>阳性药组>正常组>纳豆组,说明培养48 h之前,各组的AWCD值还在波动,各组微生物群落还未稳定;而培养48 h及之后,各组的AWCD值逐渐稳定,说明纳豆可降低模型小鼠肠道中好氧微生物代谢活动,并低于阳性组和正常组。
Shannon指数(H’)是功能多样性指标,代表整个生态系统的微生物群落的功能多样性,即同一状态下能够利用碳源种类的多少,Shannon指数大,说明在这个生态系统的微生物群落功能多样性越高,反之则越低[14,16]。微生物Shannon均匀度指数(E)包括两个因素,即丰富度和种类中个体分布的均匀性。微生态系统中的某些最为常见的微生物的优势度以及均匀度用Simpson指数和Mclntosh指数(U)两个指标衡量[21]。Simpson指数与优势度物种成反比[22]。而Mclntosh指数(U)代表微生物群落的均匀度[23]。模型组小鼠肠道微生物H’、E、1/D和U均为最大,高于正常组,在一定程度上反应出模型组小鼠肠道中好氧微生物数量丰富且结构更复杂,可能是因为使用抗生素后,对其敏感的厌氧菌减少甚至消失,耐药菌大量繁殖的原因[24];也可能是因为在模型组肠道菌群已紊乱的情况下,在停止给予抗生素的期间,好氧菌数量迅速回升且超过正常水平所造成,这与谢莉敏[19]、 Holota Y[20]结果相符合。阳性组结果提示经过阳性药物的干预,小鼠肠道菌群发生改变,功能多样性及微生物群落均匀性有所降低,而优势度物种有所增加,小鼠肠道菌群的状态与正常组已基本相同,恢复到正常态。纳豆组结果提示,纳豆可以改变模型小鼠肠道菌群状态,在H’、U及1/D 3方面恢复至正常水平,丰富度及种类中个体分布的均匀性仍未恢复至正常小鼠水平。
肠道微生物参与能够维持人体机能的稳定,包括免疫功能、代谢稳态以及其他各种疾病。肠道菌群中主要是厌氧菌,比如双歧杆菌、乳酸杆菌、拟杆菌等,其次还包括肠杆菌、肠球菌等好氧菌[25]。本研究从聚类分析和主成分分析上都可以看出,模型组与正常组之间存在较大差异,阳性组、纳豆组均发挥一定的调节作用,但两者之间也存在差异,其中,纳豆组的调节作用更接近正常组,效果更佳。使用抗生素后,对抗生素敏感的厌氧菌大量减少,好氧菌乘机繁殖,导致体内菌群间的平衡被打破。服用枯草芽胞杆菌后,枯草芽孢杆菌消耗肠道内氧气,使肠道内更倾向于无氧环境,从而促进厌氧菌繁殖,或产生包括抗生素、细菌素和类细菌素[26]在内的抗菌物质,可在一定程度上抑制肠道中肠杆菌、肠球菌等条件致病菌的生长。如Somaye Mazkour等研究结果提示,给大鼠服用枯草芽孢杆菌后,大肠杆菌数量降低[27]。Zhang X等[28]有类似研究结果,即枯草芽孢杆菌能平衡肠道菌群,增加芽胞杆菌属、理研菌科和乳酸菌属的丰度,降低大肠杆菌属和拟杆菌属的丰度。这些方面于宿主调整肠道正常菌群并维持其环境的平衡方面非常有益[29]。另一方面,枯草芽孢杆菌制剂还可以减轻肠道黏膜损伤,促进肠道黏膜屏障修复[28]。而纳豆组表现比阳性组效果更好,可能是因为纳豆为大豆的发酵产品,其中不仅含有充分的枯草芽孢杆菌,亦含有大豆本身发酵的产物以及枯草芽孢杆菌分泌的各种营养物质,比如多种维生素、氨基酸、黄酮类、皂苷类、纳豆激酶、超氧化物歧化酶等各种活性酶[30]等等,参与机体的生长代谢,并辅助发挥调节菌群的作用。
本研究通过Biolog-ECO技术以及数据分析,可从整体上看到纳豆对抗生素引起的小鼠肠道菌群失调的调节、促进恢复作用,但是研究尚有不足之处,如不能得出具体菌的种属信息等,因此需要在后续的研究中对数据从其他角度进行分析或者利用其他技术手段进行检测来实现。
