羊栖菜褐藻糖胶寡糖组分分析及抗凝血活性
2022-07-07任晨瑜张绵松白新峰王令书崔婷婷史亚萍刘昌衡贾爱荣
刘 雪,任晨瑜,2,刘 新,张绵松,白新峰,王令书,崔婷婷,史亚萍,刘昌衡,贾爱荣,*
(1.齐鲁工业大学(山东省科学院)山东省科学院生物研究所,山东 济南 250103;2.齐鲁工业大学(山东省科学院)生物工程学院,山东 济南 250353;3.潍坊医学院临床医学院,山东 潍坊 261053)
多糖是近年来研究较多的一种活性成分,具有抗氧化、抗肿瘤、抗病毒、抗凝血、降血糖降血脂等生物活性。但是,多糖作用靶点不明确、分子质量大、黏度高、生物利用度低,极大限制了其在医药上的开发应用。近年来,寡糖的相关研究逐渐增多,与多糖相比,寡糖结构清晰、水溶性高、生物利用度好,部分寡糖显示出与母糖相似或高于母糖的生物活性。因此,寡糖的开发研究对糖类化合物的发展具有重要的科学意义。
褐藻糖胶又名岩藻聚糖硫酸酯,是一种硫酸化多糖,广泛存在于褐藻和海洋无脊椎动物中。褐藻糖胶具有明显的抗凝血活性,Mansour等从海参中分离出高分子质量,高硫酸基含量的褐藻糖胶,这种褐藻糖胶表现出主要由肝素辅因子II介导的强抗凝血活性。Wang Jing等从海带中得到了3种低分子质量褐藻糖胶,这3种多糖均能显著延长活化部分凝血酶时间、凝血酶时间和凝血酶原时间,具有较好的抗凝血活性。Li Bo等研究发现羊栖菜岩藻聚糖硫酸酯能够显著延长活化部分凝血酶时间,具有良好的抗凝血活性。羊栖菜()是一种常见的褐藻,隶属于褐藻门墨角藻目马尾藻科,具有较高的食用和药用价值,广泛分布于我国的浅海水域,韩国、日本也有分布。褐藻糖胶是羊栖菜中重要的活性成分,但是,羊栖菜褐藻糖胶也存在分子质量大、黏度高等特点,限制了它的开发利用。寡糖的研究有利于推进褐藻糖胶进一步的发展。
本实验从羊栖菜中分离纯化得到一种褐藻糖胶,采用酸降解法降解得到5种寡糖组分,通过测定活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)、凝血酶原时间(prothrombin time,PT)评价其抗凝血活性。筛选高抗凝血低分子质量寡糖组分,对其结构进行质谱解析,探究羊栖菜抗凝血褐藻糖胶寡糖的结构特征。
1 材料与方法
1.1 材料与试剂
羊栖菜取自于2018年5月采自浙江省平阳县南麂岛国家海洋自然保护区。
葡聚糖标准品 美国Flu-ka公司;单糖标准品、1-苯基-3-甲基-5-吡唑啉酮(1-pheny-3-methyl-5-pyrazolone,PMP)、标准牛血清白蛋白和低分子质量肝素钠 美国Sigma公司;乙腈(色谱纯) 美国Tedia公司;APTT、TT、PT测定试剂盒 南京建成生物工程研究所;DEAE-Sepharose Fast Flow 美国GE healthcare公司;Bio-gel P4(Fine,45 μm) 美国Bio-Rad公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Elipse XDB-C(4.6 mm×250 mm,5 μm)、1260高效液相色谱仪、LCMS6460质谱仪 美国Agilent公司;ohpak SB-804HQ高效凝胶渗透色谱柱日本Shodex公司;Infinite M200 PRO酶标仪 瑞士Tecan公司;SL-318半自动血凝仪 济南森蓝公司。
1.3 方法
1.3.1 褐藻糖胶提取和分离纯化
羊栖菜褐藻糖胶的提取参照Silchenko等的方法且略作修改。将羊栖菜洗净烘干,粉碎成末。取适量藻体粉末,加入95%乙醇脱脂,料液比为1∶30(g/mL),室温下搅拌24 h。取适量脱脂后的藻体粉末,加入2% CaCl溶液,料液比为1∶30(g/mL),60 ℃搅拌3 h,静置,冷却到室温,离心,收集上层清液。将上层清液超滤浓缩,截留分子质量为100 kDa。浓缩后的提取液加入4 倍体积95%乙醇溶液,醇沉,4 ℃静置过夜12 h,离心,收集沉淀部分。沉淀经无水乙醇脱水后,置于40 ℃烘箱中干燥,得到羊栖菜多糖粗品。采用DEAESepharose Fast Flow阴离子交换柱(4.0 cm×30 cm)对羊栖菜多糖进行分离纯化,0、0.5、1、2、3 mol/L NaCl溶液进行梯度洗脱,收集2 mol/L洗脱组分,除盐、浓缩冻干,命名为SFF。
1.3.2 HPGPC法测定分子质量
将不同分子质量系列葡聚糖标准品和待测SFF配制成5 mg/mL的溶液,在下述条件下测定分子质量。分析柱:Shodex ohpak SB-804HQ(7.6 mm×300 mm),示差折光检测器在线检测,流动相0.1 mol/L NaSO溶液,流速0.5 mL/min,柱温35 ℃,进样量20 μL。绘制以标准多糖分子质量对数为纵坐标,保留时间为横坐标的标准曲线,根据标准曲线回归方程计算样品的分子质量。
1.3.3 单糖组成
采用PMP柱前衍生高效液相色谱法测定SFF的单糖组成。准确称取2 mg样品,加入1 mL 2 mol/L三氟乙酸溶液,110 ℃条件下降解6 h,得到完全酸水解的单糖样品。对单糖标准品及完全酸水解的单糖样品进行PMP衍生,首先将其溶于100 μL蒸馏水,加入100 μL 0.3 mol/L NaOH溶液及120 μL 0.5 mol/L的PMP甲醇溶液,置于70 ℃水浴中反应100 min。反应完毕后中和,用二氯甲烷萃取3 次,除去未反应的PMP,上层液体过0.22 μm的微孔滤膜后进行高效液相色谱分析。色谱条件:C色谱柱(4.6 mm×250 mm,5 μm),柱温35 ℃,流动相为磷酸缓冲溶液-乙腈(83∶17,/),流速1.0 mL/min,紫外检测器检测。
1.3.4 理化性质
总糖含量:采用硫酸-苯酚法测定,蛋白含量:采用Folin-酚法测定;硫酸基含量:采用氯化钡明胶比浊法测定;糖醛酸含量:采用咔唑-硫酸法测定。
1.3.5 寡糖的制备
将多糖以0.1 mol/L HCl溶液配制成10 mg/mL,于80 ℃水浴10 h,反应液降至室温后,调节pH值至中性。透析(截留分子质量为100 Da),浓缩冻干,样品备用。
1.3.6 寡糖的分离纯化
降解产物采用Bio-Gel P4色谱柱进行分离纯化。以0.2 mol/L NHHCO溶液为流动相,0.1 mL/min洗脱,洗脱后采用硫酸-苯酚法检测,收集峰尖部分,除氨冻干。
1.3.7 寡糖的质谱分析
采用负离子模式下的电喷雾质谱对寡糖进行分析。取少量寡糖组分,以乙腈-水(1∶1,/)溶液溶解,使其浓度达到5~10 pmol/L,注射5 μL进行质谱分析。质谱分析中,以氮气作为溶剂的吹干气体和喷雾气体,流速分别为250 L/h和15 L/h;流动相为乙腈-水(1∶1,/),在泵的动力下,从注射器以10 μL/min的流速注入;毛细管电压为3 kV,锥孔电压为50 eV,离子源和溶剂挥发温度分别为80 ℃和150 ℃。
1.3.8 核磁共振波谱分析
称取10 mg寡糖样品,用重水溶解后冻干,反复3 次。得到的样品溶于0.5 mL重水中,加入少量内标氘代丙酮,采用Bruker Avance III HD 400 MHz核磁共振波谱仪测定核磁图谱。
1.3.9 抗凝血活性测定
将SFF配制成0.5、1.0、2.5 mg/mL,与血浆以1∶9的体积比混合。APTT、TT、PT的测定按照试剂盒要求进行。
2 结果与分析
2.1 褐藻糖胶的分离纯化、分子质量和理化性质分析
从羊栖菜中提取得到褐藻糖胶粗品,经DEAESepharose Fast Flow阴离子交换柱分离纯化,得到3个明显的洗脱峰(图1),收集含量最高的2 mol/L NaCl溶液洗脱组分为SFF。测定褐藻糖胶SFF的分子质量和理化性质如表1所示。SFF的分子质量较高,为708 kDa;总糖质量分数为56.44%;蛋白质量分数较低,为1.14%;硫酸基质量分数为26.22%,不含糖醛酸。SFF的分子质量和理化性质测定结果与前期报道的结果相似。

图1 褐藻糖胶SFF的分离纯化图Fig. 1 Chromatogram for separation and purification of SFF

表1 褐藻糖胶SFF的理化性质分析Table 1 Physicochemical properties of SFF
2.2 褐藻糖胶的单糖组成分析
如图2所示,通过与标准品对比可知,SFF由岩藻糖、半乳糖、甘露糖、葡萄糖4种糖基组成,物质的量比为67.11∶26.69∶2.54∶3.66,其中岩藻糖和半乳糖为主要组成成分。SFF含有大量的硫酸基团和岩藻糖,进一步表明SFF是褐藻糖胶的一种。
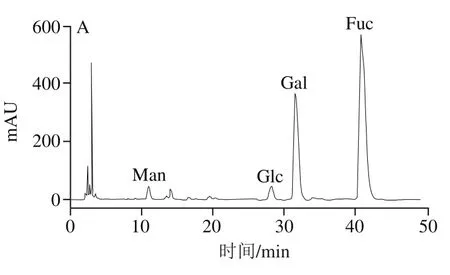
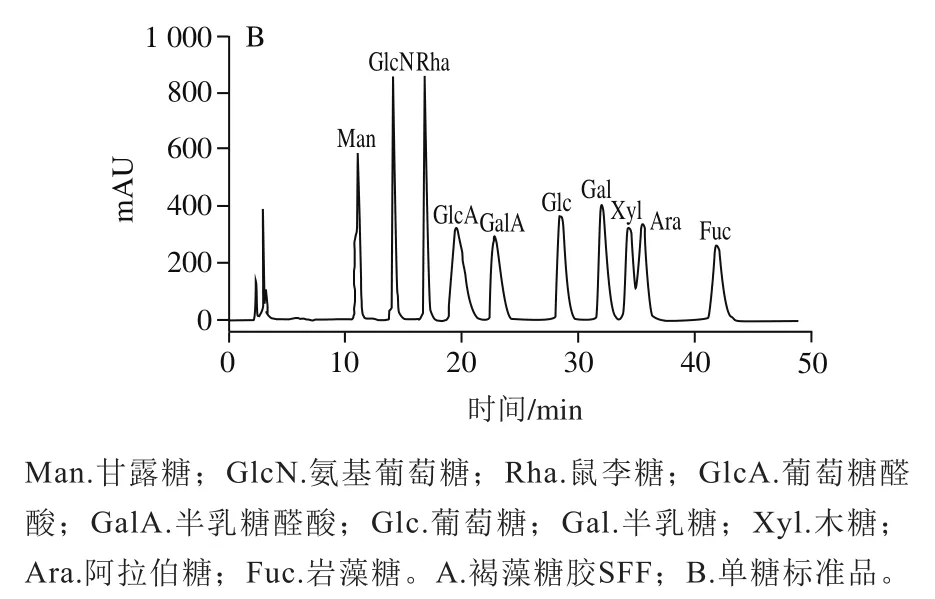
图2 褐藻糖胶SFF的单糖组成分析Fig. 2 Monosaccharide composition of SFF
2.3 寡糖的分离纯化
将多糖降解产物配制成10 mg/mL,经Bio-Gel P4色谱柱分离纯化,洗脱液以硫酸-苯酚法检测糖含量,绘制洗脱曲线,如图3所示。多糖降解产物分离后,得到5种寡糖组分,根据分子质量大小,命名为P1~P5,其中P1分子质量最大。

图3 褐藻糖胶SFF降解产物的Bio-Gel P4谱图Fig. 3 Gel permeation chromatogram of oligosaccharides on Bio-Gel P4
2.4 寡糖的抗凝血活性
在凝血机制中,APTT反映了内源性或者共同凝血途径,TT反映了对凝血酶活性或者纤维蛋白的作用,PT反映了外源性凝血途径。本实验测定5种寡糖组分对APTT、TT、PT的延长作用,以评价寡糖的抗凝血活性。如表2所示,5种寡糖组分均可延长APTT,其中寡糖组分P1、P2、P3对APTT的延长作用高于P4、P5,P3的延长作用尤其明显。对TT和PT无延长作用,说明羊栖菜褐藻糖胶寡糖组分对内源性或者共同凝血途径有抑制作用,对凝血酶活性、纤维蛋白的聚合以及外源性凝血途径的作用不大。与肝素相比,寡糖组分对APTT的延长作用偏低,但是较为温和,随着浓度的增加,延长作用逐渐增加,而肝素在50 µg/mL时,APTT已达到200 s。此外,肝素对PT和TT均具有显著的延长作用,而寡糖组分对PT和TT的延长作用不明显,说明羊栖菜褐藻胶寡糖与肝素的抗凝机制不完全相同。目前,有关褐藻糖胶/褐藻糖胶寡糖的抗凝血活性研究较少,抗凝血寡糖的结构研究更为少见。赵雪等采用自由基氧化降解法制备了不同分子质量和硫酸基含量的褐藻糖胶,测定了抗凝血活性,揭示了褐藻糖胶中影响抗凝血活性的主要因素,但是,对高抗凝血活性褐藻糖胶的结构并无说明,且分子质量降低后活性明显降低。Wang Jing等从海带中分离得到的3种低分子质量褐藻糖胶,均能显著延长活化部分凝血酶时间、凝血酶时间和凝血酶原时间,具有较好的抗凝血活性,但是分子质量仍较大,为4~8 kDa。

表2 褐藻糖胶SFF寡糖组分的抗凝血活性Table 2 Anticoagulant activity of oligosaccharides derived from SFF
2.5 寡糖组分P3的质谱及核磁共振波谱分析
寡糖组分P3是具有高抗凝血活性同时分子质量最小的组分,因此,采用质谱法对P3的结构进行解析,探究羊栖菜抗凝血褐藻糖胶寡糖的结构特征。负离子模式下的一级质谱(图4)显示P3主要存在双电荷离子峰/307,表明P3主要由分子质量为616 Da的寡糖片段组成,推断其为二硫酸化岩藻三糖[Fuc(SO)]。二级质谱给出了/307(图5)的断裂片段,但是信息相对较少。因此,对寡糖组分P5、P4中的寡糖片段进行质谱分析,进而推断出二硫酸化岩藻三糖的结构。
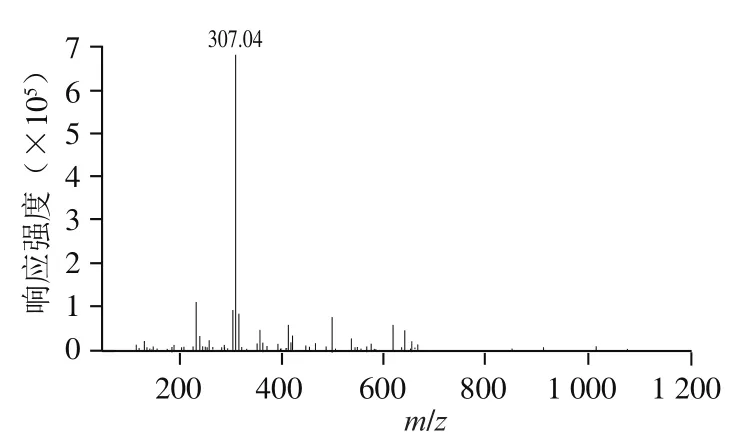
图4 寡糖组分P3的负离子电喷雾质谱图Fig. 4Negative-ion ES-MS spectrum of oligosaccharide fraction P3
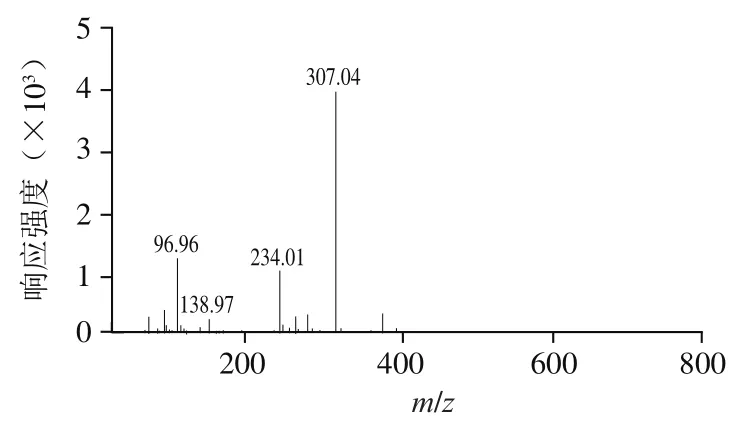
图5 寡糖片段m/z 307二级质谱图Fig. 5 Negative-ion ES-CID-MS/MS product-ion spectrum of fragment at m/z 307
图6 是寡糖组分P5的一级质谱,离子/243推断为硫酸化岩藻单糖,是其主要的寡糖片段。二级质谱(图7)显示了离子/243断裂片段信息,碎片离子/139推断为X断裂,而X断裂是C-2硫酸化的主要断裂方式,推断硫酸基团可能位于C-2位。高丰度碎片离子/97的出现表明硫酸基团也可能位于C-3位。因此,硫酸基团可能位于岩藻糖的C-2或C-3位。

图6 寡糖组分P5的负离子电喷雾质谱图Fig. 6 Negative-ion ES-MS spectrum of oligosaccharide fraction P5
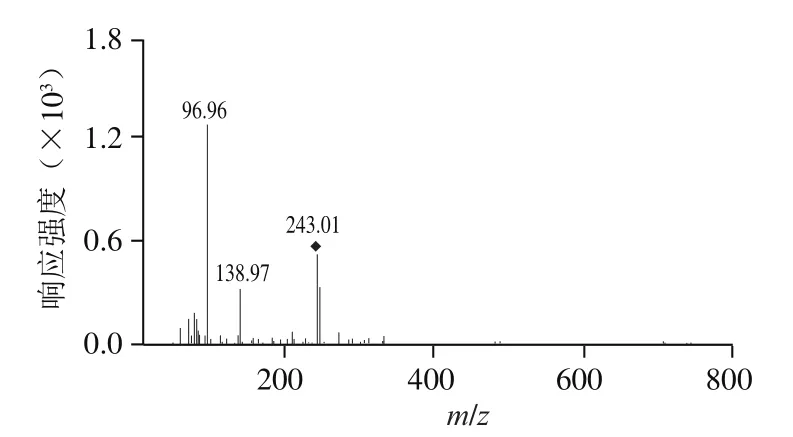
图7 寡糖片段m/z 243二级质谱图Fig. 7 Negative-ion ES-CID-MS/MS product-ion spectrum of fragment at m/z 243
图8 是寡糖组分P4的一级质谱,离子/389推断为硫酸化岩藻二糖,是其主要的寡糖片段之一。二级质谱(图9)显示了离子/389的碎片离子信息,/329的出现表明二糖间的连接方式为1→4连接,且还原端岩藻糖C-3位上无硫酸基团。未出现碎片离子/139表明还原端岩藻糖的C-2位上无硫酸基团,因此硫酸基团位于非还原端的C-2或C-3位。综上所述,硫酸化岩藻二糖可能存在以下异构体:--Fuc(2SO)-(1→4)---Fuc和-Fuc(3SO)-(1→4)---Fuc。

图8 寡糖组分P4的负离子电喷雾质谱图Fig. 8 Negative-ion ES-MS spectrum of oligosaccharide fraction P4

图9 寡糖片段m/z 389二级质谱图Fig. 9 Negative-ion ES-CID-MS/MS product-ion spectrum of fragment at m/z 389
根据上述分析结果可知,SFF寡糖组分的硫酸基团位于岩藻糖基的C-2和C-3位,岩藻糖基之间的连接方式为1,4-连接。推断离子/307为二硫酸化岩藻三糖,因此,它的结构可能是在硫酸化岩藻二糖的基础上增加硫酸基团及岩藻糖残基。在离子/307的二级质谱中,碎片离子/139的出现表明存在还原端C-2位硫酸基团,相对高丰度碎片离子/97的出现表明硫酸基团也可能位于岩藻糖残基的C-3位,这与前述分析结果一致。此外,碎片离子/234推断为二硫酸化岩藻二糖,表明两个硫酸基团相邻。因此,离子/307可能存在以下异构体,如图10所示,--Fuc-(1→4)---Fuc(3SO)-(1→4)---Fuc(2SO),--Fuc-(1→4)---Fuc(2SO)-(1→4)---Fuc(2SO),--Fuc-(1→4)---Fuc(3SO)-(1→4)---Fuc(3SO),--Fuc-(1→4)---Fuc(2SO)-(1→4)---Fuc(3SO)。二硫酸化岩藻三糖中硫酸基团的位置还可通过核磁共振氢谱进一步确定。如图11所示,低场区5.00~5.50为--Fuc异头氢所在的区域,主要有3个异头氢信号5.16、5.26及5.42,1.25是岩藻糖C-6位甲基上的氢信号。根据文献报道,5.42处为2-硫酸化-岩藻糖残基,5.26处为3-硫酸化-岩藻糖残基。其中,5.26处的异头氢信号强度最高,说明二硫酸化岩藻三糖的硫酸基团主要位于C-3位。这与质谱分析结果一致,进一步说明了二硫酸化岩藻三糖的硫酸基团位于C-2和C-3位,C-3位是主要的硫酸化位点。
硫酸化多糖的生物活性与多种因素有关,如分子质量、硫酸基团含量等。Liu Xue等从绿藻中提取得到硫酸化鼠李聚糖,发现其抗凝血活性随着分子质量的减小逐渐降低。Mazumder等从红藻中提取得到硫酸化半乳聚糖,其抗病毒活性与分子质量密切相关,分子质量越高,对单纯疱疹病毒I和II的选择性抗病毒活性越明显。硫酸基团含量也是影响多糖生物活性的重要因素,Koyanagi等研究发现褐藻糖胶和过硫酸化褐藻糖胶均可抑制血管内皮生长因子的有丝分裂和趋化性,但是过硫酸化褐藻糖胶的抑制作用更加明显。本实验中,寡糖组分P3主要是二硫酸化岩藻三糖,P4主要是硫酸化单糖(/243)和硫酸化/二硫酸化二糖(/389、405、485)的混合物,P5主要是硫酸化单糖。与P4和P5相比,寡糖组分P3具有更高的分子质量,同时也具有一定的硫酸基团含量,这可能是导致P3抗凝血活性高于P4和P5主要原因。
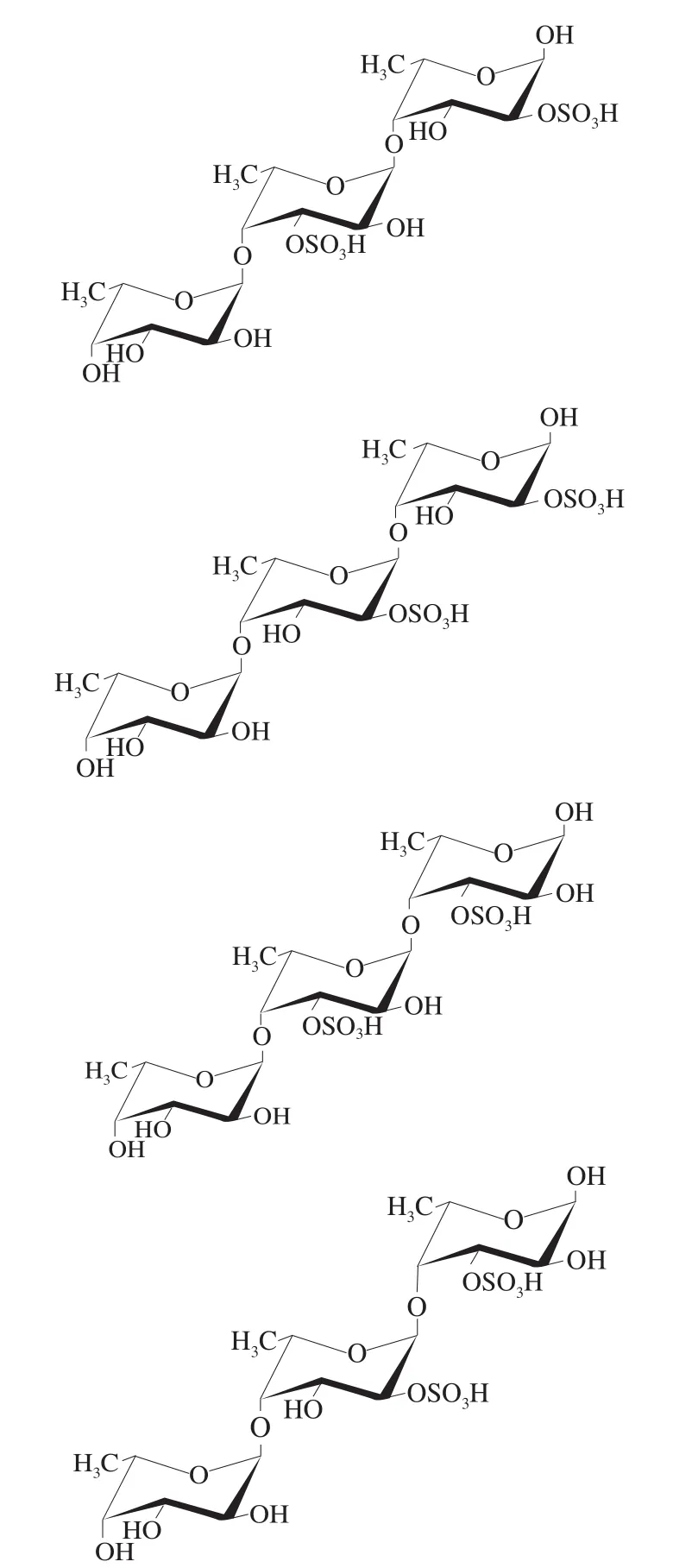
图10 寡糖组分P3的结构片段Fig. 10 Proposed sequence of oligosaccharide fraction P3

图11 寡糖组分P3的核磁共振氢谱Fig. 11 1H NMR spectrum of oligosaccharide fraction P3
3 结 论
从羊栖菜中提取并分离纯化得到褐藻糖胶SFF。通过高效液相色谱法、高效凝胶渗透色谱法、化学法测定了褐藻糖胶的单糖组成、分子质量、理化性质。采用盐酸降解法将SFF降解成寡糖,并通过Bio-gel P4凝胶色谱柱有效分离,最终得到5种寡糖组分P1~P5。5种寡糖组分均可延长APTT,其中寡糖组分P1、P2、P3对APTT的延长作用高于P4、P5,P3的延长作用尤为明显。5种寡糖组分对TT和PT无延长作用,说明SFF寡糖主要对内源性和共同凝血途径有抑制作用。选择高抗凝血活性同时分子质量最小的寡糖组分P3进行质谱分析,探究羊栖菜抗凝血褐藻糖胶寡糖的结构特征。结果表明,寡糖组分P3纯度较高,主要由二硫酸化岩藻三糖寡糖片段组成,结构为--Fuc-(1→4)---Fuc(3SO)-(1→4)--Fuc(2SO),--Fuc-(1→4)---Fuc(2SO)-(1→4)--Fuc(2SO),--Fuc-(1→4)---Fuc(3SO)-(1→4)--Fuc(3SO),--Fuc-(1→4)---Fuc(2SO)-(1→4)--Fuc(3SO)。本实验筛选出一种具有良好抗凝血活性的高纯度寡糖组分,揭示其结构特点,丰富了抗凝血褐藻糖胶寡糖的研究。
