人乙醛脱氢酶2与NusA的融合表达
2022-07-07缪士涛宫兴文
缪士涛,胡 敏,宫兴文
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
我国的酒文化历史悠久,源远流长。乙醇在人体内主要经乙醇脱氢酶(alcohol dehydrogenase,ADH)的催化作用转变为乙醛,再由乙醛脱氢酶(aldehyde dehydrogenase,ALDH)转化为乙酸,进入三羧酸循环,代谢为水和二氧化碳,排出体外。乙醛的积累会刺激大脑神经,加速血液循环,引起呕吐、头痛等不适症状。ADH无论在东亚人群还是欧美人群中,数量和酶活性均相当,而ALDH则是一个庞大的蛋白质家族,包括ALDH1、ALDH2、ALDH3和ALDH4等,其中,参与酒精代谢的主要是位于肝脏线粒体的ALDH2。但是,在中国和其他亚洲国家中,约有35%~40%的个体缺乏正常的ALDH2,主要是该蛋白的第487位氨基酸由谷氨酸突变为赖氨酸(E487K),突变比例显著高于欧美人群。突变型ALDH2(E487K)活性基本丧失,携带ALDH2突变基因()的东亚人群对乙醇非常敏感,少量饮酒就会脸红和头晕,极易引起酒精中毒。此外,国内嗜酒或酒精依赖性人群高达2亿左右,酒精相关疾病的发病率居高不下,首当其冲的是酒精性肝病,包括酒精性脂肪肝、酒精性肝炎、肝硬化、纤维化乃至肝功能衰竭等。过量饮酒也是多种癌症如肝癌、食管癌、贲门癌、胃癌、口腔癌、上喉癌等的引发因素,还会引起酒精性相关出生缺陷病等疾病,严重危害人体健康。
当前国内外的解酒产品主要有中草药提取物(如葛根、人参)、肽类(如玉米肽、花生蛋白肽)以及蛋白类(如乳制品)等,解酒机理分别为调理酒后的不适症状、提升ALDH2辅酶NAD含量以及蛋白质凝固在胃黏膜上形成保护膜等。这些产品虽然有一定的解酒作用,但是并不能解决基因突变所造成的酶活性下降这个本质问题,仅仅停留在“治标”层面上。而直接从动植物、微生物中提取ALDH2,或者利用微生物发酵方法获得ALDH2,可以更加有效地将乙醛转变为乙酸,促进酒精的代谢,是一个“治本”的方法。
目前,已有一些基于ALDH2解酒产品的研究报道,例如,从动物组织和微生物菌体中提取,或者通过毕赤酵母等基因工程菌株进行发酵制备。大肠杆菌表达系统具有操作简单、细胞增殖快速、蛋白表达量高等优点,在基因工程研究中被广泛使用,并且已有一些通过大肠杆菌系统进行ALDH2重组蛋白制备的研究报道。但是,这些研究表明ALDH2重组蛋白在大肠杆菌中通常表达为溶解性很差且没有活性的包涵体。为了解决这一问题,本研究拟将目的基因插入到载体pET44b(+)上-tag下游的特定位点,使ALDH2与NusA-tag融合表达,以便得到能在大肠杆菌中可溶表达且具有较高活性的ALDH2。
1 材料与方法
1.1 材料与试剂
大肠杆菌DH5α和大肠杆菌BL21(DE3)菌株、pET44b(+)质粒由本实验室保存;T载体pMD19-T-simple、Competent Cell Preparation Kit、限制性内切酶(RI、I) 宝日医生物技术(北京)有限公司;DNA聚合酶、dNTP、T4-DNA连接酶、Diaspin柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、50×TAE、4S Green核酸染色剂、DNA Marker生工生物工程(上海)股份有限公司;其他主要化学试剂(均为分析纯) 国药集团化学试剂有限公司。
LB液体培养基:称量1 g胰蛋白胨、0.5 g酵母提取物、1 g NaCl,用蒸馏水定容至100 mL。用1 mol/L的NaOH溶液调节pH值至7.0,121 ℃高压蒸汽灭菌20 min。
LB固体培养基:称量1 g胰蛋白胨、0.5 g酵母提取物、1 g NaCl、2 g琼脂粉,用蒸馏水定容至100 mL。用1 mol/L的NaOH溶液调节pH值至7.0,121 ℃高压蒸汽灭菌20 min。待溶液冷却至50 ℃,加入100 μL氨苄青霉素并在超净台上倒平板,凝固后备用。
1.2 仪器与设备
恒温振荡培养箱 华利达实验设备有限公司;IMS-30制冰机 常熟市雪科电器有限公司;DK-8D恒温水浴锅 上海精宏实验仪器设备有限公司;CHB-100恒温金属浴 杭州博日科技有限公司;SHP-250生化培养箱 上海三发科学仪器有限公司;JJ-CJ-1FD超净台苏州市金净净化设备科技有限司;TC-220聚合酶链式反应(polymerase chain reaction,PCR) 美国MJ Research公司;LDZX-50KBS灭菌锅 上海博迅医疗生物仪器股份有限公司;琼脂糖电泳平板装置、垂直型转膜电泳槽、垂直蛋白电泳装置 北京君意电泳设备有限公司;JS-680B凝胶成像分析仪 上海培清科技有限公司;超微量紫外-可见分光光度计 鼎昊源科技公司;JY92-IID超声波细胞破碎仪 宁波新芝生物科技有限公司。
1.3 方法
1.3.1-融合表达载体的构建
依据NCBI网站提供的人(GenBank编号为JF432260)的基因序列和-tag在pET44b(+)的位置设计引物,分别引入限制性核酸内切酶位点RI和I在上游引物和下游引物的5’端,并在下游引物加入终止密码子TAA。上游引物:5’-TAATgaattcTGCC GTGCCTGCCCCCAACCA-3’;下游引物:5’-GCG GGctcgagTTATGAGTTCTTCTGAGGCACTTT-3’。
以基因为模板,PCR设定条件为:94 ℃预变性5 min;94 ℃变性1 min;65 ℃退火2 min;72 ℃延伸2 min;72 ℃最后一步延伸10 min;变性、退火、延伸步骤总共30个循环。扩增产物与T载体连接并转化到感受态大肠杆菌DH5α中,挑选阳性菌落进行测序。用RI和I酶切测序正确的质粒,提取酶切片段并与同样酶切的pET44b(+)质粒连接,得到重组载体pET44b(+)-并转化到大肠杆菌BL21(DE3)。从转化产物中挑单菌落,提取质粒,用RI和I双酶切验证插入片段的大小,并再次测序以确认核苷酸序列的一致性。
1.3.2 重组蛋白NusA-ALDH2的表达
将携带重组载体pET44b(+)--的大肠杆菌BL21(DE3)菌株接种于含100 μg/mL氨苄青霉素的2 mL LB培养基中,于15 mL离心管中培养。在37 ℃、240 r/min的振荡摇床上培养过夜。取0.5 mL细胞,接种于含100 μg/mL氨苄青霉素的15 mL LB培养基中。37 ℃振荡孵育3 h,加入异丙基---硫代半乳糖苷(isopropyl---thiogalactopyranoside,IPTG)至终浓度为1 mmol/L,诱导蛋白表达。诱导5 h后,10 000 r/min离心收集细胞,重悬于25 mmol/L Tris-HCl缓冲液,超声裂解细胞。再次离心,得到上清液和沉淀。为了提高蛋白的表达,通过改变发酵温度、诱导时间和IPTG浓度对表达条件进行优化,分别在25、30 ℃和37 ℃条件下诱导不同的时间,IPTG浓度范围为0.25~1.5 mmol/L。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)
用SDS-PAGE(10%聚丙烯酰胺)检测重组蛋白的分子质量、表达量和纯度。每道凝胶中加入20 μL的样品。电泳后用考马斯亮蓝R-250染色,用醋酸-甲醇-水混合物(10∶30∶60,/)脱色。
1.3.4 NusA融合蛋白的切除及纯化
在重组载体pET44b(+)--中,与目的基因之间有肠激酶的酶切位点,以便目的蛋白的酶切释放,同时,在NusA上游具有His-tag,以便通过金属离子螯合层析进行亲和纯化。参照杨银萍的方法进行亲和层析,将Ni-NTA层析柱预先用含有低浓度咪唑的缓冲液平衡,然后将菌体破碎离心得到的上清液用0.45 μm滤膜处理,上样到层析柱中,用平衡缓冲液洗去杂蛋白,然后加入肠激酶进行酶切,再用平衡缓冲液洗下ALDH2,最后用含有0.5 mol/L咪唑的洗脱液洗下NusA。
1.3.5 重组蛋白的酶活力测定
参考OKIBE反应体系进行酶活力测定,反应体系为:0.3 mL 1 mol/L Tris-HCl(pH 8.5)、0.05 mL 20 mmol/L-NAD、0.05 mL 100 mmol/L乙醛、0.1 mL 3 mol/L KCl、0.03 mL 1 mol/L-巯基乙醇、2.37 mL HO、0.10 mL重组蛋白。在340 nm波长处测定吸光度的变化情况,定义每分钟消耗 1 µmol乙醛为1个酶活力单位(U)。
1.3.6 最适反应温度和pH值测定
最适反应温度的测定:分别在10、20、30、37、40、50、60 ℃的反应体系中测定重组蛋白酶活力,将37 ℃测得的酶活力定为100%,其他温度下的酶活力与之相比较得出相对酶活力,从而确定不同温度下ALDH2的活性。
最适反应pH值测定:配制pH 4~6的柠檬酸-柠檬酸钠缓冲液、pH 7.0和pH 8.0的磷酸氢二钠-磷酸二氢钠缓冲液、pH 8.5和pH 9.0的Tris-HCl缓冲液,以及pH 10的甘氨酸-氢氧化钠缓冲液(浓度均为0.1 mol/L)。调节酶活力反应体系至不同pH值,分别测定重组蛋白在不同pH值反应体系中的催化效率。以pH 8时的酶活力为100%,测定不同pH值环境中的酶活力,计算相对酶活力。
1.3.7 金属离子对重组蛋白活性的影响
在酶活测定体系中,分别加入Ca、K、Na、Mg、Mn等金属离子至终浓度为5 mmol/L,在适当温度和pH值下测定不同金属离子对重组蛋白的激活作用,以加入K的反应体系测得的酶活力为100%,计算重组蛋白的相对酶活力。
1.3.8 野生型ALDH2的表达制备
本实验室已有野生型ALDH2的基因工程菌株,参照杨银萍的方法进行表达、纯化和复性。
1.4 数据统计与图表绘制
用Origin对数据进行拟合、绘图,并用SPSS对数据的显著性进行分析。
2 结果与分析
2.1 NusA-Aldh2的分子克隆
根据NCBI网站上人基因序列(GenBank编号为JF432260)设计引物,分别引入限制性内切酶RI和I位点。根据引物值及尽量减少杂带的原则设计PCR的退火温度为65 ℃,模板为本实验室保存的含有序列的质粒,用1%琼脂糖凝胶电泳检测PCR扩增的产物。之后,将目的片段切胶回收,与pMD19-T-simple载体于16 ℃的金属浴中连接过夜,然后转化入感受态细胞大肠杆菌DH5α菌株。
挑选转化成功的单菌落,在含有氨苄青霉素的LB液体培养基中37 ℃培养12~16 h,提质粒,冻存于-20 ℃备用。用RI和I进行双酶切处理,酶切产物用1%琼脂糖凝胶电泳进行鉴定。结果如图1所示,质粒被切割成两部分,长度分别为2 700 bp和1 500 bp左右,与T载体和基因片段的长度吻合,表明基因成功与T载体连接,基因测序结果也表明序列正确。
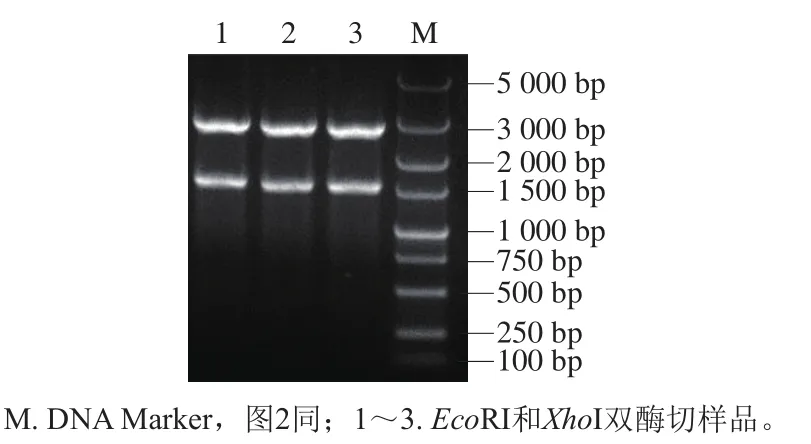
图1 EcoRI和XhoI 双酶切处理质粒pMD19-T-Aldh2Fig. 1 Digestion of pMD19-T-Aldh2 with EcoRI and XhoI
提取表达载体pET44b(+)质粒,用RI和I双酶切。然后,切胶回收基因片段和pET44b(+)载体片段进行连接,将连接产物转化大肠杆菌BL21(DE3)菌株。之后,提取质粒,用RI和I双酶切鉴定。如图2所示,双酶切后得到2个条带,长度分别约1 500 bp和7 000 bp,与基因片段和pET44b(+)载体片段长度吻合,同时,基因测序结果也正确,表明重组表达载体pET44b(+)--构建成功。

图2 EcoRI和XhoI双酶切处理pET44b(+)-NusA-Aldh2Fig. 2 Digestion of pET44b(+)-NusA-Aldh2 with EcoRI and XhoI
重组表达质粒的组成如图3所示,位于的下游,中间具有肠激酶的酶切位点,以便将重组蛋白切开。同时,NusA的上游具有6个His-tag,以便重组蛋白的亲和纯化。

图3 重组表达载体pET44b(+)-NusA-Aldh2的质粒图谱Fig. 3 Construction of plasmid pET44b(+)-NusA-Aldh2
2.2 NusA-ALDH2融合蛋白的表达
将构建好的工程菌培养过夜,用IPTG诱导重组蛋白的表达,结果如图4所示,诱导后,在分子质量约120 kDa位置处出现了新的蛋白条带,该蛋白与NusAALDH2融合蛋白的理论分子质量一致。将诱导后的菌体破碎离心后,在上清液中出现了明显的条带,并且与NusA-ALDH2融合蛋白的理论分子质量一致。这些结果说明ALDH2与NusA蛋白融合后能够表达,并且融合蛋白的溶解性也得到了很大提高,不再是以沉淀形式存在的包涵体。

图4 融合蛋白的表达情况Fig. 4 Expression of fusion protein
为了提高重组蛋白的表达量,通过改变发酵温度、诱导时间和IPTG浓度等方法对表达条件进行了优化,最终得到的最佳表达条件为在37 ℃用0.25 mmol/L IPTG诱导3 h。
2.3 融合蛋白NusA-tag的切除及纯化
在表达载体pET44b(+)上,目的基因的插入位置与-tag之间有一个肠激酶的酶切位点,即天冬氨酸-天冬氨酸-天冬氨酸-天冬氨酸-赖氨酸(DDDDK)序列,因此,可以用肠激酶将融合蛋白切开,释放出ALDH2。由于肠激酶的活性会被磷酸盐抑制,所以在破碎菌体时选择25 mmol/L Tris-HCl作为缓冲液。
收集NusA-ALDH2工程菌破碎离心后得到的上清液,即可溶表达的融合蛋白,用肠激酶酶切处理,通过SDS-PAGE检测酶切情况。如图5所示,分子质量120 kDa左右的融合蛋白在酶作用下逐渐裂解,条带消失,同时,在55 kDa位置处的条带浓度有所增加,有ALDH2产生,说明融合蛋白可以被肠激酶切开。但是,释放出的ALDH2含量较低,这可能和融合蛋白的分子质量过大,表达量较低有关。
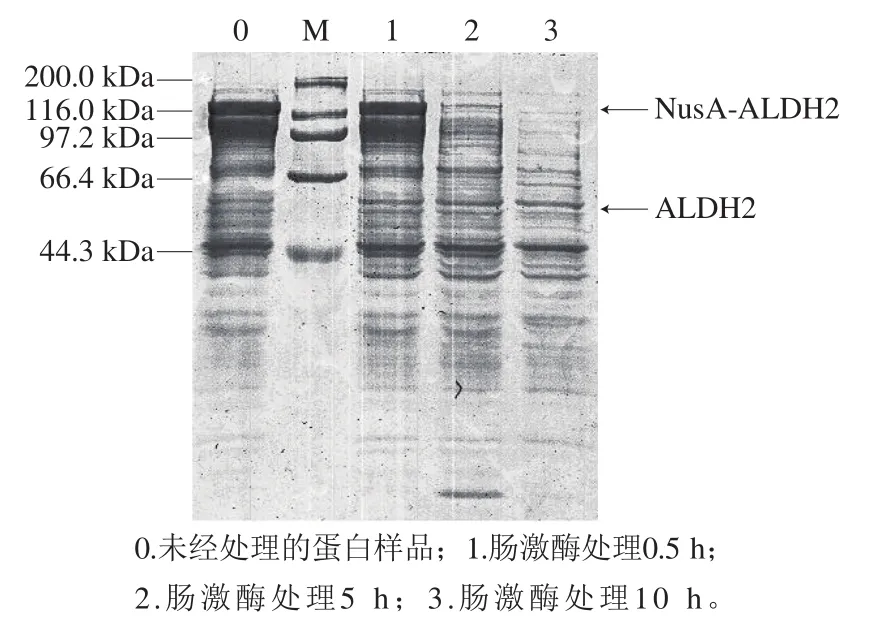
图5 肠激酶处理NusA-ALDH2Fig. 5 SDS-PAGE analysis of NusA-ALDH2 digested with enterokinase
NusA-ALDH2融合蛋白的纯化,首先是将重组蛋白结合在Ni-NTA柱上,用含有20 mmol/L咪唑的平衡缓冲液除去杂蛋白,然后加入肠激酶,切开融合蛋白,释放出ALDH2,最后将带His-tag的NusA洗脱。如图6所示,经亲和纯化可以得到较高纯度的ALDH2重组蛋白,分子质量约55 kDa。

图6 NusA-ALDH2的亲和纯化Fig. 6 SDS-PAGE analysis of affinity-purified NusA-ALDH2
2.4 重组蛋白的活性测定结果
ALDH2的辅酶是氧化型辅酶I(NAD),在催化反应中,NAD接受氢后变为还原型辅酶I(NADH)。NADH在波长340 nm处有特定的紫外吸收,因此可以通过测定一定时间内波长340 nm处吸光度的变化计算NADH生成量,从而得出单位时间内底物乙醛消耗量。根据文献[20]方法测定重组蛋白在标准反应体系中的酶活性,吸光度变化如图7所示,经过换算,重组蛋白的酶活力为1.64 U/mL。

图7 重组蛋白酶促反应吸光度变化Fig. 7 hanges in absorbance during reaction catalyzed by recombinant protease
2.5 最适反应温度和pH值测定结果
酶的催化效率易受到温度的影响,不同的酶具有不同的最适反应温度。以37 ℃时酶活力为100%,对重组蛋白的相对酶活力进行研究,如图8所示,随着温度的升高,酶活力呈现先增大后减小的趋势,在37 ℃时达到最高。当达到60 ℃时,相对酶活力不足原来的30%,酶活力损失严重。重组蛋白在40 ℃能保持一定的酶活性,对于人体的温度范围有一定的适应性,为今后解酒药物的开发奠定基础。

图8 重组蛋白的最适催化温度Fig. 8 Optimum temperature of recombinant protein
酶促反应体系的pH值影响酶活力,不同酶只能在各自适合的pH值范围内才能表现较好的催化活性,其中,酶催化活力最大时的pH值被称为酶的最适pH值。重组ALDH2在不同pH值下的相对酶活力如图9所示,重组蛋白的最适pH值为7.0,在强酸性和强碱性条件下的活性损失较大。

图9 重组蛋白的最适pH值Fig. 9 Optimum pH for recombinant protein
2.6 金属离子对重组蛋白活性的影响
Ca、K、Na、Mg和Mn均有不同程度的激活作用。在本研究的标准酶活力测定体系中采用K,但从图10可以看出Mg的激活作用高于K,可能是Mg和氨基酸残基之间形成的配位键更适合稳定重组蛋白的空间构象,从而表现出更好的活性。
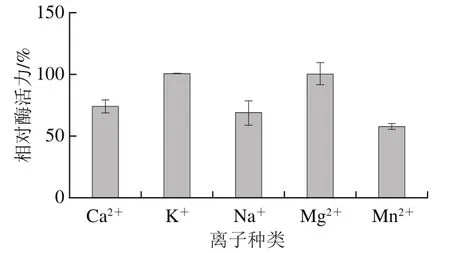
图10 不同金属离子对重组蛋白活性的影响Fig. 10 Effects of metal ions on the activity of recombinant protein
2.7 野生型ALDH2的制备
本实验室曾进行了野生型ALDH2的基因工程制备,目的基因克隆在pET44b(+)质粒的I和RI位点之间,上游引入了8个His-tag用于亲和纯化,下游引入了终止密码TAA。制备的重组ALDH2以无活性包涵体形式存在于沉淀中,分子质量约为55 kDa,上清液中几乎看不到ALDH2重组蛋白(图11)。

图11 野生型ALDH2的表达情况Fig. 11 SDS-PAGE analysis of expression of wild-type ALDH2
野生型ALDH2经过纯化和复性,最终得到的重组蛋白活性为1.43 U/mL,低于以融合表达方法制备的重组蛋白。
3 讨 论
ALDH2是非常具有市场前景的解酒用蛋白酶,主要以同型亚基四聚体的形式存在,每个亚基含有518个氨基酸,分子质量为55 kDa。关于其催化机理,相关研究表明ALDH2的催化残基包括Asn169、Glu268和Cys302,其中,Asn169的侧链酰胺基、Cys302的主链亚胺基与底物醛基的氧原子形成相互作用,Cys302的侧链巯基负责亲核攻击底物醛基的碳原子从而形成过渡态中间体,而Glu268负责活化水分子,使之能与过渡态中间体反应,形成最终的产物,辅酶NAD在整个催化反应中起着接受质子的作用,最后转变为NADH。
由于ALDH2在解酒方面的应用潜力,许多科研工作者进行了相关的研究。在ALDH2的基因工程制备方面,毕赤酵母和大肠杆菌是应用最多的两种宿主细胞,但是毕赤酵母的生长周期长、产量低、基因工程操作比较复杂。黄锟等利用毕赤酵母分泌表达ALDH2,得到的重组蛋白活性仅为0.115 U/mL,赵锦等通过毕赤酵母制备的ALDH2活性为0.315 U/mL,活性较低。而大肠杆菌表达系统具有操作简单、产量高、生长周期短等优点,因此被广泛使用。但是,以大肠杆菌为宿主细胞,采用常规基因工程方法制备的ALDH2通常会形成无活性的包涵体,虽然可以通过复性恢复部分活性,但是,增加了生产工艺的复杂性。
以往研究表明,在大肠杆菌中外源蛋白与NusA融合表达时能表现出较好的可溶性,部分重组蛋白在保留NusA-tag时仍具备生物活性,多数重组蛋白在切除NusA-tag后活性得到了不同程度的提高。因此,本研究将NusA-tag与ALDH2融合表达,以消除ALDH2包涵体,结果表明这种方法的确可以提高重组蛋白的可溶性。刘向宇等将内含肽标签与ALDH2融合表达,但融合蛋白仍以包涵体形式存在,还需要经过变性和复性过程来恢复活性。所以,融合标签的选择也是一个重要的因素。
在本研究中,通过融合表达制备的重组蛋白酶活力为1.64 U/mL,略高于文献报道的ALDH2包涵体复性后的活性,例如,黄娟制备的野生型ALDH2包涵体经过变性和复性,最终的活性为1.449 U/mL,而本实验室制备的野生型ALDH2包涵体复性后的活性为1.43 U/mL。因此,将增溶标签NusA与ALDH2融合表达既可以实现重组蛋白的可溶表达,简化了生产工艺,还可以使重组蛋白具有更好的活性。
