基质结构对纳米结构脂质载体中叶黄素生物利用度的调控机制
2022-07-07李新甜徐亚元张钟元戴竹青聂梅梅李大婧张国栋
李新甜,徐亚元,张钟元,戴竹青,冯 蕾,聂梅梅,李大婧,张国栋,张 兴
(1.江苏省农业科学院农产品加工研究所,江苏 南京 210014;2.南京农业大学食品科技学院,江苏 南京 210095;3.江苏艾兰得营养品有限公司,江苏 泰州 214504)
叶黄素是一种广泛存在于深绿色蔬菜、水果和花卉中的脂溶性类胡萝卜素,具有抗氧化、保护视力、预防心血管疾病和癌症等多种生理功能。然而,叶黄素由于其分子结构中存在较多疏水基团,在人体消化环境中溶解度极低,容易在消化道中结晶析出而不易转移至混合胶束,降低了人体对它的吸收和生物利用,这在很大程度上限制了叶黄素作为一种功能性营养素在食品和医药等领域的应用。研究发现,构建合适的纳米递送载体可有效改善叶黄素生物利用度并起到缓释作用。
纳米结构脂质载体(nanostructured lipid carriers,NLCs)是在固体纳米颗粒的基础上发展起来的新型纳米脂质载药体系,由液体油脂、固体油脂和乳化剂构成。根据生产方法和固液态油脂构成比例的不同,NLCs可分为缺陷型、复合型和无定型NLCs。由于叶黄素等脂溶性活性物质在液体油脂中的溶解度更高,NLCs中高浓度液体油可以提高其药物负载量,但是液体油的比例不可以无限增加,它存在临界水平,脂质基质中液体油含量过多可能会导致NLCs中活性物质发生“突释”,降低活性物质的生物利用率。研究发现,NLCs中的液体油可以通过降低结晶度和促进脂质基质的多态性转变提高NLCs的消化率。因此,NLCs固液态油脂比例的选择至关重要,因为它可以控制脂质基质的消化、胶束化和活性物质的释放,并最终控制其生物利用度。
本研究采用高压微射流技术制备不同基质结构叶黄素纳米结构脂质载体(lutein-loaded nanostructured lipid carriers,Lutein-NLCs),对不同基质结构Lutein-NLCs的晶体热力学特性和固化层厚度等结晶行为进行研究,并基于模拟体外消化实验,探明Lutein-NLCs基质结构通过调控结晶行为对脂质消化、叶黄素释放、胶束形成和生物可给率的调控作用,以期为提高脂溶性活性物质的生物利用度奠定理论基础,同时为NLCs在亲脂活性成分递送方面的应用提供新思路和理论指导。
1 材料与方法
1.1 材料与试剂
叶黄素(纯度>80%)、山嵛酸甘油酯、亚麻籽油、吐温80(Tween 80) 上海源叶生物科技有限公司;胰脂肪酶、胃蛋白酶 南京奥多福尼生物科技有限公司;猪胆盐 北京奥博星生物技术有限责任公司;无水乙醚(分析纯) 南京化学试剂股份有限公司;庚烷(分析纯)、乙腈(色谱纯)、异丙醇(色谱纯)上海麦克林生化科技有限公司;其余化学试剂均为分析纯,购自国药集团化学试剂公司。
1.2 仪器与设备
Q20差示扫描量热仪 美国沃特世科技有限公司;NICOMP Z3000纳米粒度电位仪 美国PSS粒度仪公司;LM20微射流纳米均质机 美国微射流均质机有限公司;GI20体外模拟消化系统 澳大利亚国家仪器公司;Elx-800酶标仪 美国BioTek公司;85-2A数显测速恒温磁力搅拌器 常州金坛华伟仪器厂;1200高效液相色谱仪美国安捷伦科技有限公司;BS224S电子分析天平 北京赛多利斯科学仪器公司;TG16-WS台式高速离心机 湖南湘仪离心机仪器有限公司;FE20实验室pH计 上海梅特勒-托利多仪器有限公司;D10氮气吹扫仪 杭州奥盛仪器有限公司。
1.3 方法
1.3.1 Lutein-NLCs的制备
参考程喆等的方法采用高压微射流法制备Lutein-NLCs:称取一定量的亚麻籽油和山嵛酸甘油酯混合后于80 ℃条件下加热熔化,然后加入叶黄素(占总油脂的质量分数为5%),通过搅拌使其溶解在混合油脂中。将加热到80 ℃的95%(/)Tween 80溶液(1%,/)迅速加入到5%(/)混合油脂中,在12 000 r/min搅拌10 min形成预乳液,然后经高压微射流(20 300 psi,4个循环)后迅速冷却得到Lutein-NLCs。亚麻籽油与山嵛酸甘油酯的质量比分别为90%∶10%、60%∶40%、30%∶70%、10%∶90%。
1.3.2 差示扫描量热分析
称取10 mg Lutein-NLCs放入铝制样品盘中,以相应的混合油脂作对照,并准确记录样品的质量。氮气以50 mL/min速率吹扫,以5 ℃/min的加热速率将样品在0~120 ℃范围内加热,空的样品盘作为参考。
1.3.3 固化层厚度的分析
参考Salminen等的方法对固化层厚度进行计算。假设Lutein-NLCs颗粒呈球形,其粒径呈单峰分布,并且不忽略球的外壳部分,根据不同基质结构Lutein-NLCs中液体油脂占总油脂的质量分数,可以通过式(1)计算球的外壳厚度,即固化层的厚度。本实验制得的Lutein-NLCs纳米颗粒的体积平均直径()在20~120 nm之间,故对体积平均半径在10~60 nm之间的Lutein-NLCs纳米颗粒的固化层厚度进行理论计算。
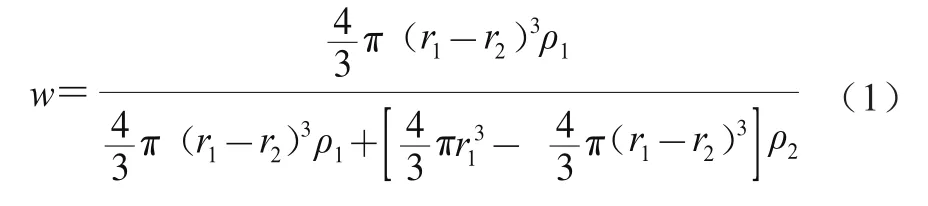
式中:为液体油脂占总油脂的质量分数/%;为Lutein-NLCs纳米颗粒的体积平均半径/nm;为固化层厚度/nm;为亚麻籽油的密度/(g/cm);为山嵛酸甘油酯的密度/(g/cm)。
1.3.4 模拟体外消化实验
体外消化参考Mutsokoti等的方法,并进行适当修改。体外消化过程在弱光条件下进行。胃消化法:称取5 g Lutein-NLCs产品于消化管中,加10 mL模拟胃液(3.5 mmol/L KHPO、10 mmol/L CaCl·2HO、3.6 mmol/L MgCl·6HO、6 mmol/L KCl、120 mmol/L NaCl),用0.1 mol/L HCl溶液调节pH 2.00±0.05,加入3.2 mg/mL胃蛋白酶。盖上盖子后置于体外消化仪(37 ℃、120 r/min)消化1 h。
肠消化法:取出消化管,用0.1 mol/L NaOH溶液调节pH 7.0±0.05,加入20 mL胰脂肪酶-胆盐消化液(胰酶30 mg/mL,胆盐28 mg/mL,用0.1 mol/L NaHCO溶液配制)。盖上盖子后置于体外消化仪(37 ℃、120 r/min)消化4 h。
1.3.5 粒径和Zeta电位分析
在模拟体外消化过程中,分别取初始乳液、胃、肠消化结束时的消化液测定粒径和Zeta电位。测定前需要用10 mmol/L磷酸盐缓冲液(pH 7.0)稀释,稀释10 倍用于粒径测定,稀释1 000 倍后用于Zeta电位测定。
1.3.6 叶黄素释放率的测定
参考Liu等的方法并进行适当修改。在模拟肠消化过程中,于设定时间(7.5、15、30、45、60、90、120、180 min和240 min)取1 mL消化液,加入3 mL正己烷,旋涡混匀后,3 000 r/min离心5 min,收集上层有机相,重复上述过程3 次,合并所有有机相,经N吹干后用甲醇复溶,在450 nm波长下测定吸光度。叶黄素释放率计算如式(2)。叶黄素的标准曲线为=0.085-0.032 5,=0.998 2。

式中:为消化过程中消化液中叶黄素质量/g;为初始乳液中叶黄素质量/g。
1.3.7 生物可给率的测定
参考Luo Hao等的方法并略作修改。在模拟肠消化过程中的设定时间取1 mL消化液于4 ℃、10 000 r/min离心1 h以获得上层胶束部分。取胶束相加入1 mL混合提取液(正己烷-乙醇-丙酮-甲苯(10∶6∶7∶7,/)),振荡摇匀,静置过夜分层,然后加入1 mL正己烷和1.5 mL 10 g/100 mL硫酸钠溶液,静置10 min后取出有机层,重复加1 mL正己烷,提取至下层无色或淡黄色,合并上清液,氮气吹干后用甲醇复溶,用0.45 μm有机滤器过滤后在450 nm波长处测定样品的吸光度。生物可给率计算如式(3)所示:
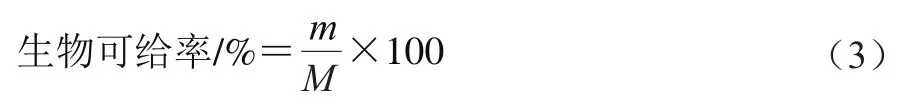
式中:为消化过程中胶束中叶黄素质量/g;为初始乳液中叶黄素质量/g。
1.3.8 脂肪酸含量和甘油酯成分的分析
脂质提取参考Verrijssen等的方法,略有修改。取1 mL样品(消化液和胶束),加入含有2 mL乙醇、3 mL乙醚-庚烷(1∶1,/)和0.2 mL 2.5 mol/L硫酸溶液的混合提取液中,涡流混匀2 min后200 r/min搅拌30 min。20 ℃、2 000 r/min离心5 min,收集上层有机相。此后,按上述方法重新往下层部分添加1 mL乙醚-庚烷(1∶1,/),搅拌15 min,提取有机相。合并有机相于容量瓶中,用乙醚-庚烷定容至5 mL。将收集的有机相过滤(Chromafil PET过滤器,孔径0.2 μm,直径25 mm)到棕色小瓶中,待高效液相色谱分析。
采用高效液相色谱分析脂肪酸含量及甘油酯的组成和含量。色谱条件参考洪颖的方法并作修改。采用C反相色谱柱(4.6 mm×250 mm,5 μm)和蒸发光散射检测器进行脂肪酸和甘油酯的高效液相色谱分析。蒸发光检测器的N流速1 mL/min;漂移管温度55 ℃;增益1。流动相:A为乙腈, B为异丙醇;柱温30 ℃;流速1.0 mL/min;进样量10 μL;梯度洗脱程序:0~10 min,70%~60% A、30%~40% B;10~40 min,60%~50% A、40%~50% B;40~55 min,50%~70% A、50%~30% B。
1.3.9 动力学模型
采用Verkempinck等的方法对不同基质结构Lutein-NLCs的脂质消化、叶黄素释放、胶束形成和叶黄素胶束化过程的实验数据进行拟合,通过非线性回归进行参数估计。在模拟消化过程中,由于胃相中缺乏胰脂肪酶和胆盐,Lutein-NLCs的脂解和叶黄素的胶束化不会在胃相中发生。因此,肠消化开始时消化液中甘油三酯(triacylglycerols,TAGs)浓度作为初始乳液中TAGs浓度,即为100%;消化液或胶束组分中甘油一酯(monoacylglycerols,MAGs)和游离脂肪酸(free fatty acids,FFAs)初始浓度、叶黄素释放率、生物可给率的初始值假定为0。根据式(4)对实验数据进行拟合,所有模型曲线均通过计算和可视化分析残差图评估模型的拟合度。

式中:C为模拟肠消化时间时的参数值;为模拟肠消化时的初始参数值;为肠消化时间=∞时的估计渐近参数值;为反应速率常数/min;为模拟肠消化时间/min。
1.4 数据分析

2 结果与分析
2.1 基质结构对Lutein-NLCs热力学性质的影响
表1显示,与纯山嵛酸甘油酯相比,混合油脂的熔点和焓值均降低,峰宽(熔化起点到终点的温度跨度)增加,并且随着亚麻籽油质量分数增加,混合油脂的峰宽逐渐增加,熔点和焓值均逐渐降低,这表明亚麻籽油的引入会破坏固体脂质的结晶状态,导致晶体的有序性和结晶结构降低。与混合油脂相比,Lutein-NLCs的焓值降低,并且随着亚麻籽油质量分数增加,Lutein-NLCs的熔点和焓值均呈现先增加后降低的趋势,Lutein-NLCs的熔点和焓值均在亚麻籽油质量分数(亚麻籽油占总混合油脂的质量分数)为30%时出现“拐点”。由于随着NLCs中液体油含量增多,NLCs结构会发生从缺陷型到复合型的转变,因此,推测当亚麻籽油质量分数为低于30%时,体系有利于形成缺陷型Lutein-NLCs,当亚麻籽油质量分数为高于30%时,体系有利于形成复合型Lutein-NLCs。

表1 混合油脂和Lutein-NLCs的热力学参数Table 1 Thermodynamic parameters of mixed lipids and Lutein-NLCs
2.2 基质结构对Lutein-NLCs的固化层厚度的影响
不同粒径下理论固化层厚度随亚麻籽油质量分数的变化情况以及固化层厚度和体积平均粒径随亚麻籽油质量分数的变化情况如图1所示。理论计算结果(图1A)显示,随着亚麻籽油质量分数的增加,固化层厚度逐渐降低;随着体积平均粒径的减小,固化层厚度也逐渐降低。根据本实验构建的Lutein-NLCs固化层厚度的计算结果(图1B),随着亚麻籽油质量分数增加,Lutein-NLCs的固化层厚度逐渐降低,这与晶体的热力学性质有关;当脂质基质中亚麻籽油质量分数低于60%时,Lutein-NLCs固化层厚度随着体积平均粒径的减小而降低;而基质中亚麻籽油的质量分数高于60%,Lutein-NLCs固化层逐渐减小但是体积平均粒径逐渐增大,这是因为含有高含量液体油的Lutein-NLCs在高压均质过程中,颗粒容易聚集,导致体积平均粒径变大。

图1 不同粒径下的理论固化层厚度(A)以及固化层厚度和体积平均粒径(B)随亚麻籽油质量分数的变化Fig. 1 Changes in theoretical solidified layer thickness under different volume mean particle sizes (A) and changes in solidified layer thickness and volume mean particle size (B) with concentration of linseed oil
2.3 不同消化阶段Lutein-NLCs粒径的变化

图2 消化过程中不同基质结构Lutein-NLCs的粒径变化Fig. 2 Changes in particle size of Lutein-NLCs with different matrix structures during digestion
如图2所示,不同基质结构Lutein-NLCs初始粒径均小于200 nm,经过胃消化后,其粒径均显著增加(<0.05),表明Lutein-NLCs在胃中发生了颗粒聚集现象,这主要由于胃液的高离子强度、强酸性以及阴离子胃蛋白酶的存在,Lutein-NLCs颗粒间的静电排斥减少。经过肠消化后,Lutein-NLCs的粒径均显著降低(<0.05),这是由于肠液中胰脂肪酶对Lutein-NLCs脂质的水解,产生了多种胶束粒子,包括未消化的脂滴、混和胶束和不溶性钙皂等。
2.4 不同消化阶段Lutein-NLCs电位的变化
在模拟体外消化过程中不同基质结构Lutein-NLCs的Zeta电位变化情况如图3所示。经胃消化后,不同基质结构Lutein-NLCs的Zeta电位绝对值均降低,表明Lutein-NLCs表面的负电荷含量减少,这是因为高离子强度的胃液可以通过静电屏蔽作用降低Zeta电位。进入小肠相后,Lutein-NLCs的负电荷显著增加(<0.05),这主要与肠液中的胆盐、FFAs等阴离子物质有关。
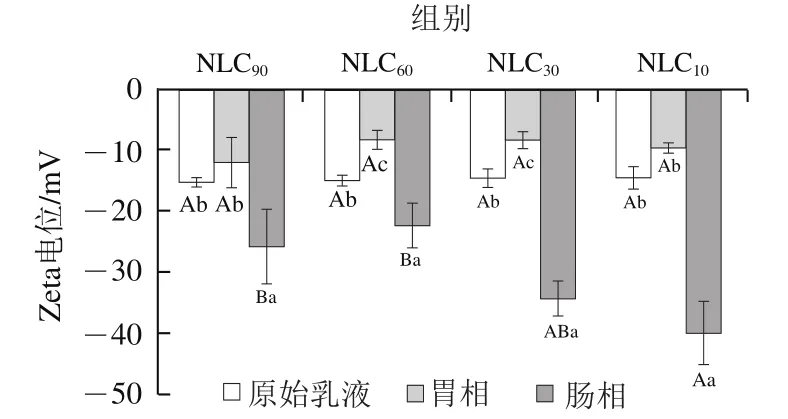
图3 消化过程中不同基质结构Lutein-NLCs的Zeta电位的变化Fig. 3 Changes in zeta potential of Lutein-NLCs with different matrix structures during digestion
2.5 基质结构对Lutein-NLCs脂质水解反应动力学的影响
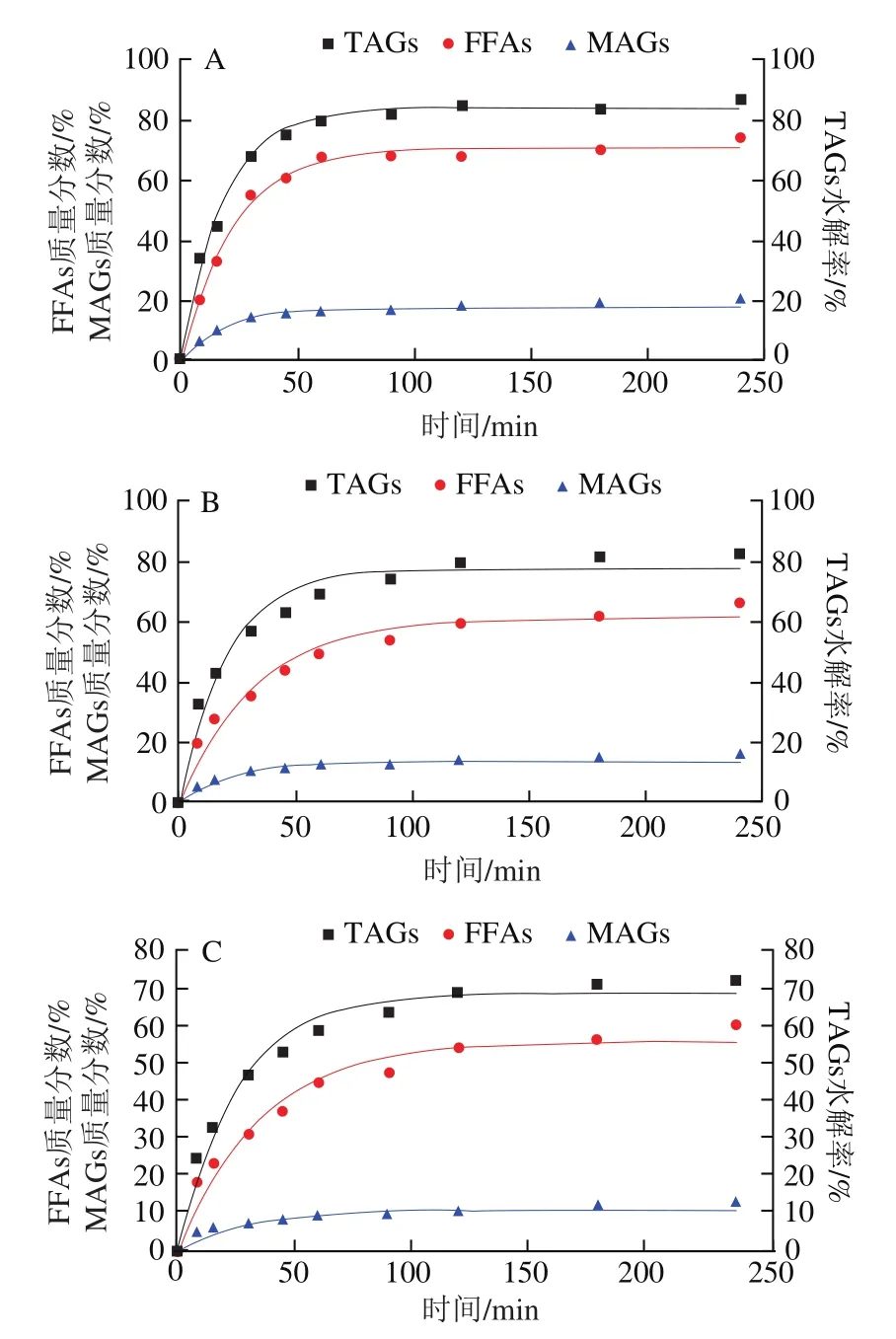

图4 不同基质结构Lutein-NLCs中脂质水解情况Fig. 4 Hydrolysis of lipids from Lutein-NLCs with different matrix structures

表2 不同基质结构Lutein-NLCs的脂质水解动力学参数Table 2 Kinetics parameters for lipid hydrolysis from Lutein-NLCs with different matrix structures
油脂的消化主要发生在小肠阶段,在小肠中,脂质中的TAGs被胰脂肪酶水解产生FFAs和MAGs,这些脂解产物与胆汁盐、磷酸等成分结合,形成混合胶束,以溶解负载脂溶性活性物质。由图4可知,消化初期,不同基质结构Lutein-NLCs的TAGs水解产物含量均呈线性增加,在消化的4 h内,所有样品水解的TAGs含量均达到稳定值,但是TAGs的水解率在60%~85%之间,脂质水解不完全,这可能是由于脂肪水解产物在界面的积累以及NLCs在胃相发生聚集,使得脂肪酶在油水界面的吸附面积降低;此外,TAGs水解的过程中伴随着FFAs和MAGs的释放,其中FFAs的释放量远高于MAGs,一方面是由于胰脂肪酶水解TAGs时,每分子TAG能水解产生两分子FFAs和一分子MAG;另一方面是由于在脂质水解过程中其释放的MAGs进一步水解成了FFAs,Tokle等的研究也发现了该现象。表2显示了不同基质结构Lutein-NLCs的脂质水解动力学参数。随着油脂基质中亚麻籽油质量分数的增加,TAGs水解的和值均显著降低(<0.05),消化结束时,NLC的TAGs的值和值最高,分别为84.02%和0.057 min,显著高于NLC、NLC和NLC(<0.05),NLC的TAGs的和值最低,分别为63.28%和0.031 min。FFAs和MAGs释放的和值变化规律与TAGs相似,即随着亚麻籽油质量分数的增加,FFAs和MAGs释放的和值均逐渐降低。不同基质结构Lutein-NLCs的脂质水解的差异可能与多不饱和脂肪酸含量有关,亚麻籽油富含多不饱和脂肪酸,山嵛酸甘油酯富含多饱和脂肪酸,多不饱和脂肪酸的弯曲结构造成空间位阻效应,以及多不饱和脂肪酸具有更高的表面活性,在油水界面与脂肪酶发生竞争性吸附,导致亚麻籽油质量分数高的Lutein-NLCs的脂质基质不容易被脂肪酶水解。
2.6 基质结构对Lutein-NLCs中叶黄素释放动力学的影响
图5显示,在肠消化过程中,随着时间的推移叶黄素释放率先快速增加后逐渐趋于稳定,不同基质结构Lutein-NLCs的叶黄素释放率达到稳定状态所需的时间存在差异,这体现了其叶黄素释放速率存在差异,图5显示除NLC外,随着亚麻籽油质量分数的增加,Lutein-NLCs的叶黄素释放速率逐渐增加,表3中的速率常数值也体现了这一规律,这可能是由于随着亚麻籽油质量分数增加,Lutein-NLCs的固化层厚度逐渐降低(图1),Lutein-NLCs的脂质更容易被脂肪酶水解而释放叶黄素。在消化结束时,NLC的叶黄素释放率最高,为73.74%,显著高于NLC、NLC和NLC(<0.05),而NLC的叶黄素释放率最低,为58.32%。

图5 不同基质结构Lutein-NLCs在消化过程中的叶黄素释放率的变化Fig. 5 Changes in degree of lutein release from Lutein-NLCs with different matrix structures during digestion

表3 消化过程中不同基质结构Lutein-NLCs中叶黄素释放动力学参数Table 3 Kinetics parameters for lutein release from Lutein-NLCs with different matrix structures during digestion
2.7 基质结构对Lutein-NLCs胶束形成动力学的影响
图6显示,消化7.5 min时,在胶束中检测到FFAs和MAGs的存在,表明肠消化开始时MAGs和FFAs就参与混合胶束形成,在消化过程中,胶束中FFAs和MAGs的含量逐渐增加,直至达到稳定状态,并且在消化过程中胶束组分中的FFAs浓度显著高于MAGs浓度。此外,表4表明,在模拟消化过程中,随着亚麻籽油质量分数的增加,Lutein-NLCs消化释放的MAGs和FFAs的胶束化程度和速率均呈显著上升趋势(<0.05),与MAGs、FFAs释放规律一致,这是因为胶束是由胆盐和脂肪消化产物混合而成的,MAGs、FFAs释放的规律会影响两者参与胶束形成的规律。然而,在消化过程的任意时刻,胶束中MAGs、FFAs含量均低于消化液,这表明并非所有的MAGs、FFAs均参与混合胶束的形成,这与Verkempinck等的研究一致,并且该研究表示参与胶束形成的MAGs和FFAs的含量取决于油脂的类型。

图6 不同基质结构Lutein-NLCs胶束中MAGs和FFAs的含量Fig. 6 Concentrations of MAGs and FFAs in micelles from Lutein-NLCs with different matrix structures

表4 不同基质结构Lutein-NLCs脂质消化产物胶束化的动力学参数Table 4 Kinetics parameters for micellization of lipid digestion products from Lutein-NLCs with different matrix structures
2.8 基质结构对Lutein-NLCs中叶黄素生物可给率动力学的影响
如图7所示,在肠消化过程中,叶黄素的生物可给率呈线性增加直至达到稳定值,NLC的叶黄素生物可给率达到稳定值所需时间最短,而NLC所需时间最长,叶黄素胶束化速率常数值变化(表5)也反映了这一点,即NLC的值最大,为0.208 min,显著高于NLC和NLC,而NLC的值最小,只有0.058 min,值可以反映叶黄素胶束化速率,因此NLC的叶黄素以最快的速度掺入到胶束中。消化结束时,NLC的叶黄素生物可给率最高,为68.50%,但与NLC没有显著差异,当亚麻籽油质量分数低于90%时,随着亚麻籽油质量分数增加,Lutein-NLCs的叶黄素生物可给率逐渐降低,这主要是因为高含量亚麻籽油中的多不饱和脂肪酸含量高,导致Lutein-NLCs的脂质水解降低,进而导致FFAs和MAGs胶束化程度,影响了混合胶束的形成,因而生物可给率降低。

图7 消化过程中不同基质结构Lutein-NLCs中叶黄素的生物可给率Fig. 7 Bioaccessibility of Lutein-NLCs with different matrix structures during digestion

表5 不同基质结构Lutein-NLCs的叶黄素生物可给率动力学参数Table 5 Kinetics parameters for bioavailability of Lutein-NLCs with different matrix structures
2.9 不同基质结构Lutein-NLCs脂质消化与生物可给率的关系
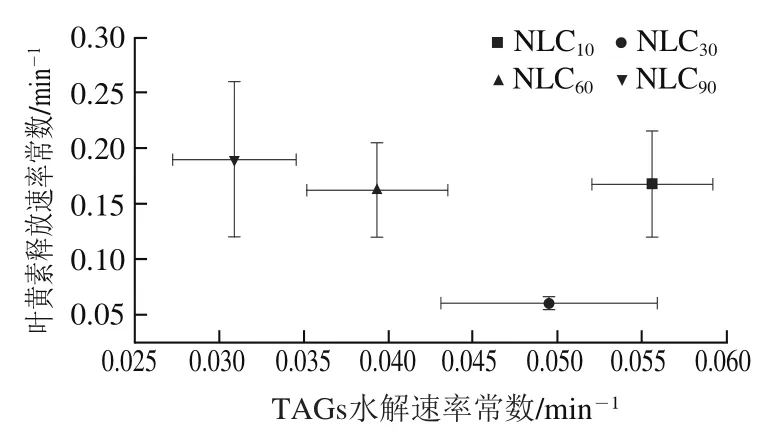


图8 TAGs释放、叶黄素释放、FFAs和MAGs胶束化以及叶黄素生物可给率的k值和Cf值的关系Fig. 8 Relationship between k-values and Cf-values for TAGs release,lutein release, micellization of FFAs and MAGs, and lutein bioavailability
通过动力学参数值和值评估TAGs水解与叶黄素释放、MAGs和FFAs释放与其胶束化、叶黄素释放与叶黄素生物可给率、MAGs和FFAs胶束化与叶黄素生物可给率之间的关系,从而阐明不同基质结构Lutein-NLCs的脂质消化对叶黄素释放和生物可给率的影响。TAGs释放、FFAs和MAGs释放、叶黄素释放、FFAs和MAGs胶束化、叶黄素生物可给率的值和值的关系如图8所示。结果显示,不同基质结构Lutein-NLCs的MAGs和FFAs释放速率和程度与MAGs和FFAs胶束化的速率和程度具有显著正相关,相关系数分别为0.985 3和0.954 4。亚麻籽油质量分数大于10%时,随亚麻籽油质量分数增加,Lutein-NLCs的TAGs水解值逐渐降低,而叶黄素释放及其胶束化的值均逐渐升高,并且随着MAGs和FFAs胶束化速率的增加,叶黄素胶束化速率逐渐降低;随着叶黄素释放速率和程度的增加,叶黄素胶束化速率和生物可给率逐渐增加。叶黄素释放值与TAGs水解值没有显著关系。
3 结 论
通过分析晶体热力学性质、固化层厚度、脂肪酸和甘油酯含量、叶黄素释放率、生物可给率等探究基质结构对Lutein-NLCs中叶黄素生物利用度的调控作用。根据Lutein-NLCs的焓值和熔点可以推测出,当亚麻籽油质量分数为低于30%时,体系有利于形成缺陷型Lutein-NLCs,当亚麻籽油质量分数为高于30%时,体系有利于形成复合型Lutein-NLCs。随着亚麻籽油质量分数增加,Lutein-NLCs的固化层厚度逐渐降低。脂质水解动力学实验表明,亚麻籽油质量分数低于90%时,随亚麻籽油质量分数增加,Lutein-NLCs的脂质基质中多不饱和脂肪酸增加,这会限制脂肪酶的水解作用,导致Lutein-NLCs脂质水解率、FFAs和MAGs的释放率以及叶黄素生物可给率均逐渐降低。亚麻籽油质量分数高于10%时,Lutein-NLCs的叶黄素释放速率随TAGs水解速率的增加而降低;此外,随着MAGs、FFAs胶束化速率增加,叶黄素胶束化速率逐渐降低;随着叶黄素释放速率和程度增加,叶黄素胶束化速率和生物可给率逐渐增加,为NLCs在新型功能食品递送领域中的应用提供科学理论依据。
