甲鱼蛋α-葡萄糖苷酶抑制肽及其纳米运载体的体外胃肠消化特性
2022-07-07裘乐芸王瑞艳邓泽元郑溜丰
肖 婷,裘乐芸,王瑞艳,李 男,邓泽元,郑溜丰
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
随着经济发展和人们膳食结构的改变,糖尿病发病率在全球范围内逐年递增。据估计,2045年全球患病人数将超过7亿。餐后血糖浓度过高是糖尿病前期患者的主要特征,持续性高血糖与-葡萄糖苷酶活性密切相关。-葡萄糖苷酶抑制剂可通过减缓碳水化合物的消化控制餐后血糖峰值,是临床中的一线降糖药物。近年来,多肽作为安全有效的-葡萄糖苷酶抑制剂备受关注。Yu Zhipeng等从鸡蛋清水解物中分离得到具有-葡萄糖苷酶抑制活性的肽段,并证实RVPSLM的抑制活性效果最好,半抑制浓度(half maximal inhibitory concentration,IC)为23.07 µmol/L。朱作艺等以蜂王浆粗蛋白为肽源制备-葡萄糖苷酶抑制肽,其IC为6.94 mg/mL。史加加用胃蛋白酶和胰蛋白酶水解西藏牦牛奶渣酪蛋白,得到的酶解液对-葡萄糖苷酶的抑制率达72%。甲鱼蛋是制备-葡萄糖苷酶抑制肽的一种优质来源。Qiu Leyun等利用木瓜蛋白酶水解甲鱼蛋,酶解液经超滤得到的组分(分子质量<2.5 kDa)具有较强的-葡萄糖苷酶抑制能力,并从中鉴定出16种-葡萄糖苷酶抑制肽。
普遍认为,生物活性肽在胃中易变性、易被蛋白酶降解,生物利用度被严重降低。因此,通常通过包埋活性肽,以避免肽在体内发挥活性前被降解,从而延长保留时间,提高吸收利用率。利用天然生物大分子的特性和纳米技术联合制备运载体系对多肽类物质进行包埋,对提高生物活性肽的蛋白酶水解稳定性,从而解决生物利用率低的问题具有重要指导意义。外泌体是一类直径在40~100 nm之间的囊泡样小体,由于独特的纳米级结构以及低免疫原性、高稳定性、高运载效率、靶向性和渗透性等优势,外泌体作为一种新型运载体系已成为众多研究者关注的焦点。Sun Dongmei等将姜黄素封装在外泌体中,外泌体-姜黄素复合物的形成提高了姜黄素的溶解度、体外稳定性、抗炎活性及体内生物利用度。Fan Yue等发现小胶质细胞分泌的外泌体是白藜芦醇的优良载体,包埋2 h后白藜芦醇的体内浓度增加,并且降解率低于30%。Wang Piaopiao等用外泌体作为紫杉醇的载体制备纳米复合物,发现外泌体-紫杉醇对4T1荷瘤小鼠表现出较紫杉醇更强的抗肿瘤作用。固体脂质纳米颗粒(solid lipid nanoparticles,SLN)是20世纪90年代初发展的一种新型固体胶粒运载体系,粒径在40~1 000 nm。SLN理化性质稳定、生物利用度高、安全性高,同时能够保护运载物质不被降解。Liu Mengyao等成功将叶黄素封装在不同脂质载体中并进行体外模拟胃肠消化,发现SLN-叶黄素的体外生物利用度最高。Sacchetti等用SLN运载一种亲水性八肽LSCQLYQR,结果表明该肽在SLN中具有良好稳定性且包埋率为23%。SLN可用作天然抗菌肽的良好载体,并保持抗菌活性长达20 d。目前对外泌体的研究大多集中在分离提取、鉴定与表征方面,对SLN的研究主要为其颗粒特征,而将两者用于包埋-葡萄糖苷酶抑制肽的研究鲜见报道。
实验前期已从甲鱼蛋蛋白水解产物中分离鉴定出具有-葡萄糖苷酶抑制特性的潜在抗糖尿病寡肽SGTLLHK,其IC为289 µmol/L。考虑到寡肽进入人体后面临的复杂体内环境会导致其生物利用率更低,难以发挥作用,为解决这一瓶颈问题,本研究选用寡肽SGTLLHK作为实验材料,探究甲鱼蛋-葡萄糖苷酶抑制肽的体外胃肠消化特性及其活性变化,并制备SGTLLHK-外泌体颗粒和SGTLLHK-SLN,以Zeta电位、粒径、多分散性指数(polymer dispersity index,PDI)、包埋率为指标,对比两种多肽-纳米颗粒包埋效果,并对其胃肠道稳定性进行研究,以期为甲鱼蛋-葡萄糖苷酶抑制肽的纳米化保护提供一定理论依据。
1 材料与方法
1.1 材料与试剂
寡肽SGTLLHK由生工生物工程(上海)股份有限公司合成,纯度达98%以上。
-葡萄糖苷酶(来源于酵母,50 U/mg) 上海源叶生物科技有限公司;胰蛋白酶(来源于猪胰腺,250 U/mg)、胃蛋白酶(来源于猪胃黏膜,3 000 U/mg)、对硝基苯基吡喃葡萄糖苷(4-nitrophenyl---glucopyranoside,-NPG)、甲酸(色谱级) 北京索莱宝科技有限公司;单硬脂酸甘油酯 上海阿拉丁生化科技股份有限公司;泊洛沙姆188 德国巴斯夫股份公司;外泌体提取试剂盒(细胞培养基上清) 上海贝博生物科技公司;乙腈(色谱级) 美国Sigma公司;氢氧化钠、乙醇、碳酸钠 西陇化工股份有限公司;浓盐酸 国药集团化学试剂有限公司。
1.2 仪器与设备
SHZ-A水浴恒温振荡器 上海博迅实业有限公司;JY-86-2-50型-80 ℃冰箱、Neofuge 15R型台式高速冷冻离心机 香港力康发展有限公司;磁力搅拌器 郑州亚荣仪器有限公司;SU8010扫描电子显微镜(scanning electron microscope,SEM)日本日立公司;1100型高效液相色谱仪、超高效液相色谱-串联四极杆飞行时间质谱(ultra-high performance liquid chromatography-quadrupole time of flight mass spectrometry,UHPLC-QTOF-MS/MS)美国Agilent公司;AR1140电子分析天平 奥豪斯仪器有限公司;Nano-ZS Zetasizer粒径分析仪 苏州安泰空气技术有限公司;EXL800全自动酶标仪 美国BioTek Instruments有限公司。
1.3 方法
1.3.1 体外模拟胃肠消化
参照Minekus等的方法并稍作修改。称取适量-葡萄糖苷酶抑制肽SGTLLHK用去离子水配成1 mg/mL标准溶液。取1 mL标准溶液加入1 mL胃蛋白酶溶液,用1 mol/L HCl溶液调节pH值至1.8,混合均匀(体系最终酶活力2 000 U/mL),于37 ℃避光反应2 h,收集胃消化液,90 ℃水浴10 min灭活蛋白酶,终止反应,冷却至室温,将胃消化液于4 ℃、10 000 r/min离心10 min,收集上清液进行测定。
在上述胃消化体系中继续加入2 mL胰蛋白酶溶液,用1 mol/L NaOH溶液调节pH值至7.0,充分混匀(体系最终酶活力100 U/mL),37 ℃避光反应2 h,收集肠消化液,90 ℃水浴10 min灭酶,冷却至室温,将胃肠消化液于4 ℃、10 000 r/min离心10 min,收集上清液,-20 ℃贮存备用。
1.3.2 消化液中肽段的鉴定
参照Wang Xuefeng等的方法并稍作修改。将收集到的消化液通过Empore™ SPE C小柱(6 mL)反相萃取脱盐,然后冷冻干燥并用体积分数0.1%甲酸溶液重悬,待UHPLC-QTOF-MS/MS进行肽段序列的鉴定。
HPLC条件:流动相A为体积分数0.1%甲酸溶液,B为体积分数84%乙腈溶液(含0.1%甲酸),Agilent RRHD Eclipse Plus C(2.1 mm×150 mm,1.8 μm)以95%的A相进行平衡,流速0.3 mL/min。样品由自动进样器Zorbax 300SB-CPeptide Traps上样,再经过液相色谱柱分离,梯度洗脱:0~1 min,96% A、4% B;1~30 min,96%~50% A、4%~50% B;30~34 min,50%~0% A、50%~100% B;34~35 min,0% A、100% B;柱温30 ℃;进样量1 µL。
MS鉴定:电喷雾离子源;正离子模式;扫描范围/100~1 800;碰撞能量30 eV;分析时长60 min。质谱测试原始文件用MaxQuant 1.5.5.1软件检索相应数据库,得到肽段鉴定及定量分析结果。查库相关参数:允许最大漏切位点数2;固定修饰Carbamidomethyl(C);可变修饰Oxidation(M);一级离子质量容差2×10;二级离子质量容差0.1 Da;错误发现率0.01。根据MaxQuant 中基于强度的绝对定量对鉴定的肽丰度进行量化。通过MS鉴定到的-葡萄糖苷酶抑制原肽及其产物的比例确定消化率。
1.3.3 消化液的-葡萄糖苷酶抑制活性测定
参照Yu Zhipeng等的方法并稍作修改。移取100 μL胃肠消化液与50 mL-葡萄糖苷酶溶液(0.35 U/mL)充分混合均匀,于37.5 ℃孵育20 min后,再加入100 μL 1 mmol/L-NPG,继续37.5 ℃孵育20 min,加入1 mol/L NaCO溶液终止反应,于410 nm波长处测定吸光度。用100 μL去离子水作为对照,-葡萄糖苷酶抑制率按式(1)计算:

1.3.4 多肽-SLN的制备
参照Chai Guihong等的方法并稍作修改。称取50 mg单硬脂酸甘油酯,溶解于50 mL无水乙醇中,在70 ℃水浴下磁力搅拌至均匀,加入50 mg寡肽SGTLLHK和50 mL 0.1%泊洛沙姆188,70 ℃、400 r/min继续搅拌5 min。然后室温放置使乙醇充分挥发,调节pH值至1.2,4 200 r/min离心20 min,取25 mL离心后的溶液加入50 mL 0.1%泊洛沙姆188中,经超声处理(超声2 s、间隙3 s,重复20 次)形成均匀白色乳液。将乳液于4 200 r/min离心20 min,获得上清液,即为SGTLLHK-SLN。
1.3.5 多肽-外泌体纳米颗粒的制备
1.3.5.1 外泌体的提取
参照外泌体提取试剂盒说明书提取牛乳外泌体。取-80 ℃贮藏牛乳于25 ℃恒温水浴锅解冻,完全解冻后移取10 mL于4 ℃、3 000 r/min离心20 min,去除大部分细胞和碎片。收集的上清液加入5 mL外泌体提取试剂,涡旋充分混合均匀后于4 ℃放置过夜。孵育后将提取液于4 ℃、10 000 r/min离心60 min,移去上清液,收集离心管底部的外泌体沉淀,用1 mL磷酸盐缓冲液重悬,于-80 ℃保存备用。
1.3.5.2 外泌体的特征分析
用去离子水稀释外泌体,配成质量浓度为1 mg/mL的悬液。取1 mL置于一次性毛细管中,使用粒径分析仪测定外泌体Zeta电位、粒径、PDI。测定3 次取平均值。
将外泌体冷冻干燥后用SEM观察。
取100 μL外泌体悬液,加入20 μL 6×上样缓冲液,涡旋混匀后沸水浴5 min使蛋白变性,冷却至室温。配制12%的分离胶和4%的浓缩胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),上样量10 μL,在70 V下使条带分离至浓缩胶与分离胶交界处,再在120 V下电泳至分离胶底部。
1.3.5.3 多肽-外泌体颗粒的制备
取0.2 mL外泌体悬液,加入1 mg寡肽SGTLLHK涡旋混合均匀后,经超声处理(超声30 s、间隙90 s,重复6 次),将超声后溶液于37 ℃下孵育60 min,回收外泌体膜。
1.3.6 多肽-纳米颗粒包埋率的测定
采用HPLC法测定游离肽含量计算多肽-纳米颗粒包埋率。Waters XBridg BEH SEC色谱柱(7.8 mm×300 mm,3.5 μm),二极管阵列检测器,流动相A为体积分数0.1%甲酸溶液,流动相B为体积分数0.1%甲酸-乙腈,柱温30 ℃,流速0.8 mL/min,检测波长214 nm,进样量10 μL。梯度洗脱条件为:0~3 min,98% A、2% B;3~6 min,98%~97% A、2%~3% B;6~9 min,97% A、3% B;9~15 min,97%~96% A、3%~4% B;15~18 min,96% A、4% B;18~21 min,96%~95% A、4%~5% B。肽包埋率按式(2)计算:
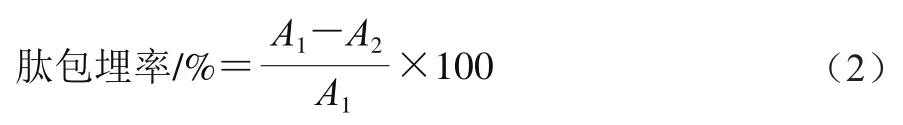
式中:、分别为包埋前后肽峰面积。
1.3.7 多肽-纳米颗粒的特征分析
方法同1.3.5.2节。
1.3.8 多肽-纳米颗粒的消化特性
方法同1.3.1和1.3.2节。
1.4 数据统计分析

2 结果与分析
2.1 α-葡萄糖苷酶抑制肽在体外模拟胃肠消化过程中的变化
活性肽在消化过程中会因pH值的急剧变化活性部分降低或丧失。因此,生物活性肽在模拟胃肠消化过程中的稳定对其在体内发挥正常的生理作用具有重要意义。通过分析胃肠道消化过程中肽段降解情况,从而确定多肽活性降低的具体消化阶段,可有针对性地保护肽段减少活性损失。如图1所示,原肽SGTLLHK在8.39 min左右出峰,经过模拟胃消化阶段后,胃消化产物在8.42 min左右出峰,经肠道消化后,峰右移,出峰时间为8.46 min。说明胃、小肠均对寡肽SGTLLHK有一定的消化作用且生成新的消化产物。
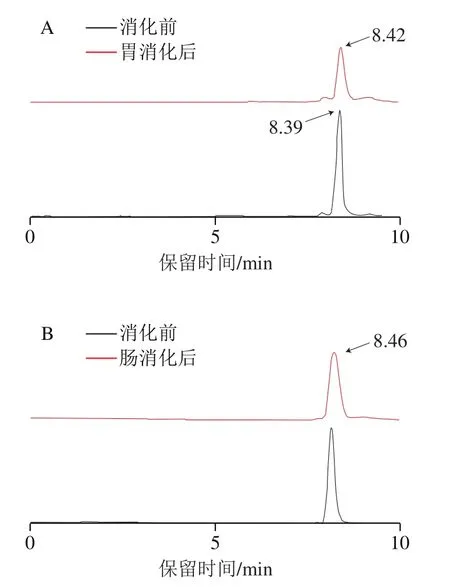
图1 SGTLLHK体外模拟胃(A)、肠道(B)消化的液相色谱图Fig. 1 HPLC profiles of SGTLLHK during in vitro simulated gastric (A) and gastrointestinal (B) digestion
2.2 胃肠消化产物的质谱鉴定
如图2所示,多肽MS/MS碎片离子主要为b离子和y离子。与谱库比对,SGTLLHK的胃消化产物共鉴别出2个序列,分别为SGTLL(Ser-Gly-Thr-Leu-Leu)和GTLL(Gly-Thr-Leu-Leu);结合图3可知,SGTLLHK在胃消化阶段被完全酶解成SGTLL和GTLL,其中SGTLL比例较高(占94.5%),而在肠消化阶段后仅存在SGTLL。说明-葡萄糖苷酶抑制肽SGTLLHK在胃消化阶段已被完全分解,可能是因为胃蛋白酶优先切割疏水性氨基酸,而SGTLLHK内部含有两个Leu,导致其对胃消化耐受性极低。
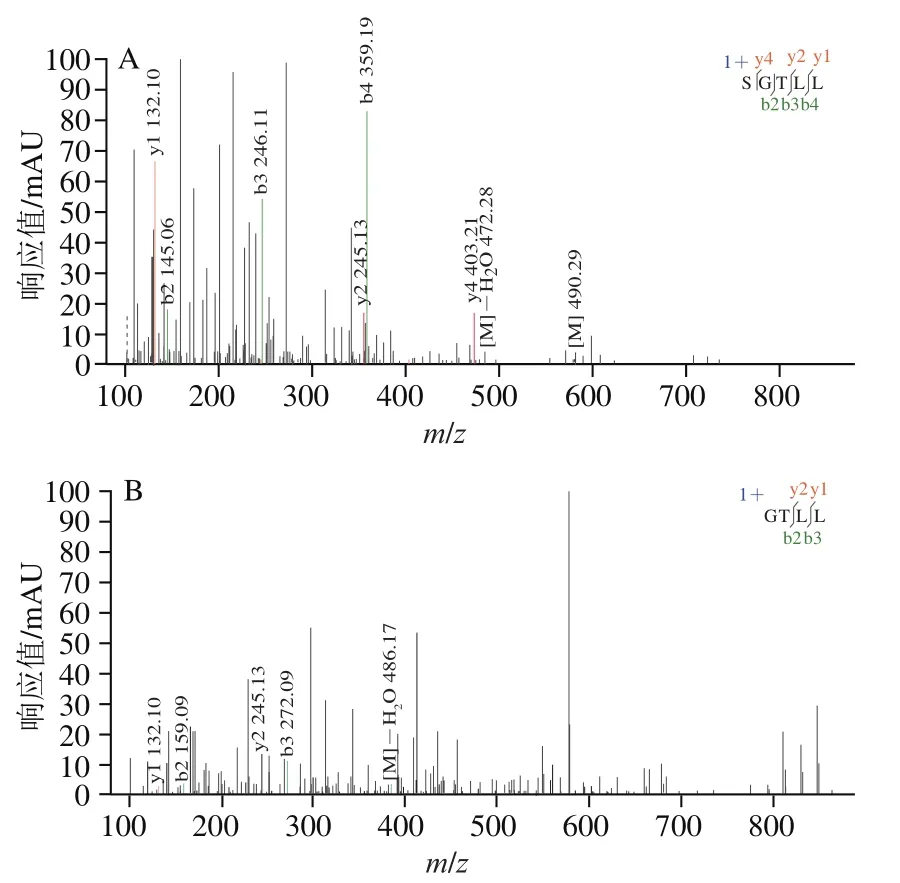
图2 SGTLLHK消化产物SGTLL(A)、GTLL(B)二级质谱图Fig. 2 ESI-MS/MS spectra of SGTLL (A) and GTLL (B) from the digestion products of SGTLLHK

图3 SGTLLHK主要消化产物占比Fig. 3 Proportions of major digestion products of SGTLLHK
2.3 消化后SGTLLHK的α-葡萄糖苷酶抑制活性
如图4所示,胃消化结束后消化液的-葡萄糖苷酶抑制活性显著升高,达到54.05%,而经肠消化后显著降低(<0.05),且低于未消化时。说明胃消化后肽段具有更好的-葡萄糖苷酶抑制能力,而肠消化产物抑制活性反而较低。氨基酸组成和结构决定多肽的生物活性。-葡萄糖苷酶抑制肽的活性可能与疏水性氨基酸含量有关,抑制-葡萄糖苷酶的多肽序列中疏水性氨基酸含量较高。Wang Rongchun等分析3种蛋白经碱性蛋白酶水解后的氨基酸组成,发现大豆蛋白酶解液中Pro(4.06%)、Tyr含量(2.59%)明显高于乳清蛋白和绿豆蛋白酶解液,且具有较高的-葡萄糖苷酶抑制活性(53.79%)。Zong Yafeng等研究-酪啡肽7(YPFPGPI)的降血糖功能,发现该肽会抑制小肠对葡萄糖的吸收,且主要由疏水性氨基酸组成。SGTLLHK受到胃蛋白酶切割,可能导致肽链内部某些疏水性基团暴露,其主要通过疏水性相互作用与-葡萄糖苷酶结合,从而产生竞争性抑制。因此,本研究经胃蛋白酶消化后SGTLLHK的-葡萄糖苷酶抑制活性显著增强,而经胰蛋白酶作用后,-葡萄糖苷酶抑制活性显著下降,推测可能是由于疏水性氨基酸含量降低,但还需进一步研究。综上,为使原肽SGTLLHK避免被胃液破坏且能到达小肠发挥对-葡萄糖苷酶的抑制作用,本实验选择纳米颗粒对该肽进行包埋,提高活性肽在胃肠消化过程中的稳定性。
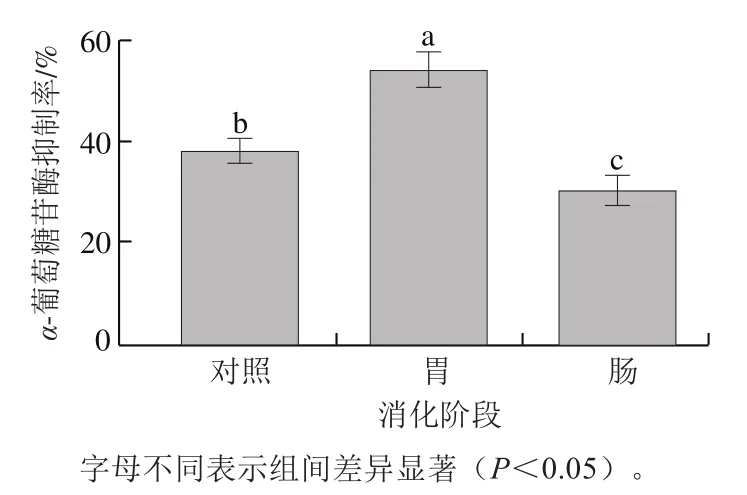
图4 消化后SGTLLHK的α-葡萄糖苷酶抑制活性Fig. 4 α-Glucosidase inhibitory activity of SGTLLHK after digestion
2.4 牛乳外泌体的特征鉴定
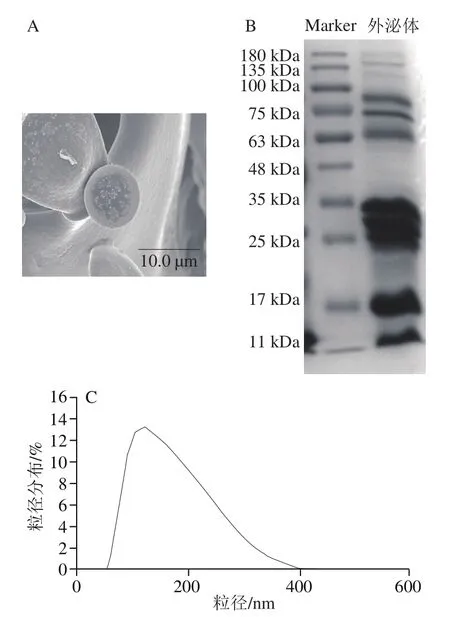
图5 牛乳-外泌体的SEM(A)、SDS-PAGE(B)和粒径分布(C)表征Fig. 5 SEM image (A), SDS-PAGE pattern (B) and particle size distribution (C) of milk-derived exosomes
牛乳成分复杂,含量丰富的脂质以脂肪球的形式大量存在,脂肪球与外泌体某些性质相似,此外还含有大量酪蛋白,其密度与外泌体密度十分接近。由表1可知,外泌体的Zeta电位为(-18.43±2.16)mV、粒径为(137.7±3.50)nm,PDI为0.13±0.02,呈较窄的分布范围。由图5可知,外泌体纳米颗粒表面光滑,形状呈球状且尺寸不均一,粒径在70~400 nm之间,峰值单一。乳源外泌体表征几乎均呈简单球形,且大部分粒径分布在30~200 nm。从SDS-PAGE图可以看出外泌体主要有6个明显条带,在76 kDa左右有明显的乳铁蛋白条带,其他条带可能为外泌体膜表面和外泌体内的蛋白质。

表1 牛乳外泌体的特性Table 1 Properties of cow milk-derived exosomes
2.5 多肽-纳米颗粒的包埋效果及特征
如图6所示,SLN和外泌体包埋后寡肽峰面积均明显减小,在SGTLLHK-SLN包埋体系中仅能检测到一小部分肽。SGTLLHK-外泌体纳米颗粒包埋率为31.98%,而SGTLLHK-SLN包埋率为96.05%。
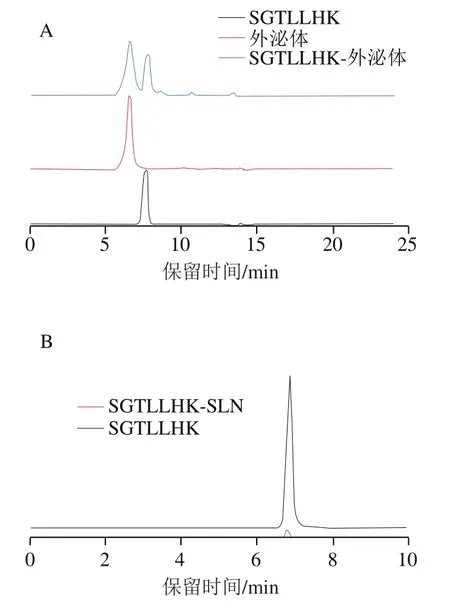
图6 SGTLLHK-外泌体(A)和SGTLLHK-SLN(B)的HPLC图Fig. 6 HPLC profiles of SGTLLHK-exosomes (A) and SGTLLHK-SLN (B)

表2 SLN、SGTLLHK、SGTLLHK-SLN和SGTLLHK-外泌体的特性Table 2 Properties of SLN, SGTLLHK, SGTLLHK-SLN and SGTLLHK-exosomes
如表2所示,SGTLLHK的Zeta电位为(2.43±0.32)mV,SGTLLHK-SLN的Zeta电位降低至(-10.56±0.78)mV,SGTLLHK-外泌体的Zeta电位降低至(-12.03±0.59)mV。Zeta电位是评价纳米颗粒体系稳定性的重要指标,反映了颗粒表面的净电荷数量,净电荷多发生静电排斥时不易聚集,说明体系越稳定。因此,SGTLLHK-外泌体颗粒体系较SGTLLHK-SLN具有较高稳定性。
在高于油相熔点的温度下得到O/W纳米乳液(或乳液),随后进行冷却促进脂质微滴结晶生产SLN。据报道由单硬脂酸甘油酯制成的SLN粒径在1 000 nm以内,本研究中制备的SLN粒径为(535.93±16.84)nm。纳米颗粒粒径越小,稳定性更好。SGTLLHK-外泌体粒径仅为(125.87±2.66)nm,远小于SGTLLHK-SLN((558.83±3.33)nm)和SLN((535.93±16.84)nm),与Zeta电位结果一致。SGTLLHK-SLN粒径较大,稳定性较低,可能是因为得到的O/W纳米乳液体系在亲水性生物活性肽或蛋白包封后容易聚集,可能会使肽或蛋白质逃逸。而SGTLLHK-外泌体粒径较小,稳定性较好,可能是因为水溶性生物活性肽被包封在外泌体囊泡的亲水性核心中。
当PDI<0.4时,说明悬浮液有良好的稳定性,而高PDI值会引起悬浮液中颗粒或液滴聚集、絮凝。本研究中,SLN的PDI值为0.31±0.04,SGTLLHKSLN和SGTLLHK-外泌体的PDI值分别为0.46±0.01和0.17±0.01。
以上结果表明,寡肽SGTLLHK成功包埋于SLN和外泌体中,并且SGTLLHK-外泌体纳米颗粒体系更稳定。
如图7所示,包埋前,-葡萄糖苷酶抑制肽SGTLLHK形状大多为片状,而用SLN和外泌体包埋后均呈圆滑的颗粒球状,此外,明显观察到SGTLLHK-SLN颗粒较大,且出现聚集现象,外泌体包埋后体系颗粒较小,极少有聚集。综上所述,SGTLLHK-外泌体颗粒体系在悬浮液中具有高度稳定性。

图7 SGTLLHK(A)、SGTLLHK-SLN(B)和SGTLLHK-外泌体(C)的SEM图Fig. 7 SEM images of SGTLLHK (A), SGTLLHK-SLN (B) and SGTLLHK-exosomes (C)
2.6 多肽-外泌体和多肽-SLN体外模拟胃肠道的消化特性
乳液的稳定性及其在胃肠道中的消化特性取决于其粒径大小,尽管SGTLLHK-外泌体和SGTLLHK-SLN纳米颗粒在悬浮液中均具有良好的稳定性,但对环境胁迫(如pH值的急剧变化、盐离子浓度及各种胃肠道蛋白酶)仍较为敏感。如图8所示,SGTLLHK-外泌体颗粒有两个明显的峰,其中寡肽SGTLLHK在8.9 min出峰。经胃消化阶段,肽峰强度没有明显减小,根据峰面积计算得出此阶段的肽保留率为93.65%,这说明SGTLLHK-外泌体能够在强pH值胃酸环境下稳定存在并保护寡肽SGTLLHK不被降解。继续肠道消化后,在8.9 min处肽峰强度降低,而11.56 min处的峰强度升高,此阶段的肽保留率较高,为72.52%,说明在肠液中性环境下,少部分肽从外泌体纳米颗粒中逃逸。Sun Dongmei等将姜黄素-外泌体于37 ℃水浴中避光孵育150 min后,检测发现大部分姜黄素免受降解,保留率达80%。Fan Yue等发现经外泌体封装的白藜芦醇在处理2 h后约70%白藜芦醇被保留,而游离白藜芦醇在前25 min内迅速被降解。综上,SGTLLHK-外泌体具有一定的耐胃肠消化特性,这一特性能够改善-葡萄糖苷酶抑制肽SGTLLHK生物可利用度低的问题。
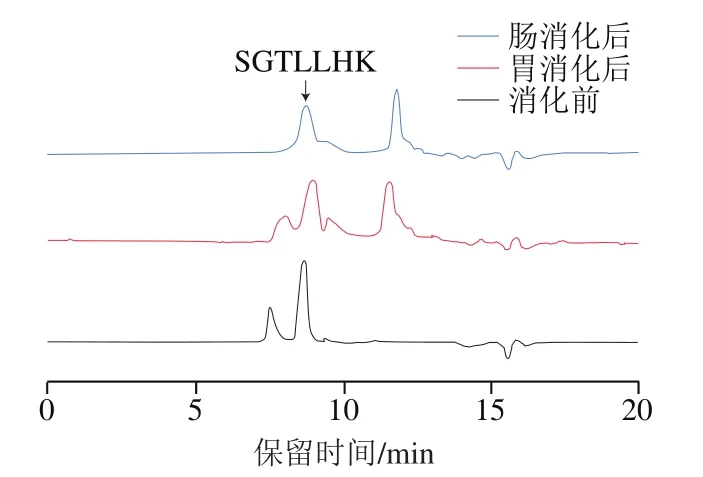
图8 SGTLLHK-外泌体模拟胃肠消化前后的HPLC图Fig. 8 HPLC profiles of SGTLLHK-exosomes during in vitro digestion
如图9所示,SGTLLHK-SLN中寡肽SGTLLHK在9.5 min左右出峰,在模拟胃消化阶段,根据峰面积进行计算得到SGTLLHK-SLN具有较高的肽保留率(88.37%),这一部分损失主要为SLN颗粒表面聚集的肽,一旦与胃液接触便可引起其降解,说明SLN可以有效保护SGTLLHK免于胃中蛋白酶的降解。然而,SGTLLHK在肠消化阶段的保留率仅为48.43%,表明SGTLLHK-SLN纳米颗粒能在肠道中存在,但对寡肽的保留率低于SGTLLHK-外泌体。综上,外泌体纳米颗粒对-葡萄糖苷酶抑制肽SGTLLHK的保护作用优于SLN纳米颗粒。
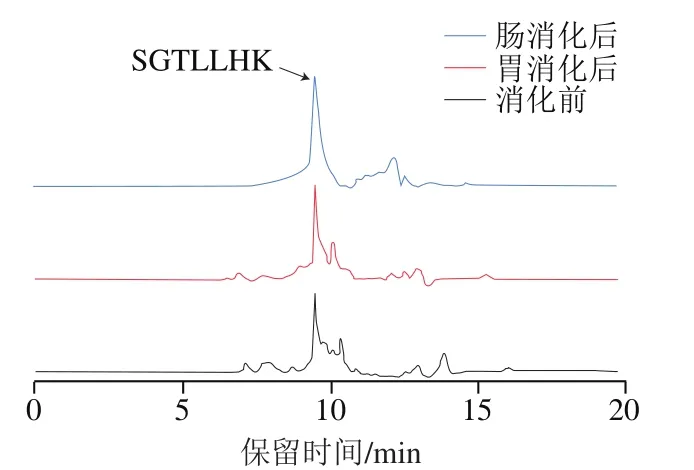
图9 SGTLLHK-SLN模拟胃肠消化前后的HPLC图Fig. 9 HPLC profiles of SGTLLHK-SLN during in vitro digestion
3 结 论
甲鱼蛋-葡萄糖苷酶抑制肽SGTLLHK不耐胃肠道消化,其在胃消化阶段就已被完全降解成两种产物SGTLL和GTLL,胃消化液的-葡萄糖苷酶抑制活性显著上升。GTLL经后续肠消化完全被降解,而SGTLL耐肠消化,胃肠消化液的-葡萄糖苷酶抑制显著下降,且低于原肽抑制能力。牛乳外泌体和SLN均能成功包埋SGTLLHK,且SGTLLHK-外泌体在模拟胃肠道消化中的稳定性优于SGTLLHK-SLN。本研究为甲鱼蛋-葡萄糖苷酶抑制肽的保护提供了理论依据。
