紫苏油多层乳液的制备及乳液油脂体外消化特性
2022-07-07孙禹凡彭新辉武利春闫世长刘冠男朱华平齐宝坤
廖 一,孙禹凡,彭新辉,王 琪,武利春,闫世长,刘冠男,朱华平,齐宝坤,*,李 杨,3,4,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150000;2.科技部中国农村技术开发中心,北京 100045;3.哈尔滨市食品产业研究院,黑龙江 哈尔滨 150000;4.国家大豆工程技术研究中心,黑龙江 哈尔滨 150000)
紫苏是唇形科一年生草本植物,广泛分布于中国和日本等亚洲国家,一般通过紫苏籽冷榨的方法获得紫苏油。紫苏油中含有丰富的-3系列不饱和脂肪酸,其中-亚麻酸极为丰富。研究表明,紫苏油能够提供人体必需脂肪酸,有降低胆固醇、调节血压、防癌和抗衰老等诸多功效。但由于紫苏油含有大量不饱和脂肪酸,导致其在贮藏过程中极易被氧化,尤其在环境变化情况下(如贮藏运输和添加到食品中)会加速氧化,限制其在食品中的应用。因此,紫苏油的包封增强其在食品中的稳定性具有重要意义。
层层自组装技术是指利用某种相互作用(如静电引力、共价键、氢键等)将2种以上的高分子材料在模板物质表面逐层交替沉积,形成多层界面膜的一种技术,静电力则是自组装中最常见的一种作用力,利用静电层层自组装技术制作多层乳液能对芯材有更好的保护,许多研究表明,多层乳液比传统单层乳液具有更好的稳定性。
目前关于以大豆分离蛋白(soybean protein isolate,SPI)和多糖作为乳化剂形成多层乳液的报道较多,但大部分集中于探究形成单层或多层乳液的稳定性以及递送活性物质的生物可及性等研究,然而在消化过程中,以层层自组装技术形成的单层和多层乳液对于乳液油脂的消化影响尚不明确。因此,深入了解界面层对于乳液油脂在胃肠道的消化过程有助于改善SPI在酸性条件下的功能特性,提高其在乳液递送系统的应用范围,进一步开发特定属性,如改善蛋白功能特性、抑制脂质氧化和脂质缓慢递送的功能性产品。
本实验以SPI作为乳化剂制备单层乳液,利用层层自组装技术使单层乳液表面分别吸附壳聚糖(chitosan,CS)、海藻酸钠(sodium alginate,SA)制备双层和三层乳液,通过粒径电位、微观形态等乳液表征方法确定乳化剂的用量,对比上述3种乳液的物理稳定性和紫苏油的氧化稳定性。构建体外消化模型,利用pH-stat全自动滴定仪比较3种乳液对于脂质消化速率和消化程度影响,最终以气相色谱法测定紫苏油乳液消化前后的脂肪酸组成的变化,以期为不饱和脂肪酸递送体系的开发提供一定的理论基础和技术支撑。
1 材料与方法
1.1 材料与试剂
SPI 山东仟聚元生物科技有限公司;紫苏油河北家丰植物油有限公司;CS、SA、胃蛋白酶(≥2 500 U/mg)、胰酶(≥250 U/mg)、胆盐 上海源叶生物科技有限公司;尼罗红、尼罗蓝、卡尔科弗卢尔荧光增白剂染液 美国Sigma-Aldrich公司;其他试剂均为分析纯。
1.2 仪器与设备
AL204型分析天平 梅勒特-托利多仪器(上海)有限公司;Zetasizer 2000激光粒度粒形分析仪 美国麦奇克公司;JJ-1增力电动搅拌器 江苏金城国胜仪器厂;BX53科研级正置显微成像系统 日本奥林巴斯公司;Sp2激光共聚焦显微镜 德国莱卡公司;TU-1800紫外-可见分光光度计 北京普析通用仪器有限责任公司;905型全自动电位滴定仪 瑞士万通中国有限公司。
1.3 方法
1.3.1 壁材分子所带电荷性质测定
参考林传舟的方法并稍作修改,称取一定质量的SPI和SA粉末溶解于pH 7.0的磷酸盐缓冲溶液中,CS粉末溶解于0.1 mol/L醋酸缓冲液中,并加入0.2 g/L的叠氮化钠抑制微生物生长。将配制好的溶液用相应溶解的缓冲液稀释至0.01%,并用1 mol/L的HCl溶液和NaOH溶液调节pH值(3~8),通过激光粒度仪测定不同pH值时壁材分子所带电荷(Zeta电位)。
1.3.2 乳液的制备
1.3.2.1 紫苏油单层乳液(SPI-E)的制备
参考Gasa-Falcon等的方法并稍作修改,在pH 7.0时,将不同SPI质量分数(0.5%~2.5%)的脂质相(紫苏油)(体积分数10%)和水相(体积分数90%)以13 000 r/min运行3 min形成粗乳液。该粗乳液在20 MPa压力下通过高压均质机进行2 次循环,制得的SPI-E保存备用(组成:10%紫苏油,pH 7.8)。将上述SPI-E调节pH值至5.5,取5 mL样品用pH 5.5的缓冲溶液稀释至20 mL,将稀释后的样品保存备用。
1.3.2.2 紫苏油双层乳液(SPI-CS)的制备
参考Silva等的方法并稍作修改,在pH 5.5、200 r/min连续搅拌条件下,以10 mL/min的滴加速率将10 mL SPI-E添加到10 mL不同质量分数(0.5%~2.5%)的CS溶液中。然后将形成的SPI-CS以4 000 r/min均质2 min,以破坏形成的絮凝物,制得的SPI-CS保存备用(组成:5%紫苏油,pH 5.5)。取10 mL样品用pH 5.5的缓冲溶液稀释至20 mL,将稀释后的样品保存备用。
1.3.2.3 紫苏油三层乳液(SPI-CS-SA)的制备
参考Silva等的方法并稍作修改,在pH 5.5、200 r/min连续搅拌条件下,以10 mL/min的滴加速率将10 mL SPICS添加到10 mL不同质量分数(0.5%~2.5%)的SA溶液中。然后将形成的SPI-CS-SA利用均质机以4 000 r/min均质2 min,以破坏形成的絮凝物,制得的SPI-CS-SA保存备用(组成:2.5%紫苏油,pH 5.5)。
1.3.3 乳液粒径及Zeta电位的测量
采用激光粒度仪测定蛋白质量分数为0.025‰的3种不同乳液的液滴粒径与Zeta电位,分散相和连续相的折射率分为1.456和1.330。将样品放入样品池中,在25 ℃条件下测定。
1.3.4 微观结构
1.3.4.1 光学显微镜观察
采用光学显微镜观察乳液液滴的大小、形状、分布状态:将制备好的3种乳液用pH 5.5的缓冲溶液稀释10 倍,取10 μL稀释后的样品滴于载玻片上,用盖玻片压好静置适当时间,待液滴不再流动后放大40 倍进行观察。
1.3.4.2 激光共聚焦显微镜观察
采用激光共聚焦显微镜观察乳液液滴分布情况,将制备好的3种乳液用pH 5.5的缓冲溶液稀释10 倍,染色方法为:80 μL 1.0%尼罗蓝荧光染料与1 mL样品避光混合染色15 min后加入40 μL 0.1%尼罗红和40 μL卡尔科弗卢尔荧光增白剂染液继续染色15 min。将样品放置在载玻片上并盖上盖玻片,对乳液进行观察,激发波长分别为633、488 nm和355 nm。
1.3.5 稳定性测定
1.3.5.1 乳液乳析指数测定
将制备的3种乳液在常温下放置30 d,乳液静置后分为2 层,乳液上层为乳析层,下层为清液层,每5 d测定2 层的厚度变化,乳析指数按式(1)计算:

式中:为乳清层的高度/cm;为玻璃管中乳液的总高度/cm。
1.3.5.2 贮藏过程中氧化产物的测定
氢过氧化物值测定参考Shantha等的方法并稍作修改,采用分光光度计法对紫苏油3种乳液中氢过氧化物含量进行测定。0.3 mL乳液与15 mL破乳剂(异辛烷-异丙醇,3∶1,/)混合,旋涡振荡10 s,重复3 次,每次间隔20 s进行乳液破乳,5 000 r/min离心10 min获得油相。取200 μmol/L上层有机相于10 mL离心管中并加入2.8 mL甲醇-丁醇(2∶1,/)混合液,紧接着加入30 μL Fe和3.14 mol/L硫氰酸铵(1∶1,/)混合液,振荡均匀,暗反应20 min后在波长510 nm处测定吸光度,使用过氧化氢异丙苯制备标准溶液绘制标准曲线,标准曲线为=0.071 6-0.010 6,=0.992,其中为吸光度,为氢过氧化物浓度。
硫代巴比妥酸反应物(thiobarbituric acid reactive su bstances,TBARS)值测定参考Zhang Haixia等的方法并稍作修改。将1.0 mL乳液与2.0 mL硫代巴比妥酸测试液(由15.0 g三氯乙酸,0.375 g硫代巴比妥酸,1.76 mL 12 mol/L HCl和82.9 mL超纯水混合而成),混合装入试管中,涡旋。将试管放入沸水浴中加热15 min,加热结束后冷却至室温,以300 r/min离心15 min,利用紫外-可见分光光度计在波长532 nm处测定样品的吸光度,使用1,1,3,3-四乙氧基丙烷制备标准溶液绘制标准曲线,标准曲线为=0.232 4+0.078 0,=0.995,其中为吸光度,为TBARS值。
1.3.6 体外消化模型的构建
参考Ding Jian等的方法进行体外模拟消化并稍作修改。模拟胃液配方为:3.2 mg/mL胃蛋白酶,0.7% HCl溶液和2 mg/mL NaCl溶液,使用1 mol/L HCl溶液将pH值调节至2.0,将乳液与模拟胃液等体积混合与37 ℃恒温培养开始胃部消化,100 r/min连续振荡1 h。随后将配制模拟肠液:10 mmol/L CaCl、150 mmol/L NaCl、5 mg/mL胆盐和1.6 mg/mL胰酶的混合,将肠液与胃消化物3∶1混合,用0.1 mol/L NaOH溶液调节pH 7.0。在30 ℃恒温培养2 h,100 r/min连续振荡期间实时监控pH值为7.0以模拟小肠条件进行消化。每隔10 min(共120 min)测定消化过程中释放的游离脂肪酸含量。
体外模拟消化过程中,在脂肪酶的作用下脂肪不断被水解为脂肪酸,测定反应容器中维持恒定pH 7.0所需0.1 mol/L NaOH溶液体积,按式(2)计算脂肪酸含量:

式中:(NaOH)为模拟小肠消化时间为时消耗的NaOH溶液的体积/L;(NaOH)为滴定用标准NaOH溶液的浓度0.1 mol/L;为紫苏油总质量/g;为紫苏油的平均摩尔质量(391 g/mol)。
1.3.7 脂肪酸含量测定
采用气相色谱法以紫苏油原油作为对照组测定消化前后乳液的脂肪酸组成,参考GB 5009.168—2016《食品中脂肪酸的测定》中脂肪的提取及脂肪酸的测定方法,分为油的甲酯化和气相色谱法测定脂肪酸含量2个阶段,使用HP-5石英毛细管柱(30 m×0.25 mm,0.25 μm)。
1.4 数据处理
所有实验重复3 次。平均值和标准偏差使用Origin Pro 2019b(美国Origin Lab公司)计算。统计分析通过方差分析进行,使用IBM SPSS 23.0(IBM公司,美国)。<0.05,差异显著。
2 结果与分析
2.1 不同pH值条件下乳液壁材所带电荷
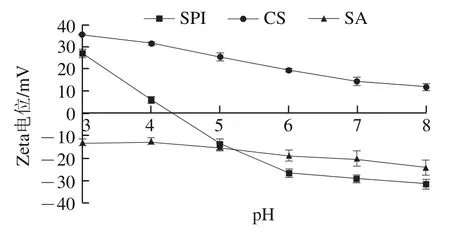
图1 不同pH值条件下壁材所带电荷Fig. 1 Effect of pH on zeta potential of wall materials
蛋白质和多糖是两类重要的高分子材料,大豆蛋白由于自身的性能在酸性条件下稳定性低,静电层层自组装技术将2种高分子材料融合形成多层乳液,增加乳滴的稳定性。多层乳液的形成受许多因素的影响,其中pH值、壁材添加比例等是形成多层乳液的关键因素。
通过考察不同pH值条件下SPI、CS和SA的Zeta电位可以分析形成多层乳液产生聚集的原因以及蛋白质和多糖之间的作用力,并确定多层乳液的吸附顺序。如图1所示,SPI在pH 3~6时Zeta电位迅速下降,在pH 4.4左右电荷下降至0,达到SPI的等电点(pI)。蛋白质分子同时含有羧基和氨基,在pH值高于pI一侧时,SPI带有净负电荷,在低于pI一侧时,SPI带有净正电荷,因此可以通过调节溶液不同pH值改变SPI的带电性。CS是自然界中唯一带正电荷的多糖,图1显示在pH 3.0~8.0的范围内CS溶液正电荷数逐渐减少,在较高的酸碱度下CS失去电荷,pH值在7以上时CS溶液出现明显的浑浊,归因于CS的解离常数(p)在6.5附近。SA的p值在3.4~4.2附近,图1显示在pH 3.0~8.0的范围内SA溶液所带电荷的绝对值逐渐增大。采用静电层层自组装制备多层乳液的过程中,带正电荷或负电荷的聚电解质交替沉积在油滴周围,根据CS和SA在不同pH值条件下的电势走向,为远离SPI的pI以及CS和SA的p值,使三者Zeta电位保持相对大的数值,易于实验操作,选择pH 5.5作为多层乳液形成的环境条件,多层乳液乳化剂添加顺序为SPI、CS、SA。
2.2 聚电解质质量分数确定
2.2.1 SPI-E粒径电位分析

图2 不同SPI质量分数形成的SPI-E平均粒径电位Fig. 2 Effect of SPI concentration on average particle size of SPI-E
为得到稳定的多层乳液,必须保证SPI-E中的蛋白质分子能够使液滴表面完全达到饱和,添加量过多或过少都会使乳液失稳。如图2所示,SPI质量分数在0.5%~2.5%范围内粒径低于400 nm,当SPI质量分数达到1.0%时,乳液的粒径最小(196.33 nm)且Zeta电位绝对值最高(-25.63 mV),当蛋白质量分数为1.0%时已经有足够的蛋白覆盖在油滴周围,空间作用力和静电力可以稳定油滴。当SPI-E中的蛋白质量分数继续增加,液滴表面吸附的蛋白饱和,多余的蛋白分子在水相中产生吸引作用,使得乳液的粒径显著增大,电位绝对值显著降低(<0.05)。综合考虑SPI-E粒径和Zeta电位结果,选择SPI质量分数为1.0%进行后续SPI-CS的制备。
2.2.2 SPI-CS粒径电位分析

图3 不同CS质量分数形成的SPI-CS平均粒径电位Fig. 3 Effect of CS concentration on average particle size and zeta potential of SPI-CS
如图3所示,SPI-CS的粒径电位为pH 5.5时测量,高于且接近SPI的pI,因此在未添加CS的情况下乳液体系呈现负电荷(-15.21 mV),液滴之间的吸引力较强排斥力较弱,相互吸引导致液滴聚集。对比图5A可以看出,当CS质量分数为0.0%时乳液已经出现明显分层,证实了上述观点,此时乳液粒径较大,接近14 μm。当添加少量的CS时,由于CS不足以覆盖SPI-E液滴,2个或者多个带负电的液滴共享1个CS分子,此时乳液带电量较低(-5.18 mV),发生静电中和效应,形成桥连结构而产生聚集,但由于CS的加入增加乳液体系的黏度,促进空间稳定性,乳液粒径由13.77 μm降至5.80 μm。当CS质量分数达到1.0%时,乳液中液滴的表面所带电荷从负电荷变为正电荷,此时阳离子CS分子吸附在阴离子SPI-E的表面上,使CS中和原有的负电荷在表面达到饱和。当CS质量分数进一步增加达到2.0%时,Zeta电位增大,体系重新稳定,乳液液滴的平均粒径下降至最低(2.10 μm),SPI-CS液滴上的正电荷随着CS质量分数的增加而增加,最终液滴表面CS分子完全饱和,表面电势达到恒定的正值。当CS质量分数进一步增加至2.5%,水中存在无法吸附在液滴表面的CS分子导致损耗絮凝,乳液的稳定性下降,因此最终选择CS质量分数2.0%的溶液添加至SPI-E制备SPI-CS。
2.2.3 SPI-CS-SA粒径电位分析
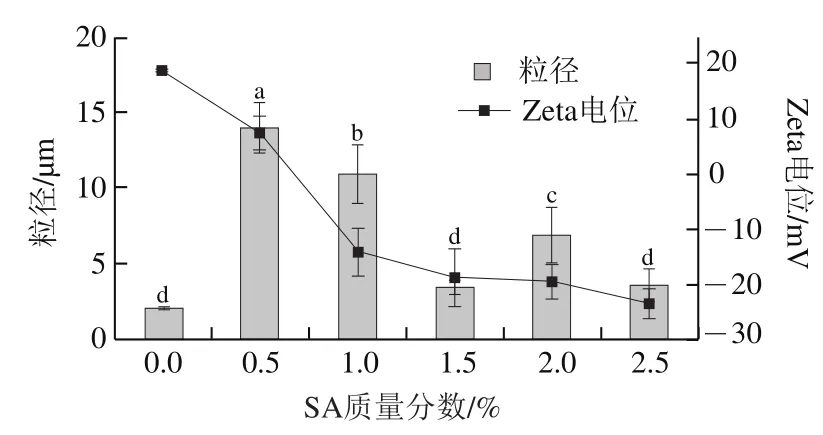
图4 不同SA质量分数形成的SPI-CS-SA平均粒径电位Fig. 4 Effect of SA concentration on average particle size and zeta potential of SPI-CS-SA

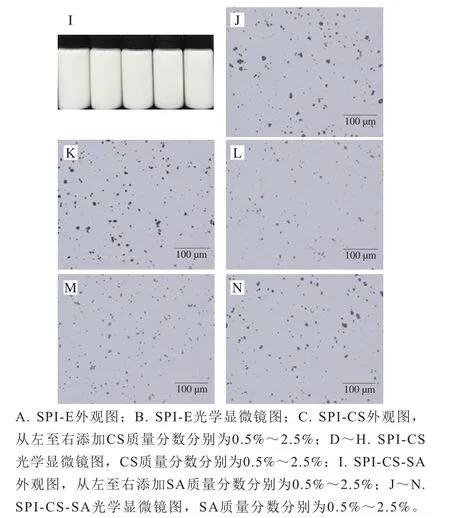
图5 3种乳液外观及光学显微镜图Fig. 5 Appearance and optical microscopic images of three emulsions
从图4和图5J~N可以看出,SA对SPI-CS-SA的稳定性影响与CS对SPI-CS的影响相似。SA质量分数逐渐增大的过程中,SPI-CS-SA的电荷也由正电荷转变为负电荷,乳液粒径呈现先增加再逐渐减小的趋势,说明携带负电荷的SA与SPI-CS表面作用,在乳液外侧以静电作用力形成SPI-CS-SA保护层。在SA质量分数为0.5%时粒径显著增加(<0.05),这是由于少量携带负电荷的SA加入通过静电屏蔽减少了液滴的带电量,范德华力和疏水相互作用等吸引作用力超过排斥力,液滴产生聚集(图5J、K),但图5I中所有质量分数SA形成的SPI-CS-SA外观都非常稳定,这是由于较厚的乳化剂包裹,液滴之间仍存在较强的静电排斥和空间排斥,使SA质量分数为0.5%时乳液外观没有明显的分层现象。在质量分数1.0%以上的SA溶液后,乳液的电荷增加幅度减小,这可能是SA聚电解质在SPI-CS表面吸附量逐渐饱和。当SA质量分数进一步增加至1.5%时,Zeta电位增大,乳液平均粒径下降,体系重新恢复稳定。当SA质量分数进一步增加时,粒径和电位没有显著变化(>0.05),因此选择添加质量分数1.5%的SA制备SPI-CS-SA。
2.3 乳液微观结构
图6A、A显示,单纯SPI在酸性条件下的乳液液滴出现严重聚集,这与图3现象一致,图6A箭头指向的区域可以明显看出乳液在蛋白pI附近的pH值环境中由于静电排斥力弱,液滴之间相互吸引导致乳液液滴聚集严重,CS和SA的加入可以有效改善乳液聚集的情况,提高SPI乳液在酸性条件下的稳定性,这与2.2.2节结果一致。
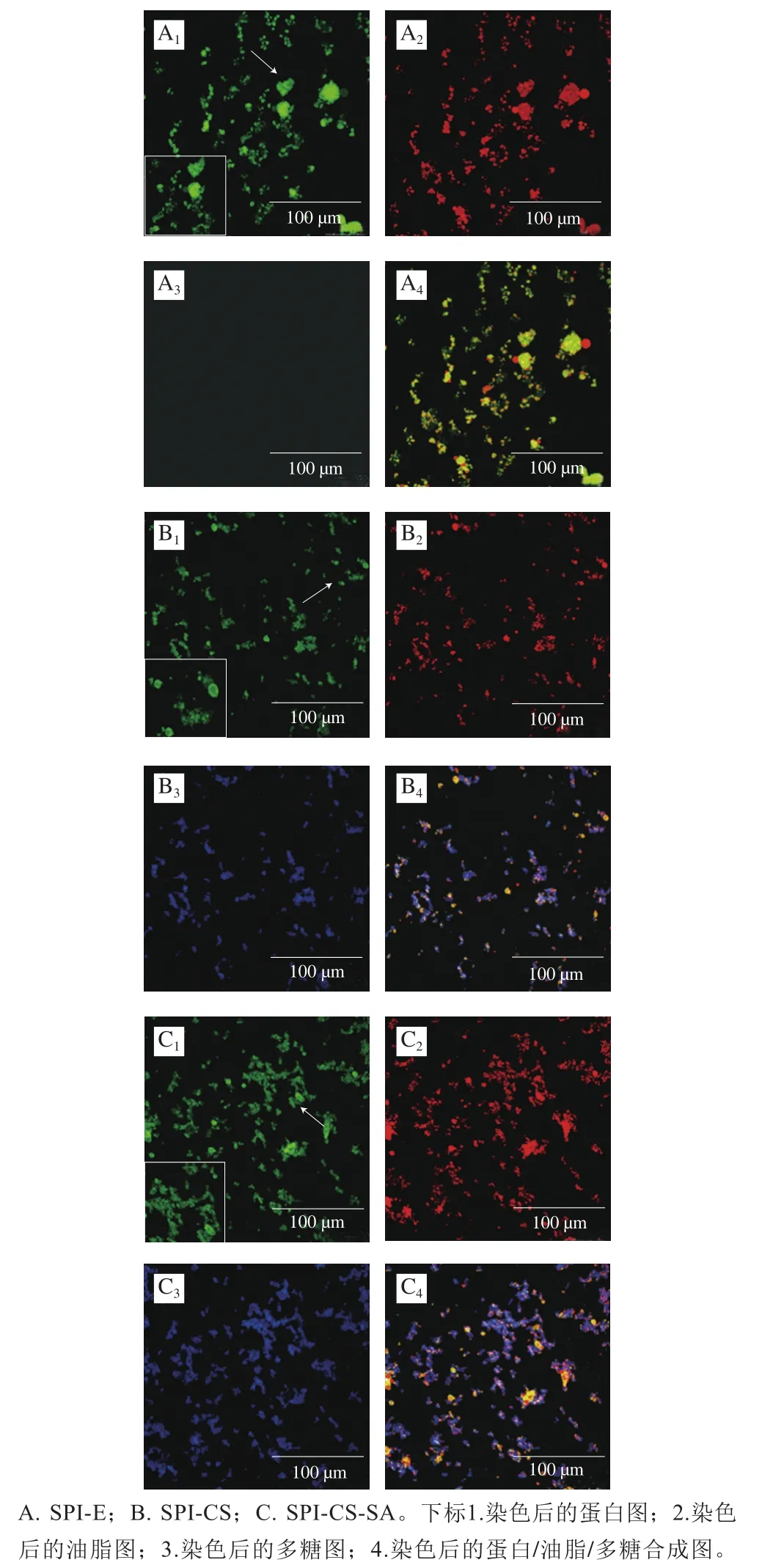
图6 不同乳液对激光共聚焦的影响Fig. 6 CLSM images of three emulsions
图6 显示乳液核心主要由紫苏油(尼罗红染色呈红色,图6A、B、C)组成,具有核壳结构(图6B、C),壳层主要由SPI(尼罗蓝染色呈绿色,图6A、B、C)和多糖(CS和SA被钙氟白色染料染色呈蓝色,图B、C)组成。结果表明,SPI-CS-SA(图6C~C)、SPI-CS(图6B~B)乳液液滴大小分布较SPI-E(图6A~A)的液滴更均匀,界面层呈现出蛋白-油脂的核壳结构(图6B、C),这是由于乳液液滴在多糖的静电力作用下更加分散,使在酸性条件下的SPI-E中液滴重叠的部分舒展开。多糖溶液分布于蛋白层的外围形成无序的厚层(图6B、C),这是由于蛋白比多糖具有更多的有序二级结构(-螺旋、-折叠等)。
2.4 乳液稳定性
2.4.1 贮藏稳定性

图7 3种紫苏油乳液常温贮存30 d乳析指数Fig. 7 Creaming index of three perilla oil emulsions stored at room temperature for up to 30 days
如图7所示,稳定性结果与粒径和Zeta电位结果一致。SPI-E在30 d后表现出最差的稳定性,乳析指数值达35.1%,新制成的乳液放置短时间后出现分层现象(图5A),这是由于在pI附近酸性条件下,SPI表面带电量低,SPI-E液滴之间相互接触而聚集,产生分层的现象。SPI-CS和SPI-CS-SA稳定性明显提高,30 d后乳析指数分别为15.1%和10.4%,这是由于添加多糖后带电量增加,由于CS的线性结构,在乳液中形成了三维网络结构,因此CS在酸性条件下是非常好的增稠剂。SA的加入同样降低了液滴之间的接触,增强了电荷强度,因此有助于紫苏油乳液的稳定性,结果表明在酸性条件下的多层乳液能够更好地保护多不饱和脂肪酸乳液递送系统。
2.4.2 贮藏过程中氧化物测定结果

图8 紫苏油乳液37 ℃避光贮藏30 d的氢过氧化物含量(A)和TBARS值(B)Fig. 8 Hydroperoxide contents (A) and TBARS values (B) of perilla oil emulsions stored at 37 ℃ in dark for up to 30 days
3种乳液氧化稳定性根据37 ℃条件下避光贮存30 d产生的初级氧化产物和次级氧化产物进行评价。图8A中,对照组和3种乳液的氢过氧化物含量随着氧化时间的延长而不断增加,表明油脂的氧化稳定性逐渐降低,初始状态下被包埋的乳液氢过氧化物含量高于对照组紫苏油,原因可能是制备乳液过程中油脂受剪切力等作用被氧化,但在第6天开始对照组超过乳液包埋油脂的氧化速度,第30天氢过氧化物含量达到20.10 mmol/kg,而30 d后3种乳液的氢过氧化物含量分别为16.06、13.19 mmol/kg和9.54 mmol/kg,显著低于对照组(<0.05),说明随着包埋层数的增加,紫苏油的氧化速率越慢。SPI-CS和SPI-CS-SA表面以静电力吸附多糖分子,与没有包埋的紫苏油和SPI-E相比油-水界面层增加,有研究表明,脂质的氧化稳定性随着油-水界面层的增加而增加。
TBARS值是表征脂质次级氧化的指标之一,一般与氢过氧化物相结合共同解释油脂氧化过程。从图8B可以看出,在初始阶段油脂氧化速度均较低,但在贮存6~24 d TBARS值迅速增加,可能是由于脂质的初级产物自发降解为次级产物,导致TBARS值增加。与对照组相比,SPI-CS与SPI-CS-SA都有延缓油脂氧化的作用,这是由于界面层数的增加充当了油滴的物理屏障,油脂液滴与具有促进油脂氧化的离子相互作用减弱,使其氧化速率越慢。此外,多种乳化剂的使用可能在增强抗氧化能力方面具有协同作用。因此结果表明乳液能够提高紫苏油的氧化稳定性,并且界面层数增多对紫苏油的氧化保护效果越好。
2.5 体外模拟消化模型
2.5.1 乳液脂肪酸释放率

图9 乳液在体外模拟消化模型中的脂肪酸释放率Fig. 9 Release rate of FFA from perilla oil emulsions in an in vitro simulated digestion model
采用滴定法对SPI-CS和SPI-CS-SA稳定的多层乳液在体外模拟消化模型中脂肪酸释放进行监控,如图9所示。SPI-CS相比SPI-E的脂肪酸最终释放率较少,并且脂肪酸释放的速率较慢,这是由于CS吸附在初级乳液表面,对液滴起到保护的作用,使脂肪酶对乳液的作用减弱。CS是含有带正电的粒子(NH),p值在6.5左右,乳液在小肠部位消化环境偏碱性,CS分子失去大部分正电荷,从乳液表面脱落,使得脂肪酶不能与液滴中油脂接近。另一方面,CS还可能具有与带负电荷的脂肪酶和其他消化酶结合的能力,从而降低脂肪酶的活性。这一结果表明,CS做为SPI-CS的聚电解质能够降低脂质的消化率和消化程度。
SA的加入明显降低了消化速率(<0.05),可能是由于SA带有高密度的线性直线分子,分子中带有葡糖酸酯基团,在胃部环境酸性条件下收缩的同时结合肠液中的钙离子形成多层聚体,阻止钙离子结合游离脂肪酸形成沉淀,从而使乳液消化变慢,因此相对SPI-E和SPICS有更多的油脂液滴到达小肠部位,最后SPI-CS-SA的聚电解质在小肠中均失去了电荷,油脂液滴暴露在消化液中,因此消化程度相比对照组有所增加。SPI-CS-SA对经过胃中的不饱和脂肪酸提供了更好的保护,并在肠中相对快速地释放,达到油脂缓释的效果。
2.5.2 乳液消化前后脂肪酸组成
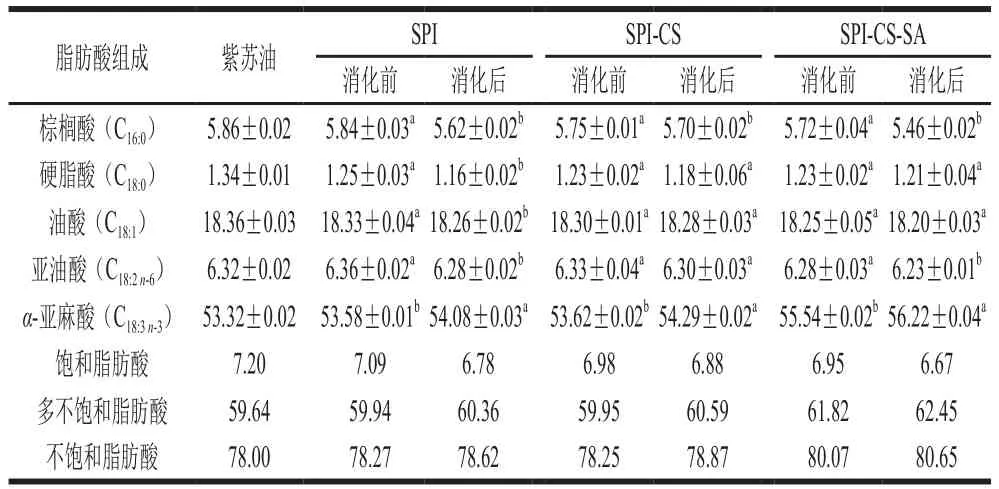
表1 紫苏油脂肪酸组成及乳液消化前后脂肪酸组成对比Table 1 Fatty acid composition of perilla oil and comparison of fatty acid composition before and after simulated digestion of perilla oil emulsions%
如表1所示,3种乳液消化前的各脂肪酸含量略低于对照组,并且随着乳液层数的增加,脂肪酸含量逐渐降低,这与朱巧莎的研究结论略有不同,可能是由于本实验乳液制备过程中的仪器和制备方式使油脂在受剪切力和摩擦作用力,产生的热量对脂肪酸产生氧化作用,这种影响随着乳液层数叠加,导致乳液中脂肪酸含量略低于对照。SPI-CS-SA表面带有大量负电荷,较高的负电荷会吸收带有正电荷的金属离子,从而导致消化前脂肪酸的降解量高于SPI-CS。3种乳液消化后的饱和脂肪酸比例下降,而多不饱和脂肪酸比例升高,主要原因是消化后的-亚麻酸(C)比例升高,说明在包埋后紫苏籽油中的棕榈油、油酸和亚油酸的体外消化量较亚麻酸的多,其他脂肪酸的释放率要高于多不饱和脂肪酸。另一方面,多不饱和脂肪酸的增加可能是由于胆盐的作用释放多不饱和脂肪酸。综合分析液滴中的多不饱和脂肪酸更难从甘油三酯水解,多层乳液可以保证油脂中脂肪酸有效释放。
3 结 论
以紫苏油为油相,SPI、CS和SA分别作为SPI-E、SPICS和SPI-CS-SA的壁材,用粒径电位、微观形态对3种乳液表征确定3种聚电解质质量分数,结果表明SPI、CS、SA最佳质量分数分别为1.0%、2.0%、1.5%时,SPI-E、SPI-CS和SPI-CS-SA理化性质最佳,结构最为稳定。
乳液稳定性结果表明,SPI-CS和SPI-CS-SA对比SPI-E乳析指数更低,稳定性更好,添加多糖可以增强乳液电荷和网络状结构。氧化稳定性结果表明乳液界面层数影响紫苏油的氧化稳定性,并且层数越多对紫苏油的保护效果越好。
体外消化结果表明3种乳液与对照组相比都可以很好保护脂肪中的脂肪酸,并且SPI-CS-SA较SPI-E和SPICS在肠部具有更好的缓释效果,因此通过多层包埋对脂肪形成保护作用,减少小肠中脂肪与界面胰酶和胆盐的接触,进而延迟脂肪的释放,使紫苏油在食品中应用中具有巨大潜力。
