甘草蜜炙前后对小鼠免疫调节的影响△
2022-07-06岳珠珠姜明瑞张婧秋王志成王慧楠陈梦雨魏晓彤石双慧王梦琳王英姿
岳珠珠,姜明瑞,张婧秋,王志成,王慧楠,陈梦雨,魏晓彤,石双慧,王梦琳,王英姿
北京中医药大学 中药学院,北京 102488
甘草来源于植物乌拉尔甘草Glycyrrhiza uralensisFisch.、胀果甘草G.inflataBat.或光果甘草G.glabraL.的干燥根和根茎,是中医临床常用的大宗中药品种,炙甘草是其常用炮制品,被收载于《中华人民共和国药典》2020 年版,具有清热解毒、补中益气等功效[1]。传统中医药理论认为,甘草蜜炙后补益作用显著增强。现代研究表明,甘草蜜炙后甘草苷、甘草酸、异甘草素等成分含量发生变化,免疫活性高于生甘草[2-7]。
机体免疫系统由非特异性免疫、体液免疫和细胞免疫三方面组成,能够识别和清除入侵人体的抗原成分、体内的衰老细胞、凋亡细胞及异常突变细胞等,从而保持机体内环境的相对稳定[8]。目前,蜜炙甘草增强免疫功能的机制尚未清晰,且研究多偏向其中一项,不够全面。因此,为了更系统地研究蜜炙甘草的免疫功能调节作用,本研究基于课题组前期优化的蜜炙甘草炮制工艺[9],采用环磷酰胺制备小鼠免疫功能低下模型,检测甘草蜜炙前后对其各类免疫功能相关指标的影响,为其临床应用提供参考。
1 材料
1.1 实验动物
无特定病原体(SPF)级BALB/c系小鼠240只,雌雄各半,3~4 周龄,体质量(20±2)g,购于北京斯贝福实验动物技术有限公司[许可证号:SCXK(京)2019-0010],本研究经北京中医药大学伦理委员会审批(编号:BUCM-4-2021112301-4068)。所有动物饲养于北京中医药大学动物实验中心,自由饮水、摄食,实验过程中严格按照实验动物使用的3R原则给予人道关怀。
1.2 试药
生甘草饮片由北京华邈药业有限公司提供(批号为XF1161),经北京中医药大学刘春生教授鉴定为豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根和根茎制成的饮片。清炒甘草饮片(不加炼蜜)和蜜炙甘草饮片均按照本课题组前期优化的炮制工艺进行炮制。
环磷酰胺、盐酸左旋咪唑、绵羊红细胞(SRBC)、豚鼠血清、都氏试剂、印度墨水、水杨酸缓冲液(SA)、吉姆萨(Giemsa)染色液、乳酸脱氢酶(LDH)基质液、1%鸡红细胞(上海源叶生物科技有限公司,批号分别为X13J11Y115691、Y23M9C56327、H14N11Q131025、H02D11Q133035、H13N11B130941、L17S11G124902、L12N11G130949、R20651、23151、R21234);LDH 细胞毒性检测试剂盒、CCK-8试剂盒(上海碧云天生物技术有限公司,批号分别为121719200902、E1CK-000208);Hank's液(北京索莱宝科技有限公司,批号:20200921);胎牛血清(杭州四季青公司,批号:110128611);RPMI 1640 完全培养液、台盼蓝染色液(美国Gibco公司,批号分别为1786045、13704);伴刀豆球蛋白A(Con A,美国Sigma公司,批号:C8110);YAC-1细胞(南京科佰生物科技有限公司,批号:CBP60886);1%乙基苯基聚乙二醇(NP-40,上海联迈生物工程有限公司,批号:LM-0304);2,4-二硝基氟苯[DNFB,萨恩化学技术(上海)有限公司,批号:RXR4 HKE8]。
1.3 仪器
5810R 型高速冷冻离心机(德国Eppendorf 公司);MULTISKAN MK3 型全自动多功能酶标仪、3111 型CO2恒温细胞培养箱、ECO 型超净工作台均购于Thermo Fisher Scientific 公司;756PC 型紫外-可见分光光度计(上海舜宇恒平科学仪器有限公司);M330-HD228S 型光学显微镜(深圳市奥斯微光学仪器有限公司)。
2 方法
2.1 样品的制备
取生甘草饮片、清炒甘草饮片及蜜炙甘草饮片[9]适量,分别加10 倍量的水回流提取3 次,每次1 h,滤过后合并提取液,浓缩至1 g·mL-1(以生药量计),给药前用蒸馏水稀释至所需质量浓度,4 ℃保存备用。
2.2 动物分组与给药
小鼠适应性喂养7 d 后按体质量随机分成4 个大组,分别为免疫一组[血清溶血素和抗体生成细胞、迟发型变态反应(DTH)实验]、免疫二组[淋巴细胞转化和自然杀伤(NK)细胞活性)]、免疫三组(腹腔巨噬细胞吞噬鸡红细胞)和免疫四组(碳廓清实验、脏器/体质量比值)[10]。每大组分为6 个小组,即对照组、模型组、阳性药组和给药组(生甘草组、清炒甘草组、蜜炙甘草组),每组随机10 只小鼠。除对照组腹腔注射0.9%氯化钠溶液外,其余各组连续5 d 腹腔注射环磷酰胺(80 mg·kg-1)构建免疫低下模型;同时对照组、模型组灌胃0.9%氯化钠溶液,阳性药组灌胃盐酸左旋咪唑(40 mg·kg-1),生、清炒、蜜炙甘草组各灌胃1.0 g·kg-1,连续给药28 d;给药体积为0.02 mL·g-1。
2.3 检测指标
根据免疫功能学评价检验对小鼠免疫功能进行测定[11],包括淋巴器官/体质量比值测定、血清溶血素测定及抗体生成细胞检测实验、脾淋巴细胞转化实验、NK 细胞活性测定、DTH 实验、碳廓清实验、腹腔巨噬细胞吞噬鸡红细胞实验。
2.3.1 血清溶血素测定和抗体生成细胞检测实验 各组小鼠灌胃至23 d,腹腔注射2%SRBC 悬液0.2 mL进行免疫。5 d后,小鼠称质量,摘眼球采血于离心管中,做血清溶血素测定;脱颈处死后取脾脏进行抗体生成细胞检测,计数每1.0×106个脾细胞中溶血空斑数来表示抗体生成水平[12-17]。
血清溶血素测定:离心管静置约1h后,2000 r·min-1离心10 min(离心半径为8 cm),取血清备用;小鼠血清用SA 缓冲液稀释200 倍;吸取1 mL稀释后血清置试管内,依次加入10%SRBC(用SA缓冲液配制)0.5 mL,豚鼠血清(用SA缓冲液按1∶8稀释)1 mL。另设不加血清的SA缓冲液为对照管。2000 r·min-1离心10 min(离心半径为8 cm),取上清液1 mL,加都氏试剂3 mL;同时设半数溶血组,取10% SRBC 0.25 mL,加都氏试剂至4 mL,充分混匀,放置10 min后,于540 nm 处以对照管调零,分别测定各管吸光度(A)。溶血素的量以半数溶血值(HC50)表示,按公式(1)计算。

抗体生成细胞检测:将小鼠的脾脏在无菌环境下取出,制成细胞悬液,经过200 目的筛网滤过,1000 r·min-1离心10 min(离心半径为8 cm),采用Hank's 液洗2 遍。表层培养基(1%琼脂糖)加热溶解后与等量pH 7.2~7.4 的2 倍浓度Hank's 液混合,分装于每管0.5 mL,加入脾细胞悬液25 μL、10%SRBC 50 μL,迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,待琼脂凝固后,将玻片水平扣放在玻片架上,37 ℃、5%CO2培养箱中温育1.5 h,然后将SA缓冲液稀释的补体加入到玻片架凹槽内,继续温育1.5 h后,计数溶血空斑数来表示抗体生成水平。
2.3.2 DTH 实验 第23 天灌胃后,小鼠腹部被毛,面积约3 cm×3 cm,用1% DNFB 溶液50 μL 均匀涂抹致敏,次日再强化重复涂抹1 次,5 d 后用1%DNFB 溶液10 μL 均匀涂抹于小鼠右耳两面[18-19]。最后一次给药24 h 后,脱颈处死小鼠,用打孔器取下直径8 mm 左右耳片称质量,并计算两耳质量差值(mg),按公式(2)计算耳肿胀度。

2.3.3 脾淋巴细胞转化实验和NK细胞活性测定 末次给药后,脱颈处死小鼠,无菌环境下取脾,将脾撕碎于盛有适量无菌Hank's 液的平皿中,滤过,制成脾细胞悬液[18,20-22],分为两部分做如下实验。
脾淋巴细胞转化实验:Hank's液洗涤单细胞悬液2次,每次1000 r·min-1离心10 min(离心半径为8 cm),后将细胞悬浮于1 mL RPMI 1640 完全培养液中,台盼蓝染色,显微镜下活细胞数计数(细胞存活率达95%以上)并调整细胞浓度为3×106个/mL。取96 孔板,对照孔加入上述细胞悬液100 μL,刺激孔加入细胞悬液100 μL 与Con A(终质量浓度为5 μg·mL-1),空白孔加RPMI 1640完全培养液100 μL,设置3个复孔。采用CCK-8 试剂盒说明书检测小鼠脾淋巴细胞增殖率,使用酶标仪在450 nm下测A。脾淋巴细胞增值率用刺激指数(SI)来表示,按公式(3)计算。

NK细胞活性测定:实验前24 h将靶细胞YAC-1传代培养,应用前将Hank's 液洗3 次,调整细胞浓度为4×105个/mL(RPMI 1640完全培养液),Hank's液洗涤脾细胞悬液2 次,每次1000 r·min-1离心10 min(离心半径为8 cm),调整细胞浓度为2×107个/mL;取靶细胞和效应细胞各100 μL(效靶比50∶1),加入96 孔培养板中,靶细胞自然释放孔内加入培养液和靶细胞各100 μL、靶细胞最大释放孔内加入1%NP-40 和靶细胞各100 μL,以上各项均设3 个复孔,于37 ℃、5%CO2培养箱中培养4 h后,1500 r·min-1离心5 min(离心半径为8 cm),每孔吸取上清液100 μL 置于96 孔培养板中,同时加入LDH 基质液100 μL,反应3 min,加入1 mol·L-1HCl 30 μL,用酶标仪测定490 nm 处A,并计算NK 细胞活性,结果以杀伤率表示,按式(4)计算。

2.3.4 腹腔巨噬细胞吞噬鸡红细胞实验 各组小鼠灌胃第23天后,给每只小鼠腹腔注射2%SRBC 0.2 mL进行免疫,5 d后脱颈处死小鼠,剪开腹部皮肤暴露腹膜,每只小鼠腹腔注射含5%的胎牛血清的Hank's液4 mL,轻轻按揉腹部,吸取腹腔洗液2 mL 于试管内。吸取腹腔洗液0.5 mL 至装有0.5 mL 的1%鸡红细胞悬液的离心管,混匀,吸取混合液0.5 mL 至玻片上已晾干的3%琼脂圈内,37 ℃温育20 min,甲醇固定,4% Giemsa-磷酸缓冲液染色,显微镜观察计数,每张涂片计数100 个巨噬细胞[18,23],按公式(5)计算吞噬率,公式(6)计算吞噬指数。

2.3.5 碳廓清实验 末次给药1 h 后,称小鼠体质量,以10 mL·kg-1剂量于尾静脉注入25%印度墨汁,分别于注射后2、10 min从内眦静脉丛取血30 μL并立即加入到3 mL 0.1%Na2CO3溶液中。Na2CO3溶液作为对照,紫外-可见分光光度计在600 nm 下检测A[24-25]。采血结束后,将小鼠脱颈处死,剥离肝脏、脾脏,称质量并分别按式(7)和(8)计算廓清指数(K)和吞噬指数(α)。

式中,K为碳廓清指数(未经矫正的吞噬指数);A1为t1样品的A;A2为t2样品的A;t1为注入墨汁后第1次取血时间;t2为注入墨汁后第2次取血时间。
2.3.6 淋巴器官/体质量比值测定 末次给药后,脱颈处死小鼠并解剖,取出脾脏、胸腺,准确称质量[26],并按公式(9)和(10)计算脾脏指数和胸腺指数(mg·g-1)。

2.4 统计学方法
采用Excel 2019和SAS 8.2统计软件对数据进行录入与统计分析,实验数据采用()表示,多组间比较采用单因素方差分析(ANOVA),两组间比较采用t检验,P<0.05为差异有统计学意义。
3 结果
3.1 甘草蜜炙前后对免疫低下小鼠血清溶血素和抗体生成细胞的影响
实验结果见表1,与对照组小鼠比较,模型组小鼠HC50和溶血空斑数均显著降低(P<0.01)。与模型组小鼠比较,阳性药组小鼠HC50和溶血空斑数均显著升高(P<0.01);生甘草组小鼠HC50显著升高(P<0.05),溶血空斑数升高,但差异无统计学意义;清炒甘草组小鼠HC50显著升高(P<0.01),溶血空斑数显著升高(P<0.05);蜜炙甘草组小鼠HC50显著升高(P<0.01),溶血空斑数显著升高(P<0.05),即清炒甘草组、蜜炙甘草组小鼠的HC50和溶血空斑数均有所升高,且差异均有统计学意义。同时,生甘草组、清炒甘草组小鼠HC50和溶血空斑数差异均有统计学意义(P<0.01),生甘草组、蜜炙甘草组小鼠HC50和溶血空斑数差异均有统计学意义(P<0.01),清炒甘草组、蜜炙甘草组小鼠HC50和溶血空斑数差异无统计学意义。
表1 不同炮制方法对免疫低下小鼠HC50及溶血空斑数的影响(, n=10)

表1 不同炮制方法对免疫低下小鼠HC50及溶血空斑数的影响(, n=10)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与生甘草组比较,▲P<0.05,▲▲P<0.01;与清炒甘草组比较,ΔP<0.05,ΔΔP<0.01;表2~6同。
3.2 甘草蜜炙前后对免疫低下小鼠DTH的影响
实验结果见表2,与对照组小鼠比较,模型组小鼠耳肿胀度显著降低(P<0.01)。与模型组小鼠比较,阳性药组小鼠耳肿胀度显著升高(P<0.01);生甘草组小鼠耳肿胀度显著升高(P<0.05);清炒甘草组小鼠耳肿胀度显著升高(P<0.01);蜜炙甘草组小鼠耳肿胀度显著升高(P<0.01),即生甘草组、清炒甘草组、蜜炙甘草组小鼠的耳肿胀度均有升高,且差异均有统计学意义。同时,生甘草组、清炒甘草组小鼠耳肿胀度的差异无统计学意义,生甘草组、蜜炙甘草组小鼠耳肿胀度的差异有统计学意义(P<0.01),清炒甘草组、蜜炙甘草组小鼠耳肿胀度的差异均有统计学意义(P<0.01)。
表2 不同炮制方法对免疫低下小鼠DTH的影响(, n=10)mg

表2 不同炮制方法对免疫低下小鼠DTH的影响(, n=10)mg
3.3 甘草蜜炙前后对免疫低下小鼠脾淋巴细胞增殖率和NK细胞活性的影响
实验结果见表3,与对照组小鼠比较,模型组小鼠SI、杀伤率均显著降低(P<0.01)。与模型组小鼠比较,阳性药组小鼠SI 显著升高(P<0.05)、杀伤率显著升高(P<0.01);生甘草组小鼠SI、杀伤率均升高,但差异无统计学意义;清炒甘草组小鼠SI 升高,但差异无统计学意义,杀伤率显著升高(P<0.01);蜜炙甘草组小鼠SI、杀伤率均显著升高(P<0.01)。同时,生甘草组、清炒甘草组小鼠SI差异有统计学意义(P<0.05),杀伤率差异有统计学意义(P<0.01);生甘草组、蜜炙甘草组小鼠SI、杀伤率差异均有统计学意义(P<0.01),清炒甘草组、蜜炙甘草组小鼠SI、杀伤率差异均有统计学意义(P<0.01)。
表3 不同炮制方法对免疫低下小鼠脾淋巴细胞增殖率和NK细胞活性的影响(, n=10)

表3 不同炮制方法对免疫低下小鼠脾淋巴细胞增殖率和NK细胞活性的影响(, n=10)
3.4 甘草蜜炙前后对免疫低下小鼠腹腔巨噬细胞吞噬功能的影响
实验结果见表4,与对照组小鼠比较,模型组小鼠吞噬率、吞噬指数均显著降低(P<0.01)。与模型组小鼠比较,阳性药组小鼠吞噬率、吞噬指数均显著升高(P<0.01);各给药组小鼠吞噬率、吞噬指数均显著升高(P<0.01),即生甘草组、清炒甘草组、蜜炙甘草组小鼠巨噬细胞吞噬功能均有升高,且差异均有统计学意义。同时,生甘草组、清炒甘草组小鼠吞噬率、吞噬指数差异均无统计学意义;生甘草组、蜜炙甘草组小鼠吞噬率差异均有统计学意义(P<0.05),吞噬指数差异有统计学意义(P<0.01);清炒甘草组、蜜炙甘草组小鼠吞噬率差异无统计学意义,吞噬指数差异有统计学意义(P<0.05)。
表4 不同炮制方法对免疫低下小鼠腹腔巨噬细胞吞噬功能的影响(, n=10)

表4 不同炮制方法对免疫低下小鼠腹腔巨噬细胞吞噬功能的影响(, n=10)
3.5 甘草蜜炙前后对免疫低下小鼠碳廓清功能的影响
实验结果见表5,与对照组小鼠比较,模型组小鼠K、α均显著降低(P<0.01)。与模型组小鼠比较,阳性药组小鼠K、α均显著升高(P<0.05);生甘草组小鼠K升高,但差异无统计学意义,α显著升高(P<0.05);清炒甘草组和蜜炙甘草组小鼠K、α均显著升高(P<0.01)。同时,生甘草组、清炒甘草组小鼠K、α之间的差异均无统计学意义;生甘草组、蜜炙甘草组小鼠K、α之间的差异均有统计学意义(P<0.01),清炒甘草、蜜炙甘草组小鼠K的差异有统计学意义(P<0.05),α之间的差异有统计学意义(P<0.01)。
表5 不同炮制方法对免疫低下小鼠碳廓清功能的影响(, n=10)
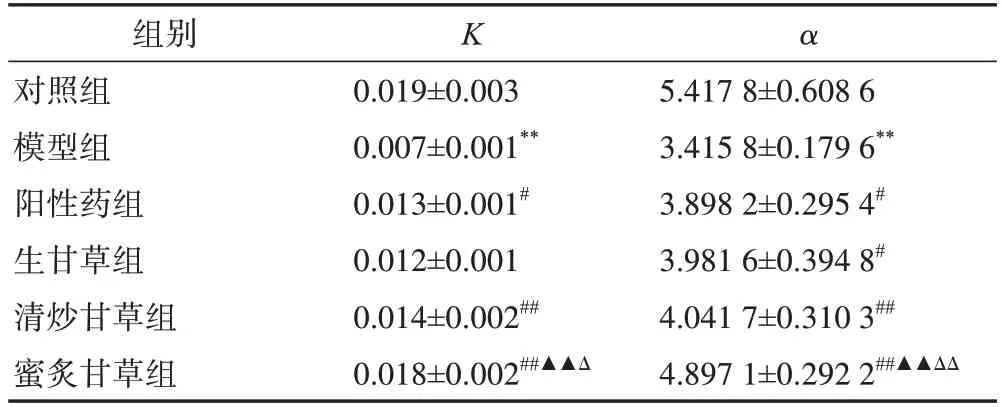
表5 不同炮制方法对免疫低下小鼠碳廓清功能的影响(, n=10)
3.6 甘草蜜炙前后对免疫低下小鼠胸腺指数、脾脏指数的影响
实验结果见表6,与对照组小鼠比较,模型组小鼠胸腺指数、脾脏指数均显著降低(P<0.01)。与模型组小鼠比较,阳性药组小鼠胸腺指数显著升高(P<0.01),脾脏指数显著升高(P<0.05);生甘草组小鼠胸腺指数显著升高(P<0.05),脾脏指数升高,但差异无统计学意义;清炒甘草组小鼠胸腺指数显著升高(P<0.01),脾脏指数显著升高(P<0.05);蜜炙甘草组小鼠胸腺指数、脾脏指数均显著升高(P<0.01)。同时,生、清炒甘草组小鼠胸腺指数、脾脏指数之间差异均无统计学意义,生、蜜炙甘草组小鼠胸腺指数差异无统计学意义,脾脏指数之间差异有统计学意义(P<0.05),清炒、蜜炙甘草组小鼠胸腺指数差异有统计学意义(P<0.05),脾脏指数之间差异无统计学意义。
表6 不同炮制方法对免疫低下小鼠胸腺指数、脾脏指数的影响(, n=10)mg·g-1

表6 不同炮制方法对免疫低下小鼠胸腺指数、脾脏指数的影响(, n=10)mg·g-1
4 讨论
脾脏及胸腺是动物体中重要的免疫器官,胸腺指数、脾脏指数可以从整体上评价小鼠体内的免疫功能,反映脏器组织的状态和功能[27-28];单核巨噬细胞为一种机体非特异性免疫的重要细胞,其吞噬能力是可用于判断机体非特异性免疫功能,而巨噬细胞的K反映其吞噬功能[29];采用SRBC对小鼠进行免疫,能够刺激小鼠B 细胞产生抗体,测定免疫后的小鼠血清对SRBC 的溶解能力,反映了抗体分泌细胞分泌抗体的能力,属于体液免疫应答功能[23];ConA 诱导脾淋巴细胞增殖实验可以评价T 细胞介导的细胞免疫功能[30];DTH 是抗原诱导机体发生的细胞性免疫应答,特异性抗原在抗原提呈细胞(APC)作用下与致敏T 细胞再次接触后,使T 细胞活化增殖并分化成为效应T 细胞,效应T 细胞进一步清除抗原,引起局部组织发生炎症反应[21]。
杨青等[31]通过比较甘草蜜炙前后对小鼠脾淋巴细胞增殖的作用发现甘草蜜炙后相比甘草生品能显著增加小鼠的免疫功能,并分析得出蜜炙后甘草免疫功能增强与甘草经蜜炙后成分发生的改变、新产生的成分及原有成分含量的变化密切相关。张恒斌等[32]通过甘草生制品与小鼠脾细胞免疫活性增殖实验发现甘草蜜炙后免疫活性增强且其水提物的免疫活性强于醇提物,并推测甘草免疫活性成分主要为多糖类成分。
本研究通过非特异性免疫、体液免疫、细胞免疫进一步全面探究甘草蜜炙前后对小鼠免疫调节作用的影响,结果表明,同等剂量下,生甘草、清炒甘草、蜜炙甘草均能一定程度上提高免疫低下小鼠的免疫功能,且蜜炙甘草组各指标均有显著提升,说明蜜炙甘草免疫调节作用优于生甘草和清炒甘草。根据已有文献报道[33-35],甘草蜜炙后以甘草苷为代表的二氢黄酮类成分含量总体呈下降趋势,以甘草酸为代表的三萜类成分含量呈下降趋势,以异甘草素为代表的查耳酮类成分含量呈上升趋势,与本团队前期研究结果一致,故推测清炒加热能使苷类成分的乙酰化产物含量增多,苷元含量降低,苷的含量升高;而蜜炙中蜂蜜对苷的乙酰化具有抑制作用,蜜炙甘草中甘草苷的含量低于生甘草、清炒甘草;而甘草中以甘草酸为代表的三萜类成分发生苷键断裂,不断生成次级苷及苷元,因此蜜炙后甘草中甘草酸含量有所下降,甘草次酸、异甘草素的含量相对升高;另外,甘草中含有多糖类组分,辅料蜂蜜中含有果糖、葡萄糖等成分,甘草蜜炙后糖类含量升高。综上,甘草蜜炙免疫调节作用增强,与甘草蜜炙后成分含量、结构的改变及新成分的生成等有密切关联,后期将对甘草蜜炙后有效成分的变化进行深入探究,为进一步阐明甘草蜜炙后免疫调节作用增强的炮制机制提供参考。
