基于UPLC-QTOF-MS和多元统计分析的赤芝道地性研究△
2022-07-06张国亮王晓彤王汉波赵建霞李振宇俞飞龙李振皓
张国亮,王晓彤,王汉波,赵建霞,李振宇,4,俞飞龙,4,李振皓,*
1.浙江寿仙谷植物药研究院有限公司,浙江 杭州 310000;2.浙江寿仙谷医药股份有限公司,浙江 武义 321200;3.寿仙谷珍稀药材产品省级重点农业企业研究院,浙江 武义 321200;4.浙江省珍稀植物药工程技术研究中心,浙江 武义 321200
灵芝为多孔菌科真菌赤芝Ganoderma lucidum(Leyss.ex Fr.)Karst.或紫芝G.sinenseZhao,Xu et Zhang 的干燥子实体,具有补气安神、止咳平喘等功效。现代研究表明,灵芝具有良好的抗肿瘤、免疫调节、抗氧化、降血糖等生物活性[1-3],在临床上有广泛应用。灵芝酸是灵芝主要的小分子活性成分,从灵芝属中分离出的灵芝酸类化合物已有300多个[4]。研究表明,灵芝酸类化合物不仅具有免疫调节活性[5],而且对不同肿瘤均有较明显的抑制作用,抗肿瘤机制包括阻滞细胞周期、诱导细胞凋亡和自噬,以及抑制转移和血管生成等[6-7]。此外,灵芝酸还具有抗炎、抗氧化、抗菌和调血脂等活性[8]。
浙江有悠久的灵芝使用历史,在浙江田螺山、余杭镇南湖、湖州千金镇塔地3 个新石器时代遗址出土的史前灵芝样品将我国灵芝的应用历史追溯至6800 多年前[9]。历代著作对浙江产灵芝也多有描述[10]。由中华中医药学会发布的《灵芝道地药材》确定浙江为灵芝的道地产区之一。灵芝也是浙江省确定的新“浙八味”代表性品种之一。但是,道地与非道地产区灵芝在化学成分、生物活性上的差异缺少系统研究,不同种植方式(段木、代料、野生)、采收时期等对灵芝质量的影响也尚未明确。本研究应用超高效液相色谱-四级杆飞行时间质谱法(UPLC-QTOF-MS)对不同产区、种植方式和采收时期的120 批赤芝样品中的灵芝酸类成分进行检测,结合多元统计分析,对赤芝的道地性进行分析,初步筛选出浙产赤芝的道地性标志物,为阐明赤芝的道地性提供数据支撑,也为赤芝优良品种选育、药效物质筛选提供参考。
1 材料
1.1 试药
从浙江、安徽、四川、山东、福建5 个产区收集了120 批赤芝样品,经浙江寿仙谷医药股份有限公司朱卫东高级农艺师鉴定均为赤芝Ganoderma lucidum(Leyss.ex Fr.)Karst.,包括代料、段木和野生3 种种植方式,以及现蕾、开伞、成熟、采收4 个生长时期,见表1。
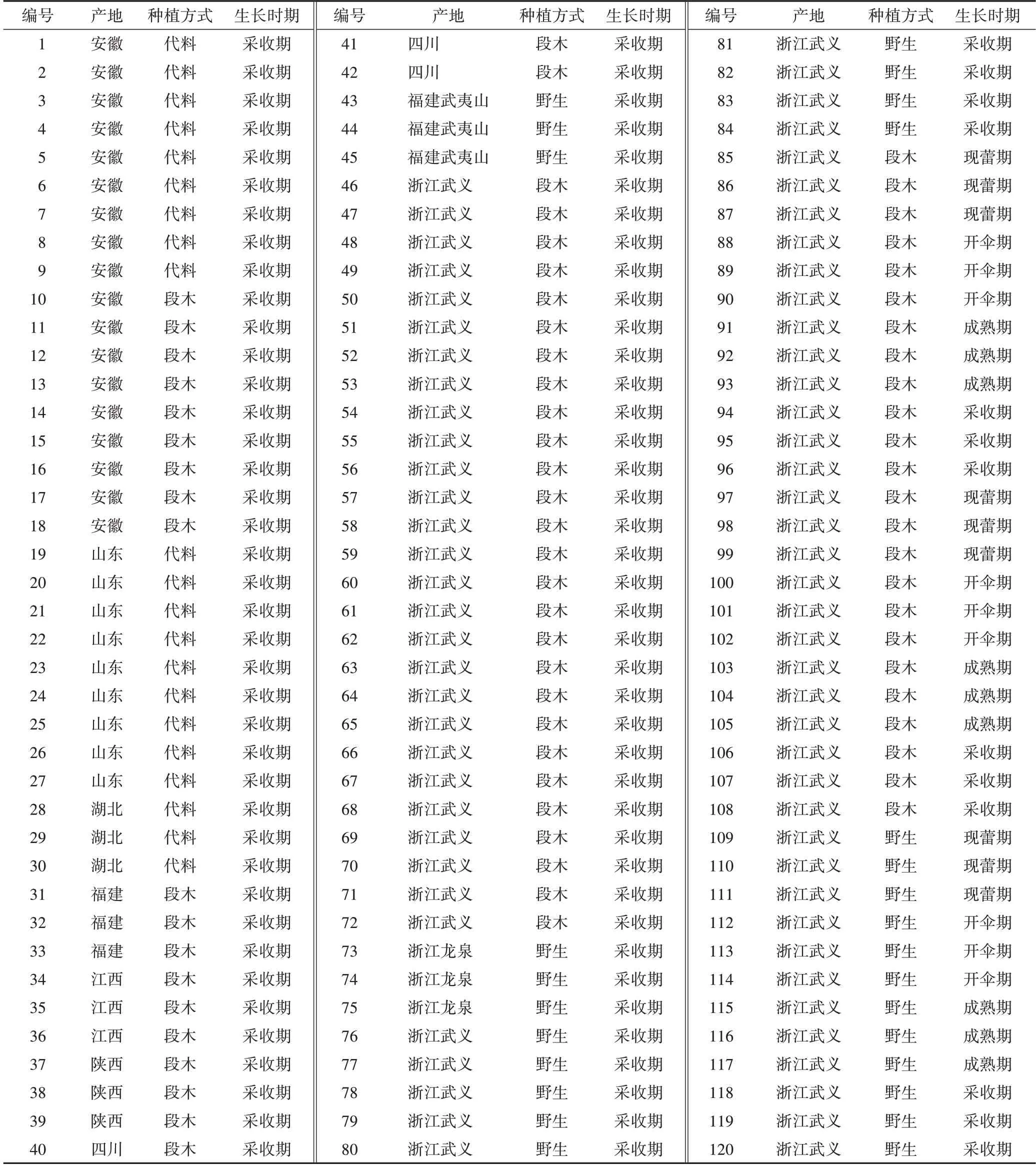
表1 赤芝样品信息
对照品灵芝酸C2(批号:PS000597,纯度:99.28%)、灵芝酸C1(批号:PS010882,纯度:99.84%)、灵芝酸G(批号:PS010838,纯度:96.76%)、灵芝烯酸B(批号:PS010839,纯度:99.88%)、灵芝酸B(批号:PS010857,纯度:99.41%)、灵芝烯酸A(批号:PS011374,纯度:98.60%)、灵芝酸A(批号:PS010388,纯度:99.89%)、赤芝酸A(批号:PS010891,纯度:98.44%)、灵芝烯酸D(批号:PS010884,纯度:99.51%)、灵芝酸D(批号:PS000598,纯度:98.82%)、灵芝醇B(批号:PS011327,纯度:98.64%)、灵芝醛A(批号:PS011330,纯度:97.54%)、灵芝烯酸C(批号:PS010840,纯度:99.87%)均购自成都普思生物科技股份有限公司;灵芝酸F(批号:CFS201903,纯度≥98%)、灵芝酸DM(批号:CFS202001,纯度≥98%)、灵芝酮三醇(批 号:CFS201903,纯 度≥98%)、灵 芝 醇F(CFS201902,纯度≥98%)均购自武汉普标科技有限公司;乙腈(色谱纯,赛默飞世尔科技公司);甲醇、甲酸(色谱纯,美国默克公司);水为实验室自制超纯水。
1.2 仪器
ACQUITY UPLC I-Class Plus 型超高效液相色谱仪、SYNAPT XS 型高分辨质谱仪、ACQUITY UPLC HSS T3 型色谱柱(美国Waters 公司);XS205DU 型分析天平(瑞士梅特勒-托利多公司);Minispin 型高速离心机(德国艾本德公司);KQ52000E型超声波清洗器(昆山市超声仪器有限公司);Direct Q5型超纯水仪(德国默克密理博公司)。
2 方法
2.1 样品制备
2.1.1 对照品溶液的制备 分别精密称取17 个灵芝酸对照品适量,加色谱级甲醇摇匀使其充分溶解,并定容,配制成终质量浓度为0.05 mg·mL-1的单一对照品溶液。
2.1.2 供试品溶液的制备 分别精密称取受试样品各0.5 g,置具塞锥形瓶中,加色谱级甲醇50 mL,超声(功率200 W,频率40 kHz)提取30 min,冷却,用0.22 μm 的微孔滤膜滤过,取续滤液,即得供试品溶液,待UPLC-QTOF-MS分析。
2.2 色谱与质谱条件
色谱条件:Waters ACQUITY UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0 min,20%B;0~2 min,20.0%~26.5%B;2~9 min,26.5%B;9~19 min,26.5%~35.0%B;19~28 min,35.0%~60.0%B;28~32 min,60.0%~70.0%B;32~37 min,70.0%~90.0%B;37~40 min,90.0%~100.0%B;40~45 min,100.0%B);流速为0.45 mL·min-1;柱温为25 ℃;进样体积为1 μL。
质谱条件:ExionLC ™AC 液相系统,串联X500R QTOF 质谱系统;电喷雾离子源,正、负离子模式;质量扫描范围为m/z100~1500;雾化气(Gas1)压力为379 kPa,干燥气(Gas2)压力为413 kPa,气帘气(Cur)压力为241 kPa,碰撞气(CAD)压力为48 kPa;离子源温度为600 ℃;离子源负离子时电压为-4500 V、正离子时电压为4000 V。
2.3 数据处理
质谱原始数据通过SCIEX OS 1.5 进行处理,对灵芝酸进行鉴定,获取相应的峰面积;采用SIMCA 14.1的正交偏最小二乘法-判别分析(OPLS-DA)模块进行多元统计分析;以模型对X和Y矩阵的解释率(R2X、R2Y)、模型的预测能力(Q2)等指标评价聚类效果,通过变量重要性投影(VIP)值(VIP>1)和t检验(P<0.05)筛选差异化合物。
3 结果与分析
3.1 赤芝化学成分鉴定
17 个对照品分别在正、负离子条件下进行质谱数据采集,并根据分析结果建立谱库。从对照品总离子流图看,灵芝酮三醇、灵芝醇F、灵芝醇B、灵芝醛A 在正、负离子条件下均未出峰,且以准分子离子或加酸峰离子等也未提取到目标峰,推测这些成分在现有分析条件下响应不佳,可能与电离模式有较大关系。其余13 个灵芝酸类化合物响应高、分离度好且峰形良好,适用于定性定量分析。13 个对照品、样品的质谱信息见表2,总离子流图见图1。

图1 赤芝样品与对照品总离子流图

表2 赤芝中灵芝酸类化合物质谱信息
3.2 基于层次聚类的赤芝道地性分析
结合对照品的二级质谱图,从赤芝中鉴定了13 个灵芝酸类成分。根据这些成分在不同赤芝样品中的相对含量,应用ward.D2 算法进行层次聚类分析(图2)。如图2A所示,尽管多数同产区的赤芝可以聚为一类,但仍有不少样品未能较好的聚类。这主要是因为检测的赤芝样品在种植方式和采收时期上存在较大差异,这些差异使得灵芝酸的含量发生变化,导致层次聚类法不能很好地将浙产和非浙产赤芝区分。
进一步分析发现,编号为7~9、19~21、25~30的样品中灵芝烯酸C、灵芝酸C2、灵芝酸A、灵芝酸DM、灵芝烯酸B、灵芝酸B、灵芝酸G、灵芝酸C1的相对含量普遍高于其他样品。编号为85~93、97~111 的样品中灵芝酸B、灵芝酸G、灵芝酸C1、灵芝酸F、灵芝酸D、灵芝烯酸D的相对含量普遍高于其他样品。此外,通过对样品中各灵芝酸的相关性进行分析(图2B),发现多数灵芝酸呈现较好的正相关。关,其中灵芝酸C1和灵芝酸F,灵芝酸C2和灵芝烯酸C,灵芝酸B 和灵芝酸G 等的相关性较强,可能因为这些成分的生物合成途径较为接近,为灵芝酸的生物合成调控研究提供了参考。

图2 基于层次聚类的赤芝道地性分析
3.3 基于多元统计分析的赤芝道地性分析
根据产地信息,将样品分为浙产和非浙产2 个组别,通过OPLS-DA 模型对两组进行差异成分分析(图3)。模型的R2X=0.866,R2Y=0.903,Q2=0.883,说明该模型拟合及预测能力良好。如图3A所示,浙产与非浙产赤芝样品可在得分图中明显聚为2 类,说明两者间的化学成分存在明显差异。通过VIP 值对差异灵芝酸进行筛选,以VIP 值>1 为限值,筛选出灵芝酸D、灵芝烯酸B、灵芝烯酸D 等差异成分,表明这些成分对聚类有较大贡献(图3B)。其中灵芝酸D、灵芝烯酸D 在浙产赤芝样品中显著高于非浙产赤芝(图3C~D),可以作为浙产赤芝的标志性成分。对浙产与非浙产赤芝样品中灵芝酸D、灵芝烯酸B、灵芝烯酸D 含量进行t检验,差异均有统计学意义(P<0.001,图4)。

图3 基于OPLS-DA的浙产和非浙产赤芝差异性分析

图4 浙产与非浙产赤芝差异性成分
3.4 浙产与非浙产段木赤芝差异性分析
不同产地赤芝的种植方式存在较大差异,如浙江赤芝以段木栽培为主,山东以代料栽培为主,安徽2 种模式都有应用。本研究收集了21 份非浙产段木赤芝和51 份浙产段木赤芝,为减少不同因素对聚类造成的差异,进一步用OPLS-DA 分析了浙产与非浙产段木赤芝的差异成分(图5)。模型的R2X=0.939,R2Y=0.932,Q2=0.918,说明该模型拟合及预测能力良好。
如图5A 所示,浙产与非浙产段木赤芝样品可明显聚为2 类,说明两者间的成分存在明显差异。VIP值>1 的化合物有4 个(图5B),对其进行t检验,4 个成分在2 组样品中含量显著有统计学意义(P<0.001,图6),且浙产段木赤芝样品中灵芝酸D、灵芝酸B、灵芝酸C1、灵芝酸G的含量均高于非浙产段木赤芝。这可能与各产地的环境气候有较大关系,浙江的环境气候有利于灵芝酸D等4个灵芝酸的积累。

图5 基于OPLS-DA的浙产与非浙产段木赤芝差异性分析
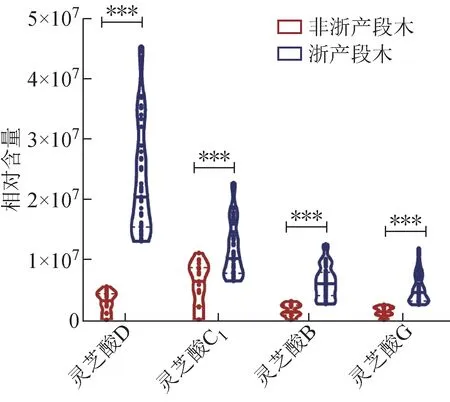
图6 浙产与非浙产段木赤芝差异性成分
3.5 浙产段木与野生赤芝差异性分析
选取采收期的27份浙产段木赤芝及12份浙产野生赤芝,通过OPLS-DA 模型对2 组进行差异性分析,比较人工栽种赤芝与野生赤芝的质量差异(图7)。模型的R2X=0.983,R2Y=0.952,Q2=0.917,说明该模型拟合及预测能力良好。如图7A所示,浙产段木赤芝与野生赤芝可明显聚为2 类,说明两者间的成分存在明显差异。野生赤芝的组内差异较大,而段木赤芝的组内差异较小,也说明人工种植有利于确保药材的质量一致性。VIP 值>1 的化合物有5 个(图7B),对其进行t检验,差异有统计学意义(P<0.001,图8),且段木赤芝中灵芝烯酸D、灵芝烯酸B、灵芝烯酸A、灵芝烯酸C、灵芝酸A 5 个成分相对含量均高于野生赤芝。

图7 基于OPLS-DA的浙产段木与野生赤芝差异性分析

图8 浙产段木与野生赤芝差异性成分
3.6 不同发育时期赤芝差异性分析
通过OPLS-DA 模型对武义产区现蕾期、开伞期、成熟期和采收期4 个发育阶段共36 份赤芝样品进行聚类分析。模型的R2X=0.990,R2Y=0.865,Q2=0.785,说明该模型拟合及预测能力良好。如图9A所示,不同发育时期赤芝样品聚类效果明显,说明成分存在明显差异。VIP 值>1 的化合物有3 个(图9B),分别是灵芝酸DM(图9C)、灵芝烯酸B(图9D)和灵芝烯酸C,表明这些成分对聚类贡献较大,是主要的差异成分。用平行坐标图直观展示不同发育时期灵芝酸含量的差异(图10),可发现现蕾期样品灵芝酸含量相对较高,随着子实体逐渐成熟,多数灵芝酸含量有下降的趋势。
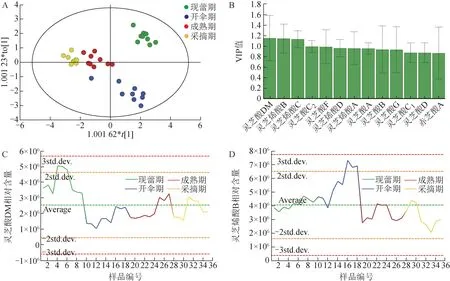
图9 基于OPLS-DA的不同发育时期赤芝差异性分析

图10 赤芝不同发育时期灵芝酸相对含量变化
4 讨论
我国灵芝种类达100 多种,分布最广地区在南岭南北,包括广东、广西、福建、台湾南部、海南、香港,以及云南西双版纳、西藏的察隅和墨脱及林芝地区。由于各产区生态环境差异,灵芝品种数量及优势菌株差异较大[11]。吴鸿雪等[12]对不同品种、不同基质、不同生长时期的灵芝子实体的总灵芝酸含量、单体灵芝酸含量及抑制肿瘤细胞增殖活性进行了测定,发现不同样品单个灵芝酸含量变化较大,但总灵芝酸含量差异较小,体外抗肿瘤作用也相近。金鑫等[13]对不同生长期灵芝的农艺性状和多糖含量进行了研究,发现成熟期多糖含量达到最高值。郭晓蕾等[14]应用高效液相色谱法(HPLC)指纹图谱评价了不同产地灵芝样品的相似性,发现除个别样品外,各产地样品与对照指纹图谱的相似度都较高。本研究结果表明,不同产区、不同栽培条件、不同生长时期赤芝的化学成分存在较明显差异。
液相色谱与质谱联用技术是一种集高效分离与高灵敏度、高选择性检测于一体的现代分离分析技术,可同时测定数十个甚至上百个成分,近年来在中药化学分析中得到了广泛运用[15-16]。在本研究中,利用UPLC-QTOF-MS 同时检测了赤芝中13 种灵芝酸类成分,并对不同产地、不同栽培方式、不同发育时期的样品进行分析,可以更全面地评价赤芝的道地性。
通过综合运用UPLC-QTOF-MS和多元统计分析发现,不同产地赤芝样品在化学成分上有较为明显的差异。灵芝酸D、灵芝烯酸D 在浙产赤芝样品中显著高于非浙产赤芝,说明浙江的气候环境容易使这2 个成分在赤芝中蓄积,可作为浙产赤芝的标志性成分。进一步对浙产和非浙产段木赤芝进行分析,发现灵芝酸D、灵芝酸B、灵芝酸C1、灵芝酸G 4个成分含量均显著高于非浙产段木赤芝,其中灵芝酸D提高了近8 倍。灵芝酸D 可以通过激活蛋白激酶R样内质网激酶(PERK)核转录因子E2相关因子2(Nrf2)通路发挥抗衰老作用[17],也具有较好的抑制肿瘤细胞增殖等作用[18]。灵芝烯酸D 为潜在的抗肿瘤活性成分[19]。灵芝酸B 对脂多糖诱导的急性肺损伤有良好的保护作用[20],可通过逆转ATP 结合蛋白亚家族1 抗体(ABCB1)介导的多药耐药来恢复化疗药物对肿瘤细胞的细胞毒作用[21],对人类免疫缺陷病毒-1(HIV-1)蛋白酶有明显的抑制作用[22]。灵芝酸C1则表现出很好的抗炎作用[23]。上述研究结果也提示,灵芝酸含量的改变可能导致赤芝相应的生物活性发生变化,可进一步应用报道的模型比较研究浙产和非浙产赤芝在生物活性上的差异。
野生药材与人工栽培药材孰优孰劣,一直存在不同的看法。本研究也对浙产段木和野生赤芝的差异进行了研究,发现人工栽培的段木赤芝中灵芝烯酸D、灵芝酸A 等成分均显著高于野生赤芝。此外,不同批的段木赤芝也表现出较好的稳定性,这有助于确保临床疗效的一致性。灵芝酸A 具有抗肿瘤、抗炎、抗氧化、恢复肝损伤、抗关节炎等多种药理活性,是具有开发前景的候选药物[24-27]。后续应结合体内、体外药效学实验,进一步评价野生与人工栽培赤芝活性的差别。
本研究也发现,不同发育时期赤芝样品中,灵芝酸含量有较大差异。总体而言,现蕾期样品中灵芝酸含量较高,开伞期次之,成熟期和采摘期相对较低,与文献[28]报道较为一致。通常认为产孢赤芝在喷孢子粉后(采摘期),灵芝酸等活性成分会呈现下降趋势。本研究也发现,有些品种成熟期和采摘期灵芝酸的含量差异较大,一些品种在喷粉后,灵芝酸含量并没有显著下降。从综合利用角度考虑,这些品种既可提供孢子粉原料,也可作为赤芝子实体(饮片)原料,且不损失活性,有较大的开发价值。下一步计划检测喷粉前后生物活性的变化,并从分子育种角度,对其种质进行评价,选育出高活性的新赤芝品种。
本研究较为全面地对赤芝的道地性进行了评价,初步筛选出具有特征性的浙产赤芝化学标志物。有研究表明,地理和气候等因素所致的土壤环境异质性,以及内生菌、微生物等微生态的因素对道地性有重要影响[29-30]。因此,后续研究也可以对不同产地的土壤及其微生态进行分析,结合遗传因素等及人工智能、神经网络等先进算法,更全面地阐明赤芝道地性形成机制。也需要结合不同层次的药效学实验进行阐释和验证,并结合临床研究,为道地药材的疗效优越性提供数据支撑。
