CuO/ZnO/Al2O3改性催化剂上CH3OH重整制氢的研究
2022-07-06张海涛
王 康, 李 涛, 张海涛
( 华东理工大学大型工业反应器工程教育部工程研究中心,上海 200237)
氢作为一种新能源,能够降低CO2的排放,从而减缓全球变暖问题[1]。氢主要用于合成氨、甲醇等工业领域[2]。近年来,氢作为一种清洁能源被用于燃料电池行业,但其中的一个难题是氢气的便携性问题,解决方案之一是利用甲醇进行车载制氢[3]。
甲醇水蒸气重整(Methanol Steam Reforming, MSR)反应体系十分复杂,反应机理也不统一,MSR体系主要包含甲醇水蒸气重整(SR)、甲醇分解(DE)和水汽变换(WGS)3个反应。从催化剂和反应活化能角度分析,有研究人员提出DE-WGS反应机理,但是实验测得的CO浓度远远低于WGS反应计算的理论值[4-5]。Choi等[6]提出了SR-DE反应机理,但仍不能预测CO含量。文献[7-8]提出SR-RWGS(逆水汽变换)反应机理,认为CO来自RWGS反应,解决了实验测得的CO含量低于理论计算值的问题。
根据MSR反应体系中所包含的方程数,MSR动力学模型分为单速率模型、双速率模型和三速率模型。Tesser等[9]在低温(160~200 ℃)下发现了几种单速率动力学模型,但是其适用范围有限,实验值与模型预测值的偏差较大。Idem等[10]提出了能够适用不同温度区间的反应动力学模型,以此来提高模型的准确性。单速率反应动力学模型简化了MSR反应体系,虽然能够快速地预测CH3OH、H2、CO2等关键组分的含量,但是无法预测CO含量,不能应用到对CO含量较敏感的燃料电池中。Purnama等[11]认为CO可能来自于RWGS反应,从而提出SR-RWGS双速率模型。Peppley等[12]提出了包含3个反应的三速率反应动力学模型,能够完整地预测产物中各组分的含量,但是该模型复杂,求解困难。上述3种MSR动力学模型中,双速率模型能够预测CO含量,并且参数少,适合推广使用。本文推导并验证了Langmuir-Hinshelwood型双速率动力学模型,为催化剂的工业化应用提供实验依据。
相比于Pd、Pt、Ni型催化剂,Cu系催化剂的失活研究比较少。Twigg等[13]提出了Cu系催化剂失活的原因主要是烧结、积碳、中毒等。本文通过对催化剂进行表征,找出催化剂失活的具体原因,有助于延长催化剂使用寿命。
1 实验部分
1.1 实验原料
甲醇:w≥99%,上海阿拉丁生化科技股份有限公司;超纯水系统(DZG-303A),上海砾鼎水处理有限公司;石英砂(SiO2):超纯砂,上海阿拉丁生化科技股份有限公司;氮气(N2):φ≥99.9%,液化空气(上海)有限公司;氢气-氮气混合气(H2-N2),体积分数H25%、N295%,液化空气(上海)有限公司。
1.2 测试与表征
低温氮气物理吸附仪(美国Micrometrics公司ASAP 2020型):453 K下真空脱气6 h,然后在77 K液氮中脱附;X射线荧光光谱仪(德国Bruker公司S4 PIONEER型):Rh靶管,最大功率是4 kW;X射线衍射仪(日本Rigaku公司D/MAX2550VB/PC型):射线源是Cu/Kα,测试电压为40 kV,电流为200 mA,扫描范围10°~80°,扫描速率为8(°)/min;全自动程序升温化学吸附仪(美国Micrometrics公司AutochemⅡ2920型):300 ℃下纯氢还原1 h,降至室温后通入CO吸附30 min,再换载气He吹扫,最后以10 ℃/min升温至700 ℃。
1.3 实验流程
在常压条件下,采用等温积分反应器(内径10 mm,长度500 mm)进行CuO/ZnO/Al2O3改性催化剂的MSR反应性能评价。40~60目(250~380 μm)的催化剂颗粒与40~60目(250~380 μm)的石英砂按照体积比1∶1混合稀释后,放置于底部垫有高温石英棉的反应器中部恒温区内。床层底部装有镍铬-康铜热电偶,用来测量反应床层温度,反应器内压力用精密压力表测量。反应前,反应器内通入H2-N2混合气(50 mL/min),程序升温至300 ℃后,保温2 h,进行催化剂还原。还原结束后,通高纯N2将反应器内温度降至室温。N2作为反应载气,配制好的甲醇水溶液通过神舟微科2PB系列平流泵进入预热器中,汽化后进入反应器中反应。反应后气体经冷凝器冷凝得到甲醇和水,不凝性气体通过气液分离器后进入Agilent 7890B气相色谱仪中,分析气体组成,反应尾气通入皂膜流量计测量后放空。甲醇转化率(X)和CO选择性(S)分别按式(1)和式(2)计算。

式中,Fi,in、Fi,out分别表示i组分(CH3OH、CO或CO2)在反应器进口和出口处的摩尔流率。
1.4 内、外扩散影响的消除
甲醇水蒸气重整制氢反应为气-固非均相催化反应,研究其反应动力学时,需要先消除内、外扩散对反应体系的影响。
对于气-固非均相催化反应,影响内扩散的主要因素是催化剂的颗粒大小,其可以通过减小催化剂粒径来消除。当催化剂粒径减小到一定程度时,甲醇转化率不会随着粒径的改变而变化,内扩散影响被消除。本实验在常压和240 ℃的条件下,采用5组不同粒径(即20~40目(380~830 μm)、40~60目(250~380 μm)、60~80目(180~250 μm)、80~100目(150~180 μm)、100~120目(120~150 μm))的催化剂。由图1可知,当催化剂粒径减小至250~380 μm时,甲醇转化率不再随着粒径的变化而变化,证明内扩散影响已消除。因此,在进行动力学实验时,催化剂粒径为250~380 μm。

图1 催化剂粒径对内扩散的影响Fig. 1 Effect of particle size of catalyst on internal diffusion
提高进料的液时空速(Liquid Hourly Space Velocity, LHSV)、增加催化剂用量均可以减弱外扩散影响。选用两组不同装填量(1 g和2 g)的催化剂,通过调整LHSV(0.1~6.0 h−1)来考察消除外扩散影响的条件,结果如图2所示。图2表明,当LHSV大于或等于0.6 h−1时,两组催化剂的甲醇转化率几乎相同,说明外扩散影响已经消除,因此动力学实验的液时空速不低于0.6 h−1。
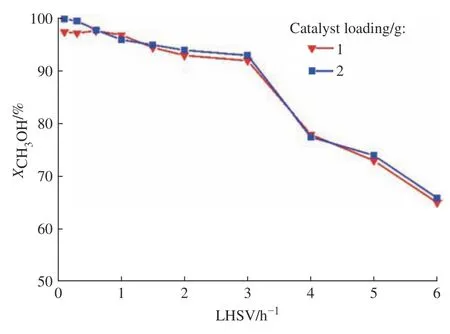
图2 进料液时空速对外扩散的影响Fig. 2 Effect of LHSV on external diffusion
2 结果与讨论
2.1 操作条件对反应的影响
在水与甲醇物质的量之比为1.2、LHSV为3.0 h−1、常压的反应条件下,考察了反应温度(200~300 ℃)对CH3OH转化率和CO选择性的影响,结果如图3所示。由图3可知,CH3OH转化率和CO选择性都随着反应温度的升高而增加,当温度超过240 ℃时,甲醇转化率接近100%。SR反应和DE反应都属于吸热反应,温度升高,CH3OH转化率会升高;WGS反应是放热反应,温度升高有利于RWGS和DE反应,所以CO选择性会升高。温度为240~250 ℃时,CH3OH转化率很高,此时CO选择性还没有急剧升高,所以,MSR反应的适宜温度为240~250 ℃。
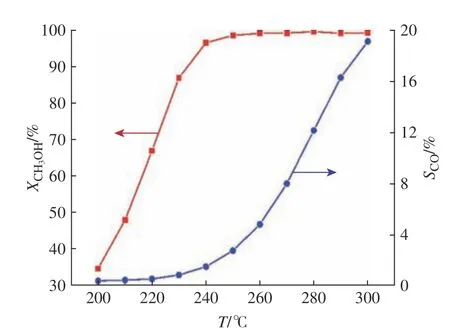
图3 温度对反应结果的影响Fig. 3 Effect of the temperature on reaction results
在温度为240 ℃、LHSV为3.0 h−1、压力为常压的反应条件下,考察了甲醇水溶液进料中水与甲醇物质的量之比(1.0~2.0)对CH3OH转化率和CO选择性的影响(图4)。由图4可知,CH3OH转化率随着水与甲醇物质的量之比的增大而增加,CO选择性则相反,随着水与甲醇物质的量之比的增大而减小,当水与甲醇物质的量之比达到1.2时,CH3OH转化率在95%以上。水与甲醇物质的量之比的增大,有利于SR和WGS反应,但是气化甲醇水溶液会消耗较高的能量。因此本实验适宜的水与甲醇物质的量之比为1.2。
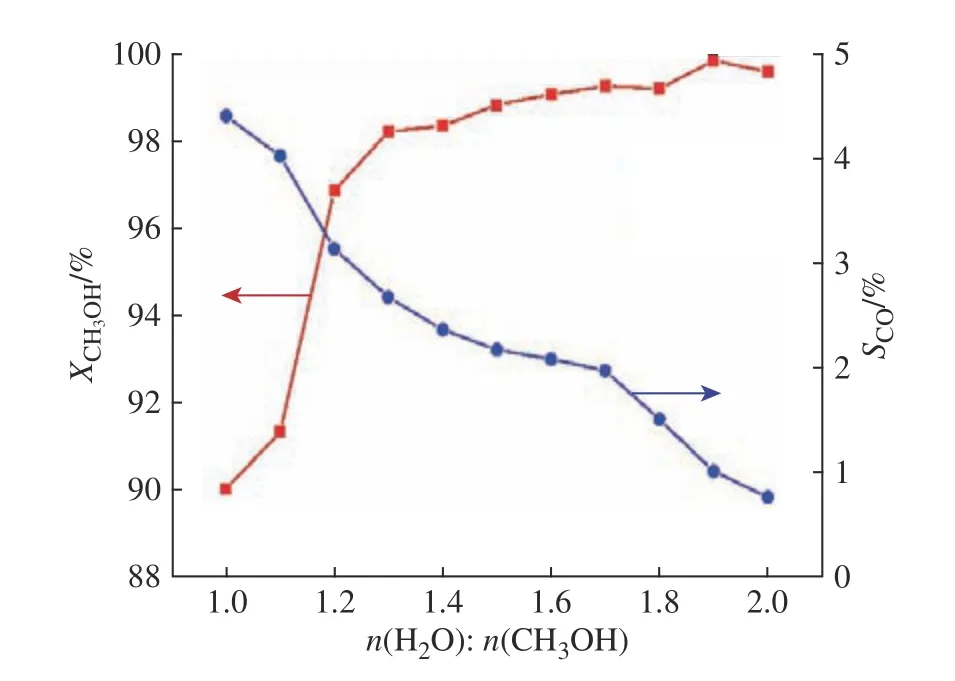
图4 水与甲醇物质的量之比对反应结果的影响Fig. 4 Effect of H2O/CH3OH molar ratio on reaction results
在温度为240 ℃、水与甲醇物质的量之比为1.2、压力为常压的反应条件下,考察了LHSV(0.3~11.1 h−1)对CH3OH转化率和CO选择性的影响。由图5可知,CH3OH转化率和CO选择性随着LHSV的增大而减小。LHSV增加,反应物在反应器床层内的停留时间变短,使得反应不完全,所以CH3OH转化率和CO含量都会下降。LHSV太大,反应不完全,会浪费原料;LHSV太小,反应速率太慢,产氢速率太慢,所以要根据不同的生产要求选择合适的LHSV。
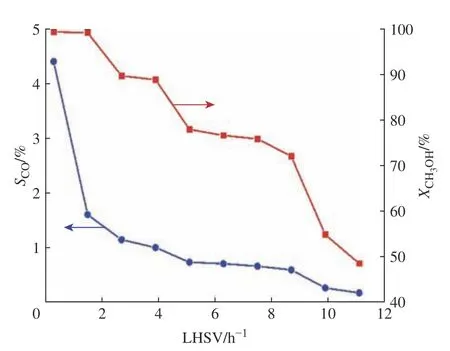
图5 液时空速对反应结果的影响Fig. 5 Effect of LHSV on reaction results
2.2 本征反应动力学模型
甲醇水蒸气重整制氢反应体系主要由SR反应、DE反应和WGS反应组成,反应式及焓变分别如式(3)~式(5)所示。

本文采用的是Sandra等[14]提出的SR-RWGS双速率模型,其既能预测主要产物H2和CO2的含量,也能预测副产物CO的含量,并且求解过程相对来说比较简单。本文涉及到的Langmuir-Hinshelwood型双速率动力学模型方程中SR反应速率表达式和RWGS反应速率表达式分别如式(6)和式(7)所示。
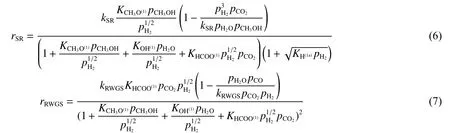
式中,kSR为SR反应的速率常数,kRWGS为RWGS反应的速率常数,Ki为组分i的吸附常数(其中括号中符号表示催化剂的活性位),pj为j组分的分压。其中与温度有关的反应速率常数和吸附常数可以用阿仑乌尼斯方程表示,具体公式如下:

对于CuO/ZnO/Al2O3催化剂而言,式(10)中的吸附热数据在许多研究中已经确定,为了减少待估参数的个数,本文采用Peppley等[12]给出的4个吸附热数据,具体如下:
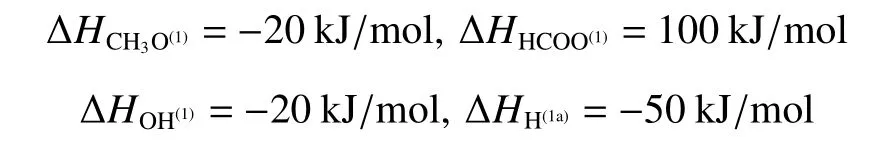
采用某研究所制备的CuO/ZnO/Al2O3催化剂,装填量2 g,粒径40~60目(250~380 μm)。反应在常压下进行,反应温度范围473.85~552.65 K,进料甲醇水溶液中水与甲醇物质的量之比1.0~1.8,进料LHSV范围0.6~10.2 h−1。采用正交试验方法设计了实验过程,得到了25组实验数据,如表1所示。

表1 甲醇水蒸气重整制氢的本征动力学实验数据Table 1 Experimental data of the intrinsic kinetics of hydrogen production via methanol steam reforming
对于本实验中的固定床反应器,CO2和CO的连续性方程如下:

式中,N为反应次数(N=25),下标cal表示模型计算值,下标exp表示实验值。
运用1STOpt软件进行编程计算,得到动力学方程参数如表2所示。甲醇水蒸气重整反应活化能为100.3 kJ/mol,逆水汽变换反应的活化能为79.5 kJ/mol。Peppley等[12]报道甲醇水蒸气重整和逆水汽变换反应活化能分别为102.8 kJ/mol和87.6 kJ/mol;Agarwal等[15]研究发现在铜基催化剂上甲醇水蒸气重整和逆水汽变换反应的活化能分别为92 kJ/mol和79.7 kJ/mol;Silva等[16]也报道了甲醇水蒸气重整反应的活化能是86.9 kJ/mol;Patel等[17]提出甲醇水蒸气重整反应的活化能是87.7 kJ/mol。通过与上述文献对比发现,本文得到的SR和RWGS反应活化能与文献报道值很接近。由表2可知,所有参数的95%置信区间都不包括0,本次参数估值具有统计学意义。
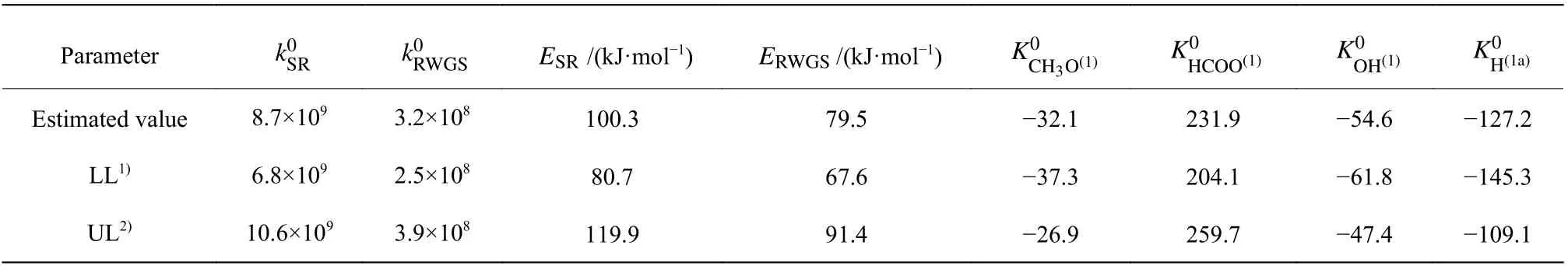
表2 运用ISTOpt软件得到的动力学模型参数Table 2 Estimated parameters for the kinetic model by ISTOpt software
图6示出了反应器出口处CO2、CO摩尔流率实验值与计算值的对比结果,可见实验值与计算值比较接近,动力学模型中反应器出口处CO2和CO的相对误差绝对值[18]分别为1.36%和0.93%,拟合效果良好。

图6 反应器出口处CO2(a)、CO(b)摩尔流率实验值与计算值的比较Fig. 6 Comparison of experimental and calculated molar flow rates of CO2(a) and CO(b) at reactor outlet
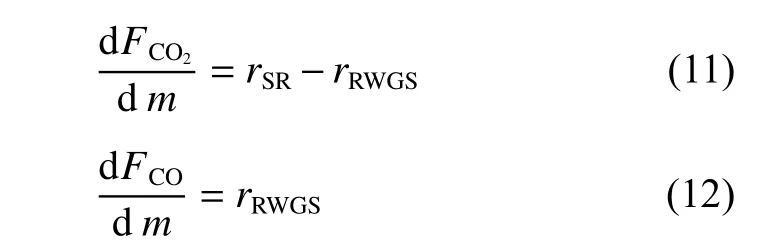
式中,m为催化剂的质量,通过四阶Runge-Kutta法求解常微分方程(11)和(12),将25组实验数据代入速率表达式中,利用最大继承法(全局+局部搜索)进行参数估值,目标函数为反应器出口处CO2、CO摩尔流率计算值与实验值的残差平方和f:
2.3 催化剂失活原因
催化剂在应用时,除了要考虑其活性外,还要考虑其失活问题。对于本实验中的改性催化剂CuO/ZnO/Al2O3来说,高温(300 ℃)下MSR反应产生的高含量CO可能会加剧催化剂的失活[19-20]。本文通过对新鲜催化剂(样品1)、新鲜催化剂在300 ℃下反应20 d后的失活催化剂(样品2)、新鲜催化剂在200 ℃下反应20 d后的失活催化剂(样品3)3种催化剂进行表征,探讨催化剂失活的具体原因,并验证300 ℃下反应时产生的高含量CO是否会加剧催化剂失活。所用到的表征手段有N2吸附-脱附测试(BET方程)、X射线荧光光谱(XRF)分析、X射线衍射(XRD)分析、CO程序升温脱附(CO-TPD)方法。由图7可知,催化剂经过20 d的使用之后,活性都出现了明显的下降,其中在300 ℃下反应的催化剂(样品2)活性下降得更快。
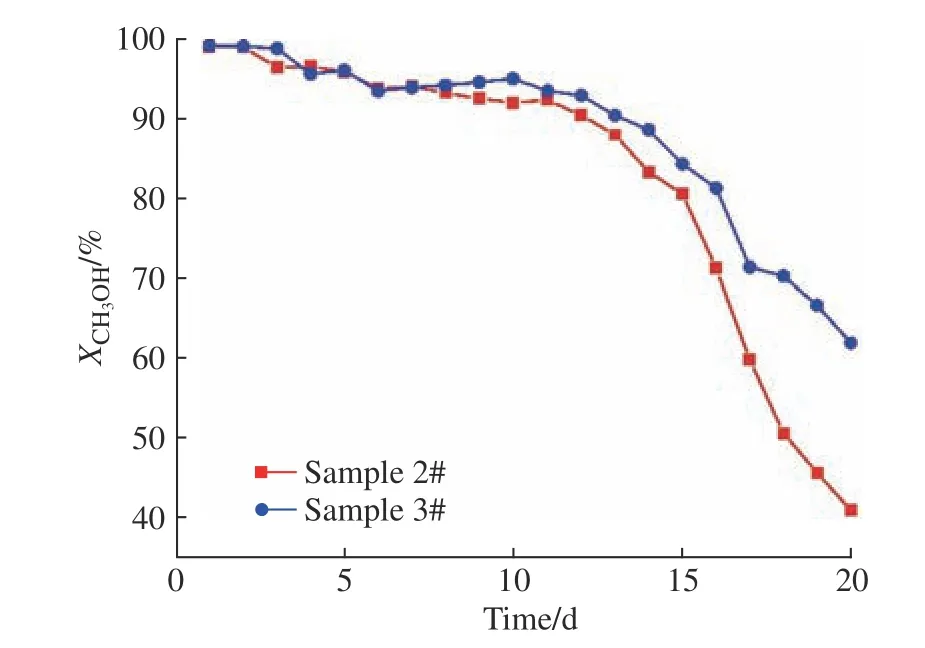
图7 催化剂活性与时间关系Fig. 7 Relationship between catalyst activity and time
BET方程主要用来表征催化剂的比表面积、孔容和孔径,反映催化剂的表面形态。一般来说,比表面积越大,反应物与催化剂的接触面积越大,越有利于活性组分的分布,催化剂的活性越好。但催化剂在高温下反应,因积碳和大孔道孔壁不稳定而坍塌会造成催化剂比表面积降低,从而使得高温(300 ℃)下催化剂的活性下降得更快。由表3可知,使用后的催化剂(样品2和样品3)比表面积减小,其中样品2的比表面积减少得更多,这与实验结果一致。值得注意的是,反应后催化剂平均孔径变大,这可能是因为反应产生的积碳堵塞微孔,使得大孔的比例增加,同时积碳会形成一些大的机械孔,使得催化剂孔径增加。
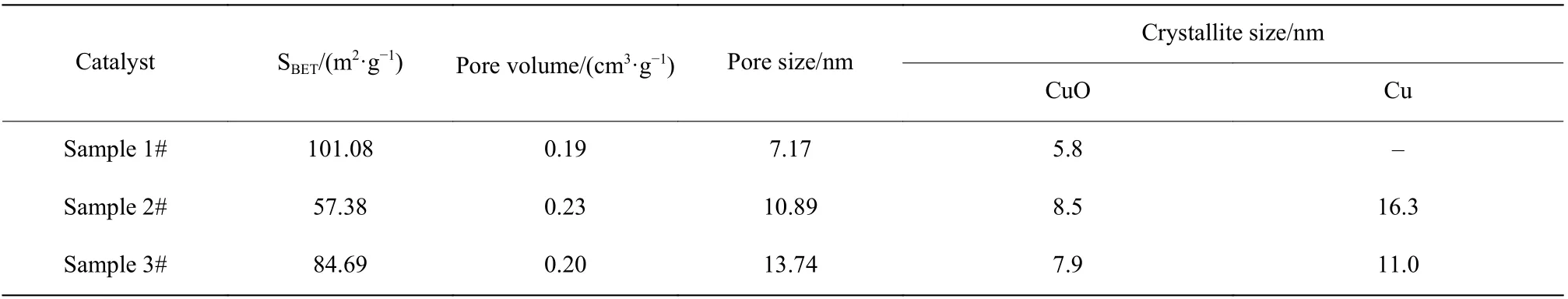
表3 催化剂的结构参数Table 3 Structure parameters of catalysts
如图8所示,3种催化剂的等温吸附-脱附曲线都属于Ⅳ型等温线,发生介孔毛细凝聚现象,都有H1滞后环。其中样品1的滞后环明显更大,说明样品1比样品2和样品3的介孔数量更多。当相对压力(p/p0)为0.60~0.90时,样品1的吸附量激增;当p/p0为0.70~0.90时,样品2的吸附量激增;当p/p0为0.75~0.90时,样品3的吸附量激增。p/p0的位置反映催化剂孔径的大小,上述结果说明催化剂样品2和样品3的孔径变大。但如前所述,相比样品1,样品2和样品3的介孔数量减少,说明这两种催化剂的大孔比例增加,由于一部分大孔是机械孔,不能提升催化剂的活性,因此介孔减少会影响催化剂的活性。
图9所示是催化剂的孔径分布曲线,可见样品1的孔径主要分布在5~12 nm,样品2的孔径主要分布在6~22 nm,样品3的孔径主要分布在5~20 nm。很明显,样品1的孔径分布更加集中,这说明新鲜催化剂的介孔比例较高,使用后催化剂的介孔比例减少。同时,样品2和样品3的孔径变大,说明催化剂活性降低,这与图8中的分析结果一致。
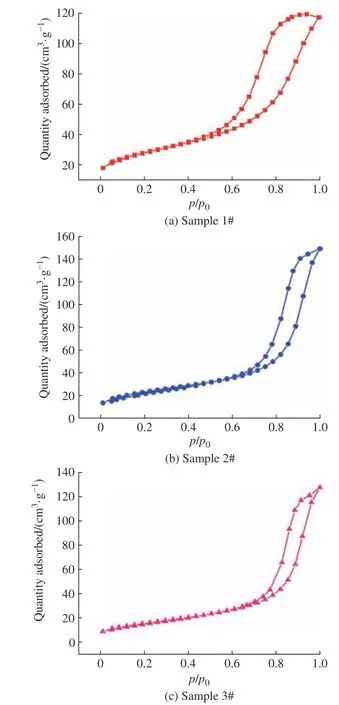
图8 催化剂的等温吸附-脱附曲线Fig. 8 Adsorption-desorption isotherms of catalysts

图9 催化剂的孔径分布曲线Fig. 9 Pore size distribution curve of catalysts
运用XRF方法表征了催化剂中主要元素的质量分数,结果如表4所示。由表4可知,催化剂中主要金属元素Cu、Zn、Al的质量分数在催化剂使用之后都出现了下降。本实验中,样品2在空气中暴露的时间比较长,因而Cu大部分被氧化为CuO;样品3在空气中暴露的时间较短,因而Cu主要以单质Cu的形式存在。Twigg等[13]认为催化剂中Cu的损失是催化剂失活的一个原因。因此推断,活性组分CuO的流失是催化剂失活的一个原因。
图10所示为不同催化剂样品的XRD谱图,可见新鲜催化剂(样品1)中CuO的衍射峰较多、峰较窄、峰面积较大,说明该催化剂中CuO含量高、结晶好。样品2催化剂中36°和38°处CuO的衍射峰面积变小,说明CuO含量下降,这与表4的分析结果一致。
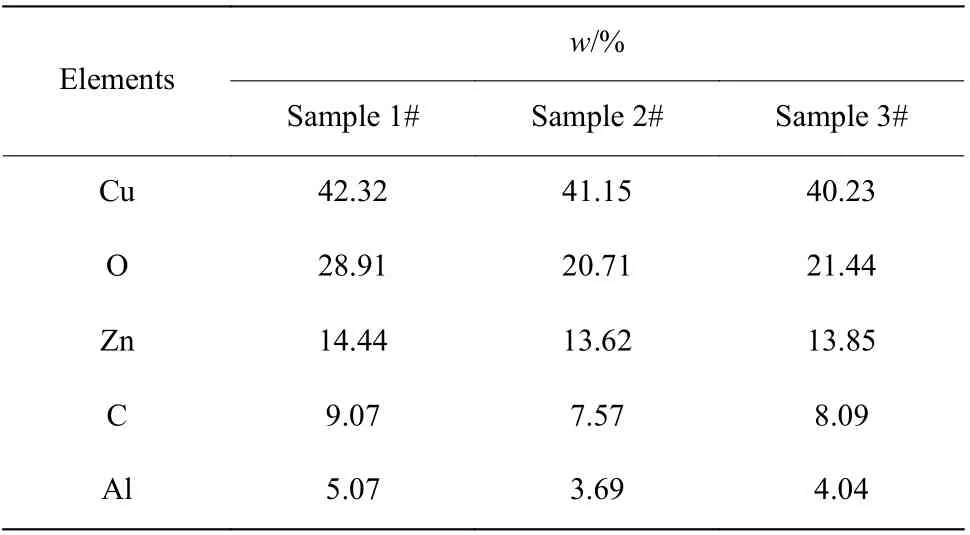
表4 催化剂中主要元素质量分数Table 4 Mass fraction of main elements in catalysts

图10 催化剂的XRD图Fig. 10 XRD diagram of catalysts
应用Scherrer公式(式(14)所示)计算晶粒尺寸,并对样品催化剂中CuO和Cu的晶粒尺寸进行计算,结果如表3所示。

式中,d为晶粒尺寸,Ks为Scherrer常数,λ为X射线波长,B为样品衍射峰半宽高,θ为衍射角。
样品2和样品3的CuO晶粒尺寸相较新鲜催化剂有所增加,样品2中Cu的晶粒尺寸比样品3中Cu晶粒尺寸大。Twigg等[13]的研究表明Cu颗粒增大也是催化剂失活的一个原因。催化剂使用后,CuO晶粒尺寸增大,不利于CuO的均匀分散。图7中样品2比样品3的催化活性更差,这与XRD分析结果一致。
CO-TPD可以测试催化剂表面金属活性中心的数量,也可以测定催化剂对CO的吸附能力。图11所示为催化剂的CO-TPD图。由图11可知,催化剂使用后对CO的吸附能力大大降低,说明催化剂表面上金属活性中心的数量减少了。MSR反应在高温(300 ℃)下会产生大量CO,但是样品2和样品3的CO吸附能力相差不大。CO的脱附温度在300 ℃左右,该温度下的MSR反应虽然生成了大量CO,但是只会有很少一部分吸附在催化剂上。因此,高温下反应生成的高含量CO对催化剂的失活没有产生明显影响。
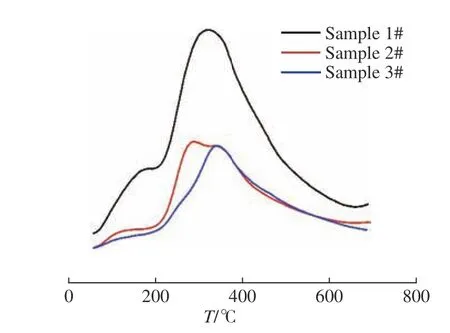
图11 催化剂的CO-TPD图Fig. 11 CO-TPD diagram of catalysts
3 结 论
(1) MSR反应的适宜温度在240 ℃左右,高温会使得CO选择性较高,低温会使得CH3OH转化率不高;甲醇水溶液进料中水与甲醇物质的量之比增大,CH3OH转化率变大,CO选择性变小,但是水与甲醇物质的量之比太大,会消耗更多的能量;在保证CH3OH转化率的前提下,适当提高进料的液时空速,能够提高反应效率。
(2) 以Langmuir-Hinshelwood理论为基础,采用SR-RWGS型双速率反应动力学模型对甲醇水蒸气重整反应动力学进行参数估值,动力学模型中反应器出口处CO2和CO的相对误差绝对值分别为1.36%和0.93%,拟合效果良好。
(3) 催化剂的主要失活原因除热烧结外,催化剂比表面积减小、介孔比例减少、活性组分CuO或Cu的流失、CuO或Cu晶粒变大也是催化剂失活的具体原因,高温反应中产生的高含量CO对催化剂的失活没有明显影响。
