RD区EspJ蛋白在结核分枝杆菌感染巨噬细胞中的作用
2022-07-05刘丽莎钟燕霄章晓联罗凤玲
刘丽莎 钟燕霄 田 晴 刘 敏 潘 勤 章晓联 罗凤玲
(武汉大学 基础医学院 免疫学系, 湖北 武汉 430071)
结核病是一种由结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)感染引起的慢性传染病,是单一传染源的头号死亡原因[1]。世界卫生组织数据显示,2021年全球结核潜伏感染人群接近20亿,新发病例987万[1]。近年来耐药结核病以及人类免疫缺陷病毒(human immunodeficiency virus, HIV)和M.tb共感染患者的增多,给我国结核病防治工作带来了更大的挑战[2]。同时,卡介苗(bacillus Calmette-Guérin, BCG)作为当前广泛使用的抗结核疫苗,保护效力存在不足[3]。因此,进一步探索M.tb逃逸免疫杀伤的机制对于结核病的研究、诊断和治疗具有重要意义。
1998年,英国Sanger中心和法国Pasteur研究所联合报告了M.tbH37Rv全基因组序列图[4]。通过全基因组比对发现,与M.tbH37Rv或牛分枝杆菌相比,BCG基因组有一部分缺失片段,被称为M.tb的差异区域(region of difference, RD),通称为RD区。RD区共有16个区域,可编码129种蛋白质,与M.tb的毒力密切相关[5]。目前对RD-1区的研究较多,RD-1区蛋白参与了M.tb感染后宿主细胞膜的破坏、免疫逃逸等诸多过程[6]。因此,研究RD区蛋白在结核病免疫中的作用具有重要意义。
研究表明,在M.tb感染的过程中,Ⅰ型干扰素(interferon,IFN)可以调节细胞因子的表达,进而破坏机体对M.tb的免疫反应,有利于M.tb在细胞内的存活[7]。M.tb的强毒力会使白细胞介素-12(interleukin-12,IL-12)依赖型Th1细胞免疫反应降低,从而诱导更高水平的Ⅰ型IFN[8-9]。M.tb的毒力主要是由毒力因子ESAT-6分泌系统1(ESAT-6 secretion system 1, ESX-1)相关蛋白决定[10]。ESX-1基因簇位于RD-1区,参与M.tb宿主逃逸,对M.tb至关重要。EspJ是由Rv3878编码的蛋白,属于ESX-1分泌相关蛋白,目前EspJ在M.tb感染过程中的具体功能尚不清楚。
本研究拟通过Rv3878基因原核表达载体,构建表达EspJ的重组耻垢分枝杆菌(MycolicibacteriumSmegmatis,M.s)及重组BCG,探究Rv3878基因编码的EspJ蛋白在结核分枝杆菌感染巨噬细胞中的作用,以期进一步阐明EspJ的生物学功能,为结核病诊治及新型疫苗研发提供理论依据。
1 材料及方法
1.1 菌株和质粒
M.tb标准菌株H37Rv [strain ATCC(美国模式培养物集存库) 25618]和M.s菌株[strain ATCC 70084]由武汉大学ABSL-Ⅲ实验室提供,并由本实验室冻存。BCG、大肠杆菌(Escherichiacoli,E.coli)DH5α(strain ATCC 25922)、E.coliBL-21(strain ATCC BAA-1025)由本实验室培养保存。pMV261、pMV361及pGEX-KG质粒由本实验室保存。
1.2 细胞和动物
RAW264.7小鼠巨噬细胞系购自中国典型培养物保藏中心,由本实验室培养保存。BALB/c小鼠,6~8周龄,雌性,购自湖北省疾控中心。本研究已通过我校伦理委员会批准(伦理批号:18021B)。
1.3 主要试剂
1.3.1 细菌培养
Middlebrook 7H9、Middlebrook 7H11及Middlebrook OADC购自BD公司;基因组提取试剂盒与溶菌酶购自TIANGEN公司;Proteinase K购自Roche公司。
1.3.2 PCR、RT-qPCR及酶切鉴定
质粒提取和琼脂糖凝胶回收试剂盒均购自Omega公司;Phanta Max Super-Fidelity DNA Polymerase购自Vazyme公司;EcoRⅠ、Hind Ⅲ购自Promega公司;DNA Ligation High Kit购自TOYOBO公司。PCR和RT-qPCR引物、DNA marker均在武汉擎科生物技术有限公司订购。
1.3.3 蛋白提取及多克隆抗体制备
异丙基硫代半乳糖苷(isopropyl beta-D-thiogalactopyranoside,IPTG)购自Sigma-Aldrich公司;GST-Sephagarose 4B购自GE公司。弗氏佐剂购自Sigma-Aldrich公司;ELISA包被液、TMB显色液购自Biolegend公司。
1.3.4 蛋白刺激细胞
培养基DMEM购自Gibco公司,胎牛血清购自Natocor公司;polymyxin B购自Sigma-Aldrich公司;小鼠巨噬细胞集落刺激因子购自PeproTech公司;逆转录试剂盒、SYBR Green均购自TOYOBO公司;TritonX100购自Amresco公司;Mouse IFN-β ΕLISA Kit购自武汉华联科公司。
1.3.5 Western Blot
十二烷基磺酸钠(sodium dodecyl sulfate, SDS)、过硫酸铵、吐温-20及无水甲醇购自中国国药集团化学试剂有限公司;聚丙烯酰胺购自Biosharp公司;TEMED购自谷歌生物公司;Tris Base、甘氨酸购自Amresco公司;Marker购自Bio-Rad公司;羊抗鼠IgG-HRP购自ABclonal公司;β-actin单抗购自Affinity Bioscience公司;ECL显色底物购自雅酶公司。
1.4 方法
1.4.1 PCR

1.4.2 原核表达质粒构建
Rv3878 PCR产物和原核表达载体pGEX-KG分别经EcoR Ⅰ和Hind Ⅲ酶切后,用DNA连接酶连接得到pGEX-KG-Rv3878,转化进E.coliDH5α感受态细胞,挑取单克隆菌落培养。提取质粒进行酶切鉴定,并送武汉擎科生物科技有限公司进行DNA基因测序。
1.4.3 重组蛋白的诱导提取及纯化
将pGEX-KG-Rv3878转化进E.coliBL21感受态细胞,挑取单克隆菌落接种于液体培养基(含氨苄霉素),37℃、200 r/min培养至菌液吸光度值达0.6~0.8,加入IPTG,25℃、150 r/min培养16 h,诱导蛋白表达。碎菌后经高速离心,留取上清和沉淀,并将转化pGEX-KG的E.coliBL21和未经IPTG诱导的重组菌作为对照。上清中加GST-Sephagarose beads于4℃混匀仪孵育2 h。收集柱子后用PBS洗3遍,用Tris-HCL-还原型谷胱甘肽-Elution buffer于混匀仪4℃,30 min洗脱,得到GST-EspJ并进行鉴定。
1.4.4 小鼠多克隆抗体的制备
取4只6~8周龄雌性BalB/c小鼠,剪尾取100~200 μL血清作为免疫前血清对照。针对每只小鼠,取同体积的100~200 μg蛋白与弗氏完全佐剂混合乳化,通过腹腔注射免疫小鼠。每隔7~10天,取同体积的50~100 μg蛋白与不完全佐剂混合超声乳化后腹腔注射免疫,共免疫4~5次。眼球取血后可获得多克隆抗体血清,置于-20℃保存。
1.4.5 ELISA
每孔加100 μL混合的1~2 μg EspJ与ELISA包被液,4℃过夜。PBST洗3次,拍干后每孔加250 μL 2% BSA 置于37℃孵育1 h。PBST洗3次,每孔加200 μL倍比稀释的多抗血清(1∶200~1∶409 600)作为一抗,保留一孔作为空白对照,置于37℃孵育1 h。PBST洗5次,每孔加200 μL IgG-HRP,置于37℃孵育1 h。PBST洗5次,每孔加显色液A、B液各50 μL,避光置于37℃孵育10~15 min,每孔加50 μL硫酸终止。测450 nm波长处的吸光度(optical density,OD450),计算效价。
1.4.6 重组蛋白GST-EspJ刺激小鼠巨噬细胞
将RAW264.7细胞和小鼠骨髓来源的巨噬细胞(bone marrow-derived macrophage,BMDM)接种于六孔板,待细胞密度长至70%~80%,加入5 μg/mL和10 μg/mL已去除内毒素的GST和GST-EspJ,分别刺激1 h、3 h、6 h、12 h。收取细胞,RT-qPCR检测INF-β mRNA表达水平,ELISA和Western blot检测IFN-β的含量及变化。
1.4.7 Western blot
将蛋白样品进行SDS-PAGE电泳,并将蛋白转移到聚偏二氟乙烯膜上。将膜放入5%脱脂奶粉封闭液中室温封闭1 h,用TBS-吐温20 [0.5%] (TBST)洗涤,加入一抗抗体溶液,4℃孵育过夜。TBST洗3次,加入羊抗鼠或兔IgG-HRP,室温孵育1 h。TBST洗3次,滴加显色液后在ECL化学发光仪中显色。
1.4.8 RT-qPCR
提取细胞总RNA,逆转录后得到互补DNA (complementary DNA, cDNA),于-20℃储存。RT-qPCR引物序列:鼠IFN-β引物序列为5’-ATGAGTGGTGGTTG-CAGGC-3’(F)和5’-TGACCTTTCAAATGCAGTAGATT-3’(R);鼠GAPDH引物序列为5’-CATCACTGCCACCCAGAAGACT G-3’(F)和5’-ATGCCAGTGAG-CTTCCCGTTCAG-3’(R);鼠IL-10引物序列为5’-AGTGGAGCAGGTGAAG-AGTG-3’(F)和5’-TTCGGAGA GAGGTACAAACG-3’(R);鼠IL-1β引物序列为5’-CCCAACTGGTACATCAGCAC-3’(F)和5’-TCTGCTCATTCACGAAA-AGG-3’(R)。RT-qPCR反应体系(20 μL):2×SYBR GREEN 10 μL,引物(F+R)1 μL,ddH2O 8 μL,cDNA 1 μL。RT-qPCR程序:Holding stage:95℃ 1 min,cycle stage: 95℃ 15 s,退火58℃ 20 s,延伸72℃ 20 s并收集荧光信号,共40个循环。
1.4.9 重组耻垢分枝杆菌(rM.s::Rv3878)和重组BCG(rBCG::Rv3878)的构建
将Rv3878构建至pMV261和pMV361穿梭载体。在M.s感受态细胞中分别电转化1~5 μg pMV261-Rv3878和pMV261,在BCG感受态细胞中分别电转化2~5 μg pMV361-Rv3878和pMV361。用卡那霉素抗性的固体培养基分别筛选3天和4周,选择单菌落作为rM.s::Rv3878和rBCG::Rv3878,并进行PCR及Western Blot鉴定。
1.4.10 重组菌株刺激小鼠巨噬细胞
将RAW264.7和BMDM细胞接种于六孔板,待细胞密度长至70%~80%,加入对数生长期的M.s、rM.s::Rv3878、BCG、rBCG::Rv3878(MOI=10∶1)感染细胞1 h后洗去,加入培养基分别培养至3 h、6 h、12 h后收取细胞,RT-qPCR检测IFN-β、IL-1β、IL-10 mRNA表达水平。
1.5 统计学方法
各实验均独立重复3次,通过SPSS 26.0进行统计学分析,数据采用means ± SEM表示,采用t检验进行组间比较分析,P<0.05认为差异有统计学意义。
2 结果
2.1 Rv3878的原核表达质粒构建及鉴定
提取M.tbH37Rv全基因组,通过PCR扩增得到Rv3878基因(图1A)。将Rv3878构建至原核表达载体pGEX-KG,经转化及培养后提取质粒进行酶切鉴定(图1B)及DNA基因测序。酶切结果表明,单克隆1、3号构建成功。DNA基因测序结果显示其与Rv3878基因序列相符。原核表达质粒pGEX-KG-Rv3878构建成功。

注: A:Rv3878的PCR扩增;B:pGEX-KG-Rv3878的EcoR Ⅰ和Hind Ⅲ双酶切鉴定。M:DL2000 DNA marker图1 Rv3878的原核表达质粒构建及鉴定
2.2 重组蛋白GST-EspJ的表达及纯化
将pGEX-KG-Rv3878转化到E.coliBL21感受态细胞,挑取单克隆菌落培养,加IPTG诱导蛋白的表达。经预实验发现,诱导效果在25℃时最佳。诱导蛋白表达12 h后,提取纯化重组蛋白,进行SDS-PAGE分析鉴定(图2)。结果显示在54 kD处有明显条带,表明成功获得GST-EspJ,可用于后续实验。

图2 GST-EspJ的表达及纯化
2.3 抗EspJ蛋白鼠多克隆抗体的制备及效价检测
用GST-EspJ免疫雌性BALB/c小鼠后收取血清,ELISA测定多克隆抗体效价。结果显示,经GST-EspJ免疫的小鼠能产生针对EspJ的特异性抗体。经预实验确定了稀释浓度,取血清倍比稀释后检测血清OD450。结果显示,随着稀释倍数的增加,其OD450随之下降。免疫后血清OD450/免疫前血清OD450≥2.1时的稀释浓度即为效价,经计算效价为1∶204 800(图3)。

图3 抗EspJ蛋白鼠多克隆抗体的效价检测
2.4 抗EspJ蛋白鼠血清多克隆抗体特异性验证
以GST-EspJ为抗原,多克隆抗体血清为一抗,羊抗鼠IgG-HRP为二抗,Western Blot检测多克隆抗体的特异性。结果显示,在54 kD处有特异性条带,表明该抗体可特异性识别EspJ(图4)。
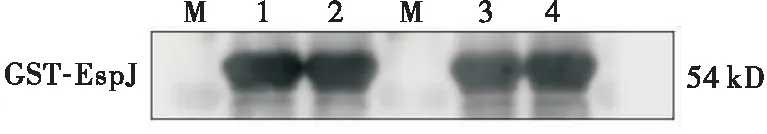
注:M:marker;1~4:分别为1~4号GST-EspJ蛋白免疫小鼠多克隆抗体图4 Western blot验证抗EspJ蛋白鼠多克隆抗体的特异性
2.5 GST-EspJ蛋白对小鼠巨噬细胞Ⅰ型干扰素的影响
用不同剂量的GST-EspJ刺激RAW264.7细胞,以及相同剂量GST-EspJ刺激巨噬细胞不同时长,RT-qPCR检测IFN-β mRNA表达水平。结果显示,GST-EspJ处理后小鼠巨噬细胞中INF-β mRNA表达水平明显升高,在6 h达到峰值,且随着蛋白刺激浓度的增加而升高(图5A和5B)。随后以10 μg/mL GST-EspJ刺激RAW264.7细胞,ELISA和Western blot检测细胞IFN-β的含量变化,发现INF-β表达水平显著升高,在12 h达到峰值(图5C和5D)。以上结果证明EspJ蛋白可以促进小鼠巨噬细胞中Ⅰ型IFN的产生。
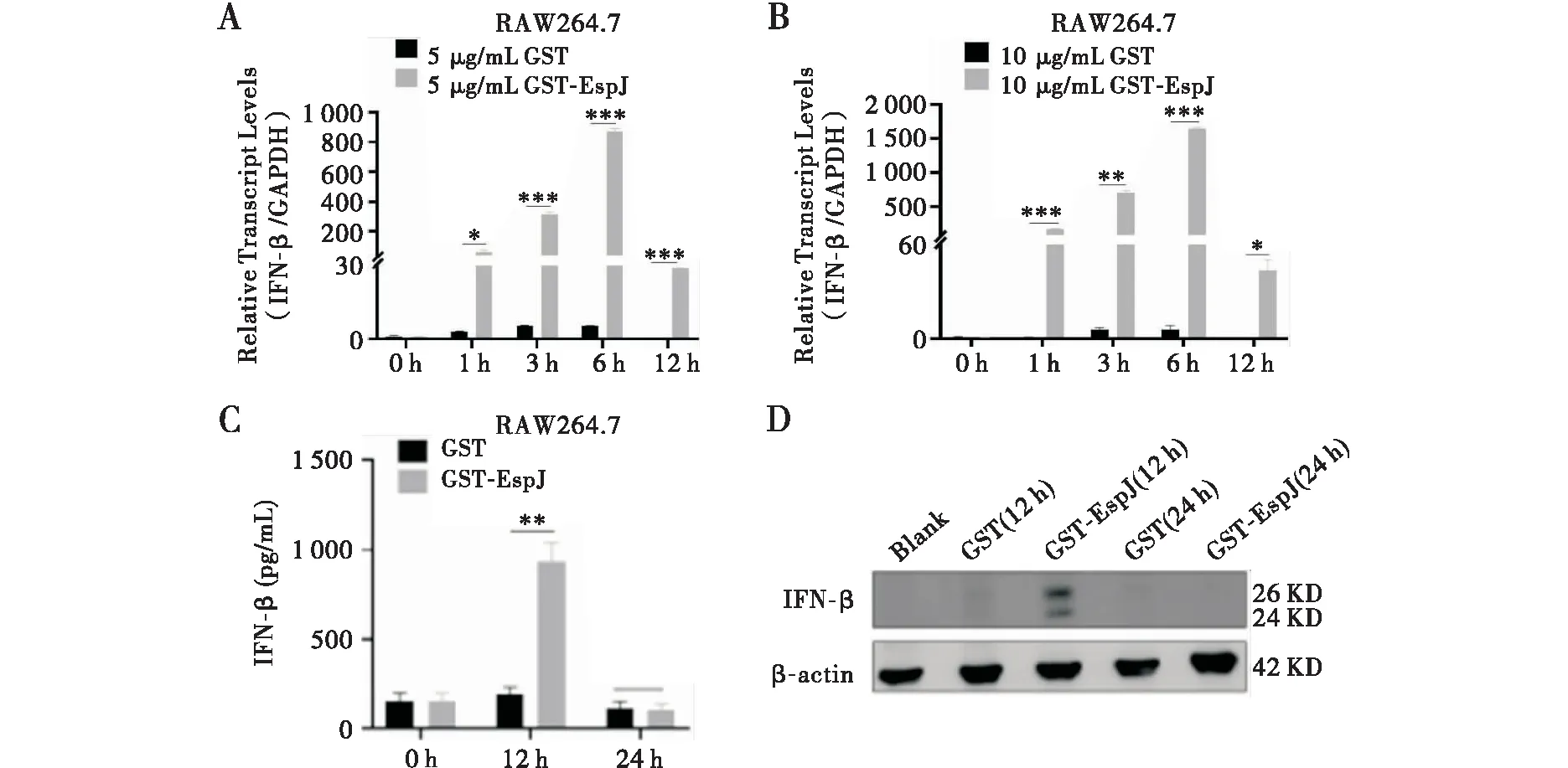
注:A和B分别为5 μg/mL和10 μg/mL GST及GST-EspJ刺激RAW264.7细胞,RT-qPCR检测IFN-β mRNA表达水平;C和D为10 μg/mL GST及GST-EspJ刺激RAW264.7细胞,ELISA和Western blot检测细胞裂解液中IFN-β的含量及表达水平;*P<0.05,**P<0.01,***P<0.001图5 GST-EspJ蛋白促进小鼠巨噬细胞产生Ⅰ型干扰素
2.6 成功构建表达Rv3878基因的rM.s::Rv3878和rBCG::Rv3878
将Rv3878基因构建至pMV261、pMV361穿梭载体,酶切鉴定结果显示重组质粒构建成功(图6A和6B)。将重组质粒分别电转化至M.s和BCG中,获得rM.s::Rv3878和rBCG::Rv3878,并进行PCR鉴定(图6C和6D)及Western Blot鉴定(图6E)。结果显示,菌液PCR产物与Rv3878基因长度相同,rBCG::Rv3878菌株包含Rv3878,并且可表达EspJ。以上结果表明rM.s::Rv3878、rBCG::Rv3878构建成功。

注:A:pMV261-Rv3878的酶切鉴定; B:pMV361-Rv3878的酶切鉴定; C:rM.s::Rv3878的PCR鉴定; D:rBCG::Rv3878的PCR鉴定; E:rBCG::Rv3878蛋白表达验证图6 表达M.tb Rv3878基因的rM.s::Rv3878和rBCG::Rv3878构建和鉴定
2.7 rM.s::Rv3878和rBCG::Rv3878感染巨噬细胞后可促进Ⅰ型干扰素的产生
取对数生长期的rMs::Rv3878和rBCG::Rv3878感染RAW264.7和BMDM细胞3 h、6 h和12 h(MOI=10∶1),同时以空载菌株作为阴性对照,RT-qPCR检测细胞IFN-β、IL-1β、IL-10等细胞因子mRNA表达水平。结果表明,rMs::Rv3878和rBCG::Rv3878可以促进巨噬细胞中IFN-β的产生(图7A和7B)。此外,rBCG::Rv3878感染BMDM细胞后还可促进IL-1β和IL-10的表达(图7C和7D)。
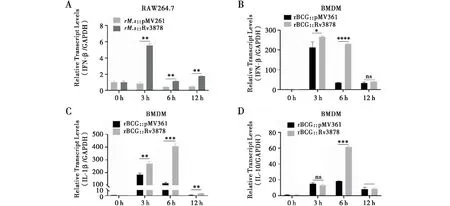
注:A:rM.s::Rv3878以MOI=10∶1感染RAW264.7细胞,RT-qPCR检测IFN-β mRNA表达水平;B~D:rBCG::Rv3878以MOI=10∶1感染BMDM细胞,RT-qPCR检测IFN-β、IL-1β、IL-10 mRNA表达水平;*P<0.05,**P<0.01,***P<0.001,****P<0.000 1图7 rM.s::Rv3878和rBCG::Rv3878感染巨噬细胞对Ⅰ型干扰素的影响
3 讨论
结核病是一种慢性传染病,可分为活动性结核病和潜伏性结核病,约5%~10%的潜伏感染个体发展为活动性结核病[1]。在中国,结核病仍然是严重的公共卫生威胁。结核病的早期诊断以及有效的疫苗研发对于结核病防控至关重要。因此,需要进一步研究M.tb感染及免疫逃逸的机制,寻找新的生物标志物和药物及疫苗新靶点。
RD区与M.tb的毒力密切相关,有多个免疫优势抗原,一直是M.tb感染机制研究及新疫苗研发热点。关于RD-1区的研究较多,RD-1区全长9.5 kb,包含9个阅读框,即Rv3871~Rv3879c。RD-1区是M.tb的主要毒力因子,参与了M.tb感染、免疫逃逸等致病过程[11]。如培养滤液蛋白10(culture filtrate protein-10,CFP-10)和ESAT-6是两种免疫优势RD-1区蛋白,可形成毒力决定簇激活免疫应答,参与结核病发病过程[12]。ESAT6分子量低且免疫原性高,在结核病诊断和亚单位疫苗开发方面有重要价值[13]。现已有研究尝试将部分RD-1区基因导入BCG构建重组菌株,可增强疫苗保护性[14]。PE35 (Rv3872)、PPE68 (Rv3873)蛋白可使巨噬细胞IL-10增加及IL-12降低,参与M.tb的免疫逃逸过程[15];二者相互作用时结构由无序向有序转变,使M.tb毒力增强[16]。高毒力M.tb感染巨噬细胞时会诱导高水平Ⅰ型IFN的产生。在M.tb感染中,高浓度的Ⅰ型IFN会通过促进免疫抑制分子的产生和降低巨噬细胞对IFN-γ激活的反应等,使细菌在细胞内存活,加重对宿主的损害[17]。Rv3878是RD-1区的基因,其编码的EspJ属于EXS-1相关蛋白,因此推测EspJ可诱导Ⅰ型IFN的产生。
我们构建了Rv3878原核表达载体,经诱导提纯得到GST-EspJ,用GST-EspJ刺激小鼠巨噬细胞后检测到细胞Ⅰ型IFN表达水平明显升高。之后构建了rMs::Rv3878和rBCG::Rv3878,感染小鼠巨噬细胞后同样发现Ⅰ型IFN表达增强。通过以上实验,我们发现EspJ可以促进巨噬细胞Ⅰ型IFN的产生,推测其参与了M.tb感染及免疫逃逸的过程。目前对EspJ在M.tb感染过程中担当的角色尚不清楚,接下来还需对EspJ促进巨噬细胞Ⅰ型IFN产生的具体机制做进一步的探究。
目前临床检测M.tb的免疫学方法主要有结核素皮肤试验(tuberculin skin test,TST)和IFN-γ释放试验(interferon gamma release assay,IGRA),我国应用最普遍的是IGRA中的T-SPOT。这些诊断方法的敏感性和特异性仍存在不足,无法有效识别可能发展为活动性结核病的高危患者,而且在评价抗结核治疗中的作用有限。因此,结核病诊断需要RD区蛋白抗原联合应用。已有研究证明,T细胞对Rv3878的反应可预测患者进展为活动性肺结核的可能性,也可作为结核病进展的预后标志物。T细胞对Rv3873和Rv3879c的反应也有疾病诊断和预后评估的作用[18]。ESAT-6、CFP-10与Rv3878等联合诊断显示出了比T-SPOT更高的灵敏度和特异度[19]。RD区蛋白抗原在作为临床诊断试剂或亚单位疫苗方面显示出巨大潜力。
综上所述,我们证实了由Rv3878编码的EspJ蛋白可以促进巨噬细胞Ⅰ型IFN的产生,有利于M.tb在细胞内的存活,但具体机制仍需进一步研究。Rv3878是M.tb的毒力相关基因之一,RD区蛋白抗原联合应用是结核病新型诊断方法和疫苗研发的热点。本研究结果有助于进一步深入探讨Rv3878的功能,为结核病的诊断和预防提供新的方向和靶点。
