甜菜SBPase基因的遗传转化
2022-07-04韩平安孙瑞芬唐宽刚常悦王良金晓蕾梁亚晖李晓东吴新荣
韩平安,孙瑞芬,唐宽刚,常悦,王良,金晓蕾,梁亚晖,李晓东,吴新荣
(1.内蒙古自治区农牧业科学院,呼和浩特 010031;2.内蒙古自治区甜菜品种遗传改良与种质创制重点实验室,呼和浩特 010031)
0 引言
食糖是人们日常生活的重要消费品。2019/2020 年榨季全国食糖仅从产量和消费量来看,产需差额400余万t,2020/2021 年榨季预计国际市场供给短缺350万t~380 万t,国内糖市“产稳需增”[1]。我国食糖消费呈增长态势,年均增速约3%,食糖供给每年缺口近500 万t[2]。甜菜糖是食糖重要组成部分,甜菜(Beta vulgarisL.)是我国重要糖料作物之一,是确保我国食糖安全的重要战略物资[3],也是潜在的能源作物[4]。甜菜具有喜温凉、耐瘠薄、耐盐碱、适应性广的特点,是东北、西北、华北地区重要特色经济作物[5]。近年来,随着国家政策的支持及国家糖料产业技术体系的启动,我国甜菜产业取得了长足进展,但与发达国家相比,仍存在甜菜种质资源匮乏,原创性种质不足,自育品种少等问题[6-7]。因此,利用基因工程技术手段创制高产甜菜种质资源,对推进我国甜菜产业健康发展、确保食糖有效供给具有重要意义。
光合作用是植物生长发育的基础。景天庚酮糖-1,7-二磷酸酶(SBPase)是卡尔文循环过程中的关键酶,主要负责CO2分子受体核酮糖-1,5-二磷酸(RuBP)的再生,是植物光合作用途径的主要限速酶之一[8],因此,SBPase 对卡尔文循环的碳源流通具有十分重要的意义。众多研究表明,SBPase 能够提高植物的光合性能,促进光合效率的提高,是一种可以利用基因工程技术提高植物碳同化效率的酶类[9]。在烟草中过表达拟南芥SBPase基因,可以促进烟草植株生长,提高光合能力[10]。增强小麦SBPase 活性可以提高小麦的光合作用与籽粒产量[11]。转基因番茄中,高水平的SBPase活性可增强番茄植株的光合作用,提高其耐冷性[12]。敲除番茄SlSBPASE基因后,突变体植株表现出严重的生长迟缓,SBPase 活性显著降低,从而显著抑制了RuBP的再生和碳同化速率,导致突变体植株的蔗糖和淀粉积累量较野生型植株低很多[13]。在水稻上鉴定到一个低分蘖突变体c6635,该突变体在生长初期叶片呈淡绿色,色素含量和光合能力急剧下降;成熟期有效穗数、粒数和结实率显著降低,籽粒产量急剧减少。通过图谱克隆、MutMap 分析和互补实验证实,SBPase基因的一个单核苷酸突变是c6635突变表型的主要原因[14]。目前,有关甜菜光合碳固定方面的研究主要集中在栽培措施对甜菜产量的影响[15-19],而关于SBPase基因对其光合碳固定及产量的影响未见报道。本研究采用农杆菌介导法,将拟南芥SBPase基因转入甜菜中获得了分子检测合格的转基因植株,通过数字PCR 检测筛选到了低拷贝转基因株系,为探索甜菜块根产量形成机理,创制具有高产潜力的甜菜种质材料奠定了基础,同时也为加强SBPase基因在作物高产育种上的利用提供理论依据。
1 材料与方法
1.1 试验材料
甜菜(Beta vulgarisL.)品系‘44176’无菌苗、植物表达载体pBWA(V)K、EHA105 农杆菌菌株由甜菜分子育种课题组保存。通过Primer 5.0 设计SBPase基因的特异引物,内参基因GS检测引物参照刘二龙等[20]。引物由南京金斯瑞公司合成,序列如表1。

表1 引物信息Table 1 Primer information
1.2 目的基因扩增
人工合成拟南芥启动子AtRBCS(X14564)和拟南芥SBPase(NM_115438)碱基序列,并根据该序列分别设计特异引物F1/R1和F2/R2,同时引入AarI酶切位点(见表1)。通过PCR 扩增AtRBC和SBPase片段,以构建AtRBCS 驱动SBPase基因的植物表达载体。两对引物的PCR 扩增体系(50 µL):PCR Buffer 5µL,dNTPs Mixture 2 µL,上、下游引物各2 µL,Taq 2 µL,模板(人工合成序列DNA)1 µL,ddH2O 34 µL;PCR 扩增程序:94 ℃5 min;94 ℃30 s,50 ℃45 s,72 ℃90 s,30个循环;72 ℃10 min,16 ℃30 min。
1.3 连接转化与鉴定
将引物F1/R1 扩增的AtRBCS(1 508 bp)和引物F2/R2 扩增的SBPase(1 182 bp)的电泳片段切下,放在同一个体系中进行溶胶回收DNA(AtRBCS-SBPase),用30µL ddH2O溶解回收AtRBCS-SBPase。用AarI分别酶切AtRBCS-SBPase 和载体pBWA(V)K,酶切反应体系(20µL):Buffer 2µL,AarI 1µL,AtRBCS-SBPase 4µL,ddH2O 13µL;Buffer 2µL,AarI 1µL,pBWA(V)K 4µL,ddH2O 13µL。37 ℃1 h。酶切产物纯化回收后,用T4-ligase 将其连接,反应体系(10 µL):Buffer 1µL,载体酶切产物1µL,AtRBCS-SBPase 酶切产物5µL,T4-ligase 1µL,ddH2O 2µL,20 ℃2 h。用连接产物转化大肠杆菌。待菌落出现后,用引物F3/R3 进行PCR 检测AtRBCS-SBPase 转化阳性克隆并测序,与人工合成序列进行比对。提取测序正确的阳性克隆质粒并采用冻融法导入农杆菌EHA105中,挑选大小一致菌落提取质粒DNA,用EcoRV进行酶切鉴定。
1.4 菌液的制备
挑取酶切鉴定正确的农杆菌单菌落于加有Kan(100 mg/L)的YEB 液体培养基中,28 ℃黑暗条件下,200 r/min 振荡培养16~20 h后,将菌液置于离心管中,5 000 r/min离心5 min 收集菌体,重新悬浮菌液,OD600值为0.4~0.5,备用。
1.5 侵染和共培养
将在分化培养基(MS+6-BA 1 mg/L+水解酪蛋白200 mg/L+琼脂7 g/L,pH 值为5.8,pH 值下同)上预培养7 d左右的甜菜叶柄放于农杆菌菌液中,置于摇床上,28 ℃侵染20 min后,用滤纸吸去多余菌液,将叶柄接种在共培养基(MS+6-BA 1 mg/L+水解酪蛋白200 mg/L+AS 300µmol/L+琼脂7 g/L)上,25 ℃暗培养3 d。
1.6 抗性筛选与植株再生
叶柄与农杆菌共培养3 d后,转移到含有Kan(50 mg/L)的筛选培养基(MS+6-BA 1 mg/L+水解酪蛋白200 mg/L+头孢250 mg/L+Kan 50 mg/L+琼脂7 g/L)中培养,每隔7 d转接1次。当丛生芽长至0.5~1 cm时,将其从外植体上切下转入生根培养基(MS+NAA 1 mg/L+琼脂7 g/L)中诱导生根。
1.7 转基因植株PCR检测
切取卡那抗性植株幼叶,利用高通量核酸提取仪(KingFisher Flex,Thermo Fisher)提取基因组DNA,具体步骤按磁珠法植物DNA 提取试剂盒说明书进行。以DNA 为模板,用特异引物F4/R4进行SBPase基因扩增,以检测SBPase基因的整合情况。PCR反应体系和PCR反应程序同1.2。
1.8 转基因植株RT-PCR检测
取阳性无菌苗叶片提取总RNA,利用微量紫外分光光度计(NanoDrop 2000)测定其浓度,并将其稀释为200 ng/µL,用RNA 反转录试剂盒将其反转录成cDNA。RNA 的提取和cDNA 的合成按照TakaRa公司RNA 试剂盒和M-MLV 反转录试剂盒使用说明书进行。以cDNA 为模板,甜菜GS基因为内参基因(引物为F6/R6),用引物F5/R5(表1)进行PCR扩增以检测SBPase基因在甜菜植株中的表达情况。
1.9 转基因植株启动子拷贝数检测
利用数字PCR(ddPCR)技术检测转基因植株中SBPase基因的拷贝数。首先对SBPase和内参基因GS(AY026353.1,甜菜单拷贝基因)扩增引物的特异性进行检测,之后用特异引物F5/R5(表1)对RT-PCR 检测阳性植株进行SBPase基因插入拷贝数检测。ddPCR 扩增体系(25µL):2xPerfeCTa Qpcr ToughMixUNG 5µL,Alexa FluorTM647 1 µL,EvaGreen20xin water 2 µL,上、下游引物各0.4 µL,模板2 µL,ddH2O 14.2 µL。将25µL 反应液加入芯片,于数字PCR 仪(Naica,Stilla Techn Logieso,France)上进行扩增反应,扩增程序为94 ℃5 min;95 ℃30 s,60 ℃30 s,72 ℃30 s,40 个循环;72 ℃5 min,每个样品进行3 次平行重复试验。扩增反应完毕后,将芯片放入微滴读取仪,依据荧光信号的有无对阳性微滴和阴性微滴进行判定读值。利用软件Crystal Reader对数据进行分析,得到核酸绝对定量结果。外源基因拷贝数为外源基因浓度/内参基因浓度。
2 结果与分析
2.1 目的片段获得
用特异引物F1/R1 和F2/R2 进行启动子AtRBCS 和SBPase基因的PCR 扩增,分别获得约1 500 bp 和1 200 bp条带,与预期大小一致(图1)。

图1 目的基因扩增Fig.1 Amplification of target gene
2.2 重组载体获得
目的片段(AtRBCS-SBPase)与载体连接后转化大肠杆菌,随机挑取3个单菌落进行PCR 检测,获得预期大小(1 036 bp)条带(图2)。将阳性克隆测序后与人工合成序列比对,证实获得序列完全正确。将测序正确质粒导入农杆菌中,提取质粒进行序列测定,证明目的片段已插入到表达载体中,将重组载体命名为pBWA(V)K-AtRBCS-SBPase-NOS(10 629 bp,见图3)。

图2 菌落PCR检测电泳图Fig.2 Colony electrophoretogram of PCR detection
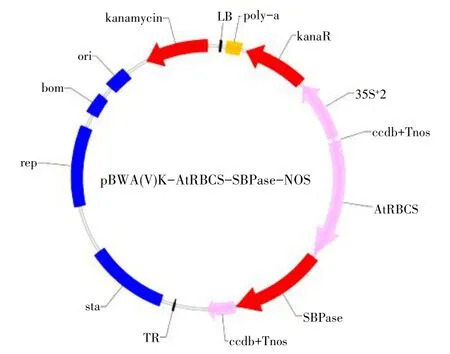
图3 重组载体结构简图Fig.3 Structure diagram of recombinant carrier
2.3 抗性植株获得
采用农杆菌介导法转化甜菜叶柄,共培养3 d 后,将叶柄移入筛选培养基(含Kan 50 mg/L)中诱导芽分化,当丛生芽长至0.5~1 cm 时,将其从叶柄上切下进行生根培养,获得抗性植株,待根系长至2~3 cm 时移栽至花盆中(图4)。

图4 甜菜的遗传转化Fig.4 Genetic transformation of sugar beet
2.4 转基因植株PCR 检测
随机取8株抗性植株进行SBPase基因的扩增,扩增产物经1%琼脂糖凝胶电泳检测,获得预期大小(908 bp)条带(图5),初步判断目的基因已整合到甜菜染色体基因组中。
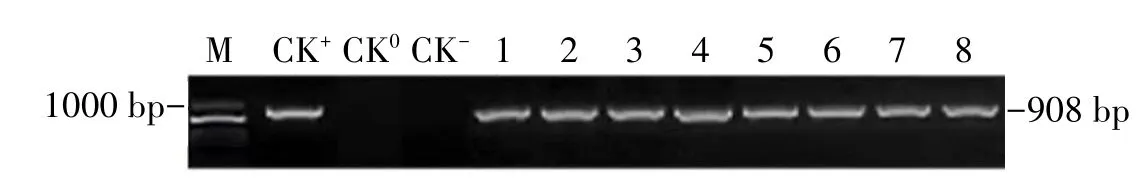
图5 转基因植株的PCR检测Fig.5 PCR detection of transgenic plants
2.5 转基因植株RT-PCR检测
以GS基因为内参基因,对PCR 检测阳性植株进行SBPase基因的RT-PCR 检测。结果显示,8 个阳性植株均获得预期大小条带(图6),表明该基因在RNA水平上获得表达。扩繁RT-PCR 检测阳性植株。
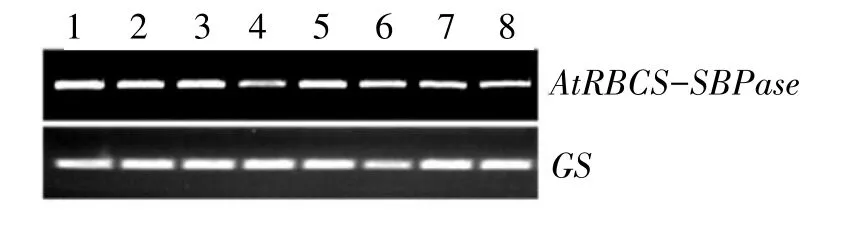
图6 转基因植株RT-PCR检测Fig.6 RT-PCR detection of transgenic plants
2.6 SBPase基因拷贝数检测
为了利于转基因植株纯合,通过ddPCR 技术对PCR 检测阳性植株进行SBPase基因插入拷贝数鉴定,以筛选低拷贝转基因植株。首先以甜菜GS基因为内参基因,检测SBPase扩增引物的特异性和ddPCR重复性。图7显示,GS和SBPase对应引物的阳性微滴(蓝色带)与阴性微滴(黑色带)都能明显区分开,表明SBPase引物的特异性较好。ddPCR 重复性分析结果显示,所有样品SBPase和GS基因的实验有效微滴总数均介于25 000~28 000(表2),满足微滴数字PCR 微滴的分析要求,实验中生成微滴的相对标准偏差(Relative standard deviation,RSD)介于2%~6%(表2),小于25%,符合欧盟核酸定量检测的要求,说明实验中建立的微滴数字PCR 体系微滴生成稳定,重复性良好,数据可靠性高。ddPCR 结果显示,8株转基因植株中有2株为低拷贝转基因植株(样品编号为2和3),拷贝数分别为1.3和1.6(表3)。

表2 ddPCR 重复性分析Table 2 Repeatability analysis of ddPCR

表3 转基因植株SBPase 拷贝数分析Table 3 SBPase copy number analysis of transgenic plant

图7 ddPCR引物特异性检测Fig.7 Primer specificity detection of ddPCR
3 讨论与结论
研究发现,景天庚酮糖-1,7-二磷酸酯酶(SBPase)是卡尔文循环中参与光合碳固定的关键酶[12],通过遗传转化手段在植物中过表达SBPase基因,调节光合作用、提高生物量,已在多种植物上得到了成功应用。在衣藻(Chlamydomonas reinhardtii)中超表达SBPase,显著增强过表达植株的光合速率[21]。在小麦中高表达二穗短柄草(Brachypodium distachyonL.)的SBPase基因,温室条件下,转基因植株叶片光合作用增强,总生物量和干种子产量增加[22]。在拟南芥上超表达杨树SBPase基因,转基因植株的叶面积更大,光合速率更快,产量更多,同时也提高了拟南芥的固碳能力[23]。本团队前期将SBPase基因转入烟草中,3个转基因烟草株系植株的茎围、叶长、净光合速率均显著高于野生型烟草[24]。迄今,SBPase基因在甜菜中的过表达研究未见报道。本研究成功获得SBPase转基因甜菜植株,后期拟对转基因植株光合特性、农艺性状等进行测定。
本研究采用农杆菌介导法对甜菜叶柄进行遗传转化,获得了SBPase低拷贝插入的转基因甜菜植株,为探索甜菜产量形成机理,创制高产新种质奠定了基础。
