乏氧条件下组蛋白去乙酰化酶6 对肝癌细胞增殖转移能力的影响△
2022-07-01牛林军柳昂王亚李心忠顾玉明
牛林军,柳昂,王亚,李心忠,顾玉明#
1徐州医科大学淮北临床学院,安徽 淮北 235000
2淮北市人民医院肿瘤科,安徽 淮北 235000
3徐州医科大学附属医院介入科,江苏 徐州 221002
原发性肝癌是中国常见的恶性肿瘤之一,病死率居所有恶性肿瘤第二位[1]。尽管目前肝癌的治疗方法已明显改善,特别是近年来抗血管生成药物及免疫治疗的应用,明显延长了晚期肝癌患者的生存期,但总体治疗效果仍差强人意。因此,寻找一种新的肝癌治疗方法尤为重要。人类实体瘤内多存在局部乏氧的微环境,在肿瘤细胞的生长过程中发挥重要作用[2]。乏氧会影响葡萄糖转运蛋白1(glucose transporter 1,GLUT1)和表皮生长因子受体(epidermal growth factor receptor,EGFR)等蛋白的表达及运输,增强肿瘤细胞的侵袭性[3]。组蛋白去乙酰化酶6(histone deacetylase 6,HDAC6)是组蛋白去乙酰化酶(histone deacetylase,HDAC)家族成员,蛋白质的乙酰化和去乙酰化在多种生理和病理过程中发挥作用[4]。本研究检测肝癌患者肝癌组织及相应癌旁组织中HDAC6 的蛋白表达情况,并探讨肝癌细胞乏氧条件下HDAC6 的变化及对细胞增殖、转移能力的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2015 年11 月至2019 年11 月淮北市人民医院和徐州医科大学附属医院收治的肝癌患者。纳入标准:①均经术后病理学检查证实为肝细胞肝癌,简称肝癌;②术前未接受任何抗肿瘤治疗;③病历资料完整。排除标准:①肝胆管细胞癌;②术前接受过抗肿瘤治疗。依据纳入和排除标准,本研究共纳入46 例肝癌患者,其中男28 例,女18例;年龄30~69 岁,中位年龄53 岁。选取46 例肝癌患者的新鲜肝癌组织及相应的癌旁组织,癌旁组织取自距肝癌组织边缘2 cm 以外的正常肝脏组织,经10%甲醛溶液固定后石蜡包埋,切成4 µm厚的连续石蜡切片备用。
1.2 细胞、主要试剂和仪器
人肝癌HepG2 细胞购自上海中科院生命科学研究院。HDAC6小干扰RNA(small interfering RNA,siRNA)购自苏州吉玛公司,胎牛血清购自杭州四季青生物科技有限公司,RNA 提取试剂Trizol购自美国Invitrogen 公司,实时逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒购自日本TaKaRa 公司,免疫组织化学试剂盒、浓缩型二氨基联苯胺(diaminobenzidine,DAB)试剂盒均购自北京中杉金桥生物技术有限公司。Matrigel 购自美国BD 公司,细胞侵袭培养板购自美国Corning 公司。
1.3 实验方法
1.3.1 细胞培养、转染和分组 人肝癌HepG2 细胞用含10%灭活胎牛血清的DMEM 培养基培养,分别置入常氧及乏氧细胞培养箱,设置细胞生长条件,常氧环境:37 ℃、21%O2、5%CO2;乏氧环境:37 ℃、3%O2、5%CO2。待乏氧培养的细胞融合至50%~70%时按试剂盒说明书将HDAC6siRNA 转染至乏氧人肝癌HepG2 细胞,作为Hp-siHDAC6组,转染过程通过Silentfect 介导;将未转染的乏氧人肝癌HepG2细胞作为乏氧对照组,即Hp组;将常氧人肝癌HepG2细胞作为常氧对照组,即NC组。
1.3.2 实时荧光定量RT-PCR 法检测HDAC6mRNA 的相对表达量 按照Trizol 试剂说明书提取肝癌组织和癌旁组织、各组人肝癌HepG2 细胞的总RNA,紫外分光光度计检测其浓度及吸光度A260/A280比 值。提 取2 µg 总RNA,按 照Prime-ScriptTMRT Master Mix 逆转录试剂盒说明书合成互补DNA(complementary DNA,cDNA),然后通过7500 型荧光定量PCR 仪进行荧光定量PCR 反应,PCR 反应体系为10 µl,反应条件:95 ℃预变性30 s、95 ℃变性5 s、60 ℃退火34 s,共40 个循环;融解曲线分析:95 ℃15 s,60 ℃1 min,95 ℃15 s。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为 内 参,采 用2-ΔΔCT计 算HDAC6mRNA 的相对表达量,每组均设3 个复孔。HDAC6上游引物:5'-GGCTTCAGTTTCCTGTGCTC- 3',下 游 引 物 :5'- CTTCCTCCTCGCTCTCCTCT- 3';GAPDH上 游 引 物 :5'-GCAAATTCCATGGCACCGT-3',下游引物:5'-TCGCCCCACTTGATTTTG-3'。
1.3.3 免疫组化法检测HDAC6 蛋白的表达情况链霉抗生物素蛋白-过氧化物酶(streptavidin-peroxidase,SP)法操作步骤严格按照试剂盒说明书进行,4 μm 厚组织切片常规进行脱蜡、梯度乙醇水化。在抗原修复液中95~99 ℃处理40 min,室温冷却20 min。清洗3 次后,分别加入1∶50 稀释的HDAC6 一抗4 ℃孵育过夜。然后应用EnVision 检测和显色试剂盒进行DAB 显色,苏木素复染,梯度乙醇脱水,二甲苯透明,然后树胶封片观察。以磷酸盐缓冲液(phosphate buffered solution,PBS)替代一抗作为阴性对照,用已知阳性切片作为阳性对照。结果判定:每张切片高倍镜(×400)下随机选取10 个视野,每个视野计数100 个细胞,计算阳性细胞百分比,取平均值,以细胞质内出现棕黄色颗粒为阳性细胞,根据阳性细胞百分比及染色强度进行评分:阳性细胞百分比<5%计0 分,阳性细胞百分比为5%~24%计1 分,阳性细胞百分比为25%~49%计2分,阳性细胞百分比为50%~75%计3分,阳性细胞百分比>75%计4 分;无着色计0 分,浅棕黄色染色计1分,棕黄色染色计2分,棕褐色染色计3分;将阳性细胞百分比和染色强度评分相乘,≤4分判定为HDAC6阴性表达,>4分判定为阳性表达。
1.3.4 CCK8 检测人肝癌HepG2 细胞增殖能力将3 组人肝癌HepG2 细胞用胰蛋白酶消化并计数,接种于96 孔板中,每组细胞设5 个复孔。铺好96孔板后将培养板置于培养箱中培养,分别转染24、48、72、96 h 后,每孔加入10 μl 的CCK8 溶液。将96 孔板在培养箱内孵育,分别在加入CCK8 后0.5、1.0、2.0、4.0 h 时用酶标仪测定450 nm 处的光密度(optical density,OD)值。重复实验3 次。
1.3.5 Transwell 实验检测人肝癌HepG2 细胞迁移、侵袭能力 取3 组人肝癌HepG2 细胞,在迁移实验中,Transwell 小室的上室加入200µl 无血清培养基重悬细胞,含有2×104个细胞,Transwell 小室的下室加入含600 µl 的10%胎牛血清培养液。侵袭实验中,应用基质胶(Matrigel 胶,比例为1∶8)包被Transwell 小室的微孔膜,放入37 ℃培养箱中培养48 h 后取出Transwell 小室,多聚甲醛固定,结晶紫染色,用棉签擦去小室上层未穿膜细胞,显微镜下拍照,随机取5 个不同的视野(×200)计数,计算迁移、侵袭细胞的平均数。
1.4 统计学方法
采用SPSS 20.0 软件对所有数据进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 肝癌组织及癌旁组织中HDAC6 mRNA 相对表达量的比较
肝癌患者肝癌组织中HDAC6mRNA 的相对表达量为(0.44±0.05),明显低于癌旁组织的(0.75±0.08),差异有统计学意义(t=5.054,P=0.007)。
2.2 肝癌组织及癌旁组织中HDAC6 蛋白阳性表达率的比较
肝癌患者肝癌组织中HDAC6 蛋白阳性表达率为34.78%(16/46),明显低于癌旁组织的73.91%(34/46),差 异 有 统 计 学 意 义(χ2=14.194,P<0.01)。肝癌组织中HDAC6 蛋白多呈低表达或阴性表达,而癌旁组织多表现为细胞质内均匀分布的棕黄色颗粒。(图1)
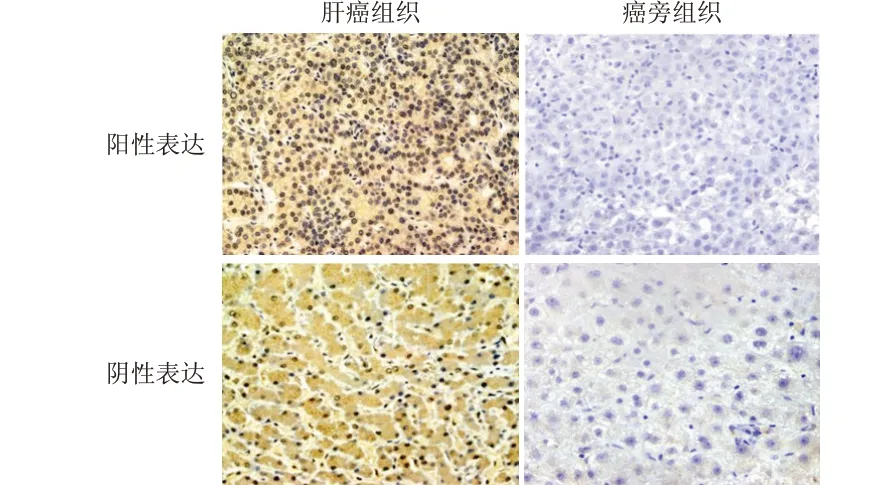
图1 肝癌患者肝癌组织及癌旁组织中HDAC6蛋白的表达情况(SP染色,×400)
2.3 不同临床特征肝癌患者肝癌组织中HDAC6蛋白表达情况的比较
不同性别、年龄、肿块数目肝癌患者肝癌组织中HDAC6 阳性表达率比较,差异均无统计学意义(P>0.05);肿瘤直径≥5 cm、术前甲胎蛋白(α-fetal protein,AFP)水平≥400 ng/ml、分化程度为低分化、TNM 分期为Ⅲ+Ⅳ期的肝癌患者肝癌组织中HDAC6 阳性表达率分别低于肿瘤直径<5 cm、术前AFP 水平<400 ng/ml、分化程度为中高分化、TNM 分期为Ⅰ+Ⅱ期的患者,差异均有统计学意义(P<0.05)。(表1)
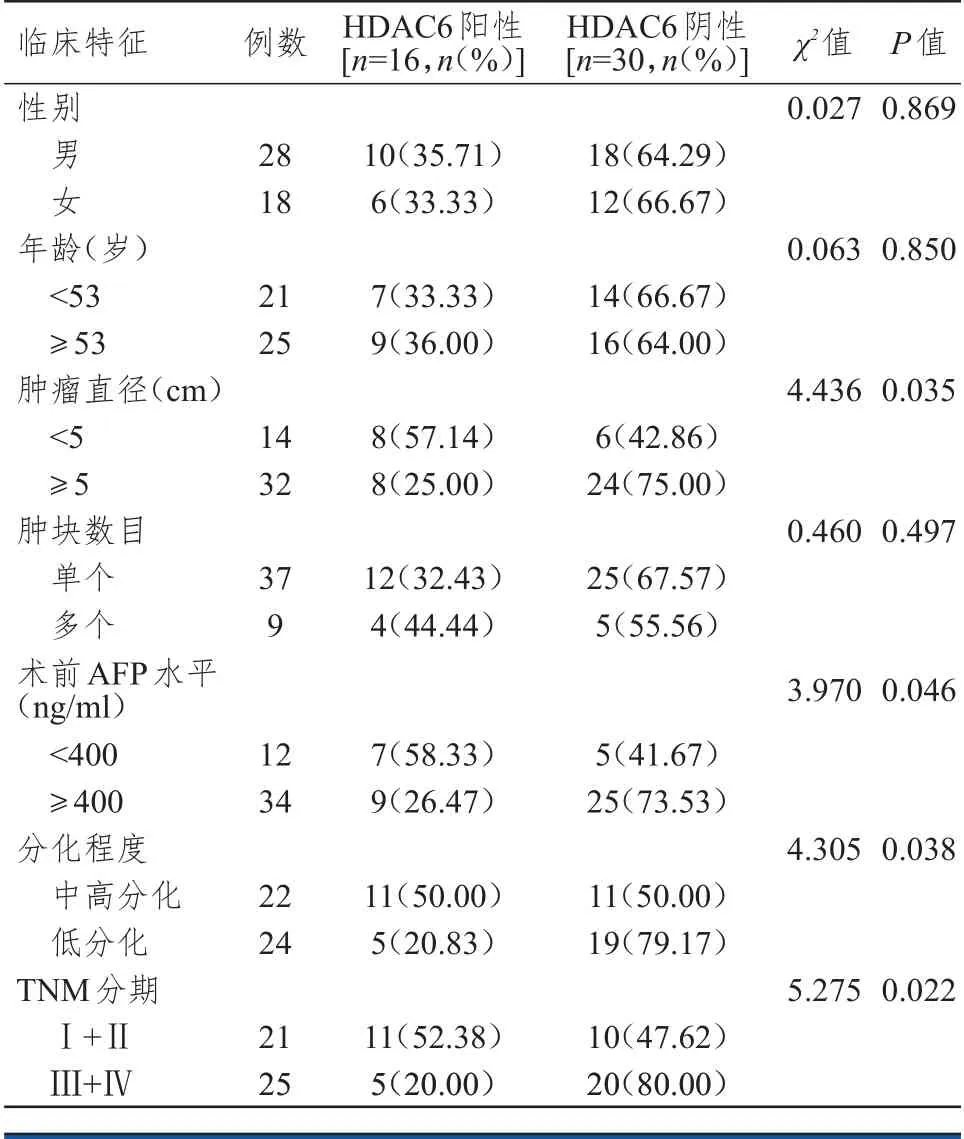
表1 不同临床特征肝癌患者肝癌组织中HDAC6 蛋白表达情况的比较(n=46)
2.4 人肝癌HepG2 细胞中HDAC6 mRNA 相对表达量的比较
NC 组、Hp 组及Hp-siHDAC6 组人肝癌HepG2细胞中HDAC6mRNA 的相对表达量比较,差异有统计学意义(P<0.01),其中Hp 组和Hp-siHDAC6组细胞中HDAC6mRNA 的相对表达量均明显低于NC 组,Hp-siHDAC6 组细胞中HDAC6mRNA 的相对表达量明显低于Hp 组,差异均有统计学意义(P<0.01)。(表2)
表2 3 组人肝癌HepG2 细胞中HDAC6 mRNA 相对表达量的比较(±s)
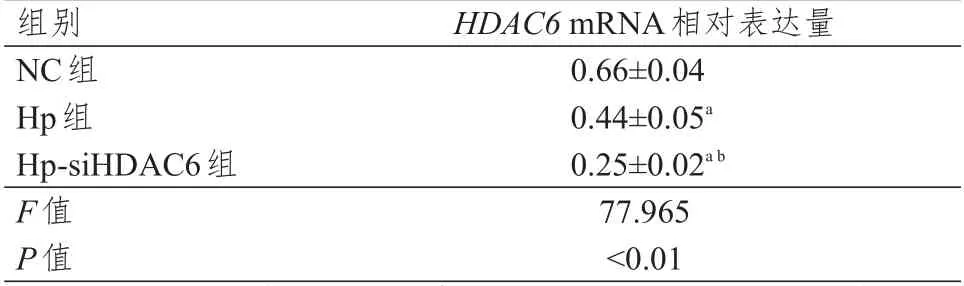
表2 3 组人肝癌HepG2 细胞中HDAC6 mRNA 相对表达量的比较(±s)
注:a与NC组人肝癌HepG2细胞比较,P<0.01;b与Hp组人肝癌HepG2细胞比较,P<0.01
组别NC组Hp组Hp-siHDAC6组F值P值HDAC6 mRNA相对表达量0.66±0.04 0.44±0.05a 0.25±0.02ab 77.965<0.01
2.5 干扰HDAC6 的表达对人肝癌细胞增殖能力的影响
转染24 h,3 组人肝癌HepG2 细胞OD 值比较,差异无统计学意义(P>0.05)。转染48、72、96 h后,3 组人肝癌HepG2 细胞OD 值比较,差异均有统计学意义(F=9.880、96.034、33.911,P<0.05);Hp 组和Hp-siHDAC6 组细胞的OD 值均明显高于NC组,Hp-siHDAC6 组细胞OD 值均明显高于Hp 组,差异均有统计学意义(P<0.01)。(表3)
表3 不同转染时间3组人肝癌HepG2细胞OD值的比较(±s)
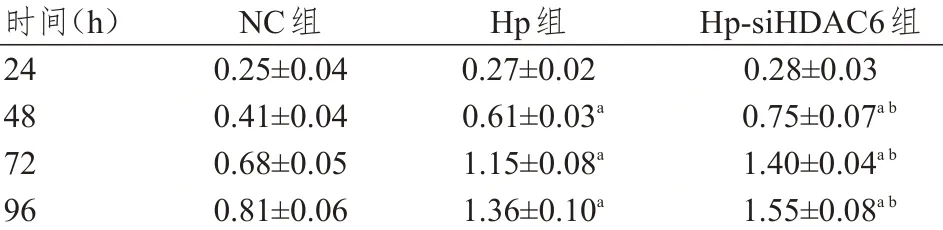
表3 不同转染时间3组人肝癌HepG2细胞OD值的比较(±s)
注:a与同时间NC组人肝癌HepG2细胞比较,P<0.01;b与同时间Hp组人肝癌HepG2细胞比较,P<0.01
时间(h)24 48 72 96
2.6 干扰HDAC6 的表达对人肝癌HepG2 细胞迁移、侵袭能力的影响
NC 组、Hp 组及Hp-siHDAC6 组人肝癌HepG2细胞中细胞迁移数、细胞侵袭数比较,差异均有统计学意义(P<0.01),其中Hp 组和Hp-siHDAC6 组细胞迁移数、细胞侵袭数均明显高于NC 组,Hp-si-HDAC6 组细胞迁移、细胞侵袭数均明显高于Hp组,差异均有统计学意义(P<0.01)。(表4、图2)
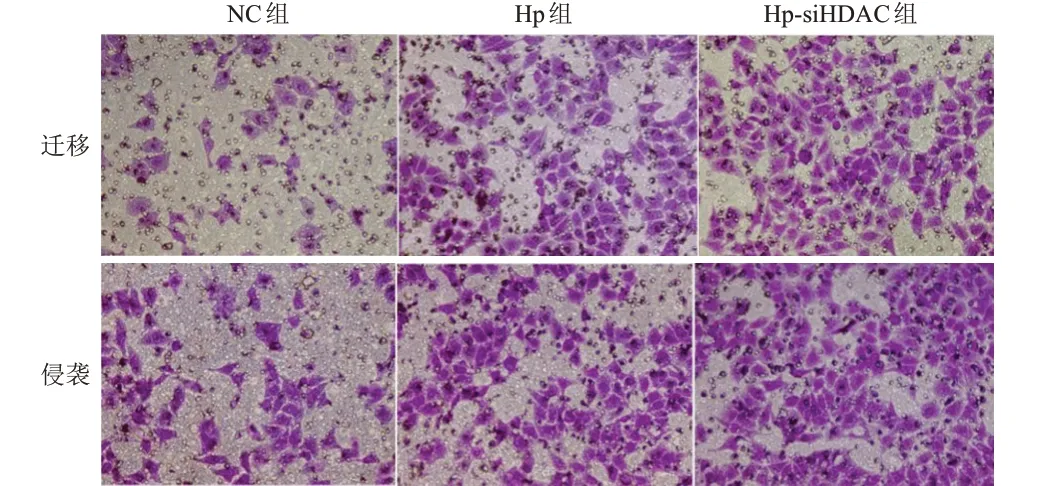
图2 Transwell实验检测干扰HDAC6的表达对3组人肝癌HepG2细胞迁移、侵袭能力的影响(结晶紫染色,×200)
表4 3 组人肝癌HepG2 细胞迁移和侵袭数目的比较(±s)
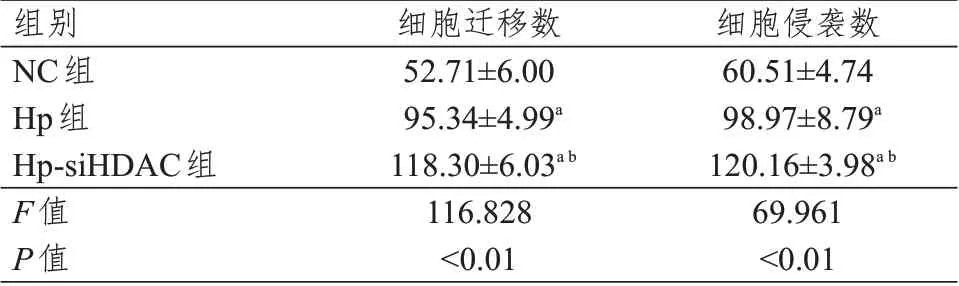
表4 3 组人肝癌HepG2 细胞迁移和侵袭数目的比较(±s)
注:a与NC组人肝癌HepG2细胞比较,P<0.01;b与Hp组人肝癌HepG2细胞比较,P<0.01
组别NC组Hp组Hp-siHDAC组F值P值细胞迁移数52.71±6.00 95.34±4.99a 118.30±6.03ab 116.828<0.01细胞侵袭数60.51±4.74 98.97±8.79a 120.16±3.98ab 69.961<0.01
3 讨论
乏氧是肿瘤微环境形成最重要的因素之一。在乏氧条件下,肿瘤可通过多种调节机制使自身肿瘤细胞更具抵抗力和存活能力。肿瘤细胞可通过调节缺氧诱导因子(hypoxia inducible factor,HIF)来促进肿瘤细胞的生长[2]。HDAC 是一类能够对染色体的结构修饰和基因表达调控发挥重要作用的蛋白酶。其中HDAC6 在自体吞噬、细胞应激反应、细胞周期进程、细胞凋亡和肿瘤新生血管生成过程中发挥重要的调节作用[5-7]。目前关于HDAC6 在肝癌中作用的研究较少,且存在较大分歧[8-9]。本研究支持HDAC6在肝癌细胞中发挥抑癌基因的作用。
乏氧能够促进肿瘤新生血管生成,增强肿瘤细胞的侵袭能力并影响相关蛋白的运输。相关研究表明,乏氧可以导致肝癌细胞HDAC6 蛋白的相对表达量明显降低[10-11],并通过磷脂酰肌醇-3-激酶(phosphoinositide 3- kinases,PI3K)/蛋 白 激 酶B(protein kinase B,PKB,又称AKT)通路参与新生血管生成[12-13]。PI3K/AKT/雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)通路是哺乳动物细胞自噬非常重要的信号转导通路之一,其通过影响下游多种效应分子的活化状态,发挥抑制细胞凋亡、促进细胞增殖的作用。有研究表明,PI3K/AKT/MTOR 通路能够促进肝癌细胞的生长并提高其黏附能力[14]。PI3K 通路能被细胞膜上的各种酪氨酸激酶受体(receptor tyrosine kinase,RTK)所激活[15],血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)是RTK 家族成员,干扰下调HDAC6 的表达后,VEGFA 水平可明显升高[11]。HDAC6 可以调节RAS 通路,RAS基因能上调血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促使肿瘤新生血管生成,促进肿瘤细胞的生长[16-17]。由此可以推测,HDAC6 可能通过介导RAS 或直接激活VEGFA/PI3K/AKT 信号通路来调节肝癌细胞的迁移、侵袭能力,但这需要进一步的研究进行验证。
本研究结果显示,肝癌组织中HDAC6 蛋白的阳性表达率、HDAC6mRNA 的相对表达量均明显低于癌旁组织,这可能与肝癌组织的乏氧环境有关。此外,HDAC6 蛋白的阳性表达率可能与肿瘤直径、术前AFP 水平、分化程度、TNM 分期有关,肿瘤直径越大、术前AFP 水平越高、分化程度越低、TNM 分期越晚,HDAC6 的阳性表达率越低。本研究通过人肝癌HepG2 细胞发现,乏氧条件下可以增强肝癌细胞增殖能力并通过下调HDAC6的表达来调节肝癌细胞的生长,但具体的作用机制尚需进一步的研究。这些结果对于明确乏氧环境对肝癌细胞的作用及其可能的机制奠定了基础,也为肝癌的治疗提供了潜在的方向。
综上所述,乏氧条件下HDAC6基因能够抑制肝癌细胞的增殖及转移,有望为肝癌的治疗提供新的靶点。
