反应历程的考点剖析和解题策略
2022-06-30冯亮
冯亮

我们所熟知的绝大多数化学反应并不是一步就能完成的,反应物通常需要经过若干步基元反应(反应物经一步反应直接转化为产物的反应,又称为简单反应)才能最终生成目标产物,这个过程就称为反应历程。普通高中化学课程标准(2017年版2020年修订)中明确提出了对反应历程的内容要求:“知道化学反应上有历程的,认识基元反应活化能对化学反应速率的影响”、“知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义”。反应历程是新课程标准新增加的内容,对于高考具有重要的的指导意义。
纵观近几年的高考真题,反应历程已经成为高考化学的考察热点,在选择题和非选择题(主要是化学反应原理题)中均有出现。这类试题背景新颖,通常都是学生未学过的催化反应,但考察的知识点基本都是学生高中已经学过的知识。通过下表可以初步了解近几年高考真题中反应历程题的考察情况:
由以上表格可知,反应历程题考查的知识点虽然繁多,但主要集中在物质结构和化学反应原理两大块。大部分知识是高中的主干知识,重现率很高,如化学反应中的能量变化、催化剂、活化能、化学键、化学反应速率和化学平衡等;另外还有少量知识点是平时不太常考的,比如有效碰撞理论;也有些知识点是相对比较新颖的,如中间体、能垒、决速步等。
按照题目所给图像信息形式的不同,可以将反应历程题分为三大类,一反应能量变化图,二反应历程图,三综合题型。这三类题的解题思路是:先通读题目和图像信息,了解题目涉及的反应;然后从选项或者题目要求出发,在题干中寻找解题所需的信息;最后结合已学知识进行解答。
1. 反应能量变化图。
该类型题目把反应历程和高中所学能量变化图结合在一起考察,重点考察焓变、活化能、催化剂、反应速率等相关知识。
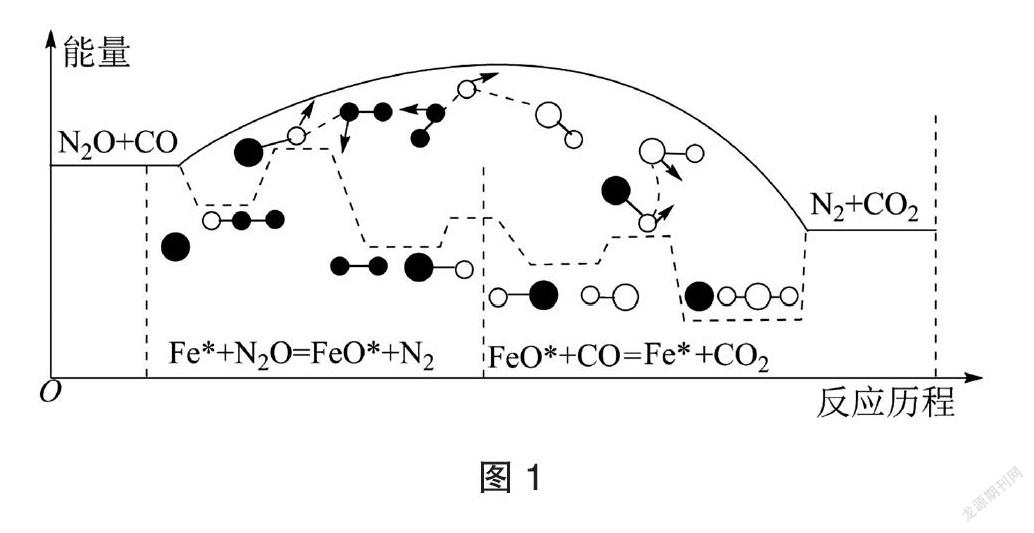
【例1】CO与N2O在铁催化剂表面进行两步反应,其相对能量与反应历程如图1所示,下列说法正确的是
A. 在整个反应历程中,只有极性键的断裂和生成
B. 第二步反应活化能较大
C. 两步反应均为放热反应
D. FeO*和Fe*均为反应的催化剂
解析:通读题目所给信息,该反应历程的反应物是CO和N2O,催化剂是铁,生成物是N2和CO2。
A选项考察的是化学键,需要分析题目中各物质化学键的变化,再结合已有极性键、非极性键的知识作答。根据图示反应历程图知,第一步Fe*和N2O反应生成FeO*和N2,断开了氮氧键(极性键),形成了氮氮三键(非极性键);第二步,CO和FeO*反应生成Fe*和CO2,生成了碳氧双键(极性键),所以在整个反应历程中,除了有极性键的断裂和生成,还有非极性键的形成,故A错误。
B选项考察的是活化能,活化能是反应物和过渡态之间的能量差值。根据反应历程图知,第一步反应的活化能大于第二步反应的活化能,故B错误。
C选项考察放热反应的基本概念,放热反应的特征是反应物总能量高于生成物总能量。根据反应历程图可知两步反应的反应物的总能量均高于相应反应生成物的总能量,所以两步反应均为放热反应,故C正确。
D选项考察催化剂的基本概念,催化剂是通过参加化学反应而改变化学反应速率且反应前后自身质量和化学性质不变的物质,其特征是先参与反应,后生成等量的该物质;而中间体则是反应过程中先生成后又发生转化的物质。由两步反应方程式可知,Fe*先参与反应,后又有等量Fe*生成,为催化剂,但FeO*是先生成后消耗,所以FeO*是反应的中间体,不是催化剂,故D错误。
答案:C
【例2】甲醇在钯基催化剂表面制氢的反应历程如图2所示,其中吸附在钯基催化剂表面上的物种用*标注。下列说法正确的是
A. 参与反应的反应物总键能小于生成物总键能
B. 该历程中最大能垒(活化能)E正=179.6KJ·mol-1
C. CH3OH(g)?葑CO(g)+2H2(g)的?驻H=+157.2kJ·mol-1
D. 甲醇在不同催化剂表面上制氢的反应历程相同
解析:通读题目所给信息,本题涉及的反应是甲醇在钯基催化剂表面制氢气和CO。
A选项考察的是总键能与焓变的关系,?驻H=反应物总键能-生成物总键能=生成物总能量-反应物总能量。图像显示,该反应为吸热反应,故?驻H>0,所以反应物总键能大于生成物总键能,故A错误。
B选项考察的是能垒(活化能),活化能是反应物和过渡态之间的能量差值。根据图像,能垒最大的一步是由CO*+4H*到过渡态IV,其值为113.9kJ·mol-1-(-65.7kJ·mol-1)=179.6kJ·mol-1,故B正确。
C选项考察热化学方程式的书写,热化学方程式同时表示物质变化和能量变化。根据图像,?驻H=生成物总能量-反应物总能量=+97.9kJ·mol-1,故C错误。
D选项显然错误,不同的催化剂催化原理不同,涉及的反应历程不同。
答案:B
能量变化图是化学反应与能量变化知识板块中非常重要的知识载体,学生首先要熟悉课本上最基本的吸热反应、放热反应、有催化剂参与的化学反应的能量变化图,会判断吸热反应和放热反应,知道催化剂对活化能、化学反应速率的影响;再结合题目所给信息就可以做出正确的判断,总体难度不大。
2. 反应历程图。
该类型题目把化学反应历程以流程图的形式展示,涉及的物质和步骤比较多。对学生获取和加工信息的能力要求比较高,重点考察化学键、氧化还原反应、催化剂、中间体、中间反应、总反应等知识。
【例3】甲醇羰基化制乙酸的催化剂为可溶性铱配合物(主催化剂)和碘化物(助催化剂),利用铱配合物[Ir(CO)2I2]-催化甲醇羰基化的反应历程如图3所示(其中Me—CH3,Ac—COCH3)。下列說法正确的是
A. Ir的成鍵数目在反应历程中没有发生变化
B. I-是反应过程中的催化剂
C. CO分压对反应速率没有影响
D. 存在反应[Ir(CO)2I3(CH3)]-+CO=Ir(CO)3I2(CH3)+I-
解析:通读题目所给信息,本题涉及的反应是铱配合物[Ir(CO)2I2]-催化甲醇羰基化生成乙酸,反应物是甲醇和CO,生成物是乙酸。
A选项考察的是成键数目,直接观察反应历程图中含铱化合物中铱的成键数目即可。反应历程图显示铱的成键数目有4,5,6三种,所以铱的成键数目发生了变化,故A错误。
B选项考察的是催化剂的概念,本题中I-先生成后参与了反应,所以I-是中间体,故B错误。
C选项考察反应物分压对化学反应速率的影响。CO是该反应的反应物,其分压越大,反应速率越快,故C错误。
D选项考察中间反应,根据图示右下角,存在该中间反应,故D正确。
答案:D
【例4】酸性条件下,环氧乙烷水合法制备乙二醇涉及的机理如下:
下列说法不正确的是
A. 制备乙二醇的总反应为
B. H+进攻环氧乙烷中的氧原子是因为碳氧键的共用电子对偏向氧
C. 二甘醇的分子式是C4H10O3
D. X的结构简式为
解析:通读题目所给信息,本题涉及反应为环氧乙烷水合法制备乙二醇,另外还生成副产物二甘醇。
A选项考察总反应的书写。由左图可知,反应物为环氧乙烷和水,催化剂为H+,生成物为乙二醇,故A正确。
B选项比较新颖,考察学生的化学思维。由于碳氧键中氧原子的吸电子能力更强,共用电子对偏向氧原子,使氧原子相对显负电性,由于电荷的吸引,带正电的氢离子进攻显负电性的氧原子,故B正确。
C选项考察中间反应和原子守恒思想。根据右图最后一步前后物质的原子种类和个数,可推知二甘醇的分子式C4H10O3。另外根据左图最后一步的反应特点,可推知二甘醇的结构简式为HOCH2CH2OCH2CH2OH,也能证明C正确。
D选项考察读图能力和原子守恒。根据右图第一步反应的产物可知X应该为,故D错误。
答案:D
反应历程图的背景虽然学生相对比较陌生,但选项的难度不大,很多选项结合图示信息即可做出判断。学生需要根据题给信息,找到起始反应,然后根据箭头指向即可逐个击破接下来的反应。这类题通常会考察图示中的反应物、生成物、催化剂和中间体,判断的方法是:只进去流程的是反应物,只从流程出来的是产物,先参与反应后又生成的是催化剂,先生成再参与反应的是中间体。
3. 综合题型。
该类型题目可能结合了反应历程方程式、反应能量图、反应历程图、化学反应速率图和化学平衡图像,思考的广度和难度都有一定提升。图像和信息的增多意味着解题需要消耗更多的时间,但只要耐心对照选项和图像,再结合已学知识也能逐个击破。
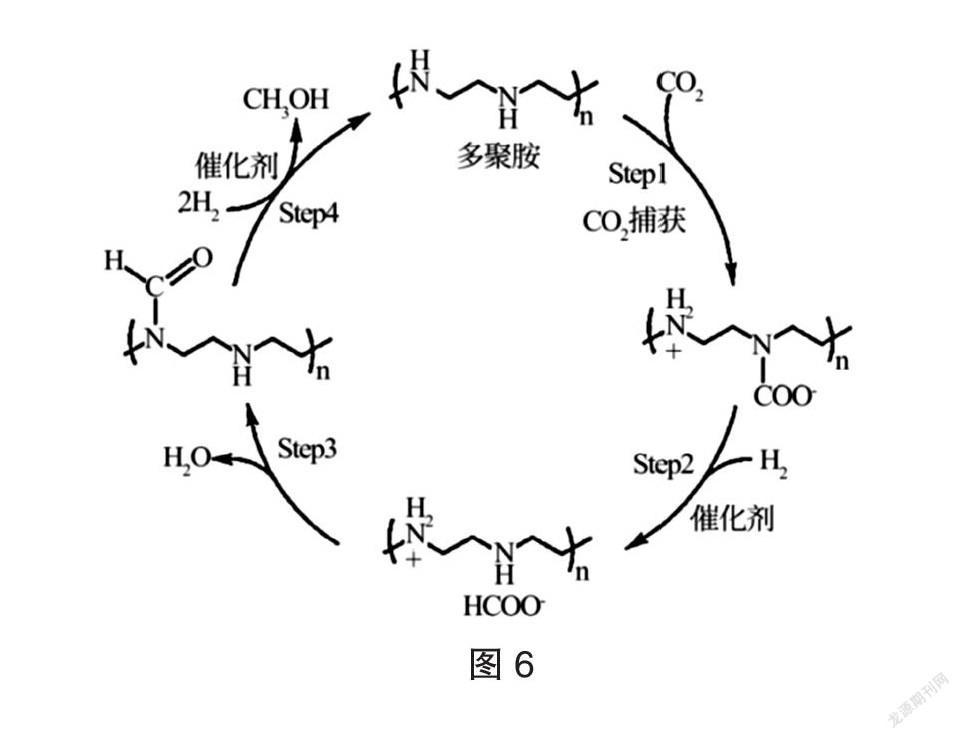
【例5】为应对全球气候问题,中国政府承诺“2030年碳达峰”、“2060年碳中和”。我国学者研究了CO2与H2在TiO2/Cu催化剂表面生成CH3OH和H2O的部分反应历程,如图5所示。另外,科学家使用络合物作催化剂,用多聚物来捕获二氧化碳,反应可能的过程如图6所示。下列叙述错误的是
A. 图Ⅰ反应历程中最大的活化能为0.89eV
B. 图Ⅱ反应若得以推广将有利于碳中和
C. 图Ⅱ总反应方程式为:CO2+3H2CH3OH+H2O
D. 图Ⅰ、图Ⅱ反应过程中都只有极性键的断裂和形成
解析:通读题目所给信息,本题涉及两个反应历程,图I是以能量图的形式展示CO2与H2在TiO2/Cu催化剂表面生成CH3OH和H2O的部分反应历程,图II是以反应历程图形式展示络合物催化多聚物捕获二氧化碳。
A选项考察活化能,活化能是是反应物分子变为活化分子所需的最小能量,体现在图像上就是过渡态相对能量与反应物相对能量的差值。图I有三个过渡态,过渡态前面的物质即为反应物。根据计算,活化能最大的是达到过渡态I,为0.89eV,故A正确。
B选项考察的是碳中和的概念,碳中和是指CO2的排放总量和减少总量相当,核心是减少CO2的总量。图II反应将CO2转化为CH3OH,有效的减少了CO2的总量,故B正确。
C选项考察总反应,总反应需要找到反应物、产物和催化剂。根据图II,进去的有CO2和H2,是反应物;出来的是CH3OH和H2O,是产物,另外还有催化剂,故C正确。
D选项考察化学键的断裂和形成,图II 中H2参与反应,会断裂H-H非极性共价键,故D错误。
答案:D
以上即是反应历程常考的三种类型,非选择题中也基本上是这些考点,只是改成了填空的形式,难度也不大。只要学生在平时多加积累,掌握好常考的知识点,考试过程中按照上述解题思路即可攻克该类型题目。考试中千万不要试图读懂每个步骤、每条信息,把注意力集中在解题所需的信息即可。毕竟信息很多,但并不是每条信息都是有用的,考试时间也比较紧张,要学会抓取有效信息快速解题。
4. 创新题型。
除了以上常考题型,目前还有一些变式的创新型题目,信息虽然不是以反应历程的形式呈现,但是和反应机理有关。解题的方法和反应历程的题目类似,都是从选项和题目信息入手,再结合所学知识进行解答。
【例6】CH3CH2CH3的溴化、氯化反应过程及产物的选择性如图7所示。下列说法正确的是
A. CH3CH2CH2·比(CH3)2CH·更稳定
B. 使用催化剂对氯化、溴化反应的ΔH有影响
C. 升高温度,氯化、溴化反应的CH3CH2CH3平衡转化率都增大
D. 以CH3CH2CH3为原料合成2-丙醇时,应该选用溴化反应,然后再水解
解析:通读题目所给信息,本题涉及的反应是CH3CH2CH3的溴化和氯化。
A选项考察的是物质稳定性,物质的能量越低越稳定。两幅图中均显示(CH3)2CH·的能量低于CH3CH2CH2·,所以(CH3)2CH·更稳定,故A错误。
B选项考察的是催化剂对焓变的影响,催化剂只能改变活化能和反应速率,不能改变反应物、生成物的总能量,所以不能改变焓变,故B错误。
C选项考察温度对化学平衡的影响,升高温度,化学平衡向吸热反应方向移动,吸热反应的平衡转化率提高。根据能量变化图,CH3CH2CH3的溴化过程为吸热反应、氯化过程为放热反应,所以升高温度只能提高溴化过程的平衡转化率,故C错误。
D选项比较新颖,要想制备2-丙醇,需要先生成(CH3)2CH·,(CH3)2CH·的量越多越有利于2-丙醇的合成。根据能量变化图所示的选择性,溴化过程中(CH3)2CH·的选择性最高达到95%,最有利于2-丙醇的合成,故D正确。
答案:D
学生在备考过程中,首先要熟练掌握基本概念(如催化剂、中间体、焓变、活化能、能垒、活化分子、有效碰撞、化学反应速率、化学平衡等)和基本理论(有效碰撞理论、勒夏特列原理等),知道如何判断能垒(即活化能)、决速步(活化能最大的一步)、物质稳定性(能量越低越稳定);然后认真完成近几年高考中出现的反应历程题,力求熟练掌握每个基本概念、理解每个选项、强化解题的基本思路;最后再做一些近期的优质模拟题、变式题,通过巩固训练提高解题的能力,最终一定可以从容应对高考。
责任编辑 李平安
