CD200R1缺失促进脂多糖诱导的小胶质细胞内吞
2022-06-29杜天舒宫晓丽艾孜儿艾尼瓦尔王晓民2
杜天舒 宫晓丽 艾孜儿·艾尼瓦尔 张 震 刘 玚 王晓民2,,4* 张 婷*
(1.首都医科大学基础医学院神经生物学系,北京 100069;2.首都医科大学教育部神经变性病重点实验室, 北京 100069;3.首都医科大学基础医学院生理与病理生理学系,北京 100069;4.北京脑重大疾病研究院,北京 100069)
小胶质细胞是脑内数量最大的免疫细胞群, 在大脑的任何病理损伤下都会发生小胶质细胞的激活[1]。国内外大量基础研究[2-3]显示,帕金森病(Parkinson’s disease, PD)模型中存在小胶质细胞的早期激活。小胶质细胞也是脑内特异的吞噬细胞,其在生理条件下的吞噬功能主要包括清除凋亡或坏死细胞,阻止促炎和神经毒性分子的溢出以及通过吞噬突触、轴突和髓磷脂碎片参与神经元连接性的重塑[4]。在病理条件下,细菌脂多糖(lipopolysaccharide, LPS)等Toll样受体(Toll-like receptor, TLR)激动剂激活小胶质细胞后,其吞噬功能增强,大量吞噬活的神经元而引起神经元死亡[5]。在6羟基多巴胺(6-hydroxydopamine,6-OHDA),1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)等PD模型中也有类似的发现。
小胶质细胞的表型和功能均受到来自神经元细胞的免疫检查点(check point)机制的严格调控。在慢性疾病或衰老中,这种检查点机制限制小胶质细胞的过度激活;小胶质细胞免疫检查点机制跨越多层监管,其中细胞和细胞之间的交流包括CX3CL1-CX3CR1、CD200-CD200R、CD22-CD45、CD47-SIRPa[6]。本课题组前期工作[7-8]筛选出对中脑黑质小胶质细胞有特异性作用的免疫检查点分子CD200-CD200R1,并且进一步深入研究发现,CD200R1敲除小鼠的脑内炎症水平变化不明显,内吞水平明显增加。然而,CD200R1对小胶质细胞内吞水平的影响及分子机制未见报道。那么CD200R1对小胶质细胞内吞功能的影响到底是什么?因此本实验通过荧光微球内吞实验研究LPS模型下BV2小胶质细胞的内吞功能,并通过RT-qPCR实验检测LPS模型下CD200R1的表达情况,进一步通过CD200R1敲除动物提取原代小胶质细胞,研究CD200R1对LPS诱导的小胶质细胞内吞功能的影响。
1 材料与方法
1.1 实验材料
BV2细胞和SH-SY5Y细胞购自协和细胞库,出生24 h 内SD大鼠乳鼠订购于北京维通利华公司,实验动物许可证号:SYXK(京)2017-0033。DMEM-F12培养基、青链霉素(penicillin-streptomycin solution,PS)、胎牛血清(fetal bovine serum,FBS)、0.25%(质量分数)胰蛋白酶(美国Hyclone公司);多聚-L-赖氨酸、细胞级别细菌脂多糖(美国Sigma公司);CellTrackerTMGreen CMFDA、Carboxylate-Modified荧光微球、Trizol(美国Invitrogen公司产品);多聚甲醛(paraformaldehyde,PFA),磷酸盐缓冲液(phosphate buffer solution, PBS)主要成分十二水磷酸氢二钠(Na2HPO4·12H2O)、二水合磷酸二氢钠(NaH2PO4·2H2O)、氯化钠(NaCl)(北京化工厂);三氯甲烷、异丙醇(北京现代东方科技发展有限公司);快速反转录试剂盒(FastQuant RT Kit)(北京天根生化科技有限公司);荧光防淬灭封片剂(美国Vector公司),PowerUpTMSYBRTMGreen Master Mix、CO2恒温培养箱、生物安全柜、4 ℃层析柜(美国Thermo 公司);电动移液器(德国Brand公司);超纯水纯化系统(美国Millipore公司);电子天平(德国Sartorius公司);倒置光学体式显微镜(日本Olympus公司);正置荧光显微镜(德国Zeiss公司);水浴锅(北京方通达科技有限公司);高压消毒灭菌锅(日本Tomy公司);水平摇床(北京六一仪器厂);Vortex-T 旋涡混合器(美国Scientific industries公司);-20 ℃冰箱(中国海尔公司);-40 ℃冰箱(中国中科美菱公司);-80 ℃ 超低温冰箱(德国NUAIR公司产品);显微器械(美国WPI公司);pH仪(英国Jenway公司)。
1.2 实验方法
1.2.1 细胞培养
将BV2细胞株、SH-SY5Y细胞株和原代小胶质细胞分别培养在含10%(体积分数)FBS和1%(体积分数)PS的DMEM-F12培养基中,5%(体积分数)的CO2,37 ℃恒温箱恒温孵育。
1.2.2 SH-SY5Y细胞染色
首先配制CellTrackerTMGreen CMFDA染料,让产品温热至室温。将每瓶50 μg冻干的产品溶于高质量11 μL DMSO中,使其终浓度为10 mmol/L,用锡纸包裹,避光保存于-20 ℃,用前稀释至工作浓度。
将提前用37 ℃水浴锅预热的0.25%(质量分数)的胰酶消化SH-SY5Y细胞2~5 min,边消化边在显微镜下观察,观察到大约90%以上的细胞消化下来时,用含10%(体积分数)FBS的DMEM/F12培养基终止消化,计数后,转速1 000g,10 min离心收集细胞,将细胞轻轻悬浮在预热的1 mL无血清的CellTrackerTM工作液中,工作液浓度为5 μmol/L(吸0.5 μL 配制好的10 mmol/L的CellTrackerTMGreen CMFDA 到1 mL无血清的DMEM/F12培养基中)在37 ℃,5%(体积分数)CO2孵箱中孵育15 min后离心收集细胞,用5 mL的0.01 mol/L的PBS重悬洗涤细胞,离心收集细胞,重复2次后,用含10%(体积分数)FBS的DMEM/F12培养基重选细胞,以2.5×104/孔接种于24孔板的BV2细胞上,用于接下来的内吞实验。
1.2.3 荧光微球内吞实验
将BV2细胞以5×104/孔接种于放有高压灭菌过的细胞玻片的24孔板上,在37 ℃,5%(体积分数)CO2孵箱中培养,稳定24 h后用于实验;分别用1 μg/mL的LPS处理BV2细胞6 h以及0.1 μg/mL的LPS处理BV2细胞6、12、24 h;在收取细胞2 h前分别加入1.5 μL,即5.4×106个1 μm的荧光微球,37 ℃,5%(体积分数)CO2孵箱孵育2 h;收取细胞,首先用预冷的0.01 mol/L的PBS洗5 min×5次,注意避光;然后用4%(质量分数)的多聚甲醛室温固定20 min;0.01 mol/L PBS洗5 min×3次, Hoechst用0.3%(体积分数)Triton X-100 1∶5 000稀释后,每孔300 μL加入孔板中,室温避光孵育15 min染细胞核,0.01 mol/L PBS洗5 min×3次,将玻片取出,荧光封片剂封片后,Confocal共聚焦显微镜拍照;每个样本计数50个细胞内吞荧光微球的情况,分别统计细胞内吞分数(将不吞珠子的细胞记为0分,吞1个荧光微球的细胞记为1分,吞两个荧光微球的细胞记为2分,依次类推,将吞6个及6个以上的荧光微球的细胞记为6分)、内吞比例以及单个细胞平均内吞荧光微球的数量。BV2细胞和SH-SY5Y细胞共培养条件时,前一天以5×104/孔接种BV2细胞到细胞玻片,第二天将5 μmol/L CellTrackerTM Green CMFDA染色15 min的SH-SY5Y细胞以2.5×104/孔接种于24孔板的BV2细胞上,待SH-SY5Y细胞稳定后,分别用1 μg/mL和0.1 μg/mL的LPS处理BV2和SH-SY5Y共培养体系6 h和24 h,之后采用上述同样的方法进行荧光微球内吞实验。
为了研究CD200R1对原代小胶质细胞内吞功能的影响,分别从野生型(WT)小鼠及CD200R1基因敲除小鼠提取WT和CD200R1-/-原代小胶质细胞,体外培养14 d后摇取并接种在24 h孔板上,稳定24 h后,用于之后的实验。加入0.1 μg/mL的LPS处理24 h,在收取细胞前2 h加入荧光微球,2 h后固定细胞,通过IBA1免疫荧光染色标记小胶质细胞,并计数各组细胞内吞荧光微球的数量;同时,在BV2小胶质细胞中分别加入2.5 μg/mL的CD200Fc,3 μg/mL 的CD200R1-Ab,1 μg/mL 的LPS,以及1 μg/mL的LPS和2.5 μg/mL CD200Fc共同处理6 h进行荧光微球内吞实验。
1.2.4 RT-qPCR实验
首先用预冷的PBS清洗一遍六孔板细胞,弃去PBS后每孔加入750 mL Trizol,室温静置15 min后,收集细胞至1.5 μL EP管中,提取总RNA。加入200 μL预冷的氯仿,并在Votex上震荡15 s,裂解液呈现出粉色乳液状后,室温继续静置10 min后,4 ℃,12 000g,离心20 min;此时,吸取上清加入等体积预冷的异丙醇,室温静置10 min后,4 ℃,12 000g,离心15 min;此时可看见EP管底部白色的RNA沉淀,弃去上清,每管加入1 μL预冷的用DEPC水配制的75%(体积分数)的乙醇,然后4 ℃,7 500g,离心5 min。重复两次弃净上清后,每管加入20 mL的RNase-free H2O溶解RNA沉淀,60 ℃金属浴加热10 min。获取总RNA后反转录成cDNA,以GAPDH为内参通过RT-qPCR检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及CD200R1的相对表达改变,CD200R1、TNF-α和GAPDH的序列如下:m-CD200R1上游引物:5′-GGAAAACCAGAAAACCGAAATG-3′;m-CD200R1下游引物:5′-CCCCCATATTAAGAGCACTGCTA-3′;m-TNF-α上游引物:5′-CCAGTGTGGGAAGCTGTCTT-3′;m-TNF-α下游引物:5′-AAGCAAAAGAGGAGGCAACA-3′,m-GAPDH上游引物:5′-AGAACATCATCCCTGCATCC-3′,m-GAPDH下游引物:5′-CACATTGGGGGTAGGAACAC-3′。循环参数如下:第一步UDG激活,50 ℃,2 min;第二步 95 ℃预变性10 min;第三步95 ℃变性15 s,60 ℃退火,72 ℃延伸 1 min,40个循环。
1.3 统计学方法
首先对计量资料进行正态性检验,满足正态分布的资料,采用 GraphPad Prism 8.0版软件对所得数据进行统计学分析,两组间比较采用t检验,多组比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用Newman-Keuls检验。如不服从正态分布,采用非参数检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 LPS促进BV2小胶质细胞内吞水平的时效曲线
LPS处理后BV2小胶质细胞内吞水平明显增加(图1A);LPS处理6 h后0分细胞数相比于对照组下降了55.9%,6分细胞数相比于对照组增加了228%(图1B)。LPS处理6 h后每个细胞平均内吞的荧光微球数量最多为6.93个,相比于对照组平均内吞荧光微球的2.55个,增加了约172%;LPS处理12 h和24 h后每个细胞平均内吞荧光微球的数量分别为5.07个和5.02个,相比于对照组分别增加了99%和97%(图1C)。
2.2 LPS促进BV2小胶质细胞内吞水平的量效曲线
荧光微球内吞实验显示,与0.1 μg/mL的LPS处理组相比,1 μg/mL LPS 并没有引起BV2小胶质细胞内吞的进一步增加(图2A);1 μg/mL LPS处理6 h组的BV2小胶质细胞6分细胞数量相比于对照组BV2小胶质细胞增加了189%;而0.1 μg/mL LPS处理6 h组的BV2小胶质细胞6分细胞数量相比于对照组BV2小胶质细胞增加了228%(图2B);同时,1 μg/mL LPS处理6 h时每个细胞平均内吞的荧光微球数量为5.37个,相比于对照组平均内吞荧光微球的2.55个,增加了约111%,而0.1 μg/mL LPS处理6 h 时每个细胞平均内吞的荧光微球数量,相比于对照组,增加了约172%(图2C)。

图2 不同浓度的LPS引起BV2小胶质细胞内吞功能的变化
2.3 LPS下调BV2小胶质细胞中CD200R1的表达水平
随着LPS浓度的递增,TNF-α的水平也在递增,分别增加了241%、458%、668%(图3A),同时,0.1 μg/mL LPS明显引起了CD200R1表达下降,与对照组相比,0.1 μg/mL LPS处理3 h组CD200R1水平下降了35.62%(图3B)。
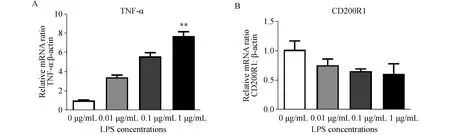
图3 不同浓度LPS引起BV2小胶质细胞TNF-α表达升高,CD200R1的表达下降
2.4 LPS促进神经元-小胶质细胞共培养体系中BV2小胶质细胞的内吞水平
荧光微球内吞实验可观察到BV2小胶质细胞内吞功能的变化(图4A),当分别用0.1 μg/mL和1 μg/mL 的LPS处理共培养体系6 h时,每个BV2小胶质细胞平均内吞荧光微球数量分别为4.89和6.3个,相比于对照组的2.17个,分别增加了125%和190%;同时当分别用0.1 μg/mL和1 μg/mL的LPS处理共培养体系24 h时,每个细胞平均内吞荧光微球的数量分别为6.14和5.85个,相比于对照组的1.37个,分别增加了348%和327%(图4B)

图4 LPS促进神经元-小胶质细胞共培养体系中BV2小胶质细胞的内吞水平
2.5 SH-SY5Y细胞与BV2细胞接触后抑制LPS诱导的BV2小胶质细胞内吞水平的增加
为了进一步研究神经元对小胶质细胞内吞能力的影响,将小胶质细胞区分为与SH-SY5Y直接接触的细胞(白色箭头所指)和非直接接触细胞(三角形所指)(图5A);通过荧光微球内吞实验,分别统计了直接接触SH-SY5Y和非直接接触SH-SY5Y的BV2小胶质细胞平均内吞荧光微球的数量,结果显示直接接触SH-SY5Y的小胶质细胞平均内吞荧光微球1.08个,非直接接触的小胶质细胞平均内吞荧光微球9.31个,与直接接触SH-SY5Y的小胶质细胞相比增加了大约762%(图5B)。

图5 SH-SY5Y细胞抑制LPS诱导的BV2小胶质细胞内吞水平的增加
2.6 CD200R1缺失的原代小胶质细胞对LPS引起的内吞更敏感,内吞更强
IBA1免疫荧光染色标记小胶质细胞(图6A),与WT组小胶质细胞相比,CD200R1-/-小胶质细胞在LPS处理后平均内吞荧光微球的数量明显增多,大约增加了144%(图6B),提示CD200R1缺失的原代小胶质细胞对LPS引起的内吞更敏感,内吞更强。
在BV2小胶质细胞中加入CD200R1-Ab后,其平均内吞荧光微球的数量明显增多,与对照组细胞相比增加了116%,并且与LPS处理组相比,LPS+CD200Fc共同处理组小胶质细胞平均内吞荧光微球的数量下降了54.66%(图6C)。
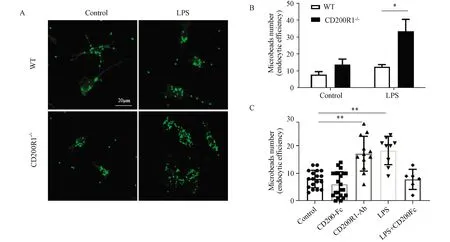
图6 CD200R1缺失的原代小胶质细胞对LPS引起的内吞更敏感,内吞更强
3 讨论
小胶质细胞的吞噬作用与炎症作用关系密切。吞噬作用为细胞对在质膜包膜内(>0.5 μm)颗粒的摄取[9]。由单核细胞、巨噬细胞、树突细胞、朗格汉斯细胞、破骨细胞和小胶质细胞等吞噬细胞负责清除感染因子、死细胞和组织碎片,并参与免疫应答[10]。
Li等[11]在2019年的报道中,用0.1 μg/mL的LPS处理BV2小胶质细胞24 h引起其吞噬比例的明显增加,这与本团队在BV2小胶质细胞上得到的结果一致。本研究应用0.1 μg/mL的LPS分别处理BV2小胶质细胞6、12、24 h,通过荧光微球内吞实验观察BV2小胶质细胞的内吞能力,结果表明LPS处理6、12、24 h均能引起BV2小胶质细胞内吞能力增加,但是LPS处理6 h时内吞荧光微球的细胞明显多于对照组细胞,同时本研究对至少50个细胞平均内吞荧光微球数量进行了统计,观察到LPS处理6 h时细胞平均内吞荧光微球数量相比于对照组平均内吞荧光微球的2.55个,增加了约172%。这与Kawabe等[12]得到的结论一致,Kawabe等通过直径为1 μm的荧光微球,和凋亡/死细胞来分别评估胞饮和吞噬作用,发现LPS刺激的BV2小胶质细胞中微球的荧光以浓度依赖的方式增加,与没有LPS刺激的对照细胞相比,浓度为30~300 ng/mL时有显著差异。另外,Lin等[13]报道0.1 μg/mL的LPS处理24 h 的BV2细胞与SH-SY5Y细胞共培养,使SH-SY5Y细胞的存活率下降了大约50%(SH-SY5Y∶BV2=1∶1)。本研究用0.1 μg/mL LPS处理BV2和SH-SY5Y共培养体系6 h和24 h,通过荧光微球内吞实验观察到BV2小胶质细胞吞噬能力增加,这与Lin等[13]用的LPS浓度和处理时间一致,推测BV2细胞内吞水平的改变直接影响了与其共培养的神经元存活。
PD主要的病理变化是中脑黑质多巴胺神经元进行性减少[14],并伴随着大量小胶质细胞的激活[15-16]。小胶质细胞免疫检查点机制细胞和细胞之间的交流包括CX3CL1-CX3CR1、CD200-CD200R、CD22-CD45、CD47-SIRPa[6]。其中 CD200分子是一种I-型膜糖蛋白,属于免疫球蛋白超家族(immuno-globulins superfamily,IgSF)成员,在中枢神经系统中,CD200主要在神经元表达,而其受体CD200R1只表达在小胶质细胞等髓系细胞上[17]。Lyons等[18]发现CD200缺失的小鼠来源的小胶质细胞内吞荧光微球的数量明显增加,并伴有溶酶体标志物CD68的表达增加;Varnum等[19]发现离体培养的小胶质细胞加入CD200Fc激活CD200R1后吞噬Aβ42的水平增加。本研究将体外培养14 d的WT组和CD200R1-/-组原代小胶质细胞摇取并接种于提前PLL铺板过夜的24孔板玻片上,加入0.1 μg/mL的LPS处理24 h,观察其内吞荧光微球的情况,结果表明,与CD200R1-/-组原代小胶质细胞相比,CD200R1-/-加LPS处理组的原代小胶质细胞平均内吞荧光微球的数量明显增多,大约增加了144%,即CD200R1缺失的原代小胶质细胞对LPS引起的内吞更敏感,内吞更强;并且在加入CD200R1的封闭抗体后小胶质细胞的内吞功能也有所增加。以上差异提示,小胶质细胞吞噬不同目标,其分子通路不同。CD200与受体结合可能促进了小胶质细胞吞噬Aβ42分子,但是其对LPS介导的吞噬或小胶质细胞对其他细胞、细胞碎片、细胞外基质的吞噬,有不同的作用。总之,LPS促进了小胶质细胞内吞水平的增加以及CD200R1表达的下降,并且在BV2-SH-SY5Y共培养模型中,神经元细胞接触小胶质细胞后抑制LPS诱导的小胶质细胞内吞增加,最后CD200R1敲除的小胶质细胞加入LPS处理后,内吞水平增加更明显,既CD200R1缺失促进了LPS诱导的小胶质细胞内吞。研究结果将提示PD早期小胶质细胞激活的分子机制,为早期干预提供新的潜在靶点。
