云南逸散紫花苜蓿MsVDE 基因的克隆与表达分析
2022-06-29何承刚
许 超,何承刚,姜 华
(1. 云南农业大学动物科学技术学院, 云南 昆明 650201;2. 云南省林业和草原科学院, 云南 昆明 650201)
紫花苜蓿(Medicago sativa)是豆科(Leguminosae)多年生草本植物,堪称“牧草之王”,既是我国草地农业的主要作物,也是生态治理的重要草种,更是畜牧业赖以发展的物质基础[1-2]。云南省自20 世纪80 年代进行了紫花苜蓿的引种工作,截止目前很多地方逸散了紫花苜蓿,其中部分逸散紫花苜蓿经过长期的适应,逐渐成为当地优势种群并被研究利用[3]。云南省立体气候显著,特别是金沙江干热河谷区气候特征独特,由于生态环境恶劣,优质豆科牧草极为缺乏。而此前在云南省迪庆州奔子栏镇发现的成群落分布的逸散紫花苜蓿,表现出了较强的耐干热性,是当地较为重要的紫花苜蓿资源。
随着全球气候的进一步变暖,干旱的趋势进一步延续,植物的抗干热能力便成为农业研究中的重要问题。植物在高温、干旱和强光等逆境下都会产生光抑制,同时在进化过程中也形成了多种保护机制[4],其中依赖于叶黄素循环(xanthophyll cycle)的热耗散作用近年不断受到学者关注,其在耗散过剩的激发能中起着重要作用,被认为是光保护的主要途径[5-6]。在紫黄质脱环氧化酶(violaxanthindeepoxidase, VDE)的催化下,紫黄质(violaxanthin)经中间产物环氧玉米黄质(antheraxanthin)转变成玉米黄质(zeaxanthin)[7],逆境条件下,如果植物形成的同化力未被碳同化过程完全消耗掉,就会使类囊体腔内的pH 降低,激活叶黄素循环,类囊体膜中的V、A、Z 色素通过叶黄素循环相互转化,与PSⅡ的捕光复合物(light-harvesting complex of PSⅡ, LHCII)相结合,通过V 和Z 对植物主要光合天线复合体LHCII的分子结构的影响,使构象发生变化,散发过量光能[8-9]。Gerganova 等[10]在对西红柿(Lycopersicon esculentum)的研究中提出叶黄素循环可能在高温和高光联合作用中有重要作用。葡萄(Vitis vinifera)叶片光合器官损害机制的研究表明,叶黄素环是响应臭氧胁迫的保护机制之一[11]。前期试验发现干热胁迫下紫花苜蓿可能通过叶黄素循环进行热耗散,是光保护的重要途径之一[4]。而VDE基因是类胡萝卜素生物合成途径中叶黄素循环脱环氧化过程的关键基因,能保护光合器官不受损害[12]。已有学者从多种植物中克隆了VDE序列,比如小麦[13](Triticum aestivum)、茶树[14](Camellia sinensis)、姜[15](Zingiberofficinale)、西红柿[16](Lycopersicon esculentum)、咖啡树[17](Coffea arabica)、黄瓜[18](Cucumis sativus)、烟草[19](Nicotiana tabacum)、毛竹[20](Phyllostachys edulis)、枸杞[21](Lycium chinense)、玉米[22](Zea mays)、草莓[23](Fragaria ananassa)、欧李[24](Cerasus humilis)等。但Bugos 和Yamamoto [25]将莴苣(Lactuca sativa)中的VDE基因分离克隆,进行原核表达,发现VDE 蛋白会受到二硫苏糖醇(1, 4-Dithiothreitol, DTT)的专一抑制。高文蕊等[26]通过对外施DTT 溶液,发现干旱条件下随着处理时间的延长,欧李的热耗散能力降低并发生了光抑制现象。徐凯等[27]提出在强光胁迫下,草莓叶片的叶黄素循环可能受到DTT 溶液的抑制而影响了热耗散能力。
目前,研究叶黄素循环关键基因之一的VDE基因是从分子层面研究光保护的切入点,备受学者关注。非生物胁迫下植株通过叶黄素循环进行光保护的研究多在水果、作物或模式植物中有报道。但关于紫花苜蓿的光抑制和光保护机制的研究鲜有报道。本研究利用RACE 技术克隆云南省典型干热河谷区的逸散紫花苜蓿MsVDE基因全长cDNA,对该基因进行蛋白结构和功能的预测分析,同时通过实时定量PCR 分析MsVDE基因在干热胁迫下的响应,为解析云南逸散紫花苜蓿特异耐干热性提供可行的路径。
1 材料与方法
1.1 植物材料与主要试剂
云南逸散紫花苜蓿种子采自云南省迪庆州德钦县东南部的奔子栏镇干热河谷地区,由云南农业大学草学实验室提供。将供试种子用0.1% HgCl2消毒30 min,然后将消毒的种子置于人工气候箱中催芽,将发芽的种子种在10 cm × 10 cm 的花盆中(介质为腐殖土 : 红土 : 蛭石 = 2 : 1 : 1),置于温室,每4 d 浇灌一次50%的Hoagland 营养液,期间浇一次清水,直到植株长到10 cm 高,选择长势一致的幼苗,将其移栽到20 cm × 20 cm 的花盆中,每盆20 株。然后将生长100 d 的植株,随机选取长势一致的供试材料,按试验设计进行处理。
RNA 提取试剂盒(北京华越洋公司)、M-MLV逆转录酶(M-MLV reverse transcriptase)、柱式DNA胶回收试剂盒(B518131)、RACE 试剂盒(Invitrogen公司)、pMD18-T 载体大肠杆菌DH5α 等由生工生物工程(上海)股份有限公司提供,LA Taq 和Super ScriptTMII 逆转录酶由大连宝生物公司提供,二硫苏糖醇(DTT)产自BBI Life Sciences 公司。其余常规药品为国产分析纯或进口分析纯。
1.2 试验设计与处理
处理前将盆栽试验材料一次性浇足水(盆底有水流出),放置14 h 后测定各盆内的土壤相对含水量,均在31%~32%。再用DTT 溶液(参照欧李幼苗[24]、草莓叶片[23]DTT 的处理浓度,5 mmo1·L−1)喷洒紫花苜蓿的叶片,以喷洒去离子水(deionized water,ddH2O)作为对照。选用两个人工气候箱,一个设定为正常条件(对照):空气湿度为75%,温度恒温22 ℃,白天14 h,夜间10 h;另一个设置为干热胁迫条件:空气湿度为30%,白天(14 h)温度为32 ℃,夜间(10 h)温度为28 ℃。将喷洒了DTT 溶液和去离子水的材料同时放入两个人工气候箱(光照强度均为180 J·s−1)内,干热胁迫下喷洒了DTT 和去离子水的材料第8 天前均不再补水,直至第8 天测定相应指标后才恢复常温并进行复水处理;正常条件下喷洒了DTT 和去离子水的材料每隔4 d 浇一次水。于第4 小时、8 小时、12 小时、16 小时、24 小时、2 天、4 天、8 天和复水及恢复常温后第4 天(分别以4 h、8 h、12 h、16 h、24 h、2 d、4 d、8 d、r4 d 表示)分别取样,测定正常条件和干热胁迫下MsVDE基因相对表达量。
1.3 MsVDE 基因的克隆
紫花苜蓿总RNA 提取参照RNA 提取试剂盒3.0 说明书(北京华越洋生物科技有限公司)。以RNA 为模板,反转录获得cDNA。根据GenBank 数据库中豆科植物的VDE基因的cDNA 的保守序列,利用Primmer 5.0 软件设计特异性引物MsVDE-1F、MsVDE-1R、 MsVDE-2F、 MsVDE-2R、 MsVDE-3F、MsVDE-3R (表1),扩增中间序列片段,PCR 产物克隆测序。3′ RACE (巢氏PCR 反应体系):以3′ adaptor为反转引物进行PCR,经PCR 纯化产物连接到pMD18-T 载体,连接产物转化,再以pMD18-T 载上的通用引物进行PCR,产物克隆测序。5′ RACE (巢氏PCR 反应体系):以特异性引物MsVDE-RT1/MsVDE-RT1 反转,得到cDNA,经RNase H 和TdT 处理后,进行巢氏PCR,产物回收测序。利用DNAstar软件对测序获得的序列进行拼接,得到MsVDEcDNA 的全长序列。引物合成及测序由生工生物工程(上海)有限公司完成。
1.4 MsVDE 基因的生物信息学分析
利用在线分析软件对MsVDE基因的氨基酸序列(Translate, https://web.expasy.org/translate/)、蛋白理化性质(EXPASy, https://web.expasy.org/protparam/)、保守结构域(CDD, http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、二级结构(SOPMA, http://npsa-pbil.ibcp.fr/)、疏水性(ProtScale, https://web.expasy.org/protscale/)、亚细胞定位(Cell-PLoc2.0, http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/; WoLF PSORT, https://wolfpsort.hgc.jp/)、跨膜结构域(TMHMM2.0, http://www.cbs.dtu.dk/services/TMHMM-2.0/)进行预测分析。
1.5 干热胁迫下MsVDE 基因的表达分析
提取紫花苜蓿嫩叶的RNA 用于qRT-PCR,根据已克隆MsVDE基因的CDS (coding sequence)全长编码序列,用Primer 5.0 设计荧光定量引物 (表1),并选取18Sr RNA为内参基因[28]。基因表达量测定反应体系为SYBR Premix Ex TaqⅡ(2X),10 μL;上游引物F (10 μmol·L−1),0.8 μL;下游引物F (10 μmol·L−1),0.8 μL; ROX Reference Dye Ⅱ, 0.4 μL; Template(cDNA),2 μL;ddH2O,6 μL;总体积为20 μL。实时荧光定量PCR 反应程序:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火34 s,循环40 次。通过荧光定量PCR 可得基因CT 值,采用2−△△CT方法[29]计算MsVDE基因的相对表达量,以18Sr基因为内参基因,校正cDNA 模板的细胞拷贝数。
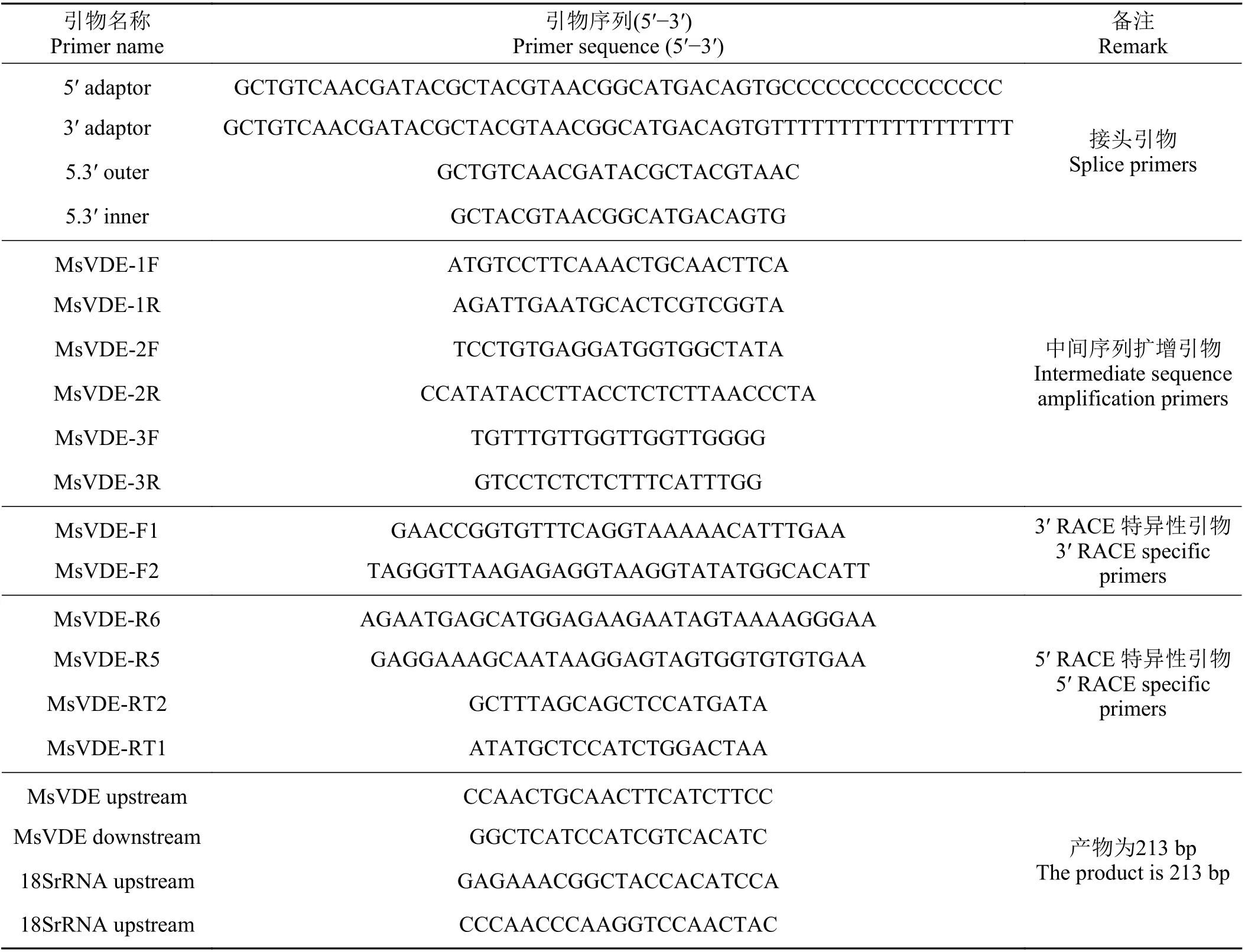
表1 MsVDE 基因克隆及荧光定量的引物序列Table 1 Gene cloning and fluorescence quantification primer sequences of MsVDE gene
1.6 数据分析
采用Excel 2013 整理数据,SPSS 20.0 统计分析数据,采用SigmaPlot 10.0 作图。不同处理之间的差异性比较采用t检验,不同时间段之间的差异采用单因素方差分析,方差同质性检验,当方差齐性时进行多重比较检验;当方差不齐时,使用Brown-Forsythe 的修正值和Games-Howell 方法。
2 结果
2.1 MsVDE 基因的克隆
所获得的中间片段、3′端和5′端片段(图1)进行拼接,得到MsVDE基因的全长cDNA 序列。将测序结果在NCBI 进行BLAST 分析,结果表明,所克隆的全长序列与其他植物VDE基因具有较高的同源性,表明克隆得到了MsVDE基因。

图1 MsVDE 基因扩增结果Figure 1 Amplification results of MsVDE gene
2.2 MsVDE 基因的生物信息学分析
经RACE 扩增后得到的cDNA 序列全长1 678 bp,通过核苷酸及氨基酸序列分析CDS 编码区全长为1 608 bp,编码535 个氨基酸,将该基因命名为MsVDE,GenBank 登录号为MW883184。
经EXPASY-ProtParam 预测,该基因的分子式为C2 738 h4192N718O797S27,编码蛋白质的分子质量60.79 kDa,等电点为5.94,负电氨基酸残基总数57,正电氨基酸残基总数50,脂肪族氨基酸指数为84.84,不稳定系数41.49,该蛋白结构不稳定,亲水性总平均值为−0.181。利用NCBI 的Conserved Domain Architecture Retrieval Tool (CDART)对MsVDE蛋白质的保守结构域进行预测(图2),发现该蛋白质的特定匹配(specific hits)为GDNF(GDNF Superfamily),该结构域富含半胱氨酸(Gly, C),位于蛋白质序列区间256~318 bp,E-value 为3.77e−3,属于脂质蛋白超级家族(lipocalin superfamily)。PLN02372 则是超级家族cl21528 (脂质蛋白/胞质脂肪酸结合蛋白家族)的成员,位于序列区间239~513,E-value 为9.15e−15,描述为紫黄质脱环氧化酶(violaxanthin de-epoxidase)。pfam07137[25]和PLN02372 均为超级家族cl21528 的成员。

图2 紫花苜蓿 MsVDE 基因编码蛋白质的保守域Figure 2 Conserved domain of protein encoded by MsVDE gene in alfalfa
通过SOPMA 预测,MsVDE 包含多种二级结构:α 螺旋158 AA (29.53%),延伸链结构118 AA (22.06%),β 转角32 AA (5.98%),无规则卷曲227 AA (42.43%)。利用Prot Scale 进行蛋白质的疏水性在线预测,MsVDE 的Score 值为-0.186,因此该蛋白总体上属于亲水性蛋白。利用Cell-PLoc2.0、WoLF PSORT 对MsVDE 的亚细胞定位进行预测,两者结果均显示定位于叶绿体。经TMHMM2.0 对紫花苜蓿MsVDE的氨基酸序列跨膜结构分析显示,整条肽链位于膜外,即该蛋白不存在跨膜结构域。
经DNAman 对紫花苜蓿氨基酸与其他物种进行相似性比对,MsVDE基因编码的氨基酸与其他物种的VDE基因编码的氨基酸序列有相同的保守区域(图3),结合保守结构域分析,该氨基酸序列包含了3 个特征区域:N-端半胱氨酸富集区(Cys-rich domain,256~318 bp)、 脂质运载蛋白特征区(lipocalin domain, 239~513 bp)和C-端谷氨酸富集区(Glu-rich domain, 478~517 bp),表明已成功克隆了紫花苜蓿紫黄质脱环氧化酶基因的序列。

图3 逸散紫花苜蓿与不同植物的VDE 基因氨基酸序列比对分析Figure 3 Schematic description of amino acid sequence alignment of MsVDE and homologous proteins
利用MEGA 6.0,将MsVDE基因的氨基酸序列与蒺藜苜蓿、密花豆、野生大豆等9 种植物VDE基因的氨基酸序列构建系统进化树,进行聚类分析,结果表明MsVDE的氨基酸序列与蒺藜苜蓿的亲缘关系最近,同源性达100%,与其他豆科植物聚为一类,而与可可树(Theobroma cacao)和拟南芥(Arabidopsis thaliana)的亲缘关系最远(图4)。

图4 紫花苜蓿与其他物种VDE 基因推导氨基酸进化树Figure 4 Phylogenetic tree of deduced amino acid sequences of VDE in escaped alfalfa and other species
2.3 干热胁迫下MsVDE 基因的表达分析
提取的紫花苜蓿叶片的RNA,经1%琼脂糖电泳凝胶检测,并用紫外分光亮度计检测其OD 值,其OD260/OD280均介于1.94~2.14,RNA 质量较好,没有降解,可用于反转录,进行后续试验。
2.3.1 干热胁迫对VDE基因表达的影响
逸散紫花苜蓿叶片在正常条件及干热胁迫下MsVDE基因相对表达量的变化不同(图5)。结果表明,在第4 小时至第2 天时,干热胁迫下的MsVDE基因表达量差异均显著低于正常条件(P< 0.05)。从第4 天起至复水后第4 天时的3 个时间段,干热胁迫下MsVDE基因相对表达量均极显著(P< 0.001)高于正常条件,第4 天和第8 天分别比正常条件上调了2.13 倍和1.97 倍。干热处理复水后植株的MsVDE基因表达量虽显著下降(P< 0.05),但仍显著高于胁迫期间的各水平(P< 0.05)。表明短期干热处理并不能促使MsVDE基因表达上调,而干热处理第4 天和第8 天时的MsVDE基因表达量极显著上调(P<0.001),复水后仍极显著高于正常条件(P< 0.001)。

图5 干热胁迫对MsVDE 基因表达的影响Figure 5 Effects of drought and heat stresses on MsVDE gene expression
2.3.2 喷洒DTT 溶液对MsVDE基因表达的影响
正常条件及干热胁迫下,均以DTT 溶液喷洒植株叶片,测定叶黄素循环抑制剂对MsVDE基因相对表达量的影响(图6)。结果显示:除第12 小时和第8 天时,其余时间段干热胁迫下MsVDE基因相对表达量极显著(P< 0.001)低于正常条件。复水后,干热胁迫的植株MsVDE基因表达显著高于正常条件(P< 0.05)。干热胁迫下MsVDE基因表达量的峰值出现在第12 小时,为3.54;正常条件下的峰值出现在第8 小时,为6.07。干热胁迫下MsVDE基因表达量在第2 天至第8 天时都维持在0.53~1.18 的较低水平,这表明喷洒了DTT 溶液的紫花苜蓿在干热胁迫一定时间段内MsVDE基因表达量较正常条件有所下调,平均降低了55%。

图6 喷洒DTT 溶液对MsVDE 基因表达的影响Figure 6 Effects of spraying dithiothreitol solution on MsVDE gene expression
2.3.3 干热胁迫下喷洒DTT 溶液对MsVDE基因表达的影响
干热胁迫下喷洒DTT 溶液与喷洒去离子水植株比较,其MsVDE基因相对表达量变化不同(图7)。结果显示:24 h 内,除第16 小时外,喷洒DTT 溶液相对于喷洒去离子水并未表现出抑制作用。在第2、4、8 天和复水后第4 天时喷洒DTT 溶液较喷洒去离子水MsVDE基因的相对表达量分别下调了72%、42%、86%和68%,存在极显著差异(P< 0.01)。因此,DTT溶液对MsVDE基因表达量只在第2 天后及复水后第4 天表现为平稳的抑制作用,平均下调了67%。
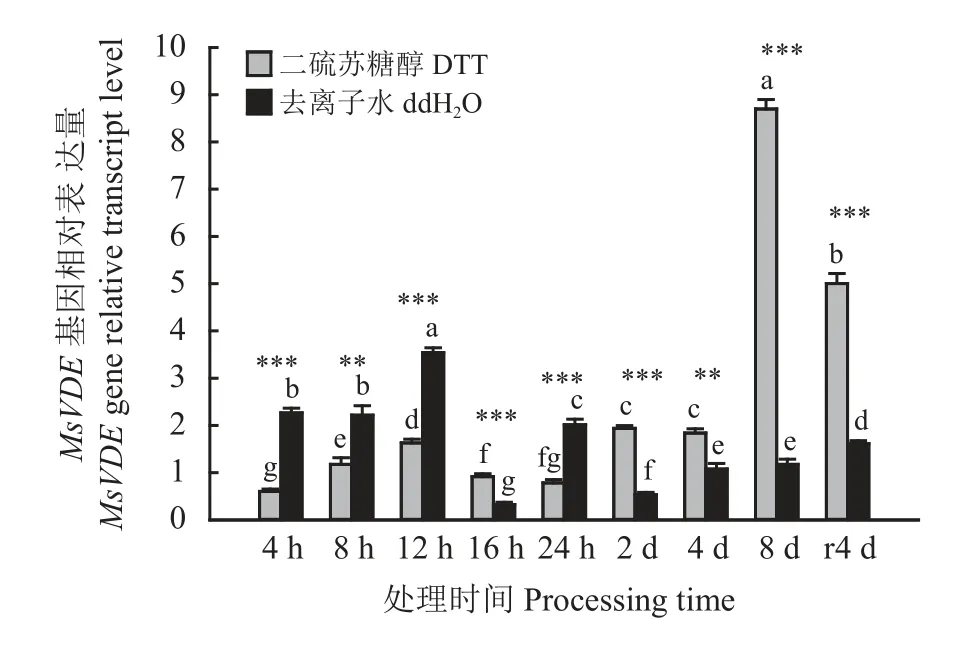
图7 干热胁迫下叶黄素循环抑制剂对MsVDE 基因相对表达量的影响Figure 7 Effects of xanthophyll cycle inhibitors on relative expression of MsVDE gene under drought and heat stresses
3 讨论与结论
高等植物中,VDE基因处于类胡萝卜素合成途径的分枝,迄今为止,未见MsVDE基因与干热胁迫下该基因表达特征的研究报道。本研究从生长在干热河谷地区的逸散紫花苜蓿中克隆了MsVDE基因,通过与豆科及其他植物的序列比对分析,结果表明氨基酸序列具有较高的保守型和相似性。经亚细胞定位预测,结果显示定位于叶绿体,与欧李的ChVDE亚细胞定位一致[24]。Huang 等[15]克隆了生姜的VDE基因,经同源性比对分析与紫花苜蓿和普通小麦比较接近,推导出的GVDE氨基酸序列包含已知VDE的保守特征,具有富含半胱氨酸的结构域和脂质运载蛋白特征。和大多数植物的VDE基因类似,MsVDE基因具有3 个特征区域,即N-端半胱氨酸富集区、脂质运载蛋白特征区和C-端谷氨酸富集区[30],其中,中央脂质运载蛋白结构域是最具特征的。
Rizhsky 等[31]研究表明烟草对两种逆境并存的分子反应与单一逆境反应也明显不同,一些基因的转录在干旱或者高温条件下升高,但是在两种逆境共同胁迫下降低,另外一小部分基因在共同胁迫下转录上调。基因表达也有可能与胁迫强度有关,在对黄瓜的CsVDE克隆研究中表明,光强的变化可改变VDE的表达的模式,弱光条件下与正常光照条件相比,基因表达发生了延迟,而在高强度光照1 h后,CsVDE转录迅速诱导,随后下降。在CsVDE启动子的研究中发现,它是一类新的绿色组织特异性强的植物启动子,它包含基因表达的阳性和阴性调节因子,其活性受激素和非生物胁迫的调节,激素改变了CsVDE启动子的活性,非生物胁迫受吲哚-3-乙酸和赤霉素的正向影响,但受聚乙二醇、脱落酸、水杨酸、甘露醇和氯化钠的负向影响。CsVDE启动子片段的高光响应随处理时间和光强而变化,且发现了高光响应和适宜水平光响应的临界区域[18]。DTT 是强还原剂,可通过阻止VDE的半胱氨酸富集区形成二硫键,从而抑制VDE 蛋白活性[25,32]。二硫化物的减少导致刚性结构的损失,热稳定性降低了15 ℃[33]。通过截断脂质运载蛋白周围的结构域表明,没有C-末端结构域的情况下VDE可能有活性,但在没有N-末端结构域的情况下VDE是不可能有活性的[34]。综合来看,VDE基因的表达可能受光照强度、多种条件共同胁迫、外源制剂或受启动子活性的影响,并可能存在对光响应的临界区域。因此,本研究中紫花苜蓿MsVDE基因的相对表达量受干热共同胁迫、胁迫强度及叶黄素循环抑制剂(DTT)的影响。另外,正常条件下MsVDE表达呈现差异性变化,推测一方面受人工气候箱内光照规律变化的影响,另外一方面有研究表明,叶黄素循环机制对水分有明显地响应[35],本研究每隔4 d 对紫花苜蓿浇一次水,MsVDE表达可能受到了水分变化的影响。
叶黄素循环的脱环氧化和环氧化过程是双向的,其环氧化过程对叶黄素循环同样有调控作用。Bethmann 等[36]报告了豌豆(Pisum sativum)、拟南芥、本氏烟草(Nicotiana benthamiana)和菠菜(Spinacia oleracea) 4 种植物叶片随光抑制增强,玉米黄质环氧化酶(ZEP)活性逐渐下降,ZEP 和D1 蛋白降解是一种光保护机制。在碳酸钠胁迫下VDE 和ZEP 的表达下调,叶黄素循环受到抑制[37]。Xie 等[38]采用水杨醛肟(SA)抑制石莼(Ulva lactuca)的ZEP 活性,然后用各种代谢抑制剂在弱光和黑暗条件下表征VDE 活性。VDE 和ZEP 在植物体内具有拮抗作用,体内VDE 活性往往因ZEP 的存在而受阻,因此,使用抑制剂抑制ZEP 可能是表征体内VDE 活性的另一种方法。在中等光照条件下,由于ZEP 与VDE 持续循环,当用水杨酸(salicylaldoxime, SA)抑制ZEP催化叶黄素循环的反向反应时,即使在很低的光强下,A 和Z 也发生了明显的积累,保护紫花苜蓿免受热损伤。ZEP 是脱落酸合成途径中的关键酶,而脱落酸途径与植物抗逆性相关[39],在西红柿中当ZEP 过量表达会增加对强光的敏感性[40]。ZEP 与VDE 基因之间是否存在互作效应?另外,基因与环境相互作用对于种群和如何应对不可预测的环境至关重要[41],这些问题的阐明对调控叶黄素循环关键酶作用的分子机制、丰富和发展紫花苜蓿光合作用理论同样重要。
本研究利用RACE 技术首次从逸散紫花苜蓿中成功克隆到MsVDE基因,cDNA 全长1 678 bp,CDS编码区1 608 bp,编码535 个氨基酸,GenBank 登录号为MW883184。经预测,其编码蛋白质的分子质量60.79 kDa,等电点为5.94,该蛋白不稳定,属于亲水性蛋白,不存在跨膜结构域。干热胁迫及喷洒叶黄素循环抑制剂后,通过实时荧光定量分析,初步确定云南逸散紫花苜蓿的MsVDE基因在调控叶黄素循环应对干热胁迫中起作用,为进一步阐明干热胁迫下叶黄素循环对逸散紫花苜蓿的光保护作用奠定了基础。
