毛果杨ZHD家族全基因组水平鉴定及在干旱胁迫下的表达分析
2022-06-28陈雪冰姜廷波夏德安魏志刚
陈雪冰,刘 聪,程 赫,姜廷波,夏德安,魏志刚
(1. 东北林业大学 林木遗传育种国家重点实验室,黑龙江 哈尔滨 150000;2. 中国林业科学研究院 国家林业和草原局盐碱地研究中心,北京 100091)
植物在生长发育过程中会通过不断调整基因的表达来适应各种逆境,而转录因子(TFs)是其调控过程的关键因子[1]。研究表明:锌指同源结构域(ZF-HD)转录因子作为一种同源异形盒(HB)蛋白在调控植物生长发育以及响应多种生物和非生物胁迫方面发挥着重要作用[2-3]。ZF-HD不仅具有同源结构域(HD),还包括1个高度保守的锌指结构域(ZF)[4],ZF是由2对保守的半胱氨酸(Cys)和/或组氨酸(His)残基结合单个锌离子组成的指环状结构蛋白,可特异性与DNA/RNA序列结合,并参与蛋白质互作[2,5];HD是1个约60个氨基酸的DNA结合域(DBD),这段序列折叠成一个识别螺旋附着在DNA的大沟上,特异性地结合DNA来激活或抑制靶基因的表达[6]。为了方便研究该家族的进化史,HU等[7]将ZFHD重新命名为ZHD。
ZHD蛋白可分ZHD和小锌指(MIF)两类,两者都含有ZF结构域,但MIF缺少HD结构域[8]。2001年ZHD首次在黄花菊Flaveria trinervia中被鉴定出来[9],随后拟南芥Arabidopsis thaliana[10]、水稻Oryza sativa[11]、葡萄 Vitis vinifera[8]、大白菜 Brassica rapa ssp. pekinensis[2]、番茄 Solanum lycopersicum[3]、茶树Camellia sinensis[5]和黄瓜Cucumis sativus[12]等的ZHD被陆续发现。研究表明:ZHD能够调控植物的抗逆性,如过表达AtZHD1可以提高拟南芥的耐旱性[13];OsZHD1基因过表达导致水稻叶片卷曲下垂,降低水稻的耐旱性[14];在大豆Glycine max中,过表达GmZF-HD1和GmZF-HD2会与编码钙调蛋白的GmGaM4基因启动子结合增强大豆的抗病能力[15];TaZFHD1参与小麦Triticum aestivum生长发育过程中茉莉酸(JA)、脱落酸(ABA)和乙烯(ET)信号转导过程,调节小麦对胁迫的抗性[16];大白菜中的BraZF-HD受光、低温等非生物胁迫诱导表达[2];此外,水稻ZHDs与OsDREB1B基因的启动子结合调节水稻对低温、干旱和机械损伤的抗性[17]。ZHD广泛存在于植物中,在植物对环境胁迫响应过程中起着重要的作用。
毛果杨Populus trichocarpa是研究木本植物生长发育、材质材性以及抗逆性状的重要模式植物,但是目前毛果杨ZHD (PtrZHD)家族及非生物胁迫响应特性的研究尚无报道。本研究通过生物信息学手段鉴定了毛果杨全基因组内的PtrZHDs基因,并对其编码蛋白特征、系统发育、基因扩张、基因结构与保守基序、启动子顺式作用元件和表达特性进行分析,为研究该家族基因的功能提供科学依据。
1 材料与方法
1.1 材料
将来自中国科学院分子植物科学卓越创新中心的野生型毛果杨‘Nisqually-1’通过组织培养扩繁后,选取长势一致的4周龄组培苗随机分成6组,用质量分数为8%的聚乙二醇(PEG 6 000,来自邢台鑫蓝星科技有限公司)水溶液处理0、3、12、24、48和72 h,分别采集各处理组植株的根、茎和叶部组织,经液氮速冻后保存于-80 ℃冰箱,每组处理重复3次。
1.2 PtrZHD家族成员鉴定及理化性质分析
利用拟南芥ZHD家族成员的氨基酸序列比对Phytozome (https://phytozome.jgi.doe.gov/pz/portal.html)网站中毛果杨基因组数据库获得候选序列,将得到的序列上传到Pfam (http://pfam.xfam.org/)和SMART(http://smart.embl-heidelberg.de/)数据库,去除不含ZF-HD_dimer (PF04770)结构域的序列得到全部的PtrZHDs[12]。从Phytozome数据库中获取PtrZHD家族基因的染色体位置、基因序列以及开放阅读框长度等信息,并根据基因所在染色体号及位置对其进行命名。在ExPasy (https://web.expasy.org/protparam/)网站预测PtrZHD家族分子质量、等电点和氨基酸序列长度。
1.3 PtrZHD 家族系统发育分析
将鉴定出的毛果杨ZHD氨基酸序列与已知的拟南芥[10]、水稻[11]和大白菜[2]的ZHD氨基酸序列在MEGA X软件的ClustaW程序中进行多重序列比对,采用邻近法(NJ)构建系统进化树,步长设为10 000次,得到系统发育进化树数据[18],经EvolView(https://www.evolgenius.info/ evolview/)网站可视化。
1.4 PtrZHD家族同源基因的同义替换率(Ks)和非同义替换率(Ka)分析
将PtrZHD家族基因的蛋白质编码序列(CDs)在美国国家生物信息中心(NCBI)网站(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行BLAST比对,以超过300 bp且同源性超过80%为标准鉴定同源基因对[19],同源关系经TBtools[20]软件可视化。利用TBtools计算同源基因的Ks、Ka以及Ka/Ks[20-21]。
1.5 PtrZHD家族结构及保守型基序分析
从毛果杨数据库(https://genome.jgi.doe.gov/portal/pages/dynamicOrganismDownload.jsf?organism=Ptrichocarpa)获得PtrZHD外显子和内含子长度及位置信息,并通过TBtools软件可视化。使用MEME(https://meme-suite.org/meme/tools/meme)网站对PtrZHD家族进行保守基序分析,保守域数目设置为15,结果由TBtools软件可视化。
1.6 PtrZHD家族启动子区顺式作用元件分析
利用TBtools软件从毛果杨基因组数据中提取PtrZHD家族起始密码子前2 000 bp的序列作为启动子区域,上传至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)网站进行顺式作用元件分析[22],获得的数据通过TBtools软件可视化。
1.7 PtrZHD家族表达特性分析
1.7.1 组织表达特异性 将野生型毛果杨通过组织培养扩繁后,挑选长势一致的4周龄组培苗,分别采集根、茎和叶组织,提取RNA后反转录成cDNA,用于实时荧光定量PCR (qRT-PCR)分析。每组处理重复3次,采用2-ΔΔCT法计算相对表达量,并通过TBtools软件可视化。
1.7.2 干旱胁迫下的响应特性 将长势一致的1月龄组培苗随机分成6组。用质量分数为8%的PEG 6000处理0、6、12、24、48和72 h。分别采集各处理组植株的根、茎和叶组织,提取RNA后反转录成cDNA进行qRT-PCR分析。每组处理重复3次,采用 2-ΔΔCt法计算相对表达量,并通过TBtools软件可视化。
1.7.3 RNA提取、反转录及qRT-PCR分析 利用植物总RNA试剂盒(TSP412,北京擎科生物科技有限公司)提取总 RNA,然后采用 PrimeScriptTMRT reagent Kit [Perfect Real Time,宝生物工程 (大连)有限公司] 试剂盒反转录RNA,获得cDNA后进行qRT-PCR分析。将PtrZHD家族蛋白质编码区序列上传至上海生工定量引物设计网站(https://www.sangon.com/new PrimerDesign)设计定量引物,以PtrActin为内参基因[19]。在赛默飞 ABI 7 500 荧光定量 PCR 仪上进行试验,体系如下:2×TransStart TOP/Tip Green qPCR Super mix 10 μL、定量引物上下游混合引物 (10 μmol·L-1) 0.4 μL、cDNA 1.5 μL,Passive Reference DyeⅡ(50×) 0.4 μL,加去离子水补充至 20 μL 体系。反应程序:94 ℃ 预变性 30 s;94 ℃ 变性 5 s,60 ℃ 退火 15 s,72 ℃ 延伸 35 s,40 次循环。
2 结果与分析
2.1 PtrZHD家族成员的鉴定及编码蛋白的基本特征
将所有含ZF-HD_dimer (PF04770)结构域的序列上传到Pfam和SMART数据库,去除冗余序列后从毛果杨基因组中鉴定出21个PtrZHD (表1),根据基因所在染色体及染色体上的位置信息,将它们分别命名为PtrZHD1~PtrZHD21。PtrZHD家族基因编码蛋白的基本特征分析表明:各PtrZHD所编码蛋白的长度为 73~339 个、分子量为 8.28~37.98 kDa、等电点为 6.39~9.31、编码序列长度为 222~1 020 bp,蛋白长度、分子量、等电点和编码序列长度差异明显。表明PtrZHD家族基因及其编码蛋白特征存在较大差异,即该家族各个成员的生物学功能发生了分化。

表1 毛果杨 ZHD家族基因概况Table 1 Overview of ZHD gene family in P. trichocarpa
2.2 PtrZHD 家族的进化
利用双子叶植物(拟南芥、毛果杨和大白菜)与单子叶植物(水稻)的ZHD蛋白序列构建系统进化树(图 1),PtrZHD 家族分为 2 个种类 (ZHD 和 MIF),这 2 个种类可以分成 7 个亚族 (Ⅰ~Ⅶ)[5,8,12],PtrZHD不同亚族中即包括单子叶植物又包括双子叶植物,表明该基因家族的分化早于单双子叶植物的分化。

图1 毛果杨、拟南芥、水稻和大白菜ZHD家族系统进化树Figure 1 Phylogenetic tree of ZHD protein family in P. trichocarpa, A. thaliana , O. sativa and B. rapa ssp. pekinensis
2.3 PtrZHD家族的扩张
PtrZHD家族成员在毛果杨染色体上的分布(图2)显示:21个PtrZHD不均匀地分布在毛果杨12条染色体上;4、5号染色体上分别分布4和3个ZHD,2、3、17和19号染色体上各分布2个ZHD,7、8、10、12、13和15号染色体上只分布1个ZHD,1、6、9、11、14、16和18号染色体上无ZHD分布。PtrZHD家族编码序列Blast结果表明:PtrZHD1和PtrZHD11、PtrZHD2和PtrZHD10、PtrZHD3和PtrZHD8、PtrZHD5和PtrZHD19、PtrZHD6和PtrZHD18、PtrZHD9和PtrZHD12、PtrZHD13和PtrZHD14以及PtrZHD15和PtrZHD17有共线性关系(图2和表2),同源片段长度大于300 bp且同源性超过80%,是进化过程中由于全基因组复制和串联复制而形成的同源基因[3,22],表明PtrZHD可能通过全基因组复制和串联复制进行家族扩张。8对同源基因的Ka/Ks均小于1(表2),说明PtrZHD家族在进化过程中经历了纯化选择,留存的基因较为保守[3]。

图2 PtrZHD 家族基因染色体定位及同源性分析Figure 2 Chromosome localization and homology analysis of PtrZHD gene

表2 同源基因的 Ka/Ks 及同源性Table 2 Ka/Ks values and homologous status of homologous genes
2.4 PtrZHD家族基因结构及其编码蛋白保守基序
PtrZHD家族21个成员中有11个成员含有内含子(图3B),这与之前报道的其他物种ZHD家族中有内含子的成员数量较少的研究结果稍有不同[5,12]。PtrZHD蛋白具有2个保守性较高的基序:同源结构域序列 (Motif 1)和锌指结构域序列 (Motif 2)(图 3C)。Motif 2 与 DNA 的特异性结合有关;Motif 1 与蛋白二聚体的形成有关[7]。所有的PtrZHD蛋白都具有Motif 1,而且除了PtrZHD4和亚族Ⅴ(MIF)的成员之外,其他家族成员都含Motif 2,说明该家族成员在进化过程中比较保守。

图3 PtrZHD 家族基因结构和蛋白保守基序分析Figure 3 Analysis of gene structure and protein conserved motif of PtrZHD gene
2.5 PtrZHD家族启动子区顺式作用元件
PtrZHD家族启动子区顺式作用元件可分为2个大类(图4):第一大类为植物激素响应元件,共有5种,分别为生长素响应元件(AuxRR-core、TGA-element),水杨酸响应元件(TCA-element),茉莉酸甲酯响应元件(CGTC-motif、TGACG-motif),脱落酸响应元件(ABRE)和赤霉素响应元件(P-box、GARE-motif);第二大类为非生物胁迫响应元件,共有4种,分别为厌氧诱导元件(ARE)、干旱诱导性结合位点(MBS)、抗病和胁迫诱导元件(TC-rich repeats)和低温响应元件(LTR)。PtrZHD家族各基因启动子区存在不同类型的作用元件,但处于同一亚族的各基因含有相似的作用元件(图4),亚族Ⅰ主要包含茉莉酸甲酯响应元件、脱落酸响应元件、赤霉素响应元件和厌氧诱导元件;亚族Ⅱ主要包含水杨酸响应元件和茉莉酸甲酯响应元件;亚族Ⅲ主要包含厌氧诱导元件、MYB干旱诱导性结合位点以及抗病和胁迫诱导元件;亚族Ⅳ主要包含生长素响应元件,水杨酸响应元件,茉莉酸甲酯响应元件,脱落酸响应元件和厌氧诱导元件;亚族Ⅴ主要包含水杨酸响应元件、赤霉素响应元件、厌氧诱导元件和MYB干旱诱导性结合位点;亚族Ⅵ主要包含茉莉酸甲酯响应元件、厌氧诱导元件、MYB干旱诱导性结合位点和低温响应元件;亚族Ⅶ主要包含水杨酸响应元件、茉莉酸甲酯响应元件和厌氧诱导元件。以上结果说明:PtrZHD家族可能对植物激素和逆境胁迫有响应能力,虽然不同基因之间响应元件种类存在差异,但是同一亚族基因启动子区顺式作用元件种类基本相同。

图4 PtrZHD 家族基因启动子区顺式作用元件分析Figure 4 Analysis of cis-acting elements in promoter region of PtrZHD gene
2.6 PtrZHD家族组织表达与干旱胁迫响应特征
为了了解ZHD在毛果杨生长发育和环境响应中的潜在功能,利用qRT-PCR对毛果杨ZHD家族成员在根、茎和叶组织中的表达模式进行分析。结果(图5)表明:毛果杨21个PtrZHDs中有1、7和13个分别在根、茎和叶部组织偏好表达。亚族Ⅰ和Ⅲ的成员主要在叶中高表达;亚族Ⅱ和Ⅳ的成员全都在叶中高表达;亚族Ⅴ成员主要在茎中高表达;亚族Ⅵ成员主要在茎和叶中高表达;亚族Ⅶ成员在茎中高表达。毛果杨ZHD家族成员在根、茎和叶中有不同的表达特性,但同一亚族各成员偏好表达部位基本相同,说明ZHD在毛果杨根、茎和叶部组织中的生物学功能产生了分化,但同一亚族各成员功能相似。
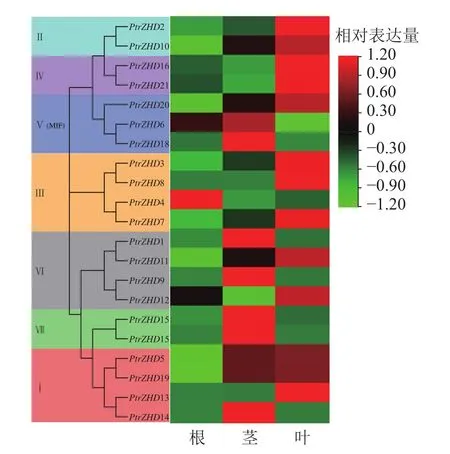
图5 PtrZHDs 组织表达特异性分析Figure 5 Analysis of tissue expression specificity of PtrZHDs gene
从图6可知:在根中,随着干旱胁迫时间的增加,部分PtrZHD的表达量显著上调,达到峰值后逐渐降低,PtrZHD3、PtrZHD8、PtrZHD9、PtrZHD10、PtrZHD11、PtrZHD5、PtrZHD13和PtrZHD14在干旱胁迫下表达量呈持续上升趋势,PtrZHD1、PtrZHD6在干旱胁迫下表达量下降;在茎中,大部分PtrZHD在干旱胁迫后显著上调表达,达到峰值后逐渐降低,而PtrZHD2、PtrZHD3、PtrZHD5、PtrZHD6和PtrZHD7在干旱胁迫下表达量呈持续上升趋势;在叶中,大部分PtrZHD在干旱胁迫后表达量同样呈先升后降的趋势,PtrZHD5、PtrZHD7和PtrZHD20在干旱胁迫下表达量持续下降,而PtrZHD1和PtrZHD18在干旱胁迫下表达量呈持续上升趋势。从响应速度来看,根中大部分PtrZHD基因响应干旱胁迫的快速上升期发生在6、12或72 h,而在茎和叶中的快速上升期发生在6或12 h。表明毛果杨ZHD家族各成员响应干旱胁迫且在胁迫中发挥不同的作用。

图6 不同组织中 PtrZHDs 在干旱胁迫下的表达谱分析Figure 6 Expression profile analysis of PtrZHDs gene in different tissues under drought stress
3 讨论
ZHD是植物特有的转录因子,在植物生长发育和逆境胁迫响应中起着重要作用[6,15]。本研究从全基因水平鉴定出21个PtrZHDs家族成员,进化分析表明(图1):21个PtrZHDs可以分为2个不同的种类(ZHD和MIF)、7个亚族(Ⅰ~Ⅶ),这与葡萄[8]、茶树[5]和黄瓜[12]中的分类基本一致。
PtrZHD家族有76%的成员涉及全基因组复制和串联复制现象,说明该基因家族扩张的主要方式是全基因组复制和串联复制[22-23],基因复制可以提供丰富的遗传物质有助于毛果杨适应外界环境。PtrZHD家族同源基因的Ka/Ks均小于1,表明纯化作用在该基因家族进化过程中存在一定的选择压力[3],说明PtrZHD家族基因具有较强的保守性。同时,PtrZHD家族基因编码蛋白保守基序分析发现:21个PtrZHD蛋白具有2个保守性较高的基序Motif 1和Motif 2,进一步说明PtrZHD家族在进化过程中较为保守。
启动子分析发现:虽然PtrZHD家族启动子区顺式作用元件的种类不同,但处于同一亚族基因启动子区顺式作用元件类型基本相同,同时,同一亚族基因编码蛋白的保守基序也基本相同,表明PtrZHD家族不同亚族的生物学功能产生了分化,但同一亚族各基因的生物学功能基本相同;PtrZHD家族成员在毛果杨根、茎和叶部组织中具有偏好性表达特征,但同一亚族基因的偏好表达部位基本相同。
毛果杨中具有内含子的ZHD占比(52%)多于拟南芥(0%)[2]、水稻(33%)[24]、玉米Zea mays(13%)[24]、黄瓜(38%)[14]、苦荞麦Fagopyrum tataricum (20%)[25]、大白菜(3%)[2]和番茄(4%)[3]等草本植物,内含子增多可以加大转录本的多样性,提高生物的抗逆能力[26]。因此,毛果杨ZHD的内含子比草本植物多的原因可能是毛果杨生命周期长、生存空间大,需要应对更为复杂的环境挑战,所以进化出了更多含有内含子的基因以保证其正常生长发育。
ZHD能够调控植物的生长发育和对干旱胁迫的抗性,如过表达AtZHD1可以提高拟南芥的耐旱性[13],OsZHD1基因过表达导致水稻叶片卷曲下垂,降低水稻的耐旱性[14];毛果杨亚族Ⅱ中的PtrZHD2、PtrZHD10与AtZHD1、OsZHD1聚类在一起,且同时在叶部组织中高表达,表明PtrZHD2和PtrZHD10可能通过调控毛果杨叶片的生长发育来响应干旱胁迫的。生物在遭受胁迫时,基因的相关顺势作用元件会影响其自身的转录以响应胁迫[27],PtrZHD家族基因启动子区含有MYB干旱诱导性结合位点,而且PtrZHD家族基因在干旱胁迫下的表达量会随着胁迫时间的增加而发生变化,进一步说明在毛果杨干旱胁迫的响应中,PtrZHD家族基因发挥着重要的调控作用。
4 结论
本研究在全基因组水平上鉴定出21个PtrZHDs,通过系统发育将其分为7个亚族;同源性及Ka、Ks分析表明:PtrZHD通过全基因组复制和串联复制进行家族扩张且在进化过程中经历了纯化选择;启动子顺式作用元件分析表明:PtrZHD家族基因能够响应干旱胁迫信号;基因结构和基序分析表明:PtrZHD家族基因功能发生了分化但同一亚族基因生物学功能基本相同;组织表达特异性和干旱胁迫下的表达模式表明:毛果杨ZHD在不同组织中行使特定的生物学功能且能够响应干旱胁迫。
