传统乳制品中乳酸菌的筛选及发酵性能研究
2022-06-23刘绒梅孙金威吕雪鹏罗力文徐飞鸿魏枫染李启明
刘绒梅,高 达,孙金威,吕雪鹏,曹 珺,罗力文,徐飞鸿,魏枫染,李启明,3*
(1.新希望乳业股份有限公司,四川 成都 610063;2.乳品营养与功能四川省重点实验室,四川 成都 610063;3.四川省优质乳品制备与质量控制技术工程实验室,四川 成都 610063)
发酵乳是以生牛(羊)乳或乳粉为原料,经杀菌、发酵后制成的pH值降低的产品[1]。嗜热链球菌(Streptococcus thermophilus)作为发酵乳最关键的发酵剂之一,在乳制品发酵和贮藏过程中具有重要作用。嗜热链球菌具备很强的产胞外多糖(exopolysaccharides,EPS)的能力,赋予产品细腻顺滑的口感[2-4],发酵过程中能产生一些风味物质,如乙醛和双乙酰等[5-6],赋予产品特有的香气。嗜热链球菌通过β-半乳糖苷酶水解牛乳中的乳糖产生葡萄糖和半乳糖,在与保加利亚乳杆菌(Lactobacillus bulgaricus)协同发酵时优先发酵,产生小分子代谢产物并降低乳pH值,进而促进保加利亚乳杆菌的发酵[7-9]。
国外一些企业拥有菌种资源库和先进的菌种生产技术[10-11],而国内乳制品行业所用菌种基本依赖于进口,具有知识产权的优良嗜热链球菌及相关加工技术更是几乎被国外垄断[6]。王丽婷[12]指出,早在19世纪末20世纪初,国外科学家就开始研究酸奶发酵剂并逐步实现商业化生产,同时涌现出了一批知名发酵剂制造商,如丹麦的Hansen、美国的Daniske、荷兰的Nizo等,他们生产的发酵剂性能优良,已遍布世界各地的乳品企业。而国内乳品工业起步于20世纪初,关于乳酸菌发酵剂的研究落后西方国家几十年。因此,亟需筛选具有自主知识产权的优良发酵菌种用于国内乳制品的开发。
中国传统乳制品丰富多样,如宫廷奶酪、马奶酒、双皮乳、酥油、曲拉、乳扇等为优良嗜热链球菌的筛选提供了菌株资源保障[13-15],ZHAO J等[16]研究的185株嗜热链球菌大多分离自中国的天然发酵乳制品;张志伟等[17]通过对分离自新疆地区传统酸奶的20株嗜热链球菌进行研究,筛选出一株发酵性能较好的嗜热链球菌QLMCC19;王凡等[18]从甘南州藏族传统发酵乳中筛选了一株高产胞外多糖的嗜热链球菌MN-002。
本研究采用传统培养方法从22个传统发酵乳样品中分离乳酸菌,将分离菌株制备发酵乳,通过感官评分筛选菌株,采用形态学观察、16S rDNA序列分析对筛选菌株进行鉴定,并测定其生长性能、产酸性能及其制备发酵乳贮藏期内的品质变化,以期获得具有优良发酵性能的菌株,为国内发酵乳制品的开发提供良好的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 发酵乳样品来源
22个传统发酵乳样品:新疆喀什,四川稻城、理塘,内蒙古,青海等地牧民家;生牛乳(蛋白质3.1~3.3 g/100 g;脂肪3.6~3.8 g/100 g;碳水化合物4.5~4.6 g/100 g)、白砂糖(食品级):四川新华西乳业有限公司。
1.1.2 试剂
Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、2×SanTaq聚合酶链式反应(polymerase chain reaction,PCR)Mix预混液(含蓝染料)、16S通用引物27F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′):生工生物工程(上海)股份有限公司;革兰氏染色液:广州环凯微生物科技有限公司。
1.1.3 培养基
MRS琼脂培养基:广东环凯生物科技有限公司;M17液体培养基:青岛海博生物科技有限公司。
1.2 仪器与设备
BBS-DDC医用洁净工作台:济南鑫贝西生物技术有限公司;INC821C两槽式恒温培养箱:雅马拓科技贸易(上海)有限公司;UPT-I-10T超纯水机:成都超纯科技有限公司;MLS-3020高压灭菌锅:松下电器(中国)有限公司;FiveEasy Plus pH计、T5电位滴定仪:梅特勒-托利多仪器(上海)有限公司;Bioscreen-C全自动生长曲线分析仪:芬兰Oy Growth Curves Ab公司;FlexCycler2双槽聚合酶链式反应(PCR)仪:德国耶拿分析仪器股份公司;ICINAC16型酸化监控仪:法国AMS-Alliance公司;LVDV-S黏度计:美国博勒飞公司;Bx43显微镜:日本OLYMPUS公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
取1.0 g传统发酵乳样品于装有9.0 mL无菌生理盐水的试管中充分振荡,10倍梯度稀释,取100 μL 10-4~10-6梯度稀释的菌液涂布于MRS琼脂平板上,37 ℃静置培养48 h后肉眼观察,挑取不同形态和大小的单菌落,平板划线纯化3次,将纯化得到的单菌落转移至M17液体培养基37 ℃静置培养18~24 h后,菌液和60%甘油按1∶1比例置于2 mL冻存管后于-20 ℃冰箱保藏,备用。
1.3.2 优良乳酸菌的筛选
(1)发酵乳的加工工艺流程
配料(930 g生牛乳中,加入70 g白砂糖)→均质(60~65 ℃,20~25 MPa)→巴氏杀菌(90~95 ℃,5~10 min)→冷却至42℃→接种(方法1.3.1分离纯化的菌株分别按107CFU/g的接种量接种)→42 ℃发酵(pH值为4.40~4.60时终止发酵)→破乳(无菌玻璃棒搅拌至均一状态)→后熟(4~6 ℃,12~24 h)→发酵乳成品
(2)发酵乳的感官品评
由新希望乳业科技研究院的10名专业酸奶研发师组成感官品评团队,对单株乳酸菌制备的发酵乳进行品评,具体评分方法参见中国乳制品工业行业规范RHB 104—2020《发酵乳感官评鉴细则》,分别对发酵乳的色泽、滋味和气味、组织状态进行品评,满分为100分。筛选得分较高的菌株继续研究,发酵乳评分标准见表1。

表1 发酵乳感官评分标准Table 1 Sensory scoring criteria of fermented milk
(3)优良发酵用乳酸菌的鉴定
形态学观察[19]:观察筛选菌株单菌落的色泽、大小,并进行革兰氏染色。
分子生物学鉴定:采用细菌基因组DNA快速抽提试剂盒提取菌株DNA,选取细菌通用引物27F/1492R通过聚合酶链式反应(PCR)扩增菌株基因组DNA的16S rDNA,PCR扩增体系(25 μL):2×SanTaqPCR Mix 预混液12.5 μL,上下游引物各1 μL,模板DNA 1~2 μL,加双蒸水(ddH2O)至终体积。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1.5 min,共30个循环,72 ℃延伸10 min。测序由生工生物工程(上海)股份有限公司完成,将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库,通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行比对搜索,选择与待测物种序列相似性最大的同源序列,采用MEGA X生物学软件的邻接法(neighbor-joining,NJ)构建系统发育树,鉴定分离菌株。
1.3.3 优良乳酸菌的特性研究
(1)优良乳酸菌生长曲线及产酸曲线的测定
将筛选的菌株置于M17液体培养基中于37 ℃静置培养16 h,重复三次以获得活性较好的菌株,将活化后的菌株以2%(V/V)的接种量接种至M17液体培养基,置于42 ℃静置培养16 h,每隔30 min取样,测定各菌株发酵液的OD600nm值,绘制筛选菌株的生长曲线;将筛选菌株按发酵乳的加工工艺流程制备发酵乳,每隔10 min取样,测定各发酵乳的pH值,绘制产酸曲线。
(2)优良乳酸菌制备的发酵乳贮藏期特性
将筛选乳酸菌制备的发酵乳分别在4 ℃、15 ℃及30 ℃条件下贮藏21 d,每周一次测定其酸度、乳酸菌活菌数变化。
1.3.4 分析检测
发酵乳的黏度:采用黏度计直接测定,参数设定为64号转子,转速20 r/min,时间30 s。
发酵乳的酸度和pH:参考GB 5009.239—2016《食品安全国家标准食品酸度的测定》测定酸度;采用pH计测定pH值[20]。
活菌数的测定:参考GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》[21]。
1.3.5 数据处理
试验结果采用Excel 2019对实验数据进行处理。
2 结果与分析
2.1 乳酸菌的分离、筛选及鉴定
2.1.1 乳酸菌的分离及初筛
经MRS乳酸菌半选择性固体平板培养,从22个样品中共分离纯化得到菌株67株。代表菌株的菌落形态和细胞形态见图1。由图1A可知,代表菌株的菌落较小,在MRS平板上呈乳白色;由图1B可知,革兰氏染色后呈紫色,为革兰氏阳性菌,细胞形态为圆形或椭圆形,呈对或链状排列。

图1 代表菌株的菌落形态(A)和细胞形态(B)Fig. 1 Colony (A) and cell(B) morphology of the representative strains
2.1.2 优良乳酸菌的复筛
用分离纯化的67株菌株分别制备发酵乳,其中有12株发酵酸度至70°T所用时间>12 h,对其余55株菌制备的发酵乳进行感官品评,将得分>85分的5株乳酸菌分别命名为菌株C-1、Q164、Q165、Q166和Q167,其分别制备的发酵乳感官品评描述和得分见表2。由表2可知,筛选菌株制备的发酵乳感官评分均>86分。

表2 5株优良乳酸菌制备的酸奶感官品评和得分Table 2 Sensory evaluation and score of yogurt prepared by 5 strains of excellent lactic acid bacteria
2.1.3 优良乳酸菌的分子生物学鉴定
以上述5株菌株的16S rDNA为模板进行PCR扩增,PCR扩增产物的琼脂糖凝胶电泳图如图2所示。由图2可知,5株乳酸菌扩增的条带明亮、PCR扩增产物碱基长度在1 500 bp左右。

图2 5株乳酸菌的16S rDNA RCR产物琼脂糖凝胶电泳图Fig. 2 Agarose gel electrophoresis of 16S rDNA RCR products of 5 strains of lactic acid bacteria
测序结果经BLAST比对,选取与菌株同源性>99%作为模式菌种,结果见表3。由表3可知,筛选的5株菌与嗜热链球菌标准菌株相似度>99.5%。根据菌株的菌落特征及显微观察特征以及16S rDNA序列结果,将5株菌株分别鉴定并命名为嗜热链球菌(Streptococcus thermophilus)Q164、嗜热链球菌(Streptococcus thermophilus)Q165、嗜热链球菌(Streptococcus thermophilus)Q166、嗜热链球菌(Strep tococcus thermophilus)Q167、嗜热链球菌(Streptococcus thermophilus)C-1。

表3 乳酸菌16S rDNA序列比对结果Table 3 Results of 16S rDNA sequence alignment of lactic acid bacteria
2.1.4 系统发育树的构建
利用MEGA X软件构建的16S rDNA基因系统进化树见图3。由图3可知,菌株Q164、Q165、Q166、Q167、C-1的亲缘关系相同,均为嗜热链球菌(Streptococcus thermophilus),与16S rDNA鉴定结果一致。

图3 基于16S rDNA基因序列筛选菌株的系统发育树Fig. 3 Phylogenetic tree of screened strains based on 16S rDNA gene sequences
2.2 优良嗜热链球菌的发酵特性研究
2.2.1 嗜热链球菌生长曲线及产酸曲线
筛选的5株嗜热链球菌的生长曲线和产酸曲线分别见图4和图5。
由图4可知,5株菌株的生长趋势一致,迟滞期为在1 h之内,菌株生长缓慢;随即进入对数期,菌株快速生长;5 h后菌株生长趋于稳定。菌株C-1进入对数期和稳定期的时间比其余4株菌晚1~2 h,菌株Q165在稳定期的OD600nm值高于其余4株菌。
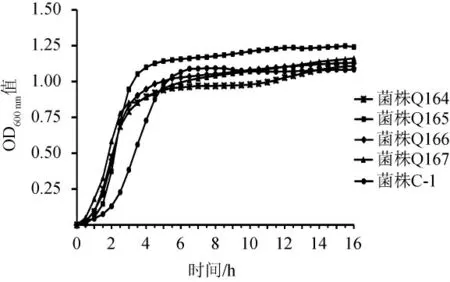
图4 5株嗜热链球菌的生长曲线Fig. 4 Growth curves of 5 strains of Streptococcus thermophilus
由图5可知,培养时间在3 h内,在不同发酵乳样品中,5株菌产酸速率较快,在6 h后进入稳定期,产酸趋于稳定。以上结果表明,筛选的5株嗜热链球菌的生长速率和产酸速率满足发酵乳用菌株的需求。

图5 5株嗜热链球菌的产酸曲线Fig. 5 Acid production curve of 5 strains of Streptococcus thermophilus
2.2.2 发酵乳黏度的测定结果
5株嗜热链球菌分别制备的发酵乳黏度检测结果表明,菌株Q167发酵乳黏度最高,为7 200 mPa·s,其余四株菌Q164、Q165、Q166和C-1发酵乳黏度依次为4 030 mPa·s、6 750 mPa·s、3 330 mPa·s和5 460 mPa·s。
2.2.3 发酵乳贮藏期内酸度及活菌数变化
发酵乳酸度是衡量消费者对货架期内产品接受程度的重要指标[22-23]。乳酸菌活菌数一定程度上可以反映发酵乳的新鲜度和品质[24],随货架期的延长,产品中乳酸菌数呈递减趋势,而且这种趋势随着贮藏温度的升高而增加[25]。5株嗜热链球菌制备的发酵乳在不同温度下贮藏期的酸度及活菌数变化见表4。
由表4可知,随着贮藏期的延长,三种贮藏温度条件下发酵乳的酸度出现不同程度的升高;4 ℃贮藏时,菌株Q164、Q166和C-1发酵乳酸度上升趋势不明显,尤其是菌株Q164和C-1,贮藏期内酸度增加<5°T,李海燕等[23]研究的弱后酸发酵剂YT-A产品4 ℃冷藏20 d后酸度上升了9°T。15 ℃贮藏时,5种发酵乳前7 d酸度升高幅度较大,后期变化相对平稳,菌株Q166和C-1的发酵乳酸度升高均<15°T;30 ℃贮藏时,5种发酵乳前7 d酸度升高幅度明显,30 ℃贮藏7 d后,5种发酵乳的酸度变化趋于稳定,不再增加;菌株C-1的发酵乳于15 ℃和30 ℃贮藏时,酸度变化趋势基本一致。我国部分地区冷链运输系统不发达,发酵乳制品贮藏和运输过程中会产生不同程度的后酸化,后酸化又是导致产品质量变差的重要因素之一。后酸化会导致产品出现消费者不可接受的过酸味[26-27]。后酸化一定程度上制约着我国酸奶的发展,筛选优良弱后酸化的菌株是解决酸奶后酸化问题的最好方法[26]。结果表明,嗜热链球菌C-1具备优良弱后酸化发酵菌株的潜力。

表4 5种发酵乳贮藏期内酸度及活菌数变化Table 4 Changes of acidity and viable count of 5 kinds of fermented milk during storage
由表4可知,5种发酵乳在4 ℃、15 ℃、30 ℃贮藏时,随贮藏期延长嗜热链球菌活菌数出现不同程度衰减。在4 ℃贮藏时,5种发酵乳嗜热链球菌活菌数变化不大,均维持在108CFU/g的水平;在15 ℃、30 ℃贮藏时,菌株Q164制备的发酵乳随贮藏期延长,活菌数下降较快;30 ℃贮藏时,菌株Q164、Q166、Q167制备的发酵乳贮藏14 d后,活菌数均降为0;菌株Q165制备的发酵乳在贮藏21 d后,活菌数降为0;而菌株C-1制备的发酵乳在4 ℃和15 ℃贮藏时活菌数变化趋势接近,且都维持在108CFU/g的水平,在30 ℃贮藏21 d后,活菌数为7.2×103CFU/g。杨海莺等[24]的研究表明,酸奶样品在30 ℃存放3 d后,菌落总数就已降至10 CFU/mL以下。结果表明,菌株C-1制备的发酵乳即使脱离冷链,也会维持较高水平的活菌数。
3 结论
本研究从22个传统乳制品中分离得到67株菌株,结合菌株制备发酵乳的感官评价结果,筛选出5株乳酸菌(编号为C-1、Q164、Q165、Q166和Q167),经菌株形态学观察、16S rDNA序列分析均被鉴定为嗜热链球菌(Streptococcus thermophilus)。其中,菌株C-1分离自四川省稻城县勒部查凑牧民自制牦牛酸奶中,长势良好,发酵速率较快;菌株C-1制备的发酵乳奶香明显,口感细腻顺滑,感官评分最高93.5分,黏度5 460 mPa·s。该发酵乳于30 ℃贮藏21 d后,酸度上升变化较小,活菌数为7.2×103CFU/g。表明菌株C-1具备优良发酵菌株的潜力,我国传统乳制品为国产发酵菌种的获得提供了良好的资源,对国内乳制品行业的发展具有重要意义。
