基于LPS诱导小鼠炎症模型对苦苣菜抗炎机制的初步研究
2022-06-23贾航航罗生杰谭莉萍王宁李永乐张建萍
贾航航,罗生杰,谭莉萍,王宁,李永乐,张建萍 ,2*
(1塔里木大学生命科学与技术学院,新疆 阿拉尔 843300)
(2新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
炎症是最常见的疾病之一,与心血管病、肿瘤、阿尔茨海默病等多种疾病的发生有关,导致炎症发生的主要原因有伤口感染、吸入性感染等。建立小鼠炎症模型的目的在于模仿炎症发生的因素、临床特征,从而为炎症的治疗提供合理有效的方法。脂多糖(lipopolysaccharide,LPS)进入小鼠机体会影响巨噬细胞,致使小鼠出现炎症[1-2]。由相关文献可知,使用二甲苯建立小鼠模型使用的研究较多[3],使用LPS建立小鼠炎症模型的研究不多,而使用苦苣菜处理LPS诱导的炎症模型尚未见文献报道。
相关研究发现,炎症因子的调节失控,会使其大量分泌,最终导致机体炎症的发作。炎症产生的机制一般情况下与核因子κB(nuclear factor kappa-B,NF-κB)的激活有关[4]。高迁移率族蛋白B1(high mobility group box-1,HMGB1)存在于细胞核内,可调节炎症通路,Toll样受体4(toll-like receptors-4,TLR4)是细胞膜上LPS的受体,参与机体的炎症调节[5]。炎症发生时,HMGB1和TLR4可以活化NF-κB信号通路,释放肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)等[6]。当机体接受外界刺激后,机体内一氧化氮合酶(iNOS)会促进NO含量升高,进而杀死入侵机体的各种病原体,对于炎症治疗具有重要意义。
相关文献报道,苦苣菜(Sonchus oleraceus L.)的成分包括倍半萜、苷类、三萜、甾体类、黄酮类、香豆素类及木脂素类等[7],有治愈咳嗽、咽喉炎等功效[8]。本试验以苦苣菜水提物为研究材料,通过LPS诱导建立小鼠炎症模型,进一步研究苦苣菜水提物的抗炎作用。通过检测苦苣菜水提物对小鼠血清和肾脏中TNF-α、IL-6及iNOS的含量,以及肾中信号通路HMGB1/TLR4/NF-κB蛋白表达量,进而判断苦苣菜水提物的抗炎效果,为进一步了解其抗炎机制提供理论依据和试验数据,也为开发苦苣菜的药用价值提供参考,更为治疗炎症药物的研发提供了思路。
1 材料与方法
1.1 试验材料
1.1.1 试验动物
塔里木大学动物科学与技术学院实训基地饲养的小鼠(雌雄各半)。饲养温度为20~26℃,试验小鼠的饮水、情绪、饮食等表现正常。
1.1.2 试验试剂
LPS、氢氧化钠、三羟甲基氨基甲烷盐酸盐、乙二胺四乙酸二钠、甘氨酸、丙烯酰胺、十二烷基硫酸钠、双蒸水、氨基丁三醇、甲醇、磷酸缓冲盐溶液、氯化钾、磷酸氢二钠、磷酸二氢钾、β-巯基乙醇、考马斯亮蓝、氯化钠、乙酸、脱脂奶粉、硫酸镍胺、过氧化氢。
1.1.3 试验仪器
高压蒸汽灭菌锅(LDZX-45L,上海申安医疗器械厂)、旋转蒸发仪(Hei-VAPAdvantage,上海亚荣生化仪器厂)、制冰机(SZB-100,常熟市菱科电器有限公司)、移液枪(DLAB Toppette,生工生物工程上海股份有限公司)、电热恒温干燥箱(DHP-9272,上海一恒科学仪器有限公司)、超低温冰箱(MDF-U53V,日本)、冰箱(BCD-216TMZL,青岛海尔股份有限公司)、纯水仪(Milli-Q,乌鲁木齐中环时代科技有限公司)、漩涡震荡器(QL-901,海门市其林贝尔仪器制造有限公司)、冷冻干燥机(LGJ-10C,北京四环科学仪器有限公司)、电子分析天平(ML204/02,梅特勒-托利多仪器上海有限公司)、低温超速离心机(Heraeus Pico 17,Germany)、酶标仪(BIO-RAD,上海卓的仪器有限公司)、电泳仪(伯乐生命医学产品有限公司)、离心管(生工生物工程股份有限公司)、硝酸纤维素膜(生工生物工程股份有限公司)、数显分散机(德国IKA T18 digital ULTRA-TURRAX)、刮棒(生工生物工程股份有限公司)。
1.2 试验方法
1.2.1 苦苣菜水提物的制备
苦苣菜采摘于塔里木大学校园内81°30′E,40°55′N。将采摘的苦苣菜洗干净后阴干,取苦苣菜阴干物用磨粉机磨碎后过80目筛,将苦苣菜阴干粉与蒸馏水按固液比为1∶10置于三角瓶中,在台式数控超声机中超声粉碎30 min,用真空抽滤机过滤,弃残渣取过滤液,于-80℃冰箱过夜,第2 d取出后敲碎成黄豆般大小的颗粒状,放入冷冻干燥机中直到样品变成粉末。将制得的冻干粉,收集并贴好标签,置于-80℃的冰箱保存备用。
1.2.2 LPS诱导小鼠炎症模型的建立
将小鼠随机分为6组:空白组、模型组、阳性对照组及苦苣菜水提物处理组(低、中、高浓度)。低、中、高浓度组小鼠依次各使用0.3mL100mg/mL、200mg/mL、400 mg/mL的苦苣菜水提物,一天给药两次,每次间隔12 h,持续一周。在第7 d正常处理0.5 h后,给空白组小鼠腹腔注射生理盐水,模型组、阳性对照组、苦苣菜水提物处理组注射30 mg/kg的LPS,6 h后拍照并记录小鼠的状态[9]。在小鼠眼球取血,将获得的血清低温离心20 min,取上清液,于4℃冰箱保存备用。在小鼠麻醉后解剖,将组织置于生理盐水中清洗,然后放进冻存管,液氮速冻,于-80℃的冰箱保存备用[10]。
1.2.3 匀浆介质的配制
称取 Tris-HCl(0.01 mol/L)0.157 g,LEDTA-2Na 0.003 g,蔗糖(0.01 mol/L)3.422 g,量取0.8%氯化钠溶液50 mL,PH为7.4。将整个肾脏器官置于冰上,剪碎,面积大约为1 mm2,之后使用匀浆机匀浆30 s,直至离心管中无明显颗粒后转入1.5 mL离心管,低温3 000 r/min,离心20 min,弃沉淀,取上清液,将其转入新的离心管,-80℃冰箱保存备用。
1.2.4 小鼠肾脏湿/干重(W/D)比值测定
将小鼠麻醉后立即放置在冰上解剖,获得小鼠肾脏,剪去多余的组织,用生理盐水多次浸泡去除血迹,吸水纸除去肾脏表面水分后称重,70℃烘72 h,再次称重,对比称重前后的数据获得小鼠W/D的比值。
1.2.5 ELISA检测小鼠血清和肾脏中TNF-α、IL-6、iNOS含量
用ELISA试剂盒进行操作,酶标仪检测吸光度值(OD值),建立标准曲线,获得小鼠血清和肾脏中的TNF-α、IL-6、iNOS浓度。
1.2.6 Western blot检测小鼠肾脏中HMGB1、TLR4、NF-κB蛋白表达水平
称取80~100 mg肾脏组织,剪碎至面积大约为1 mm2,加入1 mL RIPA蛋白裂解液,利用组织匀浆机匀浆(30 s),置于冰上低温裂解30 min后离心,弃沉淀取上清液于新离心管中。使用BCA蛋白试剂盒检测蛋白质浓度,上样前将样品加热变性,通过SDS-聚丙烯酰胺凝胶电泳分离蛋白质,转膜,用脱脂奶粉封闭1 h,分别加入一抗 NF-κB(稀释比为1:1 000)、TLR4(稀释比为1:500)、HMGB1(稀释比为1:15 000),4℃下孵育过夜,用TBST洗膜数次。加入二抗(稀释比为1:5 000)室温孵育1 h;用TBST洗膜数次。加入ECL显色后,使用凝胶成像系统对其进行成像,最后使用Alpha Ease FC 4.0软件分析图像[4]。
2 结果与分析
2.1 LPS诱导建立小鼠炎症模型
采用30 mg/kg的LPS腹腔注射处理小鼠,观察发现注射2 h后小鼠的活动明显减少,4 h后大部分小鼠已不再活动,6 h后解剖小鼠,发现模型组小鼠W/D的比值大于空白组,并且模型组与空白组相比,模型组小鼠出现肾脏肿胀、肺部发生炎症、肠道出现肠胀气的症状,如图1所示。试验结果表明,模型组血清和肾脏中炎症因子含量显著高于空白组,且相关信号通路的蛋白质含量明显降低,因此成功建立了LPS诱导小鼠炎症模型。
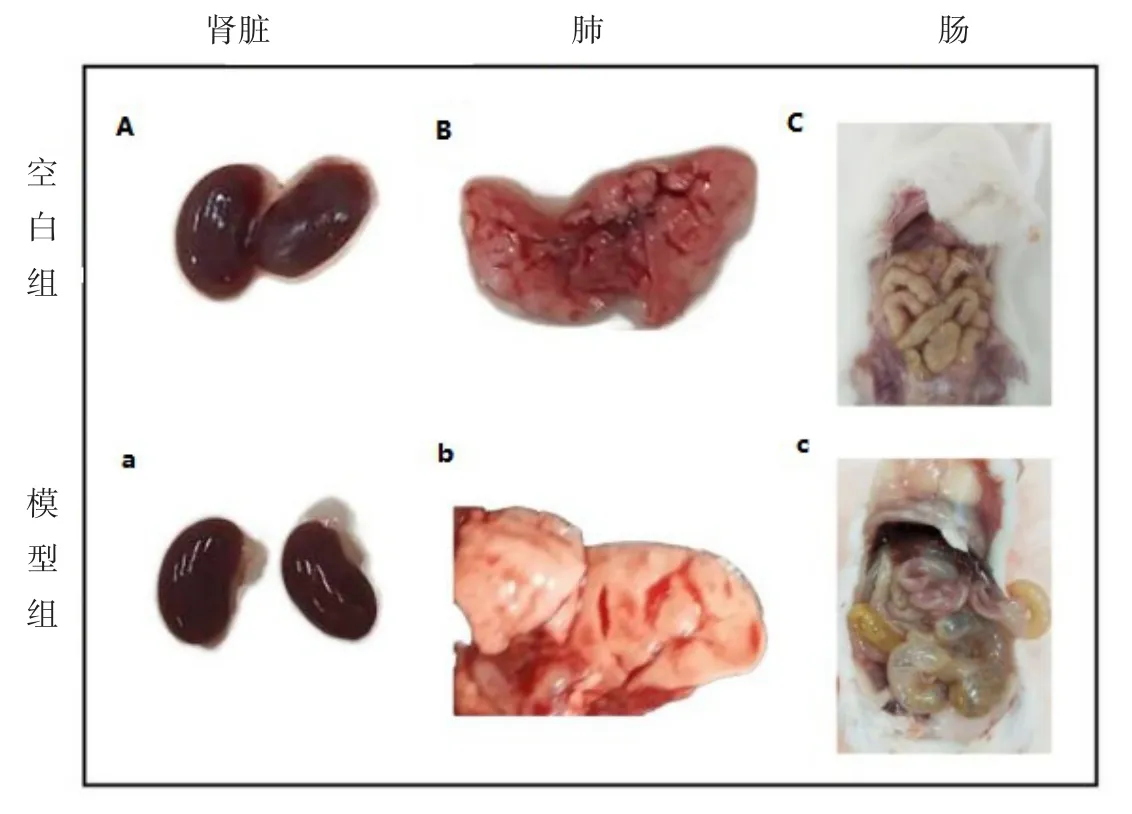
图1 空白对照组与模型组小鼠肾脏、肺部、肠道比照图
2.2 苦苣菜水提物对小鼠血清中炎症因子含量的影响
如图2所示,在小鼠血清中,模型组TNF-α(P<0.001)、IL-6(P<0.000 1)含量显著高于空白组,iNOS含量明显高于空白组。阳性对照组和苦苣菜水提物处理组 TNF-α(P<0.001)、IL-6(P<0.000 1)含量显著低于模型组,iNOS含量明显低于模型组。结果表明,与模型组相比,苦苣菜水提物处理组(低、中、高浓度组)血清中TNF-α和IL-6含量显著下降。
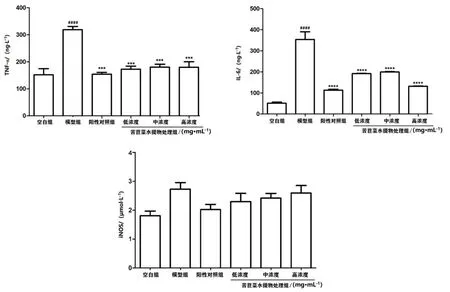
图2 ELISA检测小鼠血清中TNF-α、IL-6、iNOS含量
2.3 苦苣菜水提物对小鼠肾脏中炎症因子含量的影响
如图3所示,在小鼠肾脏中,模型组TNF-α、IL-6含量显著高于空白组(P<0.01),iNOS含量明显高于空白组,且苦苣菜水提物处理组TNF-α、IL-6、iNOS含量均低于模型组,说明苦苣菜水提物在肾脏中具有抗炎作用。
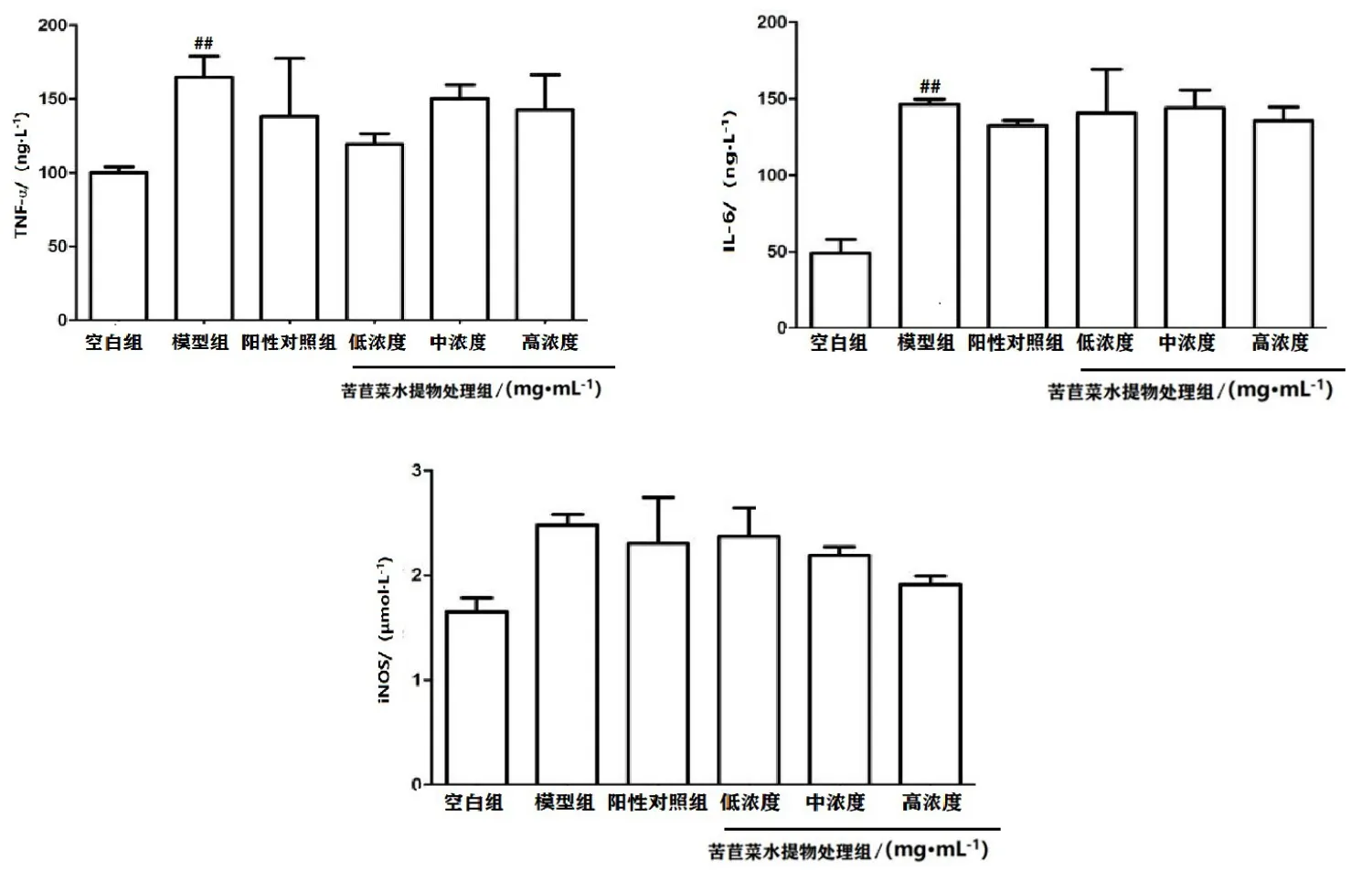
图3 ELISA检测小鼠肾脏中TNF-α、IL-6、iNOS含量
2.4 苦苣菜水提物对小鼠肾脏中HMGB1/TLR4/NF-κB信号通路蛋白表达的影响
如图4所示,模型组小鼠肾脏中HMGB1、TLR4和NF-κB蛋白表达含量较高,苦苣菜水提物处理组HMGB1的蛋白表达水平均低于模型组,且随着苦苣菜水提物浓度的增大而降低;苦苣菜水提物处理组TLR4的蛋白表达水平中浓度组、低浓度组低于模型组,高浓度组高于模型组,且随着苦苣菜水提物浓度的增大而升高;苦苣菜水提物处理组NF-κB的蛋白表达水平低浓度组高于模型组,中浓度组和高浓度组低于模型组,且随着苦苣菜水提物的浓度增大而降低。
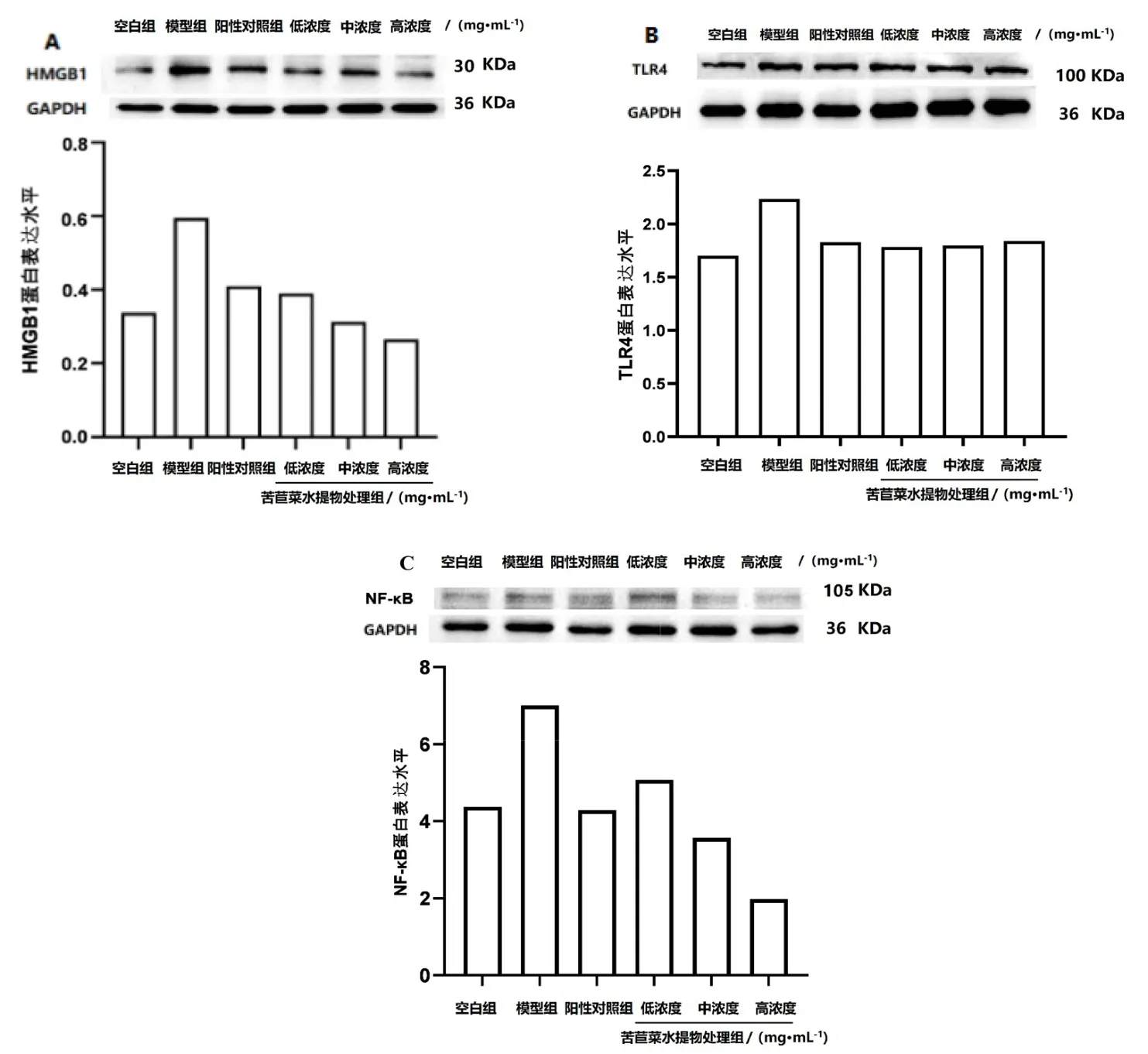
图4 Western blot检测小鼠肾脏中HMGB1/TLR4/NF-κB信号通路蛋白表达
3 讨论
小鼠被广泛用于建立动物模型[9],具有很好的研究背景,LPS诱导产生炎症的机理较为明确[11-12],使用LPS处理小鼠,不仅使模型适合该类疾病的特性,而且易于控制,重现性好[10],所以使用LPS建立小鼠炎症模型是相对简单有效的方法。与此同时,在模型使用方面,根据试验对象为小鼠的不同器官,可以采用不同的处理方法,建立恰当的模型,在建模之后,可以通过定期检测LPS处理小鼠炎症相关蛋白的特异性表达,明晰抗炎药物的作用周期,也可以在同一时间测量不同通路但具备相互作用的信号通路,获得机体内动态的调节图。LPS是导致小鼠部分炎症发生的原因,当出现离体的LPS时,其有毒部分类脂蛋白A会刺激免疫细胞,产生炎症反应[13]。建立小鼠炎症模型的目的在于模仿炎症发生的因素、临床特征,从而为炎症的治疗提供合理有效的方法。目前,国内外的学者普遍使用二甲苯建立小鼠的炎症模型,而使用LPS诱导建立小鼠炎症模型的比较少。使用二甲苯建立模型,特点是时间短,多用于建立体外肿胀等炎症状态,LPS建立的小鼠炎症模型符合小鼠受到革兰氏阴性菌感染发生的症状。因此,本试验使用LPS建立小鼠炎症模型具备非常成熟的理论依据和试验前提。根据文献报道,处理小鼠建立炎症模型的LPS浓度有5 mg/kg、10 mg/kg、30 mg/kg,但是在短时内要达到效果,浓度为30 mg/kg最合适[14]。综上所述,LPS诱导的小鼠炎症会刺激巨噬细胞产生并促进炎症细胞因子大量分泌,诱导炎症反应,从而通过多种方法刺激免疫系统产生免疫活性物质,而且不同的方法和手段刺激的通路不同,产生的炎症因子不同,适合多种情况。
试验结果表明,苦苣菜水提物能够显著降低血清中TNF-α和IL-6的含量,明显降低iNOS的含量,具备显著的抗炎效果。血清中的TNF-α和iNOS的含量随着苦苣菜水提物浓度的增大而升高,说明低浓度的苦苣菜水提物在血清中抗炎效果较好,但是IL-6的含量在苦苣菜水提物高浓度组出现降低,说明高浓度的苦苣菜水提物会影响其他因素导致IL-6含量发生变化,具体的机制推测可能与TLR4含量升高有关。在肾脏中,苦苣菜水提物能够降低TNF-α、IL-6、iNOS含量。苦苣菜水提物处理组(低、中、高浓度)与模型组相比,炎症因子浓度低,表明苦苣菜具备治疗肾炎的作用,同时苦苣菜水提物也能够降低肾脏中HMGB1、TLR4和NF-κB蛋白表达水平。NF-κB可以被HMGB1和TLR4联结激活,促成炎症因子的释放[15-16]。苦苣菜水提物促使HMGB1/TLR4蛋白表达水平下降,且下调HMGB1和TLR4蛋白,从而下调NF-κB 的蛋白,导致 TNF-α、IL-6的分泌量降低。TLR4与苦苣菜水提物浓度成正相关,与其他研究人员结果不同。TLR4是LPS的受体,同时也是HMGB1激活NF-κB的辅助因子[17],推断30 mg/mL LPS处理小鼠,会导致TLR4大量分泌,同时由于LPS导致的炎症会使HMGB蛋白大量表达,其表达水平是TLR4的3~4倍,当机体受到外界LPS刺激时HMGB1接收信号被激活,同时NF-κB被激活会结合并消耗体内产生的LPS受体TLR4,从而导致,随着HMGB1蛋白表达水平的降低导致TLR4蛋白表达水平升高(如图5)。
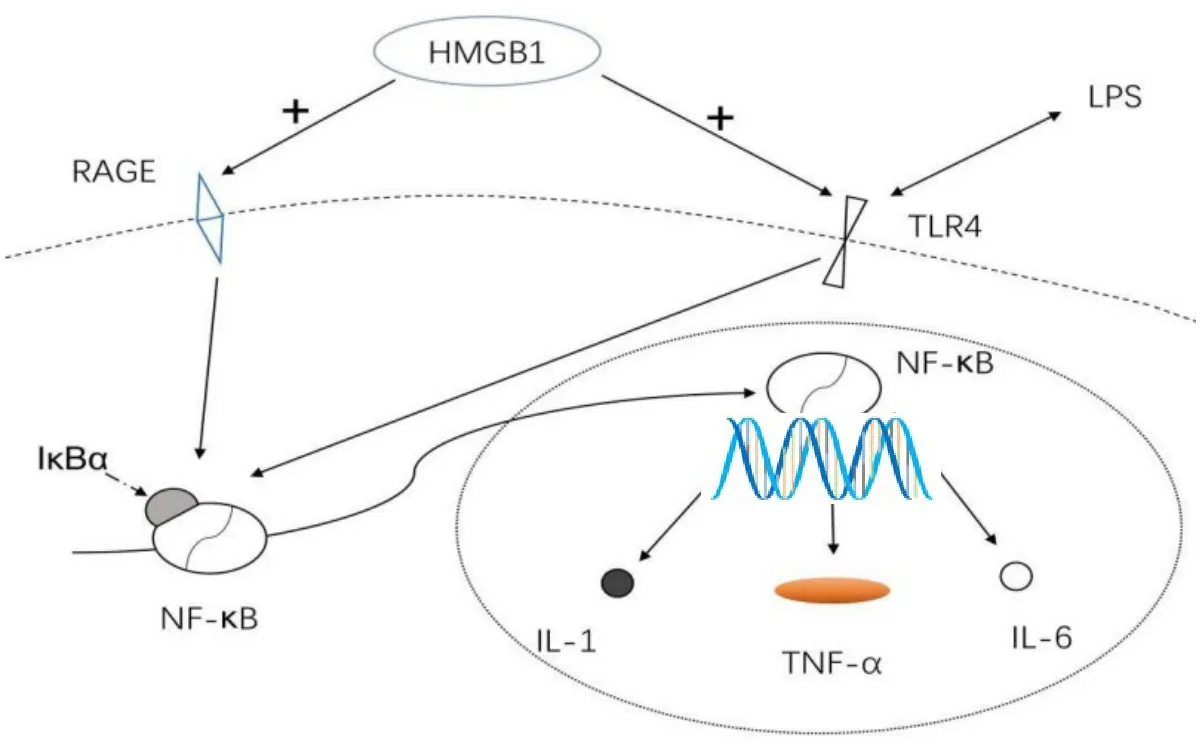
图5 HMGB1/TLR4/NF-κB信号通路
本试验中使用30 mg/mL的LPS建立小鼠炎症模型,具有显著的致炎效果。在试验过程中发现小鼠出现明显的肠道胀气,因此推测小鼠肠道炎症比较严重,但是未能探究苦苣菜水提物对肠炎的治疗效果。该结果有待进一步研究,对比席世兵等[18]研究成果,发现LPS建立的小肠和盲肠炎症模型较好[19],查阅文献发现,研究人员大多采用吸入法处理导致小鼠肺发炎,从而探究相关药物的治疗效果。炎症模型的处理方法是建立在前人研究的基础之上,并使用其最适浓度,如果需进行后续研究,可以设置LPS浓度梯度,建立适合于新疆气候条件下饲养小鼠的最佳炎症诱发模型并探究针对不同器官的最适致炎方法。
4 结论
综上所述,LPS诱导建立的小鼠炎症模型,具备较好的致炎效果,使用不同浓度的LPS处理方式,会导致不同的器官产生不同水平的炎症。本研究通过试验发现,苦苣菜水提物能够抑制HNGB1/TLR4/NF-κB信号通路蛋白的生成进而降低炎症因子的表达,因此表明苦苣菜具备明显的抗炎效果。
