基于微流控芯片装置的临床患者循环肿瘤细胞分选及分析
2022-06-20姜佳宁王若雨高金琦陈雯婷
姜佳宁 王 琪 王若雨 高金琦 陈雯婷 王 刚
大连大学附属中山医院肿瘤科,辽宁大连 116001
恶性肿瘤的发病率、死亡率逐年呈稳定上涨趋势,发病年龄则出现年轻化趋势[1]。随着肿瘤发病机制探讨、新药研发、诊疗手段的不断规范化、精准化,患者的诊断率、治疗有效率都有了明显的提升。然而,恶性肿瘤细胞通常具备高侵袭能力,一旦出现肿瘤转移,将大大提高患者的死亡风险[2]。虽现有技术已明显提高了肿瘤患者的检出率,但对于精准诊疗、评估预后、评价疗效等方面存在很多不足之处,仍有很大一部分患者就诊时已处于晚期,失去最佳治疗机会。提高恶性肿瘤患者的早期检出率是解决问题的关键。随着循环肿瘤细胞(circulating tumor cells,CTC)的出现及不断深入研究,CTC 分选作为一种“液态病理活检”技术,可协助临床诊断明确、转移评估、预后判断、疗效评价及精准个体化医疗的指导[3-4]。美国强生公司开发的CellSearch System 是唯一被食品药品监督管理局批准,用于临床乳腺癌、肺腺癌、结直肠癌、前列腺癌患者的CTC检测。但该装置因检测成本高、操作复杂、体积笨重等不足,尚未广泛应用于临床患者CTC检测。因此,如何实现临床CTC 快速、方便、准确的检测一直是研究的热点。微流控芯片技术具备微型化、自动化、集成化和便携化等优势,弥补传统检测方法的不足,在生物技术、医学、物理研究等方面均有所应用[5]。因此,利用微流控芯片的优势,构建集成化的CTC 分选装置,克服了CellSearch System的不足,具备成本低、无创、简单、可重复、顺应性好等优势,并可获得高达90%以上的检测率,更适合于临床患者CTC的检测[6]。本研究将应用该检测装置对55 例临床肿瘤患者外周血标本CTC 分选,分析CTC 分选结果与患者临床病理特征,包括发病年龄、性别、肿瘤分化程度、分期、类别、肿瘤转移及疗效评价的相关性。以期进一步实现该装置的临床普及应用,为提高肿瘤患者的诊断及治疗提供更好的方法。
1 材料与方法
1.1 材料
1.1.1 仪器 倒置荧光显微镜、光刻机、甩胶机、等离子去胶机、超净工作台、二氧化碳水套式培养箱、LS100CO2 激光雕刻机、OB1 pressure controller、热压机、低温高速离心机。
1.1.2 试剂 芯片制备试剂:PDMS、固化剂、CD45 磁珠、红细胞裂解液。免疫亲和反应试剂:鼠尾胶原蛋白、EpCAM 抗体、CD45 抗体、panCytokerin 抗体。
1.1.3 研究对象 本研究纳入2017 年1 月至2018 年12 月在大连大学附属中山医院确诊的恶性肿瘤患者共55 例,每例患者抽取外周静脉血4 ml。其中男25 例,女30 例;年龄42~82岁,平均(61.02 ±19.14)岁。纳入标准:初治经病理证实的恶性肿瘤。排除标准:①存在肝肾功能异常及心、脑、精神系统等疾病等。②临床资料不完整。本项研究经医院伦理委员会同意批准(批号:2017071)。参与的患者或家属均知情同意,并签署知情同意书。
1.2 研究方法
1.2.1 基于微流控芯片的CTC 分选装置构建 本研究利用微流控芯片技术平台,构建了集成化的CTC 分选平台。该平台由DLD 芯片、磁场负性纯化芯片及鼠尾胶原蛋白捕获组成。DLD 芯片的设计是依据CTC的物理学特性,其尺寸为15~20 μm,明显大于红细胞、血小板及95%以上白细胞。磁场负性纯化平台是依据白细胞表面特异性表达CD45 抗体,因此经DLD分选后的样本经过CD45 磁珠充分作用后,在磁场负性分离作用下将白细胞进一步去除。最后,CTC 与极少量的白细胞通过正性分选免疫亲和反应被捕获,CTC 表达为EPCAM+/CK+/CD45-,白细胞表达为EPCAM-/CK-/CD45+,整体示意图见图1[6]。
1.2.2 标本采集 应用EDTA 抗凝管留取患者初治前、治疗后的外周静脉血标本各4 ml,室温保存,6 h 内完成检测。
1.2.3 临床肿瘤患者外周血CTC 分选 应用既往设计的微流控芯片装置分选CTC,记录每例患者外周血的CTC 情况,分析检测结果与患者发病年龄、性别、肿瘤诊断、临床分期、分化程度等临床资料的相关性。
1.3 观察指标
分析患者CTC 分选结果与患者性别、年龄、诊断、分期、癌肿不同及肿瘤转移的相关性。同时,对于接受抗肿瘤治疗的患者,观察治疗前后CTC 数目的变化与临床影像学(CT、彩超、核磁等)评效的一致性。
1.4 统计学方法
采用SPSS 22.0 软件进行统计学分析。计数资料采用百分率表示,组间比较采用χ2检验;疗效评价分析采用Kappa 一致性检验。其中Kappa≥0.75 为两者一致性较好;0.75>Kappa≥0.4 为两者一致性一般;Kappa<0.4 为两者一致性较差。以P <0.05 为差异有统计学意义。
2 结果
2.1 55 例患者一般临床病理特征
55 例恶性肿瘤患者中CTC 阳性例数为29 例,检出率为52.73%,共检出178个CTC。检出率与肿瘤分化及肿瘤TNM 分期有关(P <0.05),与发病年龄、性别及不同肿瘤类别无关(P >0.05)。见表1。

表1 55 例患者一般临床病理特征及基线CTC 计数分析
2.2 CTC检测结果与肿瘤转移的关系
上述55 例患者中,29 例检测结果为阳性,其中28 例临床已证实有明确的转移灶,即CTC检出率为阳性的患者中,96.6%的患者存在转移。对于检测结果为阴性的26 例患者中,18 例存在转移。检出率与肿瘤转移情况相关(χ2=5.613,P <0.05)。
2.3 CTC检测数目变化与影像学检查结果评估疗效的关系
在55 例患者中,剔除去首诊后拒绝行抗肿瘤治疗的患者及早期未检测到CTC 后续复查仍检测结果为阴性的患者,共39 例患者纳入进一步分析。于治疗(化疗、放疗、分子靶向治疗、内分泌治疗)前后分别检测外周血中CTC 数目,同时行胸腹部CT 等相关检查,根据RECIEST 评价标准进行评效。在39 例患者中,26 例患者治疗后复查CTC 数目上升,经临床检查:血清肿瘤标志物及影像学,包括CT、MRI、全身骨显象、超声等。结果发现其中8 例患者病情复发,16 例患者病情进展,疗效评价为进展,2 例患者病情稳定,疗效评价稳定。对于CTC检测结果不变或下降的13 例患者,其中9 例患者为治疗后复查未见肿瘤复发转移征象。4 例患者为行下周期化疗入院,临床疗效评价部分缓解或稳定。通过Kappa 一致性检验分析,结果提示CTC检测情况与RECIEST 标准评价效果存在良好的一致性(Kappa=0.889,P <0.001)。见表2。
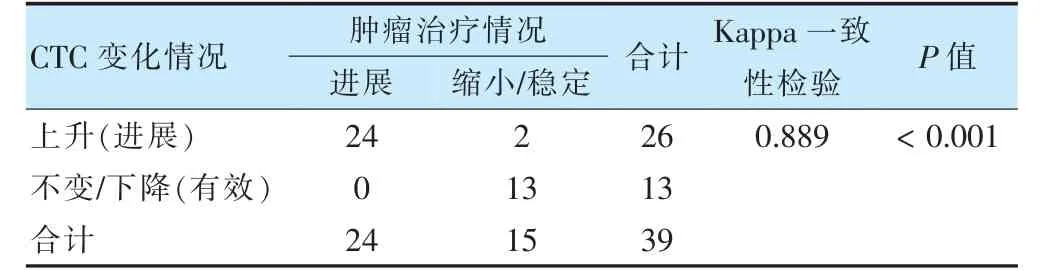
表2 CTC 变化与影像疗效评价关系统计表
3 讨论
恶性肿瘤通常分化程度差、恶性程度高,早期易发生转移,一旦出现转移,患者预后极差,生存期严重缩短,死亡率大幅度提高[7]。现有的肿瘤检查技术手段对明确诊断、判断预后及指导治疗存在一定的局限,主要有影像学、血清肿瘤标志物、组织病理学和细胞学检查等。影像学检查虽能直观地评价肿瘤的大小和侵及范围,但灵敏度低,对微小病灶检出率低。血清肿瘤标志物检测可用于辅助诊断、监测肿瘤进展和复发,但是目前尚缺少特异的肿瘤标志物,假阳性率和假阴性率较高。病理学诊断是肿瘤诊断的“金标准”,但通过手术或穿刺方法获得活检样本的方法对患者的创伤较大。另外,取材受限常导致无法实现对肿瘤实时动态的监测。CTC 与肿瘤转移密切相关,CTC 分选有助于预测及明确肿瘤转移,并反映肿瘤特征,为肿瘤诊治提供依据,也可作为靶向治疗的靶标指导治疗方案的制订[8]。且采集外周血具备创伤小、顺应性好、操作方便及可重复等优势,有望克服临床肿瘤诊疗的难题。
现有的CTC 分选原理主要依据两方面,基于物理学特性[9-11]及生物学特性进行分选[12-16]。本研究构建的基于微流控芯片的集成化的CTC 分选装置,融合了二者优势,克服了各自的不足。首先,基于CTC的尺寸远大于正常外周血细胞(红细胞、血小板及大部分白细胞)的物理学特性,构建了CTC 初步快速的分选芯片—DLD 芯片,在1 ml/min的通量下实现CTC 初步快速的分选,通过该芯片可使95%以上的白细胞、全部红细胞、血小板被去除。随后,依据白细胞表面特异性表达CD45,构建自动化的磁性负性纯化装置,进一步去除残余白细胞90%以上。最后,利用CTC的生物学特性进行免疫亲和鉴定反应,最终CTC 表达EPCAM+/CK+/CD45-,与白细胞表达EPCAM-/CK-/CD45+被分离鉴定。本研究前期研究还通过对标准细胞株的检测实现90%以上检测率,并将对临床患者CTC 分选结果与CellSearch System 对比,发现该装置的分选效率优于CellSearch System,且在检测成本、方便性、所需样本量、检测时间等方面均具备明显优势[6]。
为实现该装置的临床应用,本研究中应用该装置检测了55 例临床初治的恶性肿瘤患者CTC,CTC 阳性为29 例,检出率为52.73%,通过χ2检验,发现CTC检出率与肿瘤分化程度、肿瘤分期及临床转移相关(P <0.05),而与性别、年龄及癌种无关(P >0.05)。这与目前大多数临床CTC检测结果分析一致[17-21]。此外,本研究对接受治疗的39 例患者进行了治疗后的CTC 复查,为临床疗效评价,予以完善胸腹部CT、乳腺、浅表淋巴结彩超等检查,探讨治疗前后相同患者CTC检测水平变化与影像学评效的关系,结果发现对于CTC 数目升高26 例患者中,24 例出现了病情进展,另2 例影像学评效缩小或稳定,肿瘤标志物出现轻度升高,不除外处于肿瘤进展的早期,临床严密观察。而对于CTC 数目下降或不变的13 例患者,疗效评价均为SD 或PR,Kappa检验提示二者的结果一致(P >0.05)。因此,本研究提出利用CTC的动态检测可协助临床疗效的评价,指导治疗,与现有临床报导相符[22-26]。
因此,本研究提出CTC检测有助于协助临床评估肿瘤分化程度、预测分期、明确转移,并起到疗效评价、指导治疗的作用。而本研究设计的基于微流控芯片的CTC检测装置具备检测率高、检测成本低、检测方便等优势,有望实现CTC的临床普及应用,协助提高临床患者诊治率,提高患者生存质量、延长生存期。
